基于不同模式生物评价黄芪的抗衰老作用
杨淑惠,王雨萌,尹佳婷,李成曦,段金廒,郭建明
(1.南京中医药大学药学院,江苏省中药资源产业化过程协同创新中心,江苏 南京 210023;2.湖州市中心医院药学部,浙江 湖州 313002)
衰老是生物体发展的自然过程,也是近年来科学家热衷于研究挖掘的焦点。由2015年联合国关于世界人口老龄化的报道可知,预计到21世纪中叶,全球范围内60岁及以上的人口数将翻倍[1];2021年,第七次全国人口普查结果显示[2],截至2020年,中国老龄人口比例为18.7%,超过2.6亿,预计到2050年,中国老龄人口比例将达到27.9%,超过3.8亿。人口老龄化将对我国经济发展、社会建设、社会文化均产生深刻影响。
中医关于抗衰老理论主要集中于“肾元气虚致衰说”“五脏虚损致衰说”以及气虚、血虚、血瘀致衰说等[3]。中医理论认为,引起衰老的原因中,肾虚为首,其次脾虚会进一步影响衰老进程,再次是气血两虚,因此在中医范畴内,补肾、健脾、益气是延缓衰老的基本途径。
“药食同源”是我国劳动人民在食物和药物发现中总结的智慧结晶,体现了食物的药用功能。黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.)Bge.的干燥根,味甘,性微温,归肺、脾经。现代研究证实[4],黄芪具有延缓衰老的作用,对衰老进程中出现的代谢灵活性下降、免疫功能失调、神经系统衰退等方面都具有一定的改善作用。
在衰老研究领域,秀丽隐杆线虫是杰出模式生物之一。线虫的生命周期短、生理结构简单,在基因组水平上与人类具有60%~80%的相似性[5],已成为国际衰老研究的常用模型。黑腹果蝇作为遗传学和分子生物学研究的重要模式生物,已有100年的历史。在果蝇中可以观察到许多与衰老相关的功能丧失标志物,其中包括新陈代谢如蛋白质和脂肪合成减少,生殖能力降低,神经元功能改变导致的学习和记忆受损,免疫能力下降等[6-7]。
低等生物如线虫和果蝇等在某些衰老相关基因的研究中具有明显的优势,但哺乳动物尤其是啮齿类动物(小鼠或大鼠)模式生物对于了解人类衰老是必不可少的。基于此,本研究探讨黄芪对不同自然衰老模型的改善作用,初步探讨黄芪抗肠道衰老的作用及机制。
1 材料
1.1 实验动物与细菌
野生型N2秀丽隐杆线虫以及大肠埃希氏菌(Escherichia. coli OP50)由南京中医药大学阮秦丽老师惠赠,饲养于恒温恒湿培养箱中,温度(20±1)℃。
野生型W1118黑腹果蝇由南京中医药大学钱进军老师惠赠,饲养于恒温恒湿人工气候培养箱中,温度(25±1)℃,湿度65%~75%,光照为自然节律白天-黑夜12 h交替循环。
雄性SPF级的C57BL/6J小鼠,6~8周龄,8只,体质量(20±2)g,购自江苏集萃药康生物科技股份有限公司,实验动物许可证号:SCXK(苏)2018-0008。小鼠饲养于南京中医药大学实验动物中心,动物实验获得南京中医药大学动物伦理委员会批准(批号:202211A007)。
雄性SPF级的C57BL/6J小鼠,28周龄,32只,体质量(30±2)g,购自江苏集萃药康生物科技股份有限公司,实验动物许可证号:SCXK(苏)2018-0008。小鼠饲养于南京中医药大学实验动物中心,动物实验获得南京中医药大学动物伦理委员会批准(批号:202112A025)。
1.2 药品、试剂与仪器
黄芪饮片购自江苏省中医院,批号:20220102-01。
罗氏血糖试纸(批号:26060941)购自罗氏血糖健康医护公司;Carmine染料(批号:C11707035)、RNA follow All保存液(批号:N20211108)购自苏州新赛美生物科技有限公司;Carnoy保存液(批号:20210803)购自北京索莱宝科技有限公司;Edu(批号:B833761341604)购自美国APExBIO公司;Tissue Total RNA Isolation Kit(批号:ET121-01)、HiScriptⅡQ RT SuperMix for qPCR(+gDNA wiper)试剂盒(批号:017E2282IA)、ChamQ SYBR qPCR Master Mix试剂盒(批号:027E2262IA)购自南京诺唯赞生物科技有限公司。
体视显微镜(德国Leica公司,型号:EZ4);正置体视荧光显微镜(德国Leica公司,型号:M205 FCA);生化培养箱(天津泰斯特仪器有限公司,型号SPX-150BX);超净工作台(美国Thermo Fisher公司,型号:MSV Advantage 1.2);果蝇二氧化碳麻醉系统(武汉一泓科技有限公司,型号:YHDACO2);智能人工气候箱(宁波赛福实验仪器有限公司,型号:PRX-150B)。
2 方法
2.1 药物配制
黄芪水提物:根据课题组前期建立的制备方法[8],准确称取黄芪饮片加水(饮片∶水=1∶8)煎煮3次,每次2 h;合并水提液后进行旋蒸浓缩,冷却后缓慢加入95%乙醇,使混合物乙醇浓度为80%,静置过夜后抽滤,得沉淀,挥去残留乙醇,冷冻干燥。黄芪醇提物:取水提后剩余药渣加60%乙醇(药渣∶乙醇=1∶12)煎煮3次,每次2 h,合并醇提液并进行旋蒸浓缩,冷冻干燥。黄芪总提物为黄芪醇提物和黄芪水提物的混合物,按照提取得率,混合比例约为黄芪醇提物∶黄芪水提物=5∶8。
2.2 分组及给药
2.2.1 线虫实验分组及给药 待线虫裂解得虫卵培养48 h后,在显微镜下挑取生长情况近似的L4期线虫至新的培养基中,随机分为4组,空白对照组(Aged),黄芪总提物低(0.5 mg·mL-1)、中(2.5 mg·mL-1)、高(5.0 mg·mL-1)剂量组,自Day0开始给药,直至所有线虫死亡。
2.2.2 果蝇实验分组及给药 实验选用羽化后72 h内的果蝇,各性别均随机分为4组,即空白对照组(Aged),黄芪总提物低(0.625 mg·mL-1)、中(1.25 mg·mL-1)、高(2.5 mg·mL-1)剂量组,每组平行3个试管,每管30只,每组共计90只。
2.2.3 小鼠实验分组及给药 小鼠购入后常规饲养,饲养过程中,28周龄雄性小鼠因打架死亡2只,剩余30只饲养至13月龄,随机分为4组,分别为自然衰老组(Aged)7只、给药组(AME)8只、脏笼饲养衰老组(Co-house-Aged,CH-Aged)7只以及脏笼饲养给药组(Co-house-AME,CH-AME)8只。后期购入8周龄左右野生型小鼠作为年轻对照组(Young)。
年轻对照组小鼠每天给予常规饮食饮水。各给药组小鼠每天灌胃给予黄芪总提物,剂量为2 g·kg-1,10 mL·kg-1,每日1次,连续给药5个月;各衰老组小鼠每天给予等量纯净水灌胃。
2.3 实验方法
2.3.1 线虫寿命监测实验 以线虫同期化48 h后计为起始点(Day0),观察线虫存活情况,直至线虫生命终止。以挑虫器触碰线虫身体30 s无反应作为死亡标准。平均寿命为所有线虫寿命的平均数;最高寿命为最后10%线虫寿命的平均数;中位寿命为还有50%线虫存活时的寿命平均数。
2.3.2 线虫运动能力及咽泵速率监测[9]在寿命实验基础上,对线虫运动能力及咽泵频率进行评估。运动频率监测:在显微镜下观察,以线虫头部左右来回摆动1次计为线虫运动1次,分别于Day5、10、14、17记录线虫30 s内头部摆动次数。咽泵速率监测:在显微镜下观察,记录规定时间内线虫咽部抽动次数,分别于Day5、10、14、18记录线虫30 s内咽部抽动次数。
2.3.3 线虫脂褐素荧光检测方法[9]在药物干预Day15时,每组随机选择18条线虫转移至2%琼脂糖载玻片上,通过体视荧光显微镜观察拍摄其体内脂褐素自发荧光图像,Image-Pro Plus 6.0进行进一步处理分析。
2.3.4 果蝇寿命监测及紫外损伤实验 以果蝇羽化当天计为Day1,将果蝇以基础培养基培养至Day15,各剂量组换成相应剂量的含药培养基,培养至Day35后换为基础培养基;对照组全程以基础培养基进行培养;每2~3 d更换新鲜培养基,每天观察并记录果蝇死亡情况,绘制生存曲线。寿命计算方式同“2.3.1”。
第一批果蝇培养至Day38后,每隔2 d将所有果蝇进行15~30 min紫外照射,照射后及时更换培养基,直至所有果蝇全部死亡,每天观察并记录果蝇死亡情况,绘制生存曲线。
2.3.5 果蝇逆重力爬行实验[10]饲养至一定天数后,在透明果蝇培养试管(直径2.5 cm,高9.5 cm)中标记好规定高度(小于2 cm,2~4 cm或大于4 cm),轻拍培养试管3次,将所有果蝇置于管子底部,通过视频记录果蝇在规定时间内垂直爬升的最大距离,各组设置3个平行实验组,记录分析能爬行到最高距离的果蝇只数。
2.3.6 小鼠肠道转运以及葡萄糖吸收功能测定 胭脂红肠转运实验:灌胃给予胭脂红染料溶液(6%胭脂红染料溶解于0.5%的甲基纤维素),记录从灌胃开始直至第一颗带有红色染料的粪便排出的时间,以120 min为上限,若小鼠持续不出现排便情况,则记为上限时间。
葡萄糖吸收实验:将小鼠提前禁食不禁水16 h,灌胃给予2 g·kg-1的葡萄糖溶液后,分别于0、15、30、60、90、120 min对小鼠进行血糖测定,采用尾尖取血,实验过程保持禁食不禁水状态。
2.3.7 小鼠脏器取材以及组织病理学检测 在实验终期,采用2.5%异氟烷麻醉小鼠,脱颈处死。剪取固定位置的结肠、空肠及回肠,置于卡诺氏固定液中,将组织用常规石蜡包埋制片,切片脱蜡后进行阿利新蓝-过碘酸雪夫氏(Alcian blue periodic acid-Schiff,AB-PAS)染色。在显微镜下拍照观察肠道绒毛长度、隐窝深度以及杯状细胞数量,利用Image-Pro Plus 6.0进行进一步处理分析。
Edu免疫荧光检测:于解剖取材的前48 h对小鼠进行1次腹腔注射Edu溶液,注射剂量为5 mg·kg-1。实验终末期采集小鼠肠道组织在显微镜下观察肠道组织中Edu阳性细胞的迁移距离。利用Image-Pro Plus 6.0进行进一步处理分析,量取每根绒毛上阳性细胞区域的中点到小肠隐窝底部的距离,记为肠干细胞的增殖距离。
2.3.8 小鼠肠道组织中基因表达检测 称取小鼠空肠组织10 mg左右,研磨匀浆,按照试剂盒流程进行mRNA提取。提取后进行RNA浓度测定,按一定比例稀释到所需浓度,根据cDNA试剂盒规定转录体系进行逆转录反应,使用QuantStudio 5型qPCR仪进行扩增及检测设置。
扩增条件设置为:94 ℃预变性30 s,循环阶段94 ℃进行5 s变性,60 ℃退火30 s,进行40~45个循环,引物序列见表1。扩增结束后,数据处理以β-actin为内参基因,由2-ΔΔCt法计算目的基因的相对表达量。

表1 目的基因qPCR引物序列
2.3.9 小鼠肠道微生物群落多样性组成谱分析 小鼠处死后,解剖小鼠后取出小肠肠段,用消毒处理过的器械剪开小肠,将其内容物全部收集至无菌离心管中,迅速置于液氮冷冻保存。采用Illumina PE250平台对DNA片段进行双端测序,测序相关工作由上海派森诺公司完成。

3 结果
3.1 黄芪总提物可有效改善秀丽隐杆线虫衰老状态
由图1A可知,在自然衰老情况下,黄芪总提物各剂量组可显著提高线虫的自然寿命,且生存曲线提示,在生命后期黄芪总提物的改善作用更为明显。进一步分析寿命数据可知,低剂量(P<0.01)及高剂量(P<0.05)黄芪总提物给药后均能显著提高线虫的平均寿命,各剂量组均能显著提高线虫的最高寿命(P<0.000 1)(表2),以上结果初步提示黄芪具有良好的抗衰老药效。
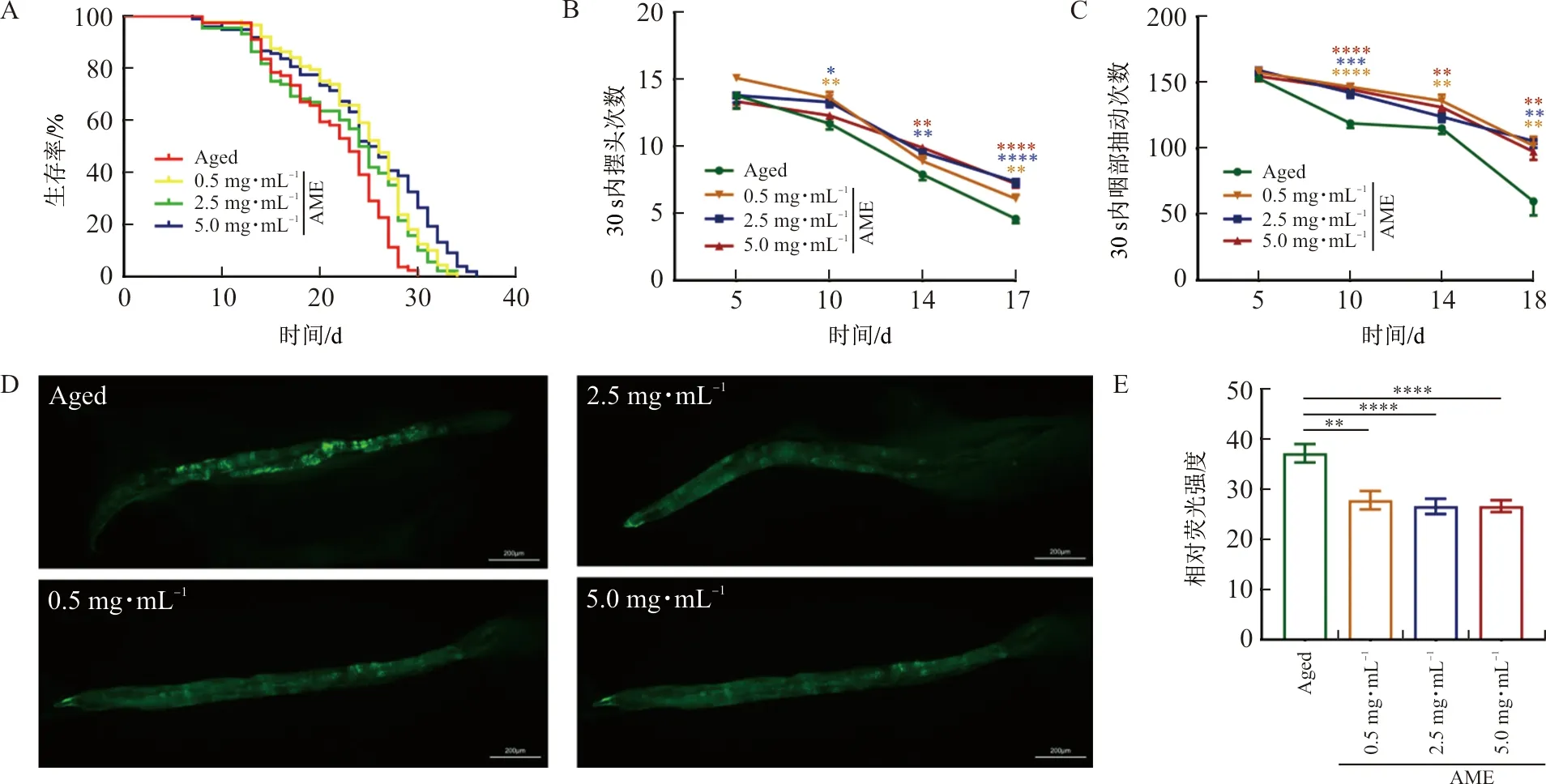
注:A.黄芪总提物对线虫自然寿命的影响;B.不同时期线虫的运动能力;C.不同时期线虫的咽泵速率;D.各组线虫体内脂褐素荧光显微图(标尺=200 μm);E.各组线虫体内脂褐素荧光强度定量分析。与Aged组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
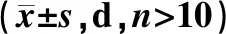
表2 黄芪总提物对线虫自然寿命的影响
随着时间增长,线虫的爬行能力及咽泵速率均呈下降趋势,说明线虫机体状态随寿命增长而日渐弱化。与空白对照组相比,黄芪总提物各剂量组可在Day10、14、17显著改善其爬行能力(P<0.05)(图1B);黄芪总提物各剂量组均显著改善了线虫在Day10、14、18的咽泵速率(P<0.01)(图1C),提示黄芪总提物具有一定改善机体健康状态的作用。
与空白对照组相比,黄芪总提物干预15 d后,各剂量组线虫体内脂褐素荧光强度较弱(P<0.01,P<0.000 1),黄芪总提物能显著降低线虫体内脂褐素的堆积(图1D~E),提示黄芪具有一定抗衰老作用。
3.2 黄芪总提物可有效改善黑腹果蝇衰老状态
由图2A~B的生存曲线可知,在自然衰老情况下,黄芪总提物各剂量对果蝇的生存率均无显著影响。然而对寿命计算可得,中剂量(1.25 mg·mL-1)黄芪总提物可显著提高雌性果蝇的平均寿命(P<0.05),各剂量组的黄芪总提物均可显著提高雌性果蝇的中位寿命(P<0.05,P<0.01)(表3)。采用紫外照射的方法构建果蝇的氧化损伤模型,加速其衰老进程。由图2C~D可知,与未进行紫外照射的果蝇相比,紫外照射后果蝇寿命缩短(P<0.05),提示紫外照射成功引起机体损伤反应。而给药组均不同程度地改善果蝇生存率,其中以中剂量组(1.25 mg·mL-1)效果最为显著(P<0.05,P<0.01),提示黄芪总提物可降低紫外辐射造成的机体损伤,提高寿命延缓衰老。
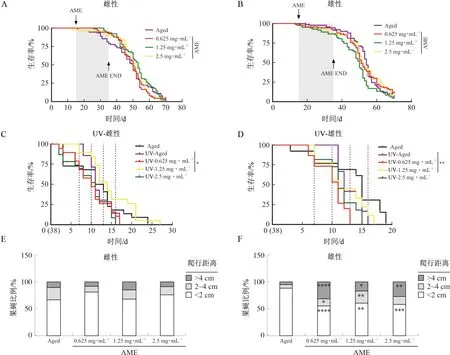
注:A.雌性自然衰老果蝇生存率;B.雄性自然衰老果蝇生存率;C.UV应激下雌性果蝇生存率;D.UV应激下雄性果蝇生存率;E.雌性自然衰老果蝇逆重力爬行;F.雄性自然衰老果蝇逆重力爬行。与Aged组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
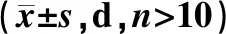
表3 黄芪总提物对果蝇自然衰老寿命的影响
实验结果显示,与空白对照组雌性果蝇相比,黄芪总提物各剂量组对其爬行能力未见明显改善作用(图2E);而与空白对照组雄性果蝇相比,黄芪总提物各剂量均显著提高了雄性果蝇的逆重力爬行能力(P<0.05,P<0.01,P<0.001,P<0.0001)(图2F),提示黄芪总提物具有一定改善机体健康状态的作用。
3.3 黄芪总提物可显著改善小鼠的肠道结构及功能
以口服葡萄糖吸收以及胭脂红染色来评估小鼠的肠道功能,黄芪总提物给药可显著增加18月龄小鼠15 min时间点的葡萄糖吸收(P<0.05)(图3A),促进营养吸收。随着年龄增长,衰老小鼠也出现更长的肠道转运时间(P<0.01),黄芪总提物可显著恢复其肠道转运功能(P<0.05)(图3B)。对于以上功能变化,在2组小鼠脏笼交换饲养后,黄芪总提物则未见改善效果。
在肠道整体形态上,随着年龄增长,衰老小鼠消化道、小肠、结肠长度出现代偿性增长(P<0.001,P<0.000 1),以达到保证足够营养吸收的目的(图3C~F)。黄芪总提物给药后能够显著恢复衰老小鼠消化道、小肠、结肠长度(P<0.01,P<0.000 1)(图3E~F),这提示黄芪总提物具有一定的肠道保护作用。
经脏笼饲养后,未经给药的衰老组小鼠在消化道、结肠长度上也相较于普通衰老小鼠较短(P<0.05),而脏笼给药组小鼠的药效作用并没有普通给药组显著(图3C~F),这提示黄芪总提物对肠道形态的作用与肠道微生物存在密切联系。
3.4 黄芪总提物能显著改善18月龄小鼠的肠道结构
对小鼠空肠组织进行AB-PAS染色,显微镜下观察其肠道绒毛结构(图4A)。研究结果发现,与年轻对照组小鼠相比,自然衰老小鼠小肠绒毛出现代偿性增长(P<0.01),且黄芪总提物能恢复空肠组织中的小肠绒毛长度。

注:A.各组小鼠空肠组织AB-PAS染色显微图(标尺:50~200 μm);B.各组小鼠空肠绒毛平均长度;C.各组小鼠空肠绒毛上杯状细胞数量。与Aged组比较,*P<0.05,**P<0.01,****P<0.000 1。
经脏笼饲养后,未经给药的衰老组小鼠小肠绒毛长度也相较于普通衰老小鼠较短(P<0.05),而脏笼给药组小鼠的药效作用并没有普通给药组显著(图4B)。
镜下观察AB-PAS病理染色,研究发现,与年轻小鼠相比,自然衰老小鼠小肠绒毛中杯状细胞数量减少(P<0.000 1),经黄芪总提物给药后,可显著增加其杯状细胞数量(P<0.01)。黄芪或可通过恢复杯状细胞的数量来进一步促进其黏液分泌,以实现肠道保护。经脏笼饲养后,给药组小鼠的药效作用并没有普通给药组显著(图4C),提示黄芪总提物对肠道形态的作用与肠道微生物存在密切联系。
3.5 黄芪总提物能促进18月龄小鼠的肠干细胞增殖能力
研究结果显示,随着年龄增长,小鼠肠道组织中Lgr5基因以及黏蛋白Muc2基因表达量显著降低(P<0.05,P<0.001),黄芪总提物给药后能显著提高Muc2基因表达量(P<0.01),并对Lgr5表达有一定恢复趋势(图5A~B)。经脏笼饲养后,未经给药的衰老组小鼠体内基因表达水平也接近于给药组小鼠。
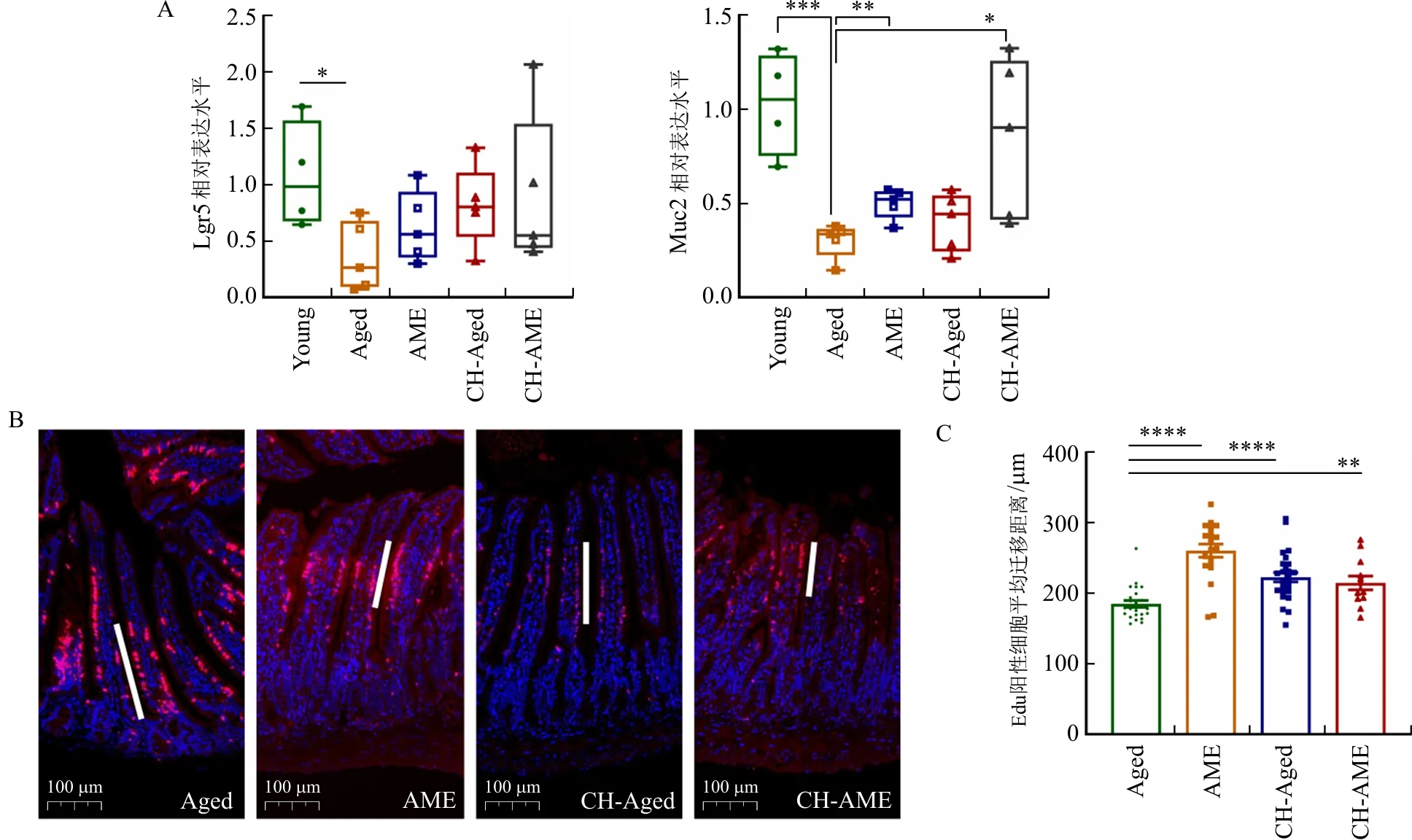
注:A.各组小鼠空肠组织中各基因表达量;B.各组小鼠空肠组织Edu标记肠细胞显微图(标尺:100 μm);C.各组小鼠肠干细胞迁移距离。与Aged组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
Edu标记肠干细胞染色结果显示,黄芪总提物给药后,可显著提高肠干细胞的迁移距离(P<0.000 1)(图5C)。而脏笼饲养的2组小鼠肠干细胞的增殖能力趋于相近,均高于模型组的迁移距离(P<0.05,P<0.000 1),但未达到普通给药组的改善效果(图5D)。
3.6 黄芪总提物对衰老小鼠的肠道菌群紊乱具有一定改善作用
为了探究黄芪对衰老小鼠肠道微生物群的影响,本研究首先采用16S rRNA测序分析了小鼠的肠道菌群多样性。研究结果显示,随着年龄增长,小鼠肠道微生物群Chao1指数显著降低(P<0.001),黄芪给药后具有一定改善趋势,且经脏笼饲养的衰老组小鼠的Chao1指数也高于普通衰老组小鼠;但与年轻对照组相比,衰老小鼠肠道菌群Shannon以及Simpson指数均显著提高(P<0.05,P<0.001)(图6A)。在门水平上对各组小鼠进行对比分析,结果显示衰老组小鼠的物种组成与年轻小鼠存在差别,且黄芪给药后也具有一定恢复作用(图6B)。对小鼠肠道微生物各级类群进行分析(图6C)发现,黄芪给药后仅对科和属的各类群数量有一定改善趋势但无显著作用。PCoA分析显示衰老小鼠的肠道微生物群与年轻小鼠存在显著差别,且黄芪给药后具有一定改变,且同笼饲养的小鼠在微生物组成上趋于一致性(图6D)。
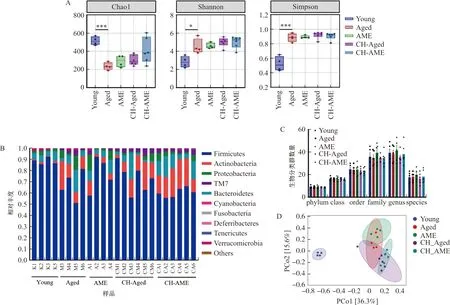
注:A.各组小鼠Alpha指数比较;B.各组小鼠在门水平上物种组成;C.各级微生物分类群数量;D.各组小鼠PCoA分析结果。与Aged组比较,*P<0.05,***P<0.001。
进一步深入分析厚壁门(Firmicutes)下细菌类群发现,黄芪给药可显著上调衰老小鼠体内芽孢杆菌纲(Bacilli)、乳酸杆菌科(Unidentified-Lactobacillus)细菌丰度(P<0.05,P<0.01)(图7A~F)。另外,分析发现黄芪总提物还可显著下调假单胞菌目(Pseudomonadales)下莫拉菌科(Moraxellaceae)、不动杆菌属(Acinetobacter)以及嗜冷菌属亚种(Psychrobacter-Sanguinis)丰度(P<0.01)(图7G~J)。
且经脏笼饲养后,未经给药的衰老小鼠其各菌群丰度接近于常规给药组,而脏笼给药组则失去显著药效。综上结果可得,黄芪对小鼠的肠道菌群调控作用受到菌群本身变化的影响,肠道微生物在其中发挥重要作用。
4 讨论
本研究引入非啮齿类生物秀丽隐杆线虫及黑腹果蝇作为黄芪总提物的药效学评估对象,初步评价其抗衰老药效。研究结果显示,黄芪总提物具有较明显的抗衰老药效,为进一步在小鼠体内考察其药效及机制提供了良好的基础。
基于课题组前期研究基础,本研究主要考察黄芪总提物在13~18月龄期间干预小鼠衰老进程的药效作用,并聚焦于黄芪对小鼠肠道衰老的作用。小肠是人体最大的营养吸收及免疫器官,营养物质主要由肠绒毛吸收。随着年龄增长,肠绒毛结构恶化,隐窝数目和深度度减少,肠干细胞数目减少和增殖能力减退[11]。研究结果显示,黄芪总提物给药5个月可显著改善小鼠的肠道营养吸收功能、转运功能,并能恢复肠道长度,改善小肠绒毛形态(图4)。
肠干细胞耗竭是目前公认的衰老标志。衰老肠干细胞再生分化功能失衡是诱发老年人肠道相关疾病的关键病理机制[12-13]。调控肠干细胞是延缓衰老的潜在途径之一[14]。有研究[15]也揭示了年龄相关的吸收不良主要是由于肠干细胞的耗竭和活性降低。本研究结果显示,黄芪给药后可增加肠干细胞迁移距离,上调肠干细胞标志物Lgr5和肠杯状细胞标志物Muc2的基因转录水平。以上结果初步提示,黄芪可以恢复老年小鼠肠干细胞数量,并促进干细胞分化,增加肠道终末分化功能细胞数量(图4)。
近年来,也多有研究发现,在哺乳动物中通过粪菌移植可影响衰老表征变化[16-17]。这些研究都为调控肠道菌群以干预衰老提供了新的证据。本研究将老年小鼠给予黄芪后,与未给药的老年小鼠互换笼盒饲养,结果发现,脏笼饲养的2组小鼠在肠道吸收能力、肠道形态、肠绒毛结构、肠干细胞及相关标志物水平上都趋于一致性,且均与单独给药组和衰老组小鼠存在差别。因此,肠道菌群或许是黄芪改善肠干细胞功能的关键要素。
黄芪总提物可在一定程度上改善随年龄增加引起的肠道菌群紊乱,进一步分析发现黄芪改善肠道微生物主要聚焦于对乳酸杆菌的恢复作用。与本研究结果类似的,有报道[18]在衰老小鼠模型中施用嗜酸乳杆菌DDS-1已被证明可以引起肠道微生物组成变化,导致代谢表型的改善,并增强盲肠和黏膜短链脂肪酸的产生;唾液乳杆菌也已被证明可以促进秀丽隐杆线虫的生长并延长其寿命;植物乳杆菌TWK10被证实可以改善衰老引起的身体成分改变,特别是肌肉质量、力量和脂肪量的改变。
黄芪总提物可有效改善衰老小鼠的肠道功能,恢复肠干细胞增殖分化活力,可推测黄芪或可通过对肠道乳杆菌的恢复进一步促进肠干细胞的活性,但其中因果关系后续需进一步通过相关实验进行验证。

