人工鱼礁区不同底质对底栖游泳生物群落特征的影响
于浩林,方光杰,周广军,唐衍力*,宋协法
(1.中国海洋大学水产学院,山东 青岛 266003;2.烟台市海洋经济研究院,山东 烟台 264004)
人工鱼礁是我国海洋牧场的主要建设内容[1],旨在促进海水交换、提高水域初级生产力、诱集游泳生物[2],并提供产卵、觅食、避敌的场所[3-4],从而实现礁区内的物种增殖与栖息地修复。日本和美国早期的人工鱼礁布设方式[5]倾向于在特定的海区中单独投放人工鱼礁并与自然礁石或珊瑚礁保持一定的距离,以消除人工鱼礁对现存生态系统的影响[6],但同时也限制了人工鱼礁布局的多样性和与自然礁石的连通性。有学者通过声学遥测方法,证实了礁区物种在人工鱼礁与珊瑚礁或石块礁之间[7]、鱼礁与周边沙地之间的强连通性[8],我国相关研究表明,恋礁型鱼类或海参、鲍等海洋经济型物种更倾向于分布在礁石型海底[9-11],这对传统的人工鱼礁设计和布局提出了挑战。目前我国海洋牧场与人工鱼礁区建设发展迅速,研究领域包括了鱼礁单体结构设计与流体力学仿真模拟[12]、鱼礁区选址与规划[13]、生物资源调查与评价[14-16]、生态系统模型建立与预测[17]等,但均以单种类礁体为研究对象,对多种鱼礁或底质类型组合的评价研究鲜有报道。
由于底栖游泳生物分布模式对底质类型及结构变化易产生迅速而直接的反应[18],恋礁型鱼类、甲壳类、棘皮类等生物常被作为评价人工鱼礁建设的主要依据[19-20]。本实验针对不同的底质环境,结合地笼与水下摄像调查方法,探究长岛海域构件礁投放形成的不同底质对底栖游泳生物群落结构特征的影响及其与环境因子的关系,为将来人工鱼礁布局和管理提供新思路及理论依据。
1 材料与方法
1.1 数据来源
研究区域位于渤海海峡中南部小竹山岛西北部海域,面积约141 hm2。2017 年6 月在海区中央投放人工构件礁24 座,以4 座鱼礁单体为一组单位鱼礁,每组超过500 空方体积,间隔约40 m,共布设6 组单位鱼礁,周边辐射分布石块礁、小圆石、砂砾、泥等底质类型。距中央鱼礁区以半径200、400 及600 m 划分研究样带,200 m 样带囊括所有构件礁及石块礁,400 m 样带为小圆石和砂砾底质,600 m 样带为泥底或砂砾底质。本研 究 于2017 年6 月和8 月、2018 年6 月(2 次)、2019 年6 月和7 月共进行6 个调查航次(图1),采用分层随机取样法,在每个样带中以地笼与摄像各设置3 个站位。共得到地笼37 个站位、摄像42 个站位。各站位地笼长30 m,由3 节组成,无饵料。每个航次放置48 h,渔获物上岸后进行物种识别与生物学测量。水下摄像采用样带法[21],由潜水员手持GoPro Hero 4 水下摄像机对该站位海底底层游泳生物进行单方向样带区间游动拍摄,内容包括海底游泳动物、各底质类型及人工鱼礁等。每次拍摄前通过潜水员携带的PVC 材质矩形拍摄框(50 cm×50 cm)校正摄像机,视野宽度固定约为25 cm,每个站位拍摄约20 min,对每段视频中出现的所有物种进行识别与计数。

图1 调查站位分布及人工构件礁结构示意图Fig.1 Distribution of sampling sites and the structure of one monomer artificial reef (AR)
海域温度、盐度、溶解氧(mg/L)及pH 用多参数水质仪(YSI Proplus)测得。透明度(m)在现场用塞氏盘法测得。水深(m)由手持式水深仪(DMT-20)测得。叶绿素a(mg/L)于现场采样后在实验室进行检测。底质分数由水下摄像数据估算得到,本研究将人工鱼礁、石块礁、小圆石、砂砾、泥共5 种底质类型分别赋值100、50、20、5、0[22],每段视频以5 s 为间隔,计算该站位的底质平均分数,地笼站位利用Arcgis 软件反距离加权插值法得到底质分数。
1.2 数据分析
计算地笼与摄像结果中物种的相对重要性指数(IRI)[23],以IRI>1 000 及IRI>500 分别判定地笼、摄像的优势种,并计算各大类物种丰度比例。应用R 语言vegan、ape 包进行主坐标分析(PCoA),探究地笼与摄像调查站位之间捕获物种的组成差异,其中地笼IRI>500、摄像IRI>100 的物种单列,其他物种以物种分类集合表示。生物数据进行Hellinger 距离转换。
计算地笼与摄像的底栖游泳动物群落的Shannon-Wiener 多样性指数(H')和丰度CPUE (单位捕捞努力量。地笼:尾/(网·d);摄像:(尾/min)。利用单因素方差分析(One-Way ANOVA)检验多样性指数与CPUE 在不同年份、区域及二者交互效应中的统计学差异,利用TurkeyHSD 方法探究各水平的统计学差异。数据均进行了四次方根转换。
式中,N为某一种类的尾数占总尾数的百分比;M为某一种类的重量占总重量的百分比;F为出现频率。
式中,Pi为第i个物种的丰度占总丰度的百分比。
应用R 语言mgcv 程序包拟合CPUE、多样性指数与各环境变量的最优广义加性模型(GAM)。因两种调查方法CPUE 度量不同,将所有站位CPUE 转化为0~1 的连续分布形式。GAM 的模型表达式:
式中,g为连接函数,Y为响应变量,α为截距,si为第i个自变量的样条平滑函数,Xi为第i个自变量,ε为残差;自变量包括所有的环境变量,并把采样方法、年份及区域纳入自变量当中。模型拟合前,将CPUE 进行平方根转换,多样性指数值进行lg (x+1)转换,使其响应变量均符合正态分布。采用逐步回归法筛选对响应变量具有显著影响且模型AICc 值最低的自变量组合[24]。
2 结果
2.1 底栖游泳动物群落优势种
6 个航次共调查到5 大类47 种生物,地笼38 种:鱼类18 种、甲壳类14 种、棘皮类2 种、腹足类2 种、头足类2 种。摄像28 种:鱼类15 种、棘皮类6 种、甲壳类4 种、头足类2 种、腹足类1 种。二者共同出现19 种。地笼优势种依次为日本蟳(Charybdis japonica,IRI=2 891)、大泷六线鱼(Hexagrammos otakii,IRI=2 351)、海燕(Asterina pectinifera,IRI=2 241)及许氏平鲥(Sebastes schlegelii,IRI=1 826),除了日本蟳未在600 m 样带中捕获外,4 个优势种均在所有年份及区域捕获(表1,IRI>500)。摄像优势种依次为海燕(IRI=5 062)、纹缟虾虎鱼(IRI=2 035)、葛氏长臂虾(IRI=624)与矛尾刺虾虎鱼(Chaeturichthvs stigmatias,IRI=598),其中海燕在所有年份及区域中均存在(表2)。PCoA 结果显示(图2),两种方法获得群落差异较大,地笼主要包括大泷六线鱼、许氏平鲉、日本蟳及梭形鱼类,摄像主要包括纹缟虾虎鱼、六丝钝尾虾虎鱼、钟馗虾虎鱼及矛尾刺虾虎鱼。海燕、多棘海盘车与其他棘皮类生物在两种方法中均大量分布。甲壳类、头足类及腹足类在两种调查方法中均有捕获但无显著差异。
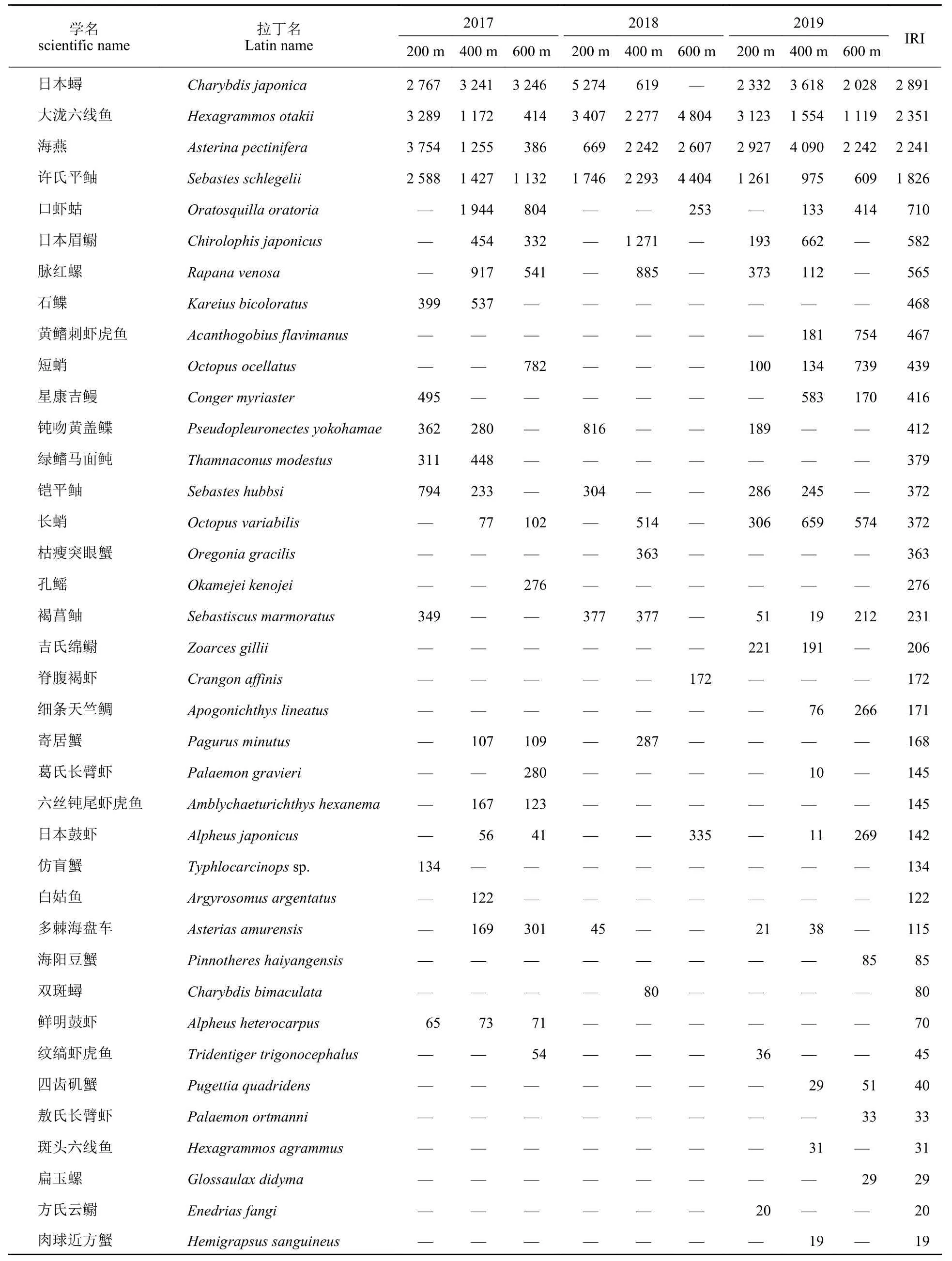
表1 地笼物种相对重要性指数分布Tab.1 Distribution of IRI for species from trap
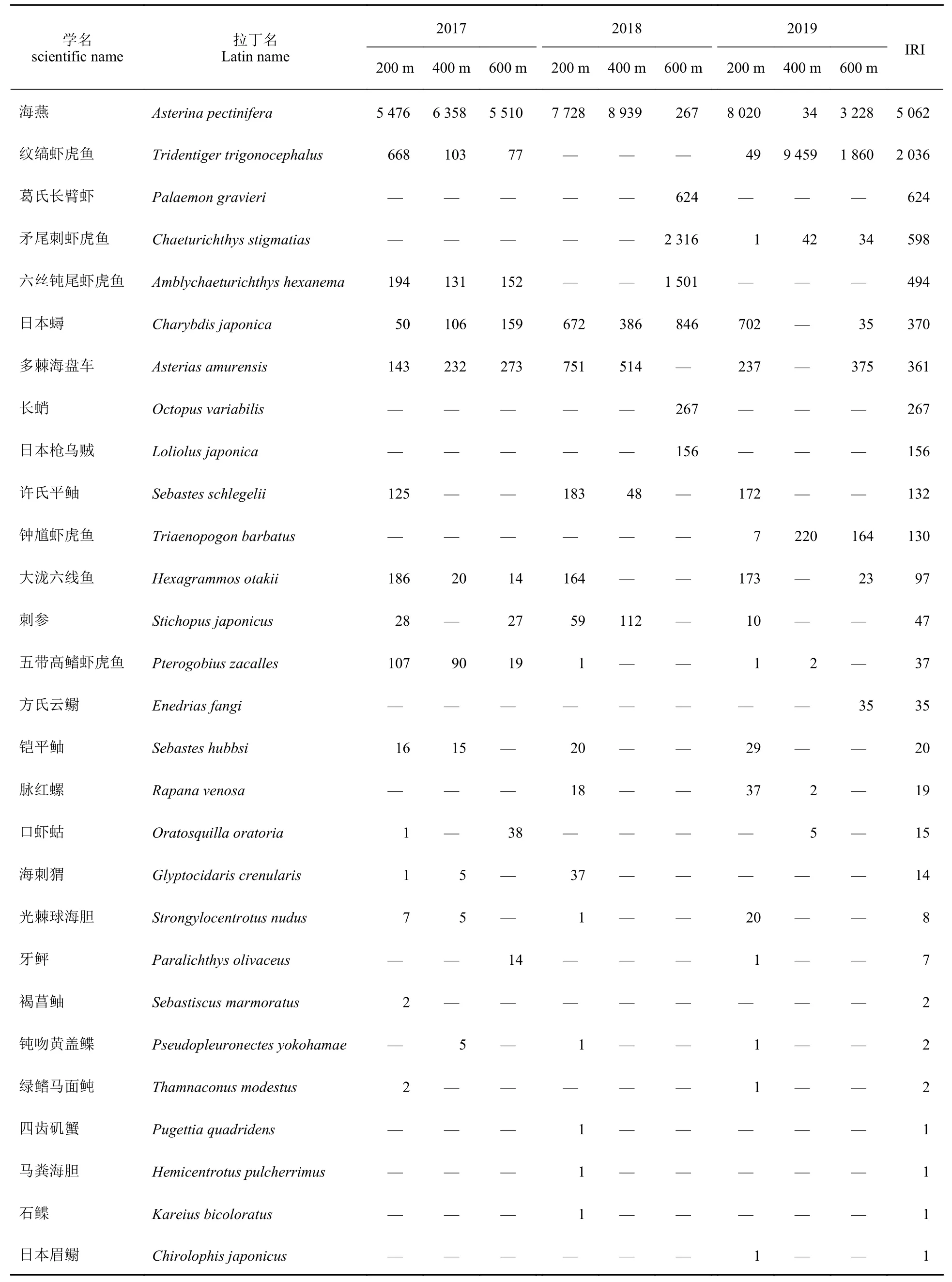
表2 水下摄像物种相对重要性指数分布Tab.2 Distribution of IRI for species from visual census
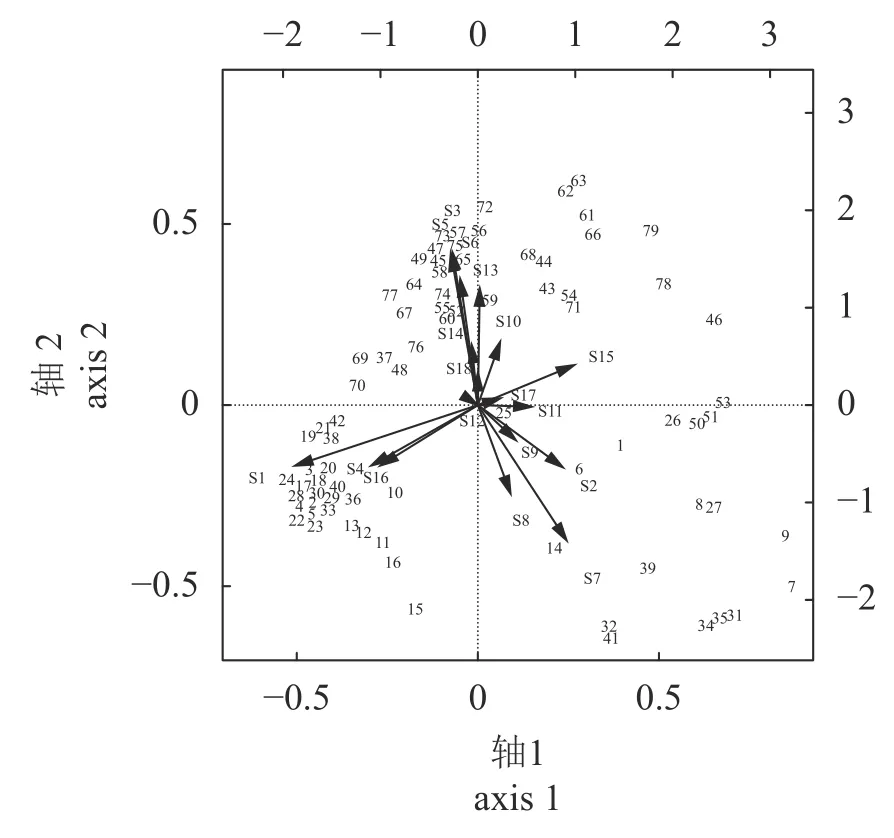
图2 常见种的主坐标分析双序图1~42.摄像,43~79.地笼。S1.海燕,S2.六丝钝尾虾虎鱼,S3.日本蟳,S4.多棘海盘车,S5.大泷六线鱼,S6.许氏平鲉,S7.纹缟虾虎鱼,S8.钟馗虾虎鱼,S9.矛尾刺虾虎鱼,S10.长蛸,S11.葛氏长臂虾,S12.日本枪乌贼,S13.梭形鱼,S14.平扁形鱼,S15.甲壳类,S16.棘皮类,S17.头足类,S18.腹足类。Fig.2 Double sequence diagram of PCoA with common species1-42.visual census;43-79.trap.S1.A.pectinifera,S2. A.hexanema,S3.C.japonica,S4. A.amurensis,S5. H.otakii,S6. S.schlegelii,S7. T.trigonocephalus,S8. T.barbatus,S9. C.stigmatias,S10. O.variabilis,S11. P.gravieri,S12. L.japonica,S13.fusiform fish,S14.flatfish,S15.Crustacea,S16.Echinodermata,S17.Cephalopoda,S18.Gastropod.
2.2 群落组成丰度对比
地笼调查结果显示,2018 年各区域平均CPUE [(6.66±1.54) 尾/(网·d)]和生物多样性指数(1.19±0.16)最低(图3-a,b) (P<0.05),与其他年份均有显著差异(表3)。2018 年的CPUE 较2017 年初投礁时差异最大(下降58.22%),而2019 年的CPUE 和生物多样性指数与2017 年没有显著差异。空间分布上,600 m 样带的平均CPUE [(7.50±3.88)尾/(网·d)]显著低于200 m 样带[(14.59±3.12)尾/(网·d),P<0.05]和400 m 样带[(14.42±1.76)尾/(网·d),P<0.1],但多样性指数在各区域之间无显著差异。水下摄像结果显示,2019 年CPUE [(19.60±5.42)尾/min]显著高于其他年份(图3-c,表4)。空间分布上,600 m 样带CPUE [(6.02±2.82)尾/min]显著低于200 m 样带[(15.55±2.27) 尾/min]和400 m样带[(17.63±4.90)尾/min]。然而生物多样性指数年际变化没有显著差异,但 200 m 样带(0.83±0.10)显著高于400 m 样带(0.53±0.10,P<0.1)。两种采样方法中区域和年份间的交互效应均不显著。
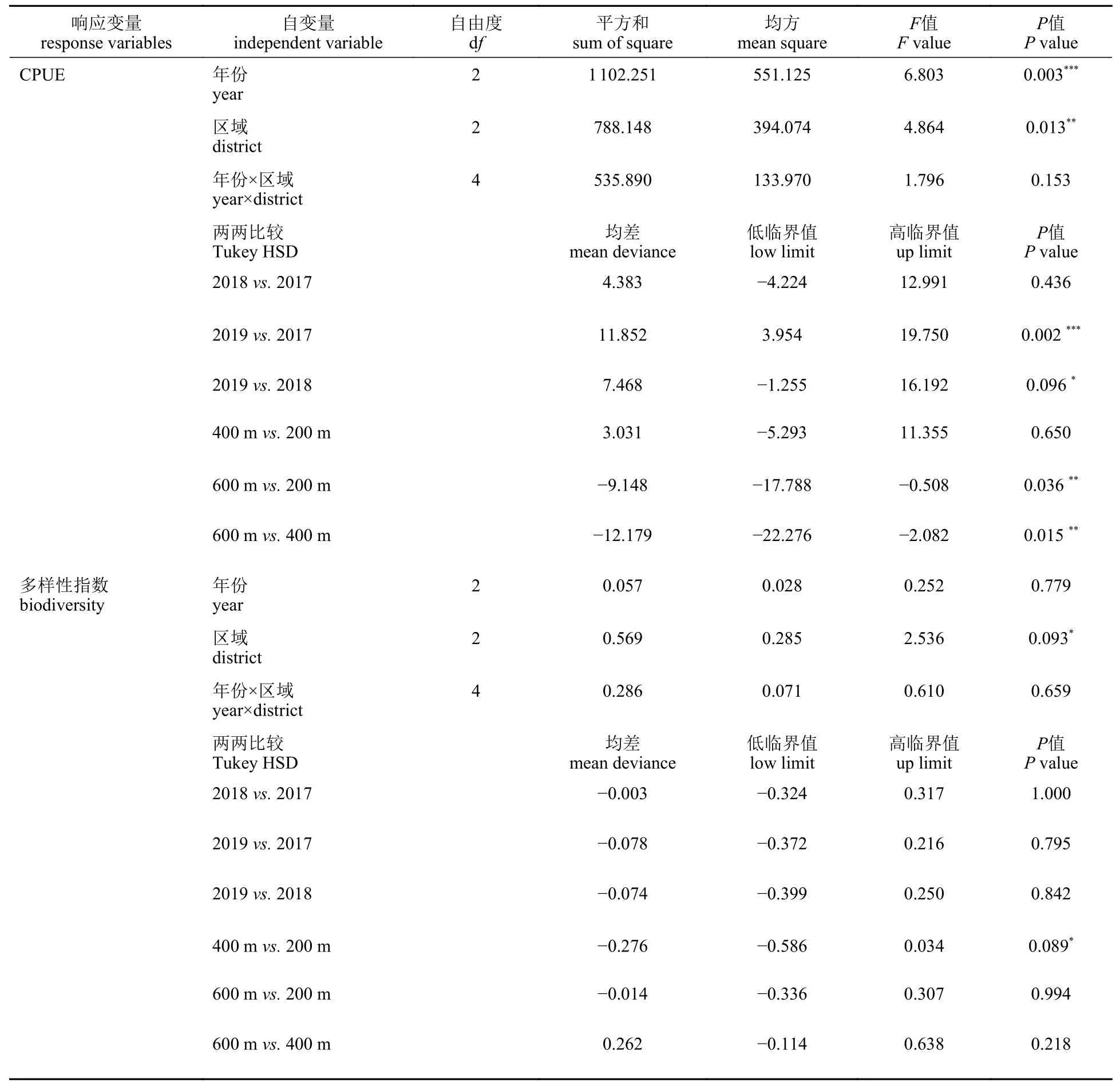
表4 摄像CPUE 和生物多样性指数的单因素方差分析Tab.4 One-Way ANOVA of biodiversity and CPUE for visual census
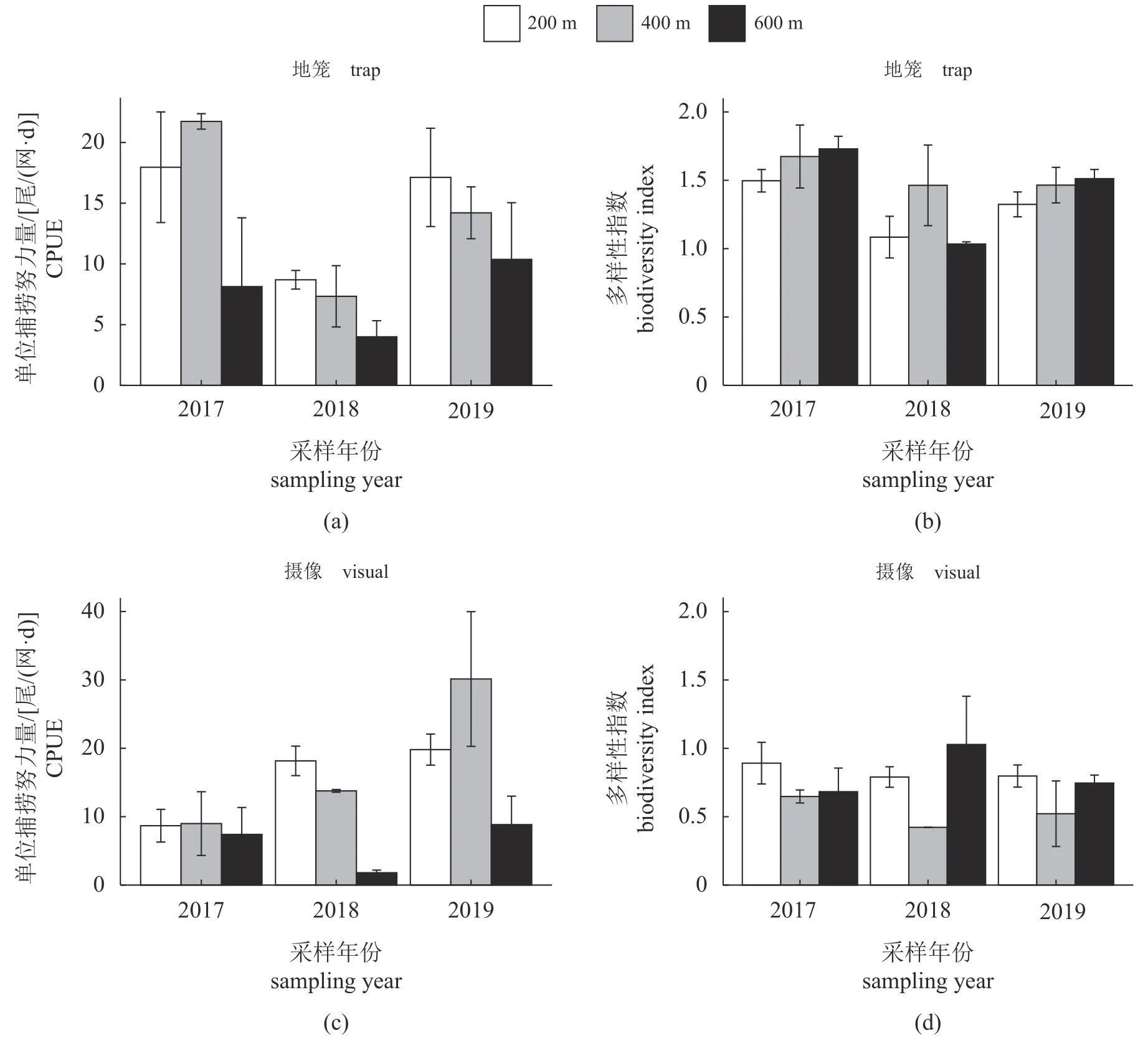
图3 CPUE 及多样性指数时空趋势图Fig.3 Temporal and spatial tendency of CPUE and biodiversity index
日本蟳、许氏平鲉和大泷六线鱼均为黄渤海重要经济物种[25],海燕为沿海敌害生物[26],本研究将探究4 种地笼优势种与其他5 大类动物共同的群落组成分布(图4-a~c)。地笼结果显示,3 年中,2018 年(投礁1 年后)日本蟳的聚集程度较强,200 m 样带中丰度比率提升至50.77%,海燕占比降至7.69%,2019 年两物种丰度占比恢复初投礁(2017 年)状态(图4-a);400 与600 m 样带均呈现海燕及其他棘皮类生物丰度占比逐年升高,甲壳类占比逐年降低的趋势(图4-b,c),其中棘皮类生物主要以多棘海盘车为主(表1,IRI=115),甲壳类以口虾蛄为主(IRI=710)。空间分布中,200 m 样带在2019 年才捕获除海燕以外的棘皮类、头足类及腹足类生物,丰度分别仅占0.38%、0.75%及0.38% (图4-a)。400 m 样带中5 类物种均有分布,2017 年日本蟳与其他甲壳类生物丰度占比居高,分别为23.26%和32.09% (图4-b),2018 年400 m样带4 大优势种丰度占比均衡,其中许氏平鲥占比最多,为25%,甲壳类达到15.91%。2019 年海燕占比37.98%,日本蟳恢复2017 年水平,其他甲壳类减少至4.65%。600 m 样带在2017 年时,海燕占比仅为7.48%,日本蟳与其他甲壳类分别为35.51%和29.91% (图4-c)。2018 年群落结构简单,日本蟳、棘皮类、头足类和腹足类生物均未捕获,大泷六线鱼与许氏平鲥占比分别为37.5%和29.17%。2019年各物种比例均衡,其中海燕占比最多,升至25.51%。

图4 群落结构组成丰度占比Fig.4 Abundance ratio histogram of community structure composition
摄像结果较地笼物种种类少,腹足类和头足类出现频率较低(图4-d~f)。与地笼结果相似,构件礁的投放对海燕和日本蟳在时空分布中也体现出了强聚集性:在200 m 样带中,海燕占比逐年升高,2017—2019年分别为70.41%、77.28%和80.2%。日本蟳趋势相同但占比较低,2017—2019年分别为1.51%、6.72%及7.02%。大泷六线鱼与许氏平鲥也主要在200 m 样带中捕获,各年份占比相似但均较低,仅为2.5% (图4-d)。400 与600 m 样带,梭形鱼类的丰度占比逐年提高(图4-e,f),这种趋势主要由纹缟虾虎鱼、矛尾刺虾虎鱼和六丝钝尾虾虎鱼主导(表2),其中,2019 年400 m样带中梭形鱼占比达到了99.28%。600 m 样带中,2017 年海燕占比最多,为82.66%,2018 年大幅降低为8.01%,而梭形鱼类从4.01%上升至57.25%,并与2019 年持平。
2.3 各因子对CPUE 及物种多样性指数的影响
CPUE 的最优GAM 模型表明,其受采样年份、采样方法、盐度、温度和底质类型分数影响显著(表5) (P<0.05)。结果显示,CPUE 随盐度及投礁年份的增加而增加(图5),当水温低于15 °C时,CPUE 随水温升高而升高,17~20 °C 时CPUE 最大,高于20 °C 时CPUE 处于缓慢下降的趋势。底质分数对CPUE 的影响呈钟形曲线趋势,当底质分数低于50 时(即小圆石、砂砾或泥底质),底质类型越复杂CPUE 越大,当底质为石块礁时CPUE 为最大值,当有人工构件礁存在时CPUE缓慢下降但仍高于小圆石、砂砾及泥底质。正态Q-Q 图和Shapiro-Wilk 检验验证了模型残差符合正态分布(图6-a) (w=0.981,P=0.290>0.05)。
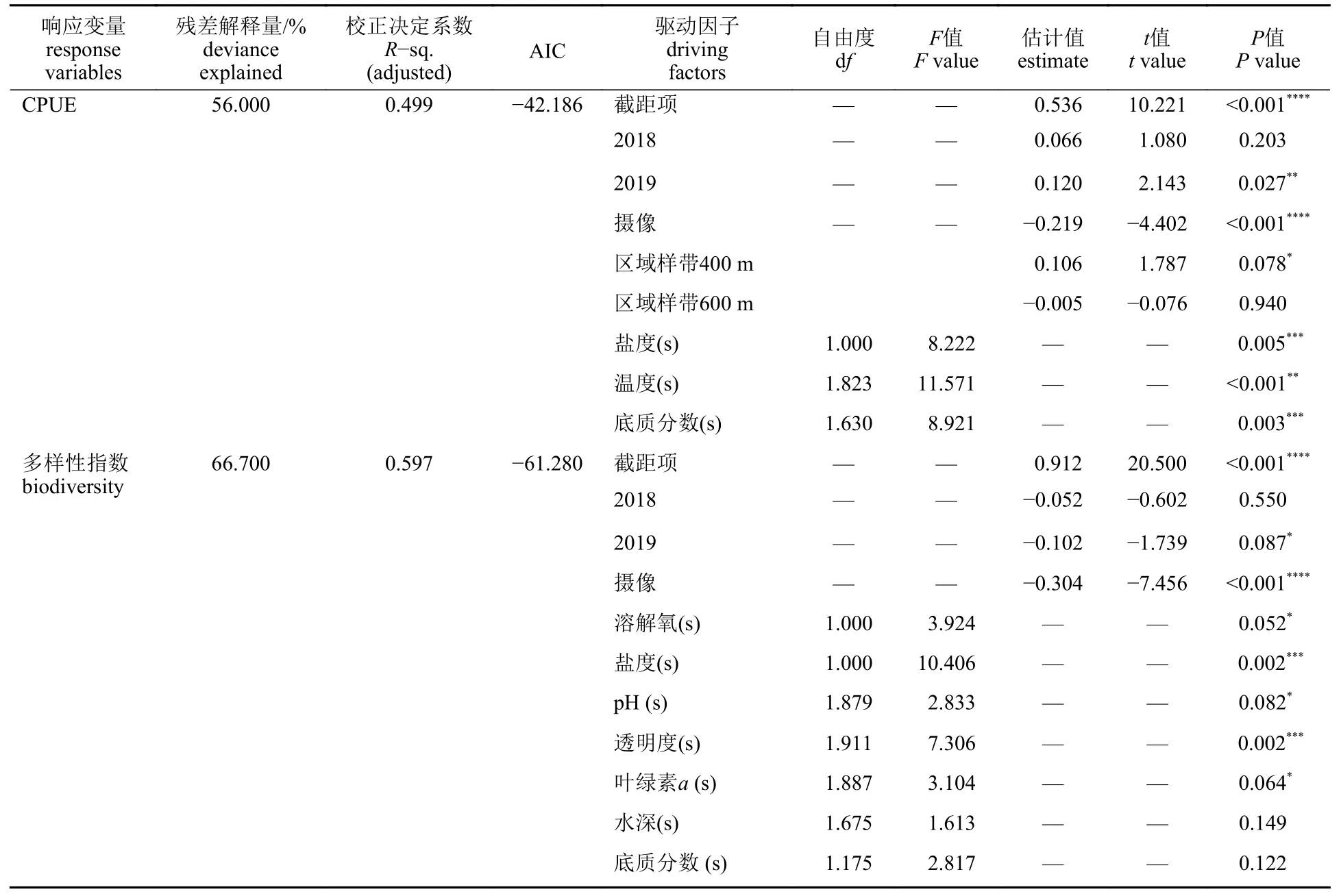
表5 多样性指数和CPUE 的GAM 最优模型Tab.5 Optimal Generalized Additive Model (GAM) for biodiversity and CPUE
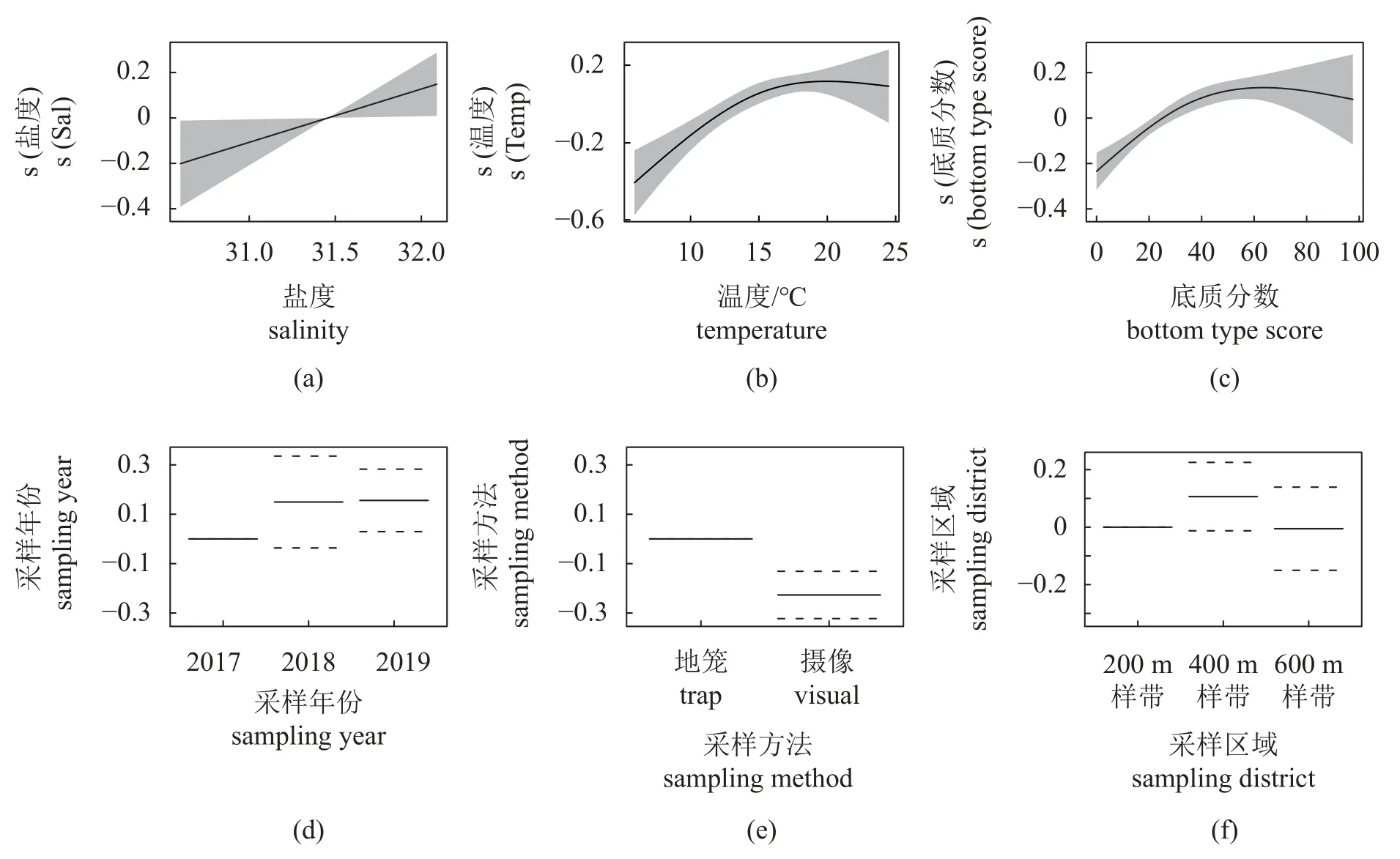
图5 各因子对CPUE 的影响Fig.5 Influence of factors for CPUE
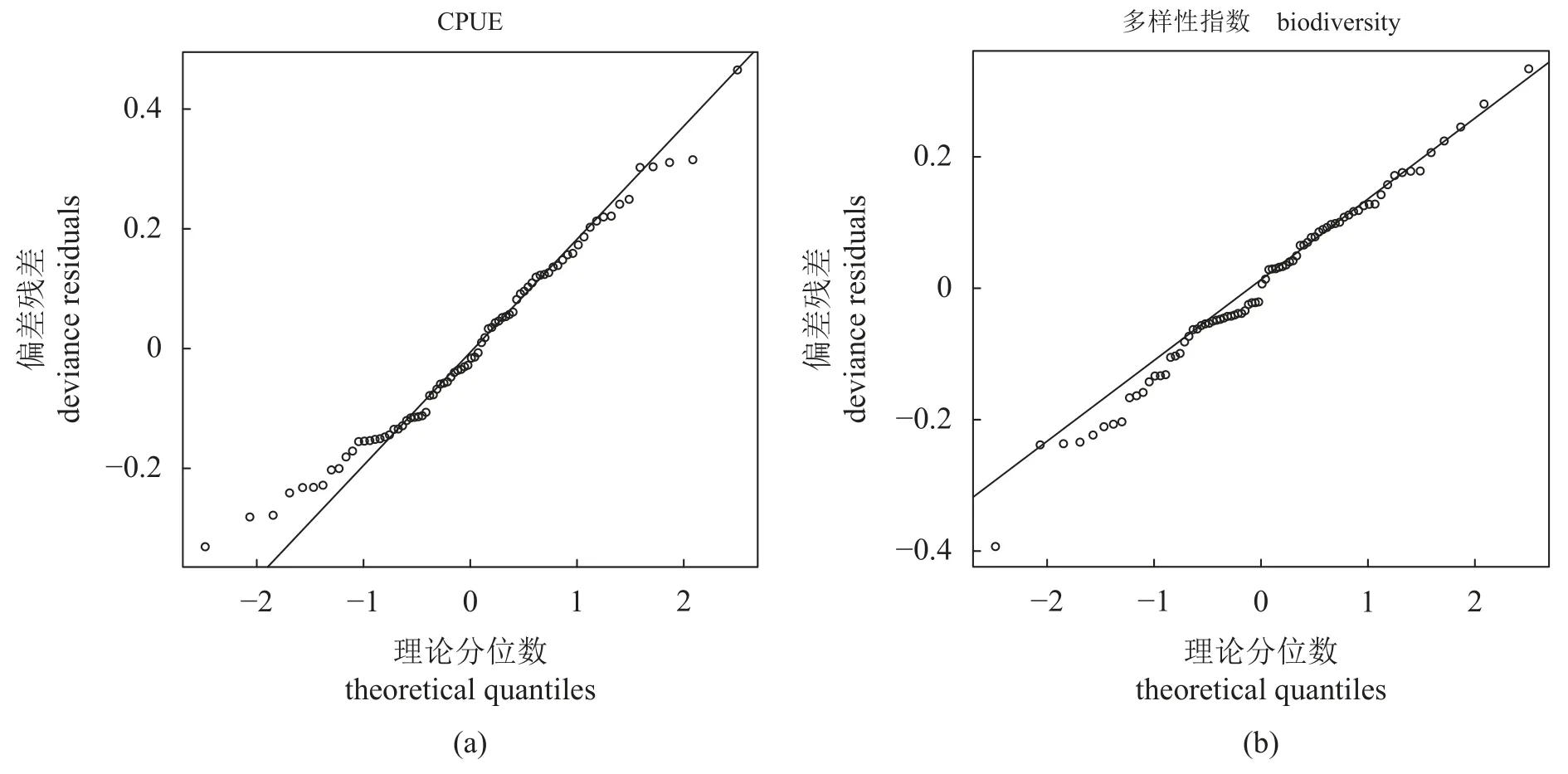
图6 CPUE 与多样性指数GAM 模型残差Q-Q 图Fig.6 Q-Q plot of GAM for CPUE and biodiversity index
多样性指数的最优GAM 模型表明,其受透明度、盐度及采样方法的影响显著(表5) (P<0.05)。结果显示,多样性指数随盐度下降而减少(图7)。透明度呈现倒钟形曲线趋势,在透明度为2.0~2.5 m 时多样性指数值最低,小于该值时变化幅度最大,并在0.5 m 时有最大值。与CPUE 情况相同,地笼的多样性指数显著高于摄像。正态Q-Q 图及Shapiro-Wilk 检验验证了残差符合正态分布(图6-b) (w=0.973,P=0.09>0.05)。整合地笼与摄像两种采样方法在各个年份及区域的CPUE、物种多样性指数及各环境数据的平均值(表6),进一步说明了GAM 结果与实际数值的一致性。
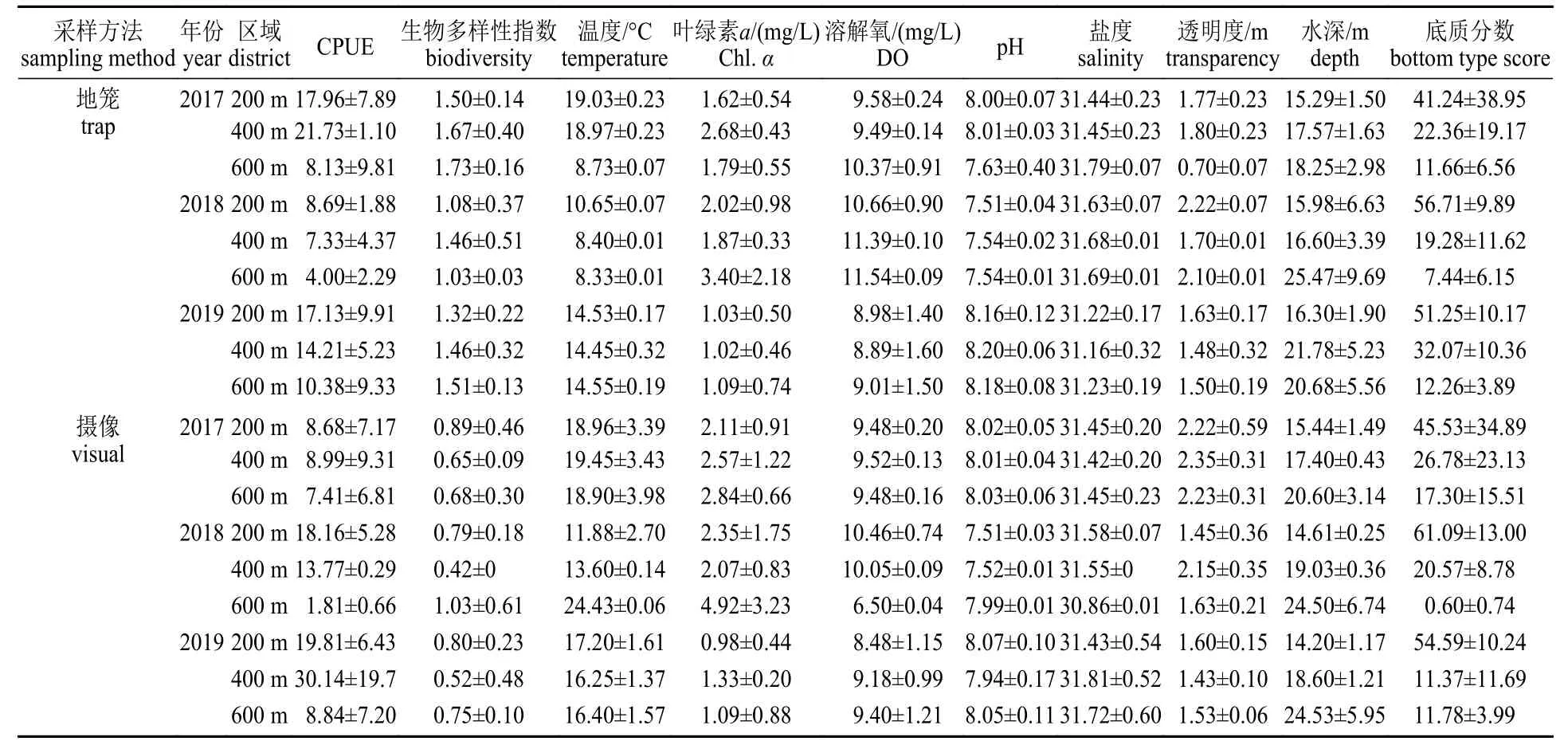
表6 地笼与摄像在不同年份及区域间采样的CPUE、物种多样性指数及环境变量均值Tab.6 Average±SD of CPUE,biodiversity index and all environmental variables among different sampling years and districts

图7 各因子对生物多样性指数的影响Fig.7 Influence of factors for biodiversity index
3 讨论
3.1 生物群落特征
地笼优势种大泷六线鱼、许氏平鲥及日本蟳与袁小楠等[27]在威海近岸、刘鸿雁等[28]在青岛崂山湾、陈勇等[29]在獐子岛人工鱼礁区中利用地笼及定置网的调查结果一致。地笼CPUE 的空间分布结果揭示了CPUE 在人工构件礁及石块礁区域(200 m 样带)比远礁区域(600 m 样带)增加了1倍(图3)。相反,多样性指数在空间中无显著差异,体现了鱼礁区对恋礁型物种的聚集性,且其他底质中非恋礁型物种同样广泛分布的特点。通过物种组成的对比,2017 年在200 m 样带中并未捕获除海燕以外的棘皮类、头足类与腹足类,而它们在2018 和2019 年的少量出现,体现了人工构件礁的投放对底层游泳生物的吸引及礁区优势种可能侵占了其他生物生态位的情况(图4)。摄像方法进一步证明,优势种虾虎鱼类主要分布在400 与600 m 样带中,因此人工鱼礁的投放不仅要关注恋礁型物种的资源增殖,还需要考虑为非恋礁型生物提供适宜的生态空间,确保偏好分布于软底质的物种的生态位不被大面积侵占与破坏[30]。
此外,海燕极高的丰度及广泛的分布模式在其他海域的人工鱼礁区中未见报道,本研究显示的物种组成中,随构件礁投放年份增加,400 与600 m 样带中海燕的占比逐年升高,平扁形鱼类占比逐年降低。这可能是由于海燕在生物链中是重要的捕食者,属于掠食性且食性范围广,繁殖力强,主要摄食海洋中的双壳类[31]、多毛类、甚至小型鱼类等[32],使与海燕一样以底栖生物为食的捕食性生物(如鲽类)的饵料生物大量减少[33],造成生态位的侵占。
3.2 环境因素的影响
底质类型是影响物种丰度CPUE 分布的重要因素,对比人工鱼礁与对照区的研究,也均证明了人工鱼礁的存在导致生物量CPUE 的成倍增加[9,28,34]。本研究表明,石块礁与人工构件礁对生物具有明显的聚集作用,由于构件礁位置被石块礁包围,难以区别二者之间的差异。但通过CPUE的GAM 模型结果,表明投礁年份具有显著影响,CPUE 与投礁年份成正相关,构件礁的投放对群落生物量增加具有积极效应。鉴于陈勇等[29]在獐子岛及刘鸿雁等[28]在青岛崂山湾人工鱼礁海域均设定调查时间为5—7 月,且刘鸿雁等[28]报告了5—7 月的生物种类较为丰富,故本研究调查时间的选取考虑到了本底调查对比,并选择种类丰富度高的月份进行采样。2018 年的采样月份温度较低,虽然温度是影响底栖生物分布的重要因素之一,较低的温度会造成物种种类减少、多样性降低[35-36],但这是基于地笼或定置网采样的结果。地笼CPUE在2018 年最低,摄像CPUE 却逐年升高,GAM 模型结果显示,CPUE 与多样性指数均未在2018 年处于最低值,因此采样方法的差异对结论的生成具有明显的影响,地笼与摄像结合可以更加全面地探究人工鱼礁区群落的分布特征。
3.3 采样方法的渔获性能差异
两种采样方法在CPUE 和物种多样性指数的分布趋势上并不一致,可能是由于采样工具的渔获性能和游泳动物行为特性差异引起的[25]。地笼是被动性捕捞渔具,渔获性能取决于渔具的网目形状和尺寸[37-38]。由于地笼作业方式简单,并不受底质类型限制,在人工鱼礁区渔业资源调查中被广泛应用[38]。水下摄像是一种非破坏性调查方法,近年来被澳大利亚、美国等国家的研究者广泛应用[7,39],但受限于海域的浑浊度、流速以及潜水员的专业技能等[40],调查结果与物种识别准确率有关,受生物个体大小影响较小。地笼与摄像的采样对象均为底层或近底层游泳生物,所以二者渔获组成拥有部分重叠,例如优势种的捕获。许氏平鲉、大泷六线鱼和日本蟳属于底层游泳生物,常栖息于岩石缝与礁体内侧[41],且游泳能力强,易被布设在水底表面的地笼捕获。日本鼓虾、口虾蛄及长蛸[42-44]等生物有穴居行为,摄像方法难以发现,故本研究地笼渔获中甲壳类与头足类生物丰度占比显著高于摄像(图4)。海燕由于在人工鱼礁区中丰度高、分布广,喜好贴附于礁石表面,游泳能力弱于其他优势种,所以在地笼和摄像中均被大量捕获。本研究摄像渔获中发现的虾虎鱼类数量多且个体较小,而地笼渔获中并未发现较多的虾虎鱼类,可能是其个体较小,易从地笼网目中逃逸所致。而如刺参等棘皮类生物因行动迟缓,喜好贴壁蠕动及常在岩石缝隙处活动[45],更易被摄像方法捕获。这种根据不同采样方法得
到的群落结构差异同时也说明了两种采样方法在鱼礁区调查中呈现了优势互补的作用。
4 结论
实验探究了小竹山岛人工鱼礁区多种底质中群落结构的差异,并分析了环境因子及不同采样方法对CPUE 及多样性指数变化的影响。CPUE受底质类型、采样方法、投礁年份及环境因子影响,构件礁及石块礁对底层游泳生物具有明显的聚集作用。多样性指数不依赖底质类型及投礁年份的变化,主要受采样方法及环境因子的影响。地笼比摄像易获得更高的CPUE 和多样性指数值,但两种采样方法在群落组成上具有明显差异。地笼与摄像方法结合调查,可在人工鱼礁区域形成优势互补,从而更全面地分析人工鱼礁对海域生物群落变化的影响。
(作者声明本文无实际或潜在的利益冲突)

