薏苡附子败酱散对肠上皮细胞屏障损伤的保护作用研究
彭君伟,周 帆,陈 江
(1.复旦大学附属肿瘤医院闵行院区中西医结合科,上海 220240;2.湖州市第三人民医院内科,浙江 湖州 313002;3.南京中医药大学苏州附属医院脾胃病科, 江苏 苏州 215009)
薏苡附子败酱散近年来被应用到溃疡性结肠炎(ulcerative colitis,UC)及炎症相关性结直肠癌(colitis-associated colorectal cancer,CAC)的治疗当中,取得较好的临床疗效[5-6]。研究证实,薏苡附子败酱散具有调节免疫、减轻炎症反应、促进肠黏膜修复等作用[7],但其对于肠黏膜屏障的保护机制尚未阐明。薏苡附子败酱散寒温并用、虚实兼顾,契合UC及CRC 脾肾衰惫为本,湿热毒邪为标的病机。本研究基于前期实验结果[7],建立脂多糖(lipopolysaccharides,LPS)诱导的 IEC-6 细胞损伤模型,观察薏苡附子败酱散纳入附子及单用附子的不同配伍对炎症损伤下肠上皮细胞屏障的影响,以期为薏苡附子败酱散治疗UC和CAC 提供实验依据。
1 材料与方法
1.1 实验细胞 大鼠小肠隐窝上皮细胞株(IEC-6),购自上海中乔新舟生物科技有限公司,货号:ZQ0783。
1.2 药物 全方组:薏苡仁30 g,附子6 g,败酱草15 g;去附子组:薏苡仁30 g,败酱草15 g;单用附子组:附子6 g,均购自苏州市春晖堂药业有限公司。各组药液浓缩至1 g 生药/mL,4℃保存。加入细胞前用完全培养基稀释至所需浓度,并过滤除菌。
1.3 主要试剂与仪器 DMEM 培养液(美国GIBCO公司,批号:1993895);四氮唑盐(MTT,批号:EZ2811A179);二甲基亚砜(AMERSCO 公司,批号:2015906);ELISA 试剂盒(杭州联科生物技术股份有限公司,批号:A382H80425、A306H80152);RIPA裂解液(上海基尔顿生物,批号:BYL40825);BCA蛋白定量试剂盒(Thermo 公司,批号:PICPI23223);ZO-1(批号:AF5145)、Occludin 一抗(美国Affinity公司,批号:DF7504);GAPDH(美国CST 公司,批号:#5174)。SpectraMax M2e 型酶标仪(Molecular Devices 公司);Millicell ERS-2 型伏特欧姆计(美国Millipore 公司)。
1.4 确定全方组的实验药物浓度
1.4.1 薏苡附子败酱散对LPS 诱导的IEC-6 细胞活力的影响 将IEC-6 细胞接种于96 孔细胞培养板,每孔100 uL(细胞数约1.0×105个)。设对照组、模型组和薏苡附子败酱散不同浓度组,共7 组,每组5个复孔。各组细胞培养24 h 后,对照组换液,其余各组吸弃上清,加入10 μg/mL 以完全培养基稀释的LPS 溶液继续培养24 h。之后对照组和模型组均加入100 μL 完全培养基,其余各组加入终浓度分别为0.5、1、5、10、20 mg/mL的以完全培养基稀释的全方药液。24 h 后,每孔加入5 mg/mL MTT 溶液10 μL,继续培养4 h 后,吸弃上清,每孔加入150 μL DMSO,水平摇床震荡,以酶标仪测定各孔吸光度(OD)值,比色选择490 nm 波长。各组细胞活率=实验组OD 值/对照组OD 值×100%。
1.4.2 薏苡附子败酱散对LPS 诱导IEC-6 细胞TNF-α、IL-6 分泌量的影响 IEC-6 细胞接种于24 孔细胞培养板,每孔约1.0×106个细胞,每组5 个复孔,分组、干预方法同“1.4.1”。培养24 h 后,分别吸取上清液至EP 管中,3 000 r/min 离心10 min,按照试剂盒说明书检测各组上清液中TNF-α 和IL-6 的含量。
1.5 全方、去附子和单用附子对LPS 诱导IEC-6 细胞活性的影响 IEC-6 细胞接种于96 孔细胞培养板,每孔约1.0×105个细胞,设对照组、模型组、全方组、去附子组和单用附子组,共5 组,每组5 个复孔。24 h后,对照组换液,其余各组加入10 μg/mL LPS 溶液继续培养24 h。之后对照组和模型组加入完全培养基,全方组加入终浓度为10 mg/mL 的全方稀释液,8.82 mg/mL 去附子和1.18 mg/mL 单用附子稀释液。24 h 后,以MTT 法检测各组细胞活率。
1.6 全方、去附子和单用附子对LPS 诱导的IEC-6 细胞分泌TNF-α和IL-6的影响 分组、干预方法同“1.5”,按试剂盒说明书检测各组细胞上清液中TNF-α 和IL-6的含量。
除此之外,笔者认为还有两篇值得关注的文章,一篇是杨振之先生从哲学角度提出的“诗意栖居说”[27],另一篇是胡传东先生从进化心理学角度提出的“心理适应说”[28](笔者姑且这样称之)。本文认为,杨振之先生的“诗意地栖居”一定程度上切近了旅游的本质。但由于其切入的路径是哲学的思辨,逻辑上虽有说服力,但比较缺少科学和事实的说服力。本文认为与其说是“诗意地栖居”,不如说是“流动地栖居”“迁移地栖居”更能反映出旅游的动态性特征,也更符合人类发展演化的历史事实。
1.7 全方、去附子和单用附子对LPS 诱导的IEC-6细胞紧密连接蛋白Occludin、ZO-1 表达的影响 将IEC-6 细胞漂洗后,加入裂解液后收集,12 000 r/min离心10 min。取上清液,采用BCA 试剂盒测定蛋白浓度。各组样本经分离、转膜、孵育一抗洗涤;二抗经HRP稀释、孵育、洗涤等步骤,再加入显影液曝光条带。以GAPDH 作为内参,通过Gel-PRO Analyzer 软件分析各组结果。
1.8 全方、去附子和单用附子对LPS 诱导的IEC-6 细胞跨细胞单层电阻的影响 将IEC-6 细胞以5×105/孔接种于Millipore Transwell 24 孔板上室,置于37℃,5% CO2培养箱中培养。接种第4 天开始,每2 天用Millicell ERS-2 伏特欧姆计监测单层IEC-6 细胞的跨膜电阻值(TEER)。待TEER 上升到平台期时,分组造模,方法同“1.5”。最后检测各组细胞TEER。
1.9 统计学方法 采用SPSS 19.0 统计软件,数据用均数±标准差(±s)表示,若符合正态分布资料数据组间比较采用单因素方差分析;若为非正态分布资料数据采用Mann-Whitney U 秩和检验。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 全方对LPS 诱导IEC-6 细胞活性及炎症因子表达的影响 与模型组比较,10 mg/mL 薏苡附子败酱散明显提高 LPS 损伤后的 IEC-6 细胞活率(P< 0.01),见表1,且明显降低 TNF-α 和 IL-6 分泌量(P< 0.01),见表2,增强细胞活性和抗炎作用均最佳,故以10 mg/mL 作为全方组后续实验浓度并以此换算出去附子组和单用附子组的浓度。
表1 不同浓度YFBS 对IEC-6 细胞活率比较(±s,n = 5)%

表1 不同浓度YFBS 对IEC-6 细胞活率比较(±s,n = 5)%
注:与对照组比较,## P <0.01;与模型组比较,△△P <0.01
组别细胞活率对照组100模型组70.94±4.25##0.5 mg/mL75.32±4.40 1 mg/mL80.86±4.21△△5 mg/mL85.25±4.43△△10 mg/mL88.87±5.97△△20 mg/mL82.80±5.45△△
表2 不同浓度YFBS 对IEC-6 细胞TNF-α 和IL-6 分泌量的影响(±s,n = 5) pg/mL

表2 不同浓度YFBS 对IEC-6 细胞TNF-α 和IL-6 分泌量的影响(±s,n = 5) pg/mL
注:与对照组比较,## P <0.01;与模型组比较,△P <0.05,△△P <0.01
组别TNF-αIL-6对照组 73.99±7.25117.71±4.69模型组106.45±7.12##149.20±6.32##0.5 mg/mL103.39±5.21147.08±6.16 1 mg/mL 98.51±4.93△142.48±4.68 5 mg/mL 91.67±5.00 △△133.63±7.00 △△10 mg/mL 83.12±5.25 △△124.06±7.06 △△20 mg/mL 95.24±5.71 △△135.92±8.28 △△
2.2 全方、全方去附子和单用附子对LPS 诱导的IEC-6 细胞活性的影响 3 组均能提高LPS 损伤后的IEC-6 细胞活率(P<0.05),但以全方组最高,去附子组次之,单用附子组最低,见表3。
表3 各组IEC-6 细胞活率比较(±s,n = 5) %
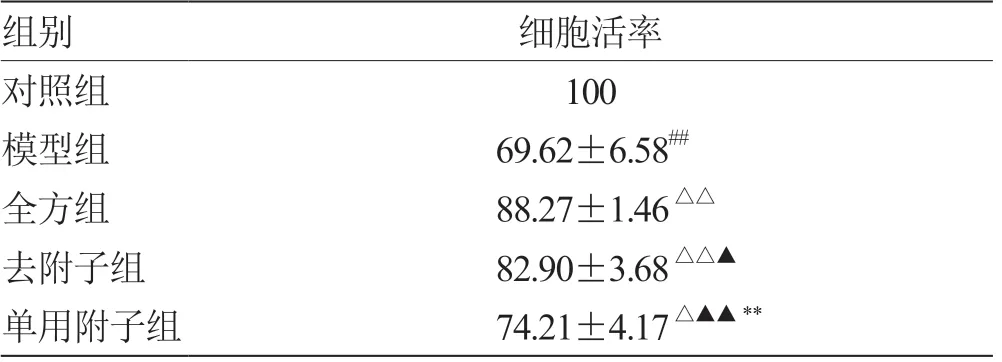
表3 各组IEC-6 细胞活率比较(±s,n = 5) %
注:与对照组比较,## P <0.01;与模型组比较,△P <0.05,△△P <0.01;与全方组比较,▲P <0.05,▲▲P <0.01;与去附子组比较,**P <0.01
组别细胞活率对照组100模型组69.62±6.58##全方组88.27±1.46△△去附子组82.90±3.68△△▲单用附子组74.21±4.17△▲▲**
2.3 全方、去附子和单用附子对LPS 诱导的IEC-6 细胞TNF-α 和IL-6 分泌量的影响 全方和去附子组均可明显降低LPS 诱导下TNF-α 和IL-6 分泌量(P<0.01),且全方和去附子组效应相当(P>0.05),单用附子组无明显作用(P>0.05),见表4。
表4 各组IEC-6 细胞TNF-α 和IL-6 分泌量的比较(±s,n = 5) pg/mL

表4 各组IEC-6 细胞TNF-α 和IL-6 分泌量的比较(±s,n = 5) pg/mL
注:与对照组比较,## P <0.01;与模型组比较,△△P <0.01;与全方组比较,▲▲P <0.01;与去附子组比较,*P <0.05
组别TNF-αIL-6对照组 66.52±5.91110.79±8.19模型组110.65±7.37##143.12±9.62##全方组 89.58±7.84△△119.10±8.00△△去附子组 93.18±2.82△△122.47±6.18△△单用附子组103.69±5.46▲▲*133.60±6.84▲▲*
2.4 全方、去附子和单用附子对LPS 诱导的IEC-6 细胞ZO-1 和Occludin 蛋白表达的影响 3 组均可减轻
LPS 对ZO-1 蛋白的破坏,3 组间两两比较均有统计学意义(P<0.05),即ZO-1 表达量全方组>去附子组>单用附子组。在Occludin 表达量上,全方组、去附子组均表达增高(P<0.01),单用附子组无明显作用(P>0.05),见表5,如图1。
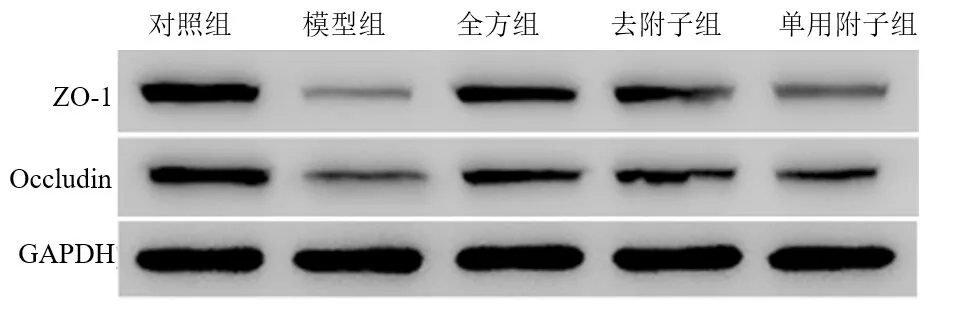
图1 各组IEC-6 细胞ZO-1、Occludin 蛋白表达量比较
表5 各组细胞ZO-1、Occludin 蛋白相对表达量(±s,n = 3) GAPDH
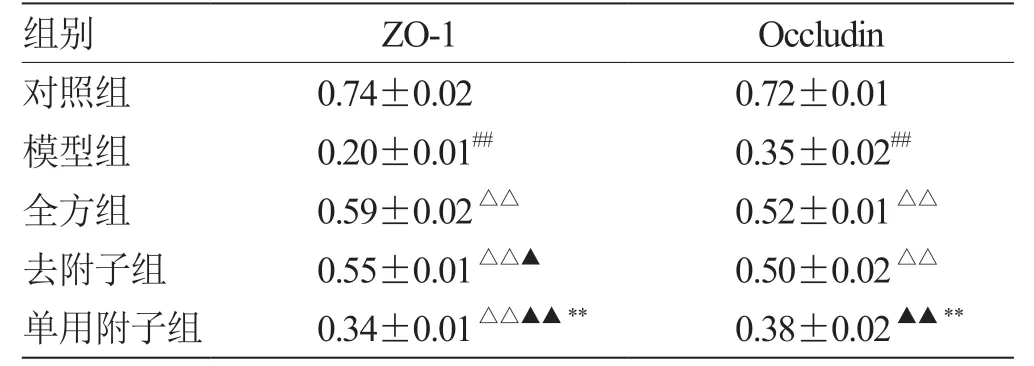
表5 各组细胞ZO-1、Occludin 蛋白相对表达量(±s,n = 3) GAPDH
注:与对照组比较,## P <0.01;与模型组比较,△△P <0.01;与全方组比较,▲P <0.05,▲▲P <0.01;与去附子组比较,**P <0.01
组别ZO-1Occludin对照组0.74±0.020.72±0.01模型组0.20±0.01##0.35±0.02##全方组0.59±0.02△△0.52±0.01△△去附子组0.55±0.01△△▲0.50±0.02△△单用附子组0.34±0.01△△▲▲**0.38±0.02▲▲**
2.5 全方、全方去附子和单用附子对LPS 诱导的IEC-6 细胞通透性的影响 与对照组相比,模型组TEER 值显著下降(P<0.01),与模型组相比,3 组均显著升高TEER 值(P<0.01)。各组相比,全方组TEER 最高(P<0.01),去附子和单用附子组没有明显差异(P>0.05),见表6。
表6 各组IEC-6细胞跨细胞单层电阻值(±s,n = 3)Ω·cm2
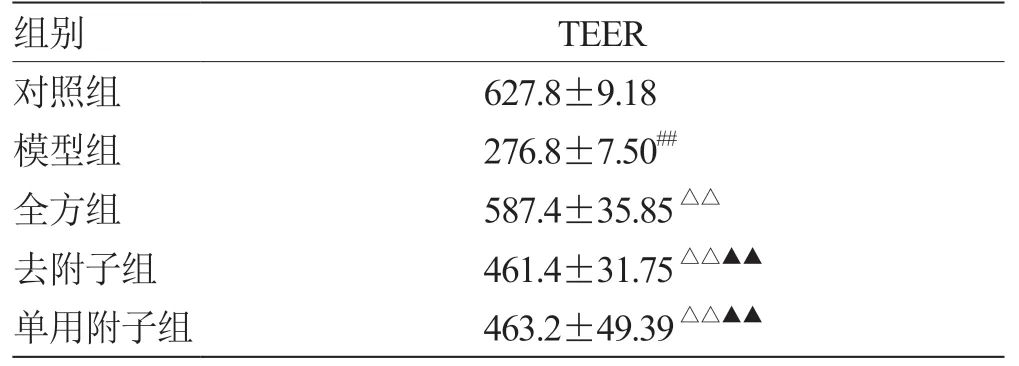
表6 各组IEC-6细胞跨细胞单层电阻值(±s,n = 3)Ω·cm2
注:与对照组比较,## P <0.01;与模型组比较,△△P <0.01;与全方组比较,▲▲P <0.01
组别TEER对照组627.8±9.18模型组276.8±7.50##全方组587.4±35.85△△去附子组461.4±31.75△△▲▲单用附子组463.2±49.39△△▲▲
3 讨论
肠上皮细胞既能交换营养物质,又充当着肠黏膜屏障的角色[8-9]。在病理状态下,维持肠上皮细胞的适度增殖是重建肠上皮屏障完整性的重要环节[10-11]。TJs在电镜下表现为紧密连接蛋白相互交错,包绕在相邻细胞的连接面上,以封闭细胞间隙。TJs 中的Occludin蛋白在调节细胞旁路渗透性中起到重要作用[12-13]。ZO-1 蛋白位于细胞质内膜表面,通过PDZ 结构域与绝大多数紧密连接蛋白及细胞骨架相连[14],对于维持TJ 的稳固性发挥重要作用。此外,ZO-1 和Occludin还发挥着促进细胞黏附、维持上皮极性、调控细胞增殖分化等功能。两者减少、缺失或移位均能引起肠上皮细胞间通透性的增加。肠上皮屏障的通透性可通过测定跨细胞电阻值(transepithelial electrical resistance,TEER)来反应,两者成反比,即TEER 越大,细胞通透性越低[15]。
薏苡附子败酱散中薏苡仁清热利湿,消痈利肠[16];败酱草泻热解毒,祛瘀排脓[17-18];少佐附子为妙用,既可扶助脾肾之阳以治本,又可辛通温散,以利湿热瘀毒排出。三药共奏温阳健脾、清热祛湿解毒之功[19]。临床实践也表明,薏苡附子败酱散加减对UC 具有较好的治疗效果[20]。为此,我们建立以LPS 刺激IEC-6细胞模拟肠黏膜屏障功能损伤模型,观察薏苡附子败酱散纳入附子及单用附子对炎症损伤后肠黏膜屏障的影响进一步佐证温阳解毒除湿治法治疗UC 和CAC 的合理性。
实验结果表明:全方组、去附子组均能够提高LPS 损伤下IEC-6 细胞的活率,降低炎症状态下的TNF-α 和IL-6 分泌量,上调ZO-1、Occludin 的表达,降低跨膜电阻值,降低上皮屏障通透性。全方组在提高细胞活率作用强于去附子组;在降低TNF-α 和IL-6分泌上2 组作用相当;在增加ZO-1 蛋白表达上,全方组强于去附子组,而对Occludin 的表达,2 组作用相当。单味附子无明显抗炎作用,但可以提高损伤细胞的活性,是全方良好增殖效应的基础之一。另外,单味附子虽然只对ZO-1 蛋白促表达有明显作用,但仍可明显降低黏膜通透性究其原因可能附子主要作用于其他紧密连接蛋白或涉及其他机制。可见,薏苡仁+败酱草主要作用在于抗炎、提高细胞活性,保护紧密连接蛋白;附子则主要集中在增强细胞活性、维持上皮屏障紧密性等作用,与前两味药相配使肠上皮屏障的保护作用发挥到最大。当然,全方的效应不是三味药药理作用的简单叠加,而是各有侧重,密切配合,其中的机制通路尚待进一步研究。

