槲皮素-3-O-葡萄糖苷抑制α-乳白蛋白非酶糖基化机制分析
张 露,徐林菊,彭春彦,王佩欣,谢作桦,谢 星,贾晓燕,涂宗财,3,*
(1.江西师范大学生命科学学院,国家淡水鱼加工技术研发专业中心,江西 南昌 330022;2.江西德上制药股份有限公司,江西 樟树 331200;3.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
糖基化反应是普遍存在于食物加工储存过程中还原糖羰基和蛋白质游离氨基之间的羰氨缩合反应,会形成一系列含氮和含氧杂环的异质荧光产物,如5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)、丙烯酰胺、活性自由基和晚期糖基化产物(advanced glycosylation end products,AGEs)等[1]。研究发现一些糖基化产物会对细胞或人体产生多种危害,如体内过多的5-HMF可促进肠道隐性病灶的发展[2];食物中的丙烯酰胺摄入过多会加速细胞凋亡和促进炎症反应,其代谢产物环氧丙酰胺也会通过攻击DNA造成机体损伤[3];AGEs在体内的积累会增加糖尿病、肾病、动脉粥样硬化等疾病的发生概率[4],因此,减缓非酶糖基化的反应进程和抑制有害糖基化产物的生成对提高食品安全,促进人体健康具有重要意义。
目前,人工合成的糖基化抑制剂氨基胍对非酶糖基化具有较好抑制效果,但其毒副作用强,会引起胃肠功能紊乱、肝功能异常、贫血等症状,已被临床上禁止使用[5]。多酚是天然抗糖基化剂的优质来源,具有高效、低毒和副作用小等特点,是目前的研究热点。据报道,多酚可通过清除自由基、影响蛋白质的空间结构、捕获甲基乙二醛等多种方式抑制糖基化过程以及糖基化产物的形成[6]。如:Wu Chihao等[7]发现槲皮素、山柰酚、异鼠李素和杨梅素可有效抑制卵清蛋白-果糖体系的糖基化反应,屏蔽卵清蛋白(ovalbumin,OVA)的糖基化位点,减少5-HMF等有害产物的形成。Jia Li等[8]发现狭叶沙枣花提取物及其主要成分丁香苷可与OVA自发结合,改变OVA的构象,减少其与果糖的结合位点,表现出显著的糖基化抑制效果。槲皮素-3-O-葡萄糖苷(quercetin-3-O-β-D-glucuronide,Q3G)是槲皮素的同系化合物,由于其葡萄糖苷部分α键的伸长使其生物利用度和安全性均优于芦丁及槲皮素[9]。前期研究发现,Q3G通过与牛α-乳白蛋白(bovineα-lactalbumin,α-La)相互作用,改变其构象,显著减少AGEs的形成,然而,其抑制机制尚不明确,需要进一步的探究[10]。
本实验以α-L a-果糖为糖基化模型,以Q3G为抑制剂,通过检测褐变程度和游离氨基、果糖胺、5-HMF等的含量,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析糖化导致的α-La交联,考察Q3G对非酶糖基化的抑制活性;然后,利用分子对接技术分析Q3G与α-La之间的相互作用关系,并运用超高效液相色谱-四极杆-静电场轨道离子阱串联质谱(ultra-high performance liquid chromatography-quadrupoleorbitrap tandem mass spectrometry,UPLC-Q-Orbitrap MS/MS)技术探究Q3G对α-La糖基化位点的影响,旨在揭示Q3G对非酶糖基化的抑制机制。
1 材料与方法
1.1 材料与试剂
Q3G、L-赖氨酸(L-lysine,Lys)上海源叶生物科技有限公司;氨基胍(aminoguanidine,AG)、尿素、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)美国Bio-Rad公司;乙腈、甲醇、甲酸(均为色谱级)上海阿拉丁生化科技股份有限公司;α-La 美国Sigma公司;三氟乙酸、邻苯二甲醛(o-phthaladehyde,OPA)、胰蛋白酶、糖化血清蛋白检测试剂盒、果糖及其他试剂(均为分析级)北京索莱宝科技有限公司。
1.2 仪器与设备
Synergy H1多功能酶标仪 美国BioTek公司;1260液相色谱仪 美国Agilent Technologies Inc科技公司;UPLC-Q-Orbitrap MS/MS仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 糖基化体系制备
参照文献[10]方法构建α-La糖基化体系。取1 mL 20 mg/mLα-La(pH 7.4,200 mmol/L磷酸盐缓冲溶液(phosphate buffered saline,PBS)含0.2%叠代钠)、1 mL 20 mg/mL果糖(溶于PBS)和100 μL不同浓度样品于试管中混匀,55 ℃反应24 h后快速冷却到室温,-4 ℃冰箱保存用于后续分析。以AG为阳性对照品,无水乙醇和PBS代替反应体系的Q3G和果糖为控制组和空白组。
1.3.2 游离氨基测定
参照刘俊等[11]的方法测定样品中游离氨基含量。取50 μL适宜浓度样品与1 mL OPA混匀,避光反应2 min后,取200 μL反应液于96 孔酶标板上,采用酶标仪测定其在340 nm波长处的吸光度,以PBS代替样品为空白对照。配制0~0.8 mg/mL的Lys标准品溶液用于制作Lys标准曲线,获得标准曲线y=1.6304x+0.1323,R2=0.9989。结果以Lys当量(mg/mL)表示。
1.3.3 果糖胺含量测定
采用糖化血清蛋白试剂盒测定样品中果糖胺的含量,详细方法参照试剂盒说明书。
1.3.4 褐变程度测定
参考Tu Zongcai等[12]的方法测定样品的褐变程度。取一定量5 倍稀释后的样品于96 孔酶标板上,采用酶标仪测定样品在294 nm波长处的褐变程度,以PBS代替样品作为空白对照。实验结果以A294nm表示。
1.3.5 5-HMF含量的测定
参照李军等[13]的方法测定样品中5-HMF的含量。取1 mL样品与100 μL 6 mol/L盐酸于试管中,沸水浴反应15 min,冷却至室温后,4000 r/min离心20 min,收集上清液,过0.22 μm滤膜,采用配备有Phenomenex C18柱(150 mm×4.6 mm,5 μm)的UPLC仪进行定量分析。色谱条件如下:流动相:A为0.1%的甲酸溶液,B为纯甲醇;流速:0.6 mL/min;柱温:25 ℃;紫外检测波长:285 nm;进样量:10 μL。采用30% B对样品等度洗脱20 min。配制1、2、2.5、5 μg/mL和7.5 μg/mL的标准品溶液用于制作5-HMF的标准曲线,获得标准曲线y=129.85x+330.94,R2=0.998。实验结果表示为μg/mL。
1.3.6 SDS-PAGE分析
参照刘俊等[11]的方法进行SDS-PAGE分析。制备5%浓缩胶和12%分离胶,并调节样品蛋白质量浓度至1 mg/mL,将蛋白质溶液与样品缓冲液以3∶1(V/V)的比例混合,沸水浴5 min。取10 μL样品进行SDS-PAGE分析,再用考马斯亮蓝染色液染色0.5 h,脱色24 h,拍照分析。
1.3.7 分子对接
从蛋白质数据库(protein data bank,PDB)获取α-La的3D结构(PDB编号:1F6S),从NCBI网站下载Q3G的三维结构(https://pubchem.ncbi.nlm.nih.gov/compound/5280804),再采用AutoDock Tools 1.5.6对α-La和Q3G的结构进行优化处理,生成.pdb文件,用于后续分子对接。利用Discovery Studio 2017软件拟合配体与氨基酸残基之间的相互作用关系,参数如下:对接盒子中心坐标(X,Y,Z:46.76,99.312,12.307),盒子大小为60 Å×60 Å×60 Å,格点间距0.375 Å,对接次数设为100,采用拉马克遗传算法进行拟合,并选择具有最低结合能的构象作为模型用于后续分析。
1.3.8 糖基化位点鉴定
1.3.81 样品的水解
参考ZhangLu等[14]的方法,使用SDT缓冲液(4% SDS、100 mmol/L Tris-HCl、1.0 mmol/L DTT,pH 7.4)、50 mmol/L IAA溶液(溶于UA缓冲液:8.0 mol/L尿素、150 mmol/L Tris-HCl,pH 8.0)和碳酸氢铵缓冲液(100 mmol/L,pH 8.5)对糖基化α-La溶液进行变性、还原和烷基化处理。然后用胰蛋白酶在37 ℃水解糖蛋白16 h,并用50%三氟乙酸溶液终止水解。最后将水解产物于14000 r/min离心10 min,收集过滤的蛋白水解肽用于UPLC-Q-Orbitrap MS/MS分析。
1.3.82 UPLC-Q-Orbitrap MS/MS分析
采用3000RSLCnano液相色谱系统对蛋白质水解肽进行分离。流动相A和流动相B分别为含0.1%甲酸的超纯水和含0.1%甲酸的乙腈组成。洗脱程序为:0~6 min,96% A、4% B;6~50 min,96%~75% A、4%~25%B;50~58 min,75%~60% A、25%~40% B;58~61min,60%~15% A、40%~85% B;61~66 min,15% A、85% B;66~73 min,96% A、4% B。流速300 nL/min;进样量2.0 μL。
采用UPLC-Q-Orbitrap MS/MS获取肽段的MS和MS/MS数据。MS参数为:负离子模式,质量扫描范围:m/z300~1800;裂解模式:电子转移解离(electron transfer dissociation,ETD)和高能碰撞解离;MS分辨率:60000;自动增益控制为:4×105;最大注射时间:50 ms;归一化碰撞能量:30 eV。MS/MS参数:分辨率15000;自动增益控制:4×105;最大注射时间:50 ms;归一化碰撞能量:30 eV。
1.4 数据分析
所有实验重复3 次,采用IBM SPSS 25.0软件进行统计学分析,结果以±s表示。通过单因素方差分析评价样品之间的差异显著性(P<0.05,差异显著);采用OriginPro 2017对数据进行作图(OriginLab Corp,USA)。
2 结果与分析
2.1 游离氨基含量
美拉德反应诱导的糖基化主要发生在Lys残基的ε-氨基上,而在组氨酸的咪唑基团、色氨酸的吲哚基团、精氨酸(Arg)残基的胍基和蛋白质的N端上发生的程度较低,因此,Lys残基上游离氨基的数量可反映糖基化的程度[15]。如图1所示,Q3G显著提高了糖基化过程中游离氨基的含量,呈现出剂量效应,且效果强于阳性对照品AG。当添加Q3G浓度为3 mmol/L时,体系中的游离氨基质量浓度最高,达0.693 mg/mL,约为控制组(0.521 mg/mL)的1.33 倍。以上结果表明Q3G阻止了α-La游离氨基参与糖基化反应,减缓了糖基化反应的进程,可能的原因是Q3G通过清除活性自由基减少了游离氨基的氧化。Dias等[16]通过荧光分析测定氨基酸氧化的标记物也发现槲皮素和芦丁有同样的效果,与本研究一致。
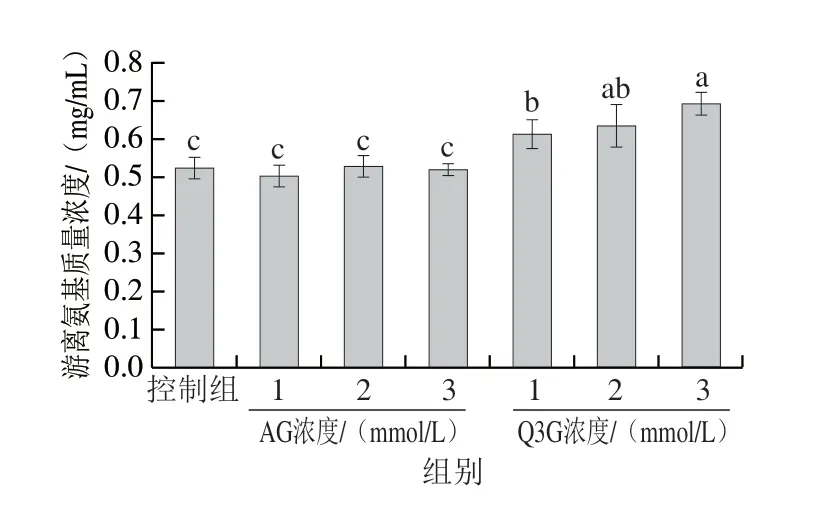
图1 Q3G和AG对糖基化过程中游离氨基含量的影响Fig.1 Effects of Q3G and AG on the content of free aminos in α-La/fructose glycosylation system
2.2 果糖胺分析
果糖胺是非酶糖基化早期标志物,通过测定其含量可考察Q3G对非酶糖基化早期反应的抑制能力。如图2所示,Q3G显著抑制了糖基化过程中果糖胺的形成,且存在浓度依赖性。当Q3G添加浓度为1、2 mmol/L和3 m m o l/L 时,果糖胺浓度分别为1.69、1.21、1.26 mmol/L,显著低于控制组(2.09 mmol/L)和AG组(P<0.05)。同时,添加2 mmol/L与3 mmol/L Q3G的反应体系中果糖胺含量无显著差异(P>0.05),表明添加2 mmol/L的Q3G对果糖胺生成的抑制作用已达到峰值。以上结果表明Q3G能延缓糖基化早期反应的进程,这可能是由于Q3G参与螯合金属离子,降低了糖化蛋白的氧化作用[17];同时,Q3G可能通过与α-La形成络合物,影响了游离氨基对还原糖羰基的可及性,进而减少了果糖胺的形成[18]。
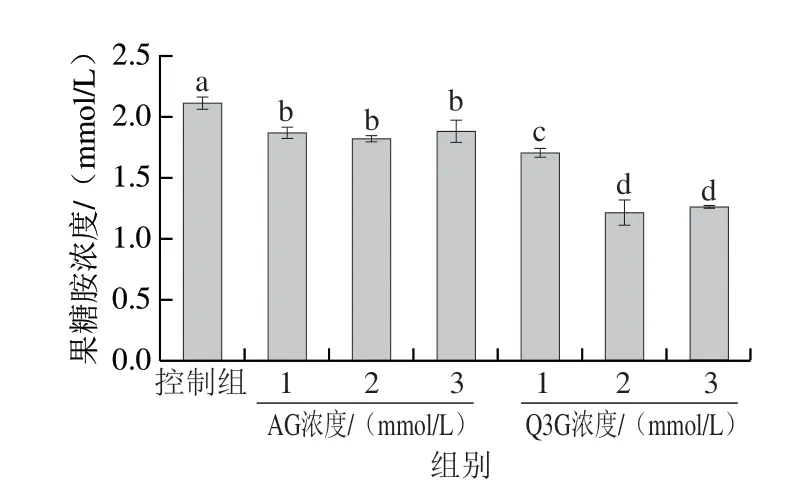
图2 AG和Q3G对糖基化过程中果糖胺浓度的影响Fig.2 Effects of AG and Q3G on the concentration of fructosamine in α-La/fructose glycosylation system
2.3 褐变程度分析
糖基化反应初期产物进一步裂解氧化,产生一系列小分子,这些小分子是褐色色素形成的主要前体物质,通过测定294 nm波长处的吸光度反映其含量,并体现样品褐变程度[19]。如图3所示,控制组、添加1、2 mmol/L和3 mmol/L Q3G实验组的吸光度分别为1.1、1.026、1.096、1.104,Q3G的添加改变了反应体系在294 nm波长处的吸光度,含1 mmol/L Q3G实验组效果最好,其吸光度显著低于控制组;含3 mmol/L Q3G实验组的吸光度与控制组和3 mmol/L AG组(1.107)无显著差异(P>0.05)。以上结果说明Q3G显著抑制了糖基化导致的褐变,这可能是由于Q3G通过自由基清除活性减缓了初期产物的氧化裂解[20-21]。Zhang Lu等[14]也报道,槲皮素、山柰酚、异鼠李素和杨梅素等黄酮醇化合物能缓解OVA-果糖糖基化引起的褐变,且呈剂量依赖性。另外,多酚的邻苯二酚基团会氧化成醌导致褐变,这可能是高浓度Q3G导致褐变程度加深的原因[22]。
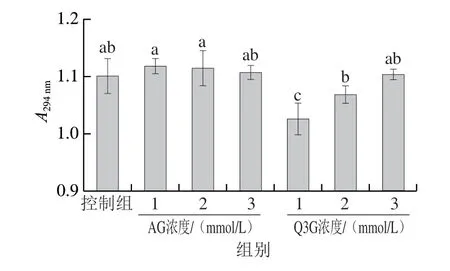
图3 Q3G和AG对糖基化过程中褐变程度的影响Fig.3 Effects of Q3G and AG on browning degree in α-La/fructose glycosylation system
2.4 5-HMF含量的测定
5-HMF是还原糖通过异构和脱水产生的呋喃化合物,是糖基化反应中期的标志性产物[23],如图4所示,添加1、2、3 mmol/L的Q3G后,体系中5-HMF质量浓度由165.28 μg/mL降至111.64、145.09 μg/mL和158.34 μg/mL;添加1 mmol/L Q3G的α-La-果糖糖基化体系中5-HMF含量最低,显著低于相同添加量的AG(116.26 μg/mL)(P<0.05)。然而,随着Q3G浓度的升高,5-HMF含量呈现升高的趋势。当Q3G浓度低于2 mmol/L时,其能显著减少5-HMF的形成。代杨艳[24]报道,茶多酚显著降低了糖基化过程中5-HMF的生成,与本研究结果相似。此外,前期研究发现,当Q3G浓度为36.58 μmol/L时,其对AGEs的抑制率可达74.66%[10],表明Q3G能显著延缓晚期糖基化反应的进行,造成中期产物如5-HMF等的积累。
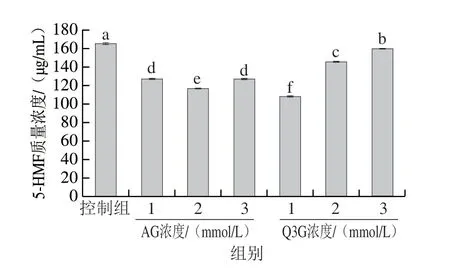
图4 Q3G和AG对糖基化过程中5-HMF生成的影响Fig.4 Effects of Q3G and AG on the generation of 5-HMF in α-La/fructose glycosylation system
2.5 SDS-PAGE分析结果
α-La由123 个氨基酸残基组成,分子质量大约为14.2 kDa,糖基化会导致蛋白质交联而使得其分子质量增大如图5所示,控制组在14.4 kDa略下方和31 kDa处各有一明显条带,表明糖基化会引发α-La的交联。卜单等[15]也发现糖化α-La在SDS-PAGE中存在相似的条带。添加Q3G之后,31 kDa处蛋白条带与控制组相比明显变浅,当Q3G浓度为2 mmol/L和3 mmol/L时,31 kDa处条带的颜色差异不明显,但显著浅于AG组。以上结果说明Q3G能抑制糖化导致的α-La交联,添加量为2 mmol/L时的抑制效果最好。Wu Chihao等[7]也通过SDS-PAGE发现,槲皮素、儿茶素、芦丁等化合物也能显著减轻糖基化引起的蛋白交联。

图5 Q3G和AG对糖化α-La交联的影响Fig.5 Effects of Q3G and AG on cross-linking degree of glycated α-La
2.6 分子对接分析
分子对接常用于研究小分子化合物和蛋白的相互作用机制。经过100 次模拟之后,选用结合能量最低(-8.51 kcal/mol)最稳定的模型进行后续的分析(图6A)。从对接结果可以看出,Q3G可进入α-La的疏水口袋中,通过疏水作用力、范德华力和氢键与其氨基酸残基进行结合。由图6B、C可知,Q3G和α-La的氨基酸残基Glu49、Gln54、Lys58、Tyr103、Ala106形成了5 个氢键,与氨基酸残基Thr33、Asn44、Ser47、Phe53、Asn56、Ile59、Trp60形成了范德华力,并和氨基酸残基Trp104、Leu105形成疏水相互作用。Zhang Yuanyuan等[25]也发现Ser-47、Glu-49、Gln-54、Asn-56、Tyr-103、Trp-104、Leu-105、Ala-106、Thr-33等氨基酸残基是α-La的活性位点。研究发现,小分子化合物受氢键、范德华力和疏水相互作用驱动,能自发与蛋白质形成稳定络合物,并影响其构象[10,26]。比如:牡荆素是一类经典的黄酮类化合物,与蛋白质,如牛血清白蛋白(bovine serum albumin,BSA)结合时,氨基酸残基Glu424、Leu112、Asp111和Thr518与牡荆素的B环或其他羟基形成氢键稳定蛋白质结构,进而阻止BSA与果糖的反应产物形成[27]。因此,Q3G可能是通过与α-La的活性位点结合形成稳定的络合物,影响其空间结构变化,进而影响了果糖与α-La的反应,达到抑制糖基化的早、中和晚期产物形成的效果。
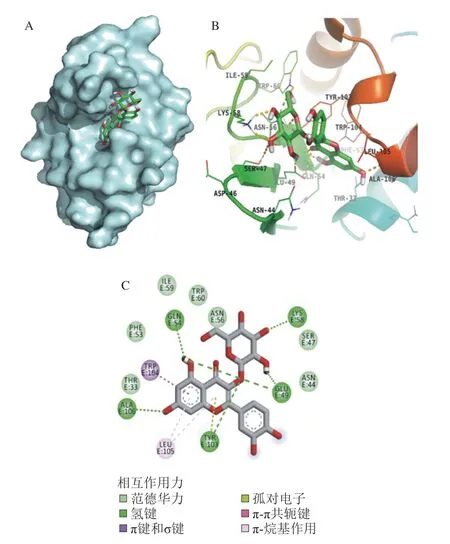
图6 Q3G与α-La结合的最优三维构型(A)、Q3G与α-La氨基酸残基相互作用的三维(B)和二维(C)示意图Fig.6 Optimal 3D docking conformation of α-La with Q3G (A),and 3D (B) and 2D (C) schematic diagram of Q3G interacting with the amino residues of α-La
2.7 糖基化位点鉴定
为更好地阐明Q3G对α-La-果糖糖基化的抑制机制,采用UPLC-Q-Orbitrap MS/MS技术研究Q3G对α-La糖基化位点的影响。糖化的多肽可通过对比其糖化前后的质量偏移进行确定。Lys、Arg和N末端的氨基是蛋白质的潜在糖化位点,而胰酶不会破坏Lys、Arg的糖基化修饰,因此,将C系列和Z系列离子与已发现的蛋白质组中记录的离子匹配可对糖基化位点进行表征。果糖相对分子质量为180,当一分子果糖连接到Lys上时,C(n)和C(n-1)之间或Z(m-n)和Z(m-n+1)之间的质量偏移为162+128,而Arg为162+156(其中m为特定肽段中氨基酸残基的数目,n为Lys/Arg的位置)。当多肽所带电荷为+1、+2、+3、+4时,单糖基化肽段质荷比(Δm/z)分别增加162.0528、81.0264、54.0176和40.5132;而双糖基化肽段m/z分别增加324.1056、162.0528、108.0352和81.0264。如图7A、B所示,未糖基化肽段109~122(ALCSEKLDQWLCEK)和115~123(LDQWLCEKL)的m/z峰值分别为593.95713+和602.80592+,糖化之后其m/z分别增加了54.0116和81.0263,表明肽段109~122和115~123均被一分子果糖糖化。肽段95~108(ILDKVGINYWLAHK)的m/z由418.25444+增加至458.75444+,可推断该肽段结合了一分子果糖,Lys98和Lys108是其潜在的糖化位点,利用肽谱(图7C)分析发现,C4+的m/z为649,C3+的m/z为359,表明C4位(Lys98)发生糖基化。同理,C14或Z1位未发现相应规律,即Lys108不是糖基化位点。参照其鉴定规律,从添加Q3G前后糖化α-La中分别鉴定出6 个和5 个糖基化位点(表1)。Zhang Lu等[28]通过质谱鉴定也发现了α-La的糖基化位点Lys62、Lys93、Lys98和Lys114。
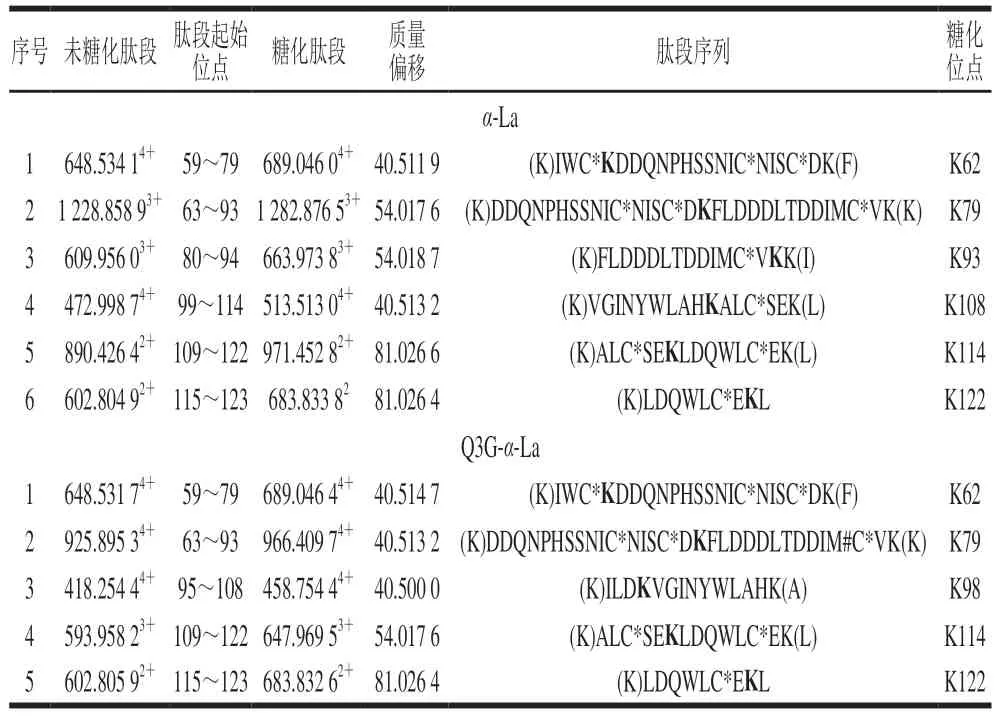
表1 胰酶消化后检测到的糖基化多肽Table 1 Glycosylated peptides detected after trypsin digestion

图7 单个糖化肽109~122和113~123的MS谱(A和B)和单个糖化肽95~108的ETD MS/MS谱图(m/z 458.75444+)(C)Fig.7 MS spectra of single glycosylated peptides 109–122 and 113–123(A and B),and ETD MS/MS spectra of single glycosylated peptide 95–108 (m/z 458.75444+) (C)
已有研究证明,糖基化位点的增加和减少与黄酮化合物诱导蛋白质Lys残基周围的构象结构和微环境的变化有关[29]。Zhang Lu等[28]报道,槲皮素可以阻止糖基化诱导的BSA结构的展开,改变Lys残基的微环境,从而使BSA糖基化位点减少了一个。如图8所示,受影响的糖基化位点Lys108、Lys93和Lys98位于Q3G所在的疏水口袋内,说明Q3G可能通过稳定α-La构象并影响Lys残基的微环境,导致α-La的糖基化活性位点减少了一个,达到延缓糖基化进程和减少有害糖基化产物形成的效果。
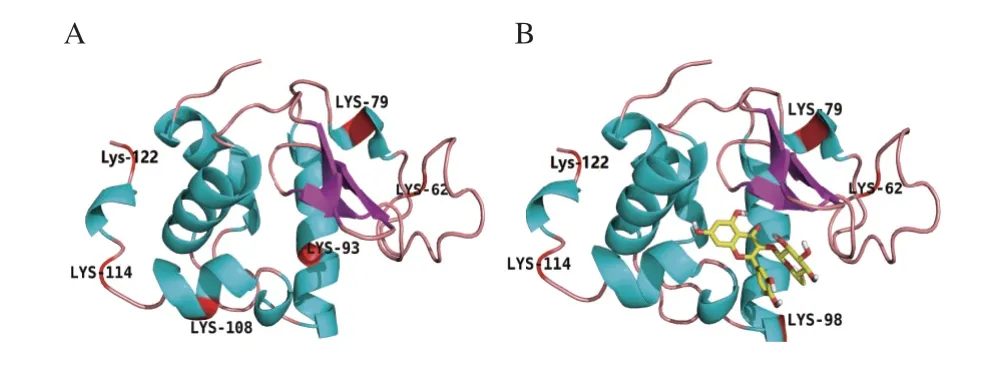
图8 α-La(A)和Q3G-α-La(B)的糖基化位点示意图Fig.8 Schematic diagram of glycated sites of α-La (A) and Q3G-α-La (B)
3 结论
以Q3G为研究对象,通过构建α-La-果糖糖基化模型,考察Q3G的非酶糖基化抑制作用及其机制。结果发现,Q3G的添加能显著增加游离氨基含量,且3 mmol/L Q3G可将游离氨基质量浓度提高0.172 mg/mL。同时,Q3G能抑制果糖胺及5-HMF的产生,缓解糖基化导致的褐变及α-La交联;其中,2 mmol/L Q3G对果糖胺和交联α-La的抑制作用最佳。低浓度的Q3G对5-HMF和褐变程度的抑制效果最好,且随着Q3G浓度升高而有所减弱,但是Q3G抑制效果显著强于AG。另外,Q3G能缓解糖化α-La的交联,且添加量为2 mmol/L时效果最好。分子模拟研究发现Q3G能通过氢键、疏水相互作用和范德华力与α-La的活性氨基酸残基Glu49、Gln54、Lys58、Tyr103、Ala106、Thr33、Asn44、Ser47、Phe53、Asn56、Ile59、Trp60、Trp104、Leu105作用,改变其疏水口袋内的微环境,从而影响氨基酸残基与果糖的结合,抑制非酶糖基化反应。同时,UPLC-Q-Orbitrap MS/MS分析也发现Q3G屏蔽了α-La的糖基化位点Lys93和Lys108,新增了糖基化位点Lys98,达到延缓非酶糖基化和减少有害糖基化产物形成的效果。综上,Q3G具有很强的抗糖基化能力,可作为抗糖基化剂或者功能食品配料用于预防糖尿病并发症。然而,Q3G是否能够添加到食品中发挥抗糖化作用还有待进一步研究。下一步工作计划通过动物实验验证Q3G对体内AGEs形成的抑制效果以及对糖尿病并发症的预防作用。

