蛋黄中免疫球蛋白提取副产物的综合利用研究
高净乐, 顾璐萍, 常翠华, 李俊华, 杨严俊, 苏宇杰*
(1. 江南大学食品科学与资源挖掘全国重点实验室, 江苏无锡 214122;2. 江南大学国家功能食品工程技术研究中心,江苏无锡 214122;3. 江南大学食品学院,江苏无锡 214122)
蛋黄中含有多种优质蛋白质, 氨基酸配比均衡,消化率高达98%,生物学价值高达96,远远高于其他动植物性食物蛋白质的消化率和生物学价值[1]。此外,蛋黄中还含有免疫球蛋白(immunoglobulin of egg yolk,IgY)、卵磷脂、卵黄高磷蛋白等活性成分,具有极高的营养价值。其中,IgY 因具有良好抑菌活性以及廉价易得、不产生耐药性等优点,有望部分代替抗生素用于细菌感染性疾病的治疗及提高免疫力[2]。 与传统IgY 提取方法相比,冻融-水稀释法[3]能有效简化提取流程、提高产品纯度,因而成为一种极具应用前景的IgY 提取新方法。 然而,在冻融-水稀释法提取IgY 过程中将会产生大量的副产物—冻融蛋黄颗粒 (freeze-thaw egg yolk pellet,FYP)。FYP 因经过冻融和高速剪切处理而发生严重变性,几乎丧失其原有的溶解性、乳化性等功能特性,无法直接用于食品加工,大大降低了蛋品的附加值。 此外FYP 中还含有丰富的蛋白质与脂质,具有极高的营养价值, 若不加以利用而直接丢弃,势必造成蛋黄资源的严重浪费。 因此,如何充分利用FYP 成为IgY 提取与蛋黄资源综合利用中一个亟待解决的课题。
近年来,限制性酶解技术因能显著改善蛋白质功能性质而被广泛应用于各种蛋白质原料,如大豆蛋白[4]、乳清蛋白[5]、蛋黄粉[6]等。 Gu 等发现限制性酶解可使大分子蛋白质分解为小分子的肽或氨基酸,从而提高蛋白质的溶解性[7];Bao 等认为溶解性与蛋白质的其他功能性质密切相关,如乳化性等,并对碱性、 中性及风味蛋白酶的水解效果进行了比较,结果表明碱性蛋白酶能更显著提高蛋白质的功能性质[8]。 因而采用限制性酶解将有望改善FYP 的溶解性及其他功能特性,拓宽其应用领域。
此外,针对FYP 不易保存的问题,可将经酶解后的FYP 进行喷雾干燥处理,得到酶解蛋黄颗粒干粉(hydrolyzed egg yolk pellet powder,HYP)。HYP 水分含量低,在运输与保质期方面有显著优势。 然而,其脂肪质量分数为50%~60%, 胆固醇质量分数为20 mg/g,这显然与目前大众追求的健康低脂消费观相违背。 因此,选择合适的方法对HYP 中的油脂进行分离,一方面可降低蛋黄颗粒中的脂质及胆固醇含量, 有利于提高酶解蛋黄颗粒的消费者接受度、拓宽其应用范围,与此同时又可以制得副产品蛋黄油,进一步提高蛋黄综合利用率。 目前,蛋黄粉中蛋黄油分离的方法主要包括有机溶剂法、酶法[9]、超临界萃取法、亚临界萃取法等。 其中,超临界和亚临界萃取技术是2 种新型绿色油脂萃取技术,具有无溶剂残留,提取率高,保护有益成分等优点[10-11]。 且与超临界萃取技术相比,亚临界萃取成本更低,常温萃取、低温脱溶,易实现大规模工业化应用[12]。 目前国内外对于采用亚临界萃取技术提取蛋黄粉中脂质的研究较少。
作者以冻融-水稀释法提取蛋黄免疫球蛋白之后变性严重的冻融蛋黄颗粒副产物为原料,采用限制性酶解结合亚临界萃取技术,制得低脂蛋黄粉与副产物蛋黄油,对亚临界萃取工艺进行优化,并对产品性质进行研究,以期拓宽冻融蛋黄颗粒副产物的应用范围,进而为蛋黄资源的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋和葵花籽油: 购自江苏无锡超市;碱性蛋白酶:购自南宁庞博生物工程有限公司;邻苯二甲醛(OPA)、1-4-二硫苏糖醇(DTT):购自Sigma公司;其余化学试剂:均为分析纯,购于国药化学试剂有限公司。
1.2 仪器与设备
分析天平(AB204-N):梅特勒-托利多仪器公司产品;pH 计:梅特勒-托利多仪器公司产品;喷雾干燥机(MOBILE MINOR):基伊埃工程技术(中国)有限公司;冷冻离心机(5430R):德国Eppendorf 公司产品;电热恒温鼓风干燥器(DGG-9240A):上海森信实验仪器有限公司产品;凯氏定氮仪(K9840):济南海能仪器股份有限公司产品;紫外分光光度计(UH5300): 日本日立公司产品; 高速剪切器(T25 basic): 德国IKA 公司产品; 激光粒度分析仪(S3500):美国Microtrac 公司产品;冷场发射扫描电子显微镜(SU8100):日本株式会社日立高新技术公司产品;CBE-5L 亚临界流体萃取实验成套设备:河南省亚临界萃取设备工程技术研究中心产品。
1.3 实验方法
1.3.1 冻融蛋黄颗粒(FYP)的制备参考王旭婷等[3]人提取IgY 的方法并作适当修改,人工分离蛋黄和蛋清,并将蛋黄在吸水纸上小心滚动以去除表面残留蛋清。 用镊子刺破蛋黄膜,收集蛋黄液,将其放置在(-18±2) ℃的温度下冷冻8 h,之后在4 ℃的温度下解冻,得到蛋黄凝胶。 将蛋黄凝胶与去离子水以质量比1∶5 混合, 然后用高速剪切机以11 000 r/min 剪切15 s, 再将混合液以8 000 r/min的转速离心20 min, 得到上清液为IgY 粗提液,沉淀即为FYP。
1.3.2 酶解蛋黄颗粒干粉(HYP)的制备及成分分析将FYP 与去离子水以质量比1∶2 混合,25 ℃搅拌30 min,使其混合均匀。 预热至50 ℃,并用1 mol/L的NaOH 调节体系pH 至8.0。 加酶量分别为250、500、1 000、2 000 U/g, 反应4 h, 酶解过程中用1 mol/L 的NaOH 维持体系pH 值恒定,用磁力搅拌器搅拌使FYP 始终保持分散均匀。 酶解过程中每隔0.5 h 取0.4 mL 的水解液, 迅速用冰水浴冷却至室温,测定水解度(DH)。 同样条件处理的未加酶组为对照组。 反应结束后,迅速将水解液用冰水浴冷却至室温,经喷雾干燥得到酶解蛋黄粉(HYP),喷雾干燥入口温度175~185 ℃,出口温度80~90 ℃,适当调整不同水解度水解液的干燥时的进出口温度,确保所得干燥产品的流动性基本接近,HYP 在4 ℃下贮存。 对制得的HYP 成分进行测定,水分质量分数按照GB/T 5009.3—2016 中的第一法直接干燥法测定; 蛋白质含量参照GB 5009.5—2016 中的凯氏定氮法进行测定;脂肪含量采用氯仿-甲醇改良法[13]测定;磷脂含量参照GB/T 5537—2008 中的钼蓝比色法进行测定,并做适当修改:为排除其他含磷物质的干扰,先提取总脂质,再测定磷脂含量;胆固醇含量按照Sun 等[14]人的方法进行测定。
1.3.3 水解度(DH)的测定参照文献[15]的方法对酶解过程中蛋白质的水解度(DH)进行测定。首先配置邻苯二甲醛(OPA)试剂,然后选用L-丝氨酸与OPA 试剂反应制作标准曲线。 将酶解物用去离子水稀释至4 mg/mL,将400 μL 稀释液与3 mL OPA 试剂混合, 反应2 min 后用紫外分光光度计测定340 nm 处的吸光度。 根据标准曲线和公式(1)计算蛋白质水解度DH:
式中:DH 为水解度,%;h为每单位质量断裂的肽键质量摩尔浓度,mmol/g;htot为每单位质量的肽键质量摩尔浓度,mmol/g[17]。
1.3.4 酶解蛋黄颗粒干粉(HYP)激光共聚焦分析参照Xu 的方法[18]用激光共聚焦显微镜观察HYP 的微观结构, 并做适当修改。 将对照组 (未酶解)与HYP 样品溶解在去离子水中(质量比1∶20),室温下混匀5 min。 分别将尼罗红和尼罗蓝溶于质量分数0.1%丙酮中。 脂肪用尼罗红染色,蛋白质用尼罗蓝染色。 取10 μL 尼罗红和尼罗蓝溶液加入1 mL 样品溶液中,染色20 min,取20 μL 样品涂布于显微镜载玻片上。 蛋白质的分析模式:绿色荧光通道发射波长为488 nm,激发波长为500~595 nm。 油脂的分析模式:红色荧光通道发射波长为633 nm,激发波长为649~780 nm。 对焦后扫描并保存图像。
1.3.5 酶解蛋黄颗粒干粉(HYP)溶解度分析溶解度的测定根据Tang 等[19]的方法并做适当修改,将1 g 样品和30 mL 去离子水转移至50 mL 离心管中,振荡5 min,然后于8 000 r/min 离心20 min,收集沉淀物,再加入30 mL 去离子水,同样条件再次离心。最后将所有收集到的沉淀物于鼓风干燥箱中在105 ℃的温度下干燥8 h。 以公式(2)计算蛋黄粉溶解度S。
式中:S为溶解度,g;m为样品质量,g;m1为沉淀及培养皿总质量,g;m2为培养皿质量,g。
1.3.6 酶解蛋黄颗粒干粉(HYP)乳化性分析采用比浊法测定样品的乳化活性指数(EAI)和乳化稳定性指数(ESI)[20]。 将HYP 样品分散在去离子水中(2 g/dL),室温下磁力搅拌1 h。 取30 mL 样品溶液,加入10 mL 葵花籽油,使用高速乳化器以11 000 r/min乳化1 min。 乳化后于0 min 和10 min 时分别从管底吸取100 μL 乳液移至10 mL 的0.1 g/dL 十二烷基硫酸钠(SDS)溶液中,然后在500 nm 下测定稀释溶液的浊度。 ESI 值通过下式计算:
式中:ESI 为乳化后立即测定的吸光度;A0和A10分别为乳液在0、10 min 时的吸光度。
1.3.7 低脂蛋黄粉制备工艺优化
1) 亚临界萃取溶剂选择 分别选择丙烷或丁烷作为亚临界萃取溶剂,制备蛋黄油与低脂酶解蛋黄粉, 以萃取后低脂酶解蛋黄粉中残油率为指标,选择最佳萃取溶剂。 具体制备工艺如下:
亚临界丙烷萃取:称取适量HYP 样品,用150目尼龙纱布袋分装,置于萃取罐,通过设备流量阀送入一定体积丙烷,萃取压力1.1 MPa,萃取温度35℃,每次萃取40 min,重复萃取3 次。 然后减压脱溶,从分离罐底部收集萃取得到的蛋黄油,离心后取上清液置于4 ℃冰箱待分析。 从萃取罐内收集剩余低脂酶解蛋黄粉用于进一步分析。
亚临界丁烷萃取:称取适量HYP 样品,用150目尼龙纱布袋分装,置于萃取罐(与丙烷相同),通过设备流量阀送入一定体积丁烷, 萃取压力0.46 MPa,萃取温度45 ℃,每次萃取40 min,重复萃取3次。 后续操作与上述丙烷相同。
2) 亚临界萃取工艺优化 最终选用丙烷作为萃取溶剂,以萃取后低脂酶解蛋黄粉中残油率为指标,对萃取温度、萃取压力、萃取时间、料液质量体积比等可调工艺参数进行优化。
萃取温度: 分别将萃取温度设定为25、30、35、40、45 ℃,萃取压力1.5 MPa,萃取时间120 min,按照料液质量体积比l g∶9 mL 加入亚临界丙烷溶剂进行萃取。
萃取压力:分别将萃取压力设定为0.5、1.0、1.5、2.0、2.5 MPa,萃取温度35 ℃,萃取时间120 min,按照料液质量体积比l g∶9 mL 加入亚临界丙烷溶剂进行萃取。
萃取时间: 分别将萃取时间设定为30、60、90、120、150 min,萃取温度35 ℃,萃取压力1.5 MPa,按照料液质量体积比l g∶9 mL 加入亚临界丙烷溶剂进行萃取。
料液质量体积比:分别将料液质量体积比设定为l g∶3 mL、l g∶5 mL、l g∶7 mL、l g∶9 mL、l g∶11 mL,萃取温度35 ℃, 萃取压力1.5 MPa, 萃取时间120 min,加入亚临界丙烷溶剂进行萃取。
1.3.8 低脂蛋黄粉理化与功能性质分析
1) 残油率测定 参照氯仿-甲醇改良法[13]并做适当修改。 称取1 g 左右的待测蛋黄粉, 加入1.2 mL 去离子水、5 mL 甲醇、2.5 mL 氯仿, 旋涡振荡2 min,再加入2.5 mL 去离子水和2.5 mL 氯仿,振荡3 min,使溶液从一相系统转变成二相系统。 离心分离出氯仿层,用氮气吹去氯仿,称质量。
2) 粒度分析 将0.1 g 待测蛋黄粉溶于10 mL去离子水,旋涡振荡5 min,保证蛋黄粉溶液混合均匀[7]。 采用激光粒度分析仪测量不同水解度样品的粒径分布。
3) 微观结构分析 用扫描电子显微镜(SEM)观察蛋黄粉的微观结构[21]。 取少量样品用双面胶固定,镀金并进行观察。 每个样品选取放大倍数1 000和2 000 观察并拍摄。
4) 溶解度分析 方法同1.3.5。
5) 乳化性分析 方法同1.3.6。
1.4 数据统计分析
所有实验均重复3 次, 实验结果表示为平均值± 标准偏差。 采用SPSS 22.0 统计软件的Duncan法检验进行显著性分析,P<0.05 表示具有显著性差异。 实验数据采用OriginPro 2018C 绘图。
2 结果与分析
2.1 酶解蛋黄颗粒干粉(HYP)成分分析
对HYP 进行成分分析,结果如表1 所示。 与对照组(未酶解)相比,酶解处理步骤并未显著改变蛋黄粉主要营养物质的含量。 经过提取IgY 后剩余的HYP 仍然具有较高的营养价值,需要对其进行合理处理以实现蛋黄资源的充分开发利用。
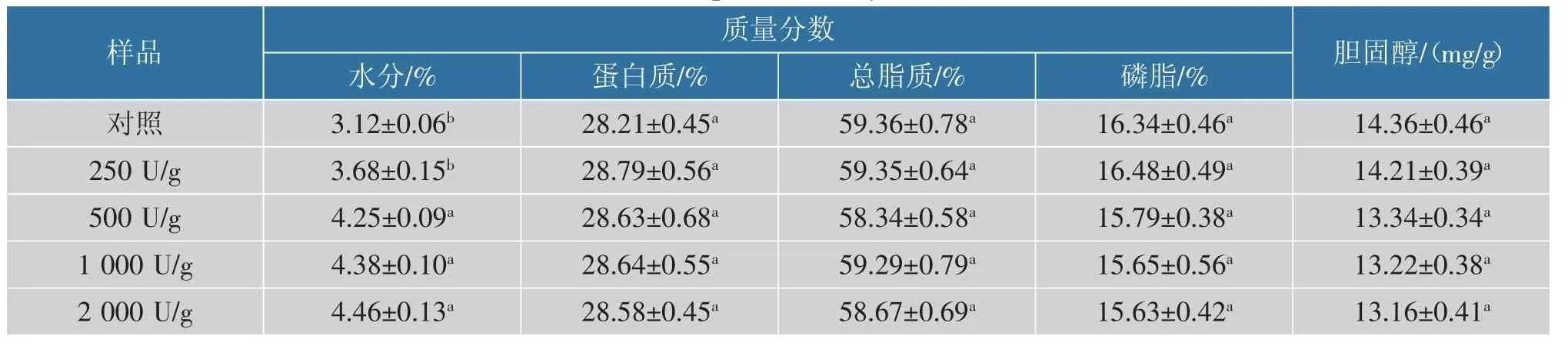
表1 HYP 成分分析Table 1 Composition analysis of HYP
2.2 加酶量对酶解液水解度的影响
如图1 可知,不同酶添加量的条件下,蛋黄颗粒水解度呈现相同的变化趋势,蛋黄颗粒的快速酶解发生在反应最初的0.5 h 左右, 之后水解度上升趋势明显减缓,经4 h 左右,酶解反应基本达到平衡状态,该变化趋势与Gu 等[7]人的研究结果一致。 此外, 当加酶量分别为250、500、1 000 和2 000 U/g时,随着加酶量的增加,最终的DH 值逐渐升高,最终DH 分别为8.0%、11.22%、13.85%和13.99%。 这是由于体系中酶分子越多,与底物分子的接触概率越大,蛋白质被酶解产生氨基酸和小肽的量增加从而导致水解度提高。 当加酶量超过1 000 U/g 时,体系的最终水解度值基本无差异,这可能是由于在此加酶量条件下, 酶对底物的作用位点已趋于饱和,进一步增大加酶量对水解度的提高作用有限。 为了区分各组样品,后续以加酶量来表示不同样品。
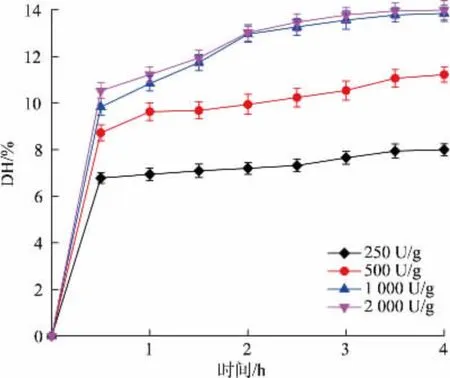
图1 不同加酶量下的酶解液水解度变化Fig. 1 Degree of hydrolysis of enzymatic hydrolysate under different enzyme dosages
值得注意的是,与未经冻融处理的新鲜蛋黄的酶解研究结果相比,本研究在相同的加酶量和反应时间下可以获得相对较高的DH[7]。 这可能是由于IgY 提取过程中的冻融及剪切操作, 导致蛋黄脂蛋白结构被破坏,从而使碱性蛋白酶可以更好地与底物接触,促进酶水解。
2.3 酶解蛋黄颗粒干粉(HYP)微观结构分析
为了获得样品的微观结构信息,采用激光共聚焦显微镜(CLSM)观察蛋白质和脂质在HYP 中的分布情况。 如图2 所示,能够从对照组样品清楚地观察到HYP 是由内部的油滴和外部的蛋白质共同构成的颗粒组成的,对照组样品与原蛋黄粉相比具有更小的粒径[7],颗粒表面可以清晰观察到许多孔洞,这可能与之前的冻融和剪切处理有关。 经酶解处理后,颗粒尺寸变得更小、更为均一,这些结构上的变化可能导致随着水解度的增加,样品的溶解度逐渐增加。 值得注意的是,当水解程度较低时,没有出现游离的脂肪滴,然而,当加酶量达到500~1 000 U/g时,可以观察到许多游离的红色脂肪滴,这可能是由于当处于较低的水解度时,颗粒的结构尚未被破坏,仍然保持其包裹脂质分子的结构,随着加酶量的增加,蛋黄颗粒表面的蛋白质被水解,从而导致内部脂质的释放[7]。 当加酶量达到1 000 U/g 时,出现相对较大的游离脂肪滴,这可能是由于此时蛋黄颗粒结构被严重破坏,更多的脂质被释放并聚集从而形成了较大的脂肪滴。 但当加酶量进一步增加到2 000 U/g 时,游离的脂肪滴反而减少,同时出现一些尺寸较大的颗粒, 可能是因为随着水解度提高HYP 的乳化性逐渐提高, 游离的脂肪滴被重新乳化,蛋黄颗粒非极性表面之间发生疏水相互作用而聚集在一起[19]。
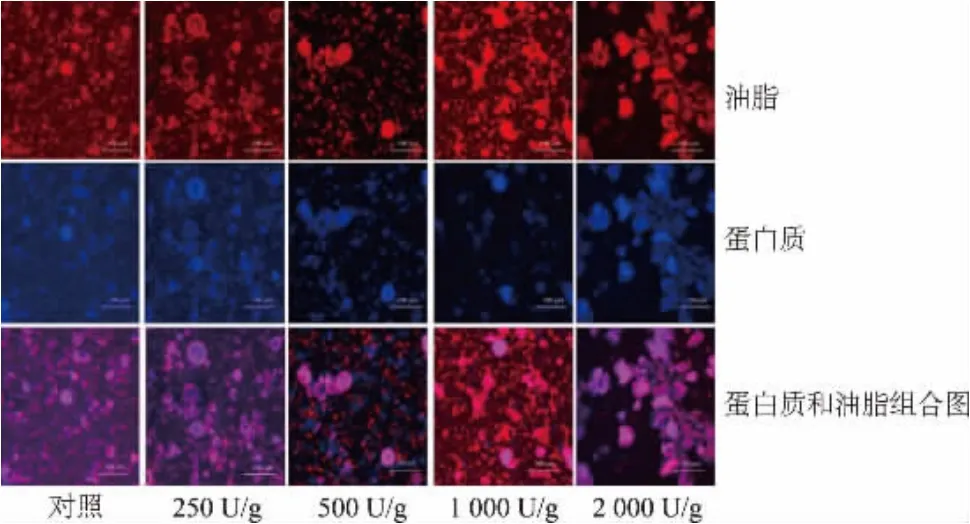
图2 HYP 及对照组的激光共聚焦图Fig.2 CLSM micrographs of HYP and the control group
2.4 酶解蛋黄颗粒干粉(HYP)溶解度分析
蛋白质的溶解性与其他功能性质如乳化性、发泡性等密切相关,因此被认为是其最基本的理化性质。 如图3 所示,HYP 的溶解度与对照组相比显著提高。 此外,在相对较低的加酶量条件下,样品的溶解度提高趋势明显, 而随着加酶量的进一步增大,溶解度上升速度趋缓, 直到达到一个相对恒定值,这与Gao 等电泳观察到的结果一致[22]。 水解程度对蛋白质的溶解性具有积极的作用,当水解程度较高时,形成的多肽相对分子质量较小,溶解性更佳,这主要归因于小分子多肽表面具有较多的极性氨基酸残基,易与周围溶剂环境的水分子形成更多的氢键[23]。 此外,有报道称卵黄高磷蛋白质和HDL 在自然条件下通过钙磷桥形成的不溶性复合物在水解过程中被破坏也会促使蛋白质溶解度提高[24]。
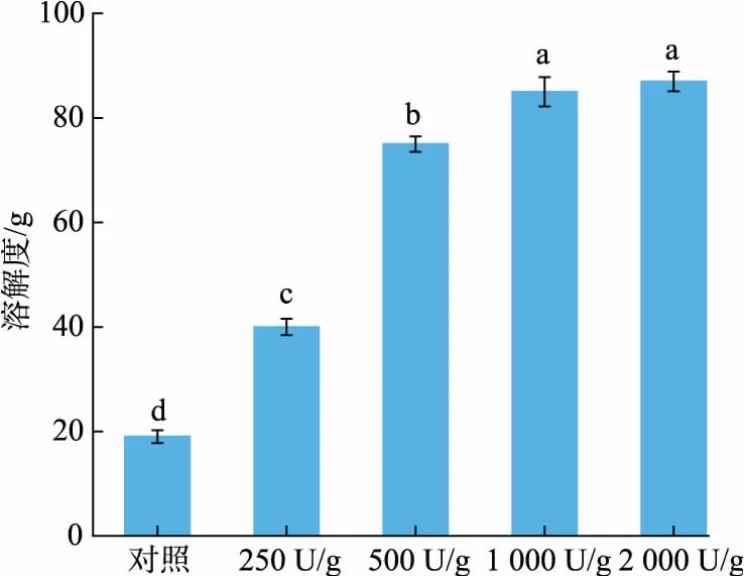
图3 HYP 及对照组的溶解度Fig. 3 Powder solubility of HYP and the control group
2.5 酶解蛋黄颗粒干粉(HYP)乳化性分析
乳化性是蛋黄的一项重要的功能特性,可赋予产品所需要的口感和质感。 通过测定ESI 和EAI 来观察酶解处理对样品乳化性的影响。 如图4 所示,样品的EAI 没有显著差异(P<0.05),而乳化液的稳定性随着加酶量的增加而显著提高,这可能与HYP粒径的减小和溶解度的增加密切相关。 据报道粒径越小,越有利于形成更均匀、更稳定的乳状液[25]。此外, 较高的表面疏水性也有助于提高乳化性能,这可能由于酶解产生的多肽可通过与油滴相互作用从而形成更强的界面膜[26]。还有研究认为,酶解产生的同时具有亲水和疏水基团的小肽段转移到油水界面上,也可能通过降低界面张力而起到稳定乳液的作用[24]。
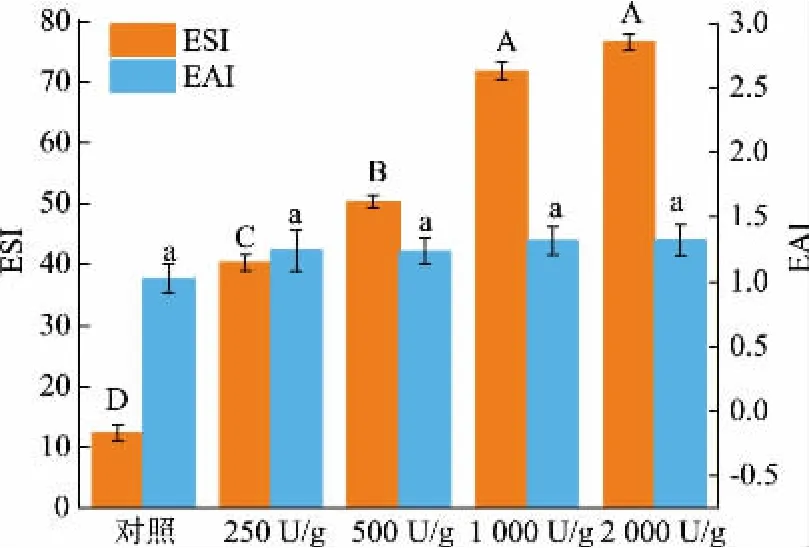
图4 HYP 及对照组的乳化性质Fig. 4 Emulsifying properties of HYP and the control group
2.6 蛋黄粉残油率对比分析
如图5 所示,原蛋黄粉(OEYP)、亚临界丙烷萃取后的蛋黄粉(EYP-P)及亚临界丁烷萃取后蛋黄粉(EYP-B) 的脂肪质量分数分别为58.75%、37.00%、45.25%。 由此可见,与丁烷相比,亚临界丙烷显示出了对蛋黄粉中油脂更强的提取能力。
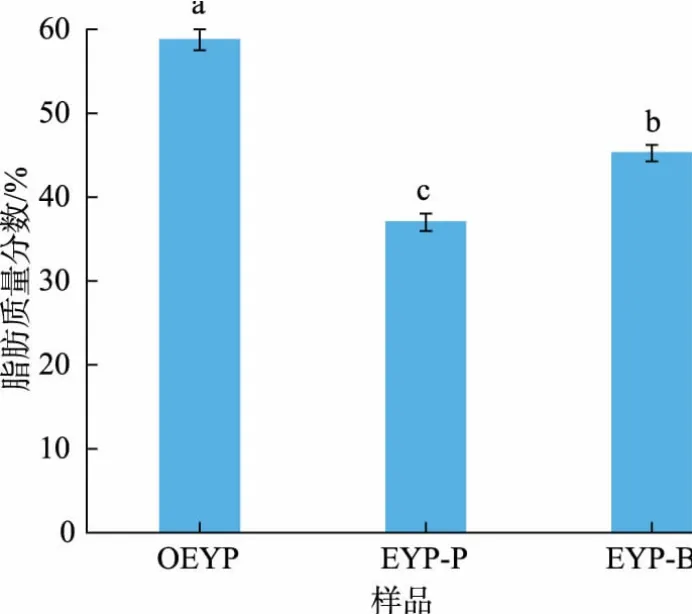
图5 亚临界丙烷和丁烷萃取后蛋黄粉脂肪质量分数分析Fig. 5 Analysis of the fat content of egg yolk powder after subcritical propane and butane extraction
2.7 亚临界萃取工艺优化
由亚临界丙烷和丁烷萃取对低脂蛋黄粉残油率指标的分析可知,亚临界丙烷对蛋黄油的萃取效果优于丁烷。 此外,前期的研究结果显示,与亚临界丙烷相比,采用亚临界丁烷萃取时低脂蛋黄粉中磷脂的保留率更低,降低了产物低脂蛋黄粉的营养价值。 因而作者最终选择亚临界丙烷作为萃取溶剂,并进一步对亚临界丙烷萃取技术的工艺参数包括萃取温度、萃取压力、萃取时间、料液比等进行优化。
2.7.1 萃取温度由图6(a)可知,当萃取温度从25℃升高到35 ℃时,萃取后蛋黄粉残油率呈明显下降的趋势,在35 ℃时残油率达到最低值,若继续提高萃取温度,蛋黄粉残油率反而呈上升趋势。 这可能是由于温度适当升高可有效增大丙烷溶剂的挥发性和扩散系数,从而更好溶解蛋黄脂质,使得蛋黄油提取率提高;然而当温度过高时,萃取溶剂在萃取釜中易气化,萃取过程中传质推动力减小,油脂提取率反而降低[27]。 另外,萃取温度过高会增加能耗, 并会导致脂质中磷脂等活性物质的变性与降解,故萃取温度宜选择35 ℃。
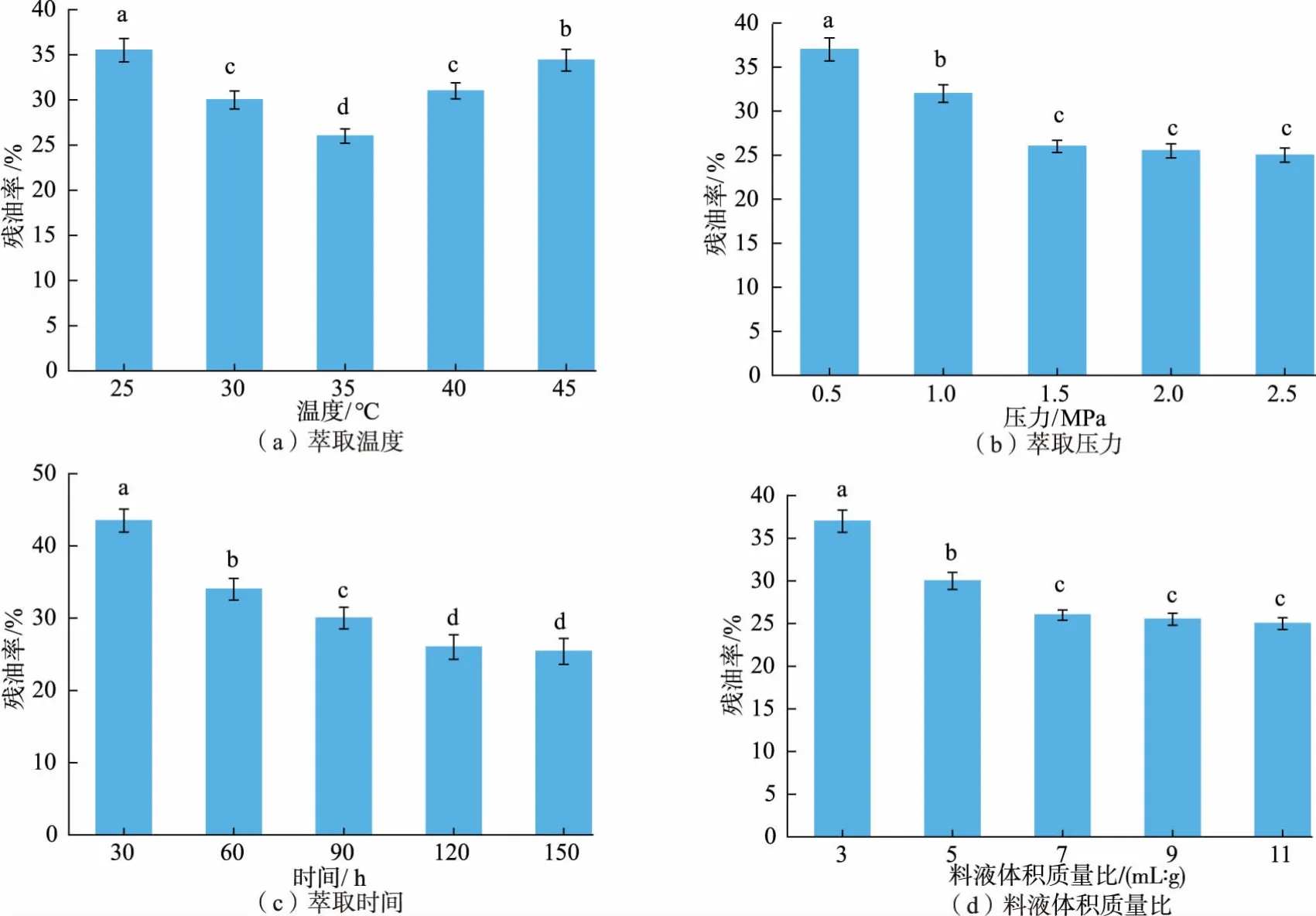
图6 萃取温度、萃取压力、萃取时间、料液体积质量比对蛋黄粉残油率的影响Fig. 6 Effect of temperature, pressure, time and solid-liquid ratio on the residual oil rate of egg yolk powder
2.7.2 萃取压力由图6(b)可知,当萃取压力从0.5 MPa 升高到1.5 MPa 时, 萃取后蛋黄粉残油率呈明显下降的趋势,继续增大萃取压力,残油率未发生显著改变。 原因可能是由于在温度不变的条件下,当萃取压力达到一定值时,丙烷对甘油三酯和胆固醇的溶解趋于饱和,而进一步提高萃取压力反而使丙烷的传质效率降低,萃取效率随之降低。 故萃取压力宜选择1.5 MPa。
2.7.3 萃取时间由图6(c)可知,当萃取时间从30 min 增加到120 min 时, 萃取后蛋黄粉残油率呈明显下降的趋势,继续延长萃取时间,残油率下降不显著。 且随着萃取时间的延长,能量消耗增大,萃取成本提高。 因此, 考虑实际需求, 萃取时间为120 min 最适宜。
2.7.4 料液质量体积比由图6(d)可知,随着液化丙烷体积的增加, 萃取后蛋黄粉残油率显著下降,但是当料液质量体积比超过1 g∶7mL 时, 残油率下降不显著,且丙烷溶剂的消耗增加也会提高萃取成本。 因此,综合考虑残油率与成本需求,选择1 g∶7 mL 作为最合适的料液质量体积比。
综上,亚临界丙烷萃取脱除HYP 中脂质的最佳条件为:温度35 ℃,压力1.5 MPa,时间120 min,料液质量体积比为1 g∶7 mL。此条件下,不同加酶量的HYP 经过亚临界丙烷萃取后,所得低脂酶解蛋黄粉的残油率分别为26.00%、23.25%、19.25%、15.50%、20.23%。
2.8 低脂蛋黄粉理化与功能特性分析
2.8.1 粒度分析如图7 所示, 与对照组相比,酶解后的蛋黄颗粒样品整体呈现出更小的粒径。 随着加酶量的增加,样品的粒径逐渐变小。 表明随着加酶量的增加, 蛋黄脂蛋白的结构被破坏愈发严重,更有助于脂质溶出。 这也在一定程度上能够解释亚临界萃取后蛋黄粉中残油率会随加酶量的增加而下降的现象。
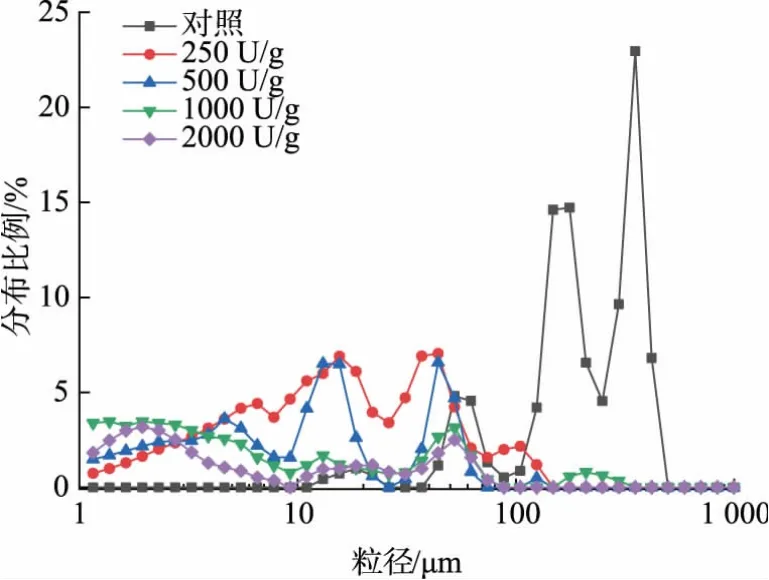
图7 蛋黄粉的粒径分布Fig. 7 Particle size distribution of egg yolk powder
2.8.2 微观结构分析扫描电镜(SEM)结果表明经过亚临界萃取处理后蛋黄粉的微观结构会发生显著变化,如图8 所示。 与对照组(只剪切,未酶解)相比,HYP 经亚临界丙烷萃取后结构被破坏愈发严重,这更有助于蛋黄油的提取。 随着酶解程度的增大,HYP 的平均尺寸明显减小,聚集减少。但当加酶量为2 000 U/g 时, 蛋黄颗粒干粉出现聚集结块现象。 这可能是由于碱性蛋白酶的酶解产生了大量的小分子, 而水解暴露的疏水基团与脂蛋白结合,导致微小颗粒的大量聚集结块[28]。 此外当加酶量较高时样品粒度过细,样品在萃取罐中更易受萃取压力挤压而结块,在一定程度上阻碍了亚临界溶剂对样品的渗透和油脂的提取,从而使得萃取后蛋黄粉的残油率较高。 这一结果与低脂蛋黄粉残油率测定结果一致。

图8 蛋黄粉的扫描电镜图Fig. 8 SEM images of egg yolk powder
2.8.3 溶解特性分析如图9 所示,由HYP 提油制得的低脂蛋黄粉的溶解度均显著高于未酶解组。 与脱脂前HYP 的溶解度相比较,经亚临界萃取后低脂蛋黄粉的溶解度大多会进一步提高,但当加酶量达到2 000 U/g 时,HYP 经亚临界丙烷萃取后所得低脂蛋黄粉的溶解度反而下降。 这可能是由于水解度较高时产生蛋黄颗粒较小,在亚临界萃取过程中颗粒易产生颗粒聚集结块现象,从而导致蛋黄粉的溶解度变差。 由此可见,经酶解和亚临界萃取步骤得到的低脂蛋黄粉具备良好的溶解性能。
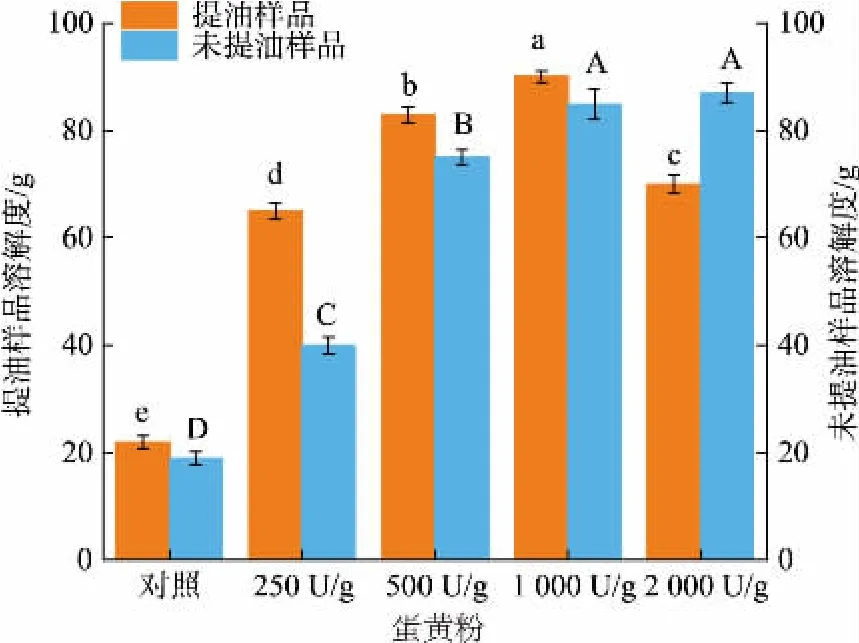
图9 蛋黄粉的溶解性Fig. 9 Solubility of egg yolk powder
2.8.4 乳化特性分析如图10(a)所示,与对照组(未酶解)相比,低脂蛋黄粉的乳化活性无显著性差异, 而乳化稳定性随着加酶量的增加显著提高,当加酶量达到1 000 U/g 时,乳化稳定性达到最大值,这与HYP 的乳化稳定性变化趋势基本一致。 蛋黄粉的乳液宏观结果(20 min 内)如图10(b)所示,低脂蛋黄粉的乳化性能明显优于对照组。 由此可见,经酶解和亚临界萃取步骤得到的低脂蛋黄粉具备良好的乳化性能。
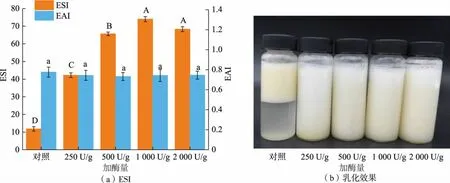
图10 蛋黄粉的乳化性质Fig. 10 Emmlsion properties of egg yolk powder
3 结 语
以冻融-水稀释法提取蛋黄免疫球蛋白后剩余变性严重的冻融蛋黄颗粒为原料,采用限制性酶解制备酶解蛋黄颗粒干粉(HYP),并进一步结合亚临界萃取工艺制备低脂蛋黄粉产品。 结果显示,酶解处理可以显著影响HYP 的结构和功能性质,破坏脂蛋白结构,有助于提高亚临界萃取脱脂效率。 当酶添加量为1 000 U/g 时,在萃取温度35 ℃,压力1.5 MPa,时间120 min,料液质量体积比为1 g∶7 mL 的最优萃取条件下进行亚临界丙烷萃取,得到低脂蛋黄粉的残油率仅为15.50%。 作者制备的HYP 和低脂蛋黄粉均呈现良好的溶解和乳化性能,可根据不同应用场合作为食品加工原料加以利用,有效提高蛋黄资源的综合利用效率。 同时采用亚临界萃取技术还可制得副产物蛋黄油,具备进一步开展深入研制新产品的潜力。 因而本研究方法可有效解决冻融-水稀释法提取免疫球蛋白后剩余蛋黄颗粒功能性差、利用率低的问题,提高蛋黄产品附加值,有望拓宽蛋制品深加工的产业链,推动蛋黄资源的综合利用。

