恶性肿瘤患者中心静脉导管相关性血栓形成的危险因素分析及预测模型构建
王雪星, 何 媛, 楚 杰, 陈春梅, 王羽丰
肿瘤患者是一个特殊的群体,反复化疗、输血、营养治疗、输液等是其诊治历程中极其重要的部分[1]。中心静脉置管术由于具有避免反复穿刺给患者带来心理、生理上的痛苦,方便医护工作者施治,便于从医院过渡到中间护理环境和家庭进行间歇性化疗等诸多优点,在肿瘤患者诊治过程中被广泛应用。然而,由于肿瘤患者个体因素、置管技术水平、肿瘤治疗及护理技术以及导管相关因素等的影响,增加患者导管相关性血栓(catheter-related thrombosis,CRT)形成的风险[2-3]。有研究显示,CRT患者肺栓塞发生率及死亡率分别高达4%~36%、12%~34%[4-5]。因此,了解CRT形成的风险因素并进行有效干预具有重要的临床意义。本研究通过大样本分析肿瘤患者中心静脉CRT形成的危险因素,构建列线图预测模型,并通过受试者工作特征(receiver operating characteristic,ROC)曲线、校准图形及内部验证法评估列线图模型预测CRT的准确性,对指导临床医师及时识别CRT形成的高危患者有较好的应用价值,现报道如下。
1 资料与方法
1.1临床资料 选择2019年1月至2022年6月于昆明医科大学第三附属医院接受中心静脉导管(central venous catheter,CVC)置管的2 096例恶性肿瘤患者的临床资料,男836例,女1 260例,年龄7~86(54.00±11.83)岁。根据CRT形成情况分为CRT组(n=178)和对照组(无CRT形成,n=1 918)。纳入标准:(1)经病理诊断确诊为恶性肿瘤患者;(2)导管留置时间≤48 h;(3)接受CVC置管,并在置入术后45 d内行超声、血管造影或其他辅助检查判定CRT的发生情况;(4)经颈内静脉置管,且经胸部X线片检查证实置管末端位于上腔或下腔静脉;(5)病历资料完整。排除标准:(1)诊断不明确者;(2)有抗凝药物接触史,近2周内有口服抗凝药物或停用抗凝药物时间不足2周者;(3)接受华法林治疗后凝血酶原时间-国际标准化比率(prothrombin time-international normalized ratio,PT-INR)>1.3者;(4)合并严重心、肺、肾功能不全者;(5)住院期间转诊至重症监护室、心血管监测室等监护室者。本研究已获昆明医科大学第三附属医院伦理委员会批准(批号:KYLX2023-101)。
1.2资料收集 通过查阅文献、专家咨询及临床经验选择对导致CRT形成有影响的指标,并通过医院电子病历系统对相关资料进行收集。(1)患者个体相关因素:性别、年龄、肿瘤分期、化疗史、体质量指数(body mass index,BMI)、卡式活动状态(Karnofsky Performance Status,KPS)评分、抽烟史、饮酒史、输血史、手术史、合并感染、激素使用情况、高血压、糖尿病、高脂血症以及血栓形成/高凝状态史情况等。(2)置管因素:置管次数、置管部位活动情况。(3)实验室指标:红细胞(red blood cell,RBC)、白细胞(white blood cell,WBC)、血红蛋白(hemoglobin,HGB)、血小板(platelet,PLT)、纤维蛋白原(fibrinogen,FIB)、D-二聚体、白蛋白/球蛋白比值、空腹血糖(fasting blood glucose,FBG)等。血常规应用SysmexXT-4000i全血细胞分析仪进行检测;血生化相关指标应用罗氏Cobas c 702全自动生化分析仪检测;凝血功能指标应用希森美康CS5100全自动凝血分析仪进行检测。(4)CRT形成部位及发生时间。
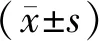
2 结果
2.1肿瘤患者的CRT形成情况 2 096例患者中有178例发生CRT,发生率为8.50%。37例患者处于高凝状态,其发生率为1.76%。CRT形成部位以颈部血管最常见,其次为下肢静脉、腹腔静脉/双侧髂血管,锁骨下/头静脉及附近发生最少。见图1。患者发生CRT的时间距最后一次导管置入的中位时间为10.00 d,最早形成于导管置入后第2天,最晚为41 d。见图2。
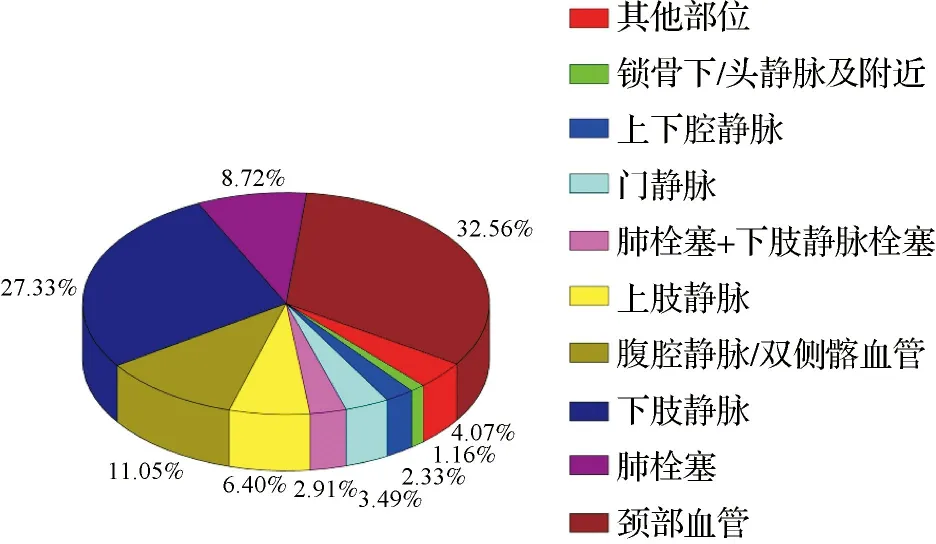
图1 肿瘤患者CVC置管后CRT形成部位分布图
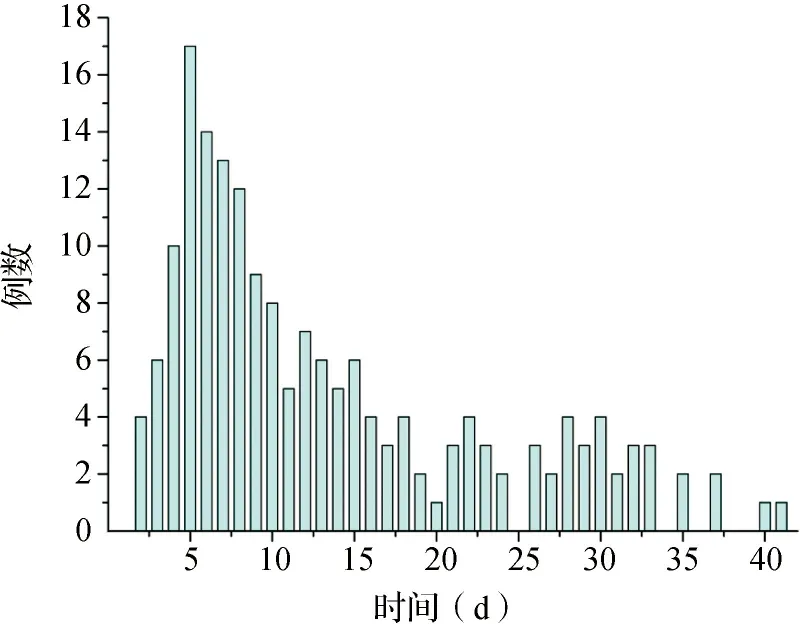
图2 肿瘤患者CVC置管后至CRT形成时间分布图
2.2两组临床资料及实验室指标比较 两组年龄、肿瘤分期、KPS评分、输血史、合并感染、激素使用情况、高血压、高脂血症、血栓形成/高凝状态史、置管次数及置管部位活动情况比较差异有统计学意义(P<0.05)。见表1。两组RBC、WBC、PLT、HGB、FIB、D-二聚体、白蛋白/球蛋白比值水平比较差异有统计学意义(P<0.05)。见表2。
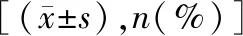
表1 两组临床资料比较
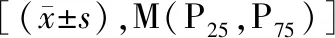
表2 两组实验室指标水平比较
2.3影响CRT形成的多因素logistic回归分析结果 以CRT形成情况为因变量(1=有,0=无),将表1、2中有统计学意义的指标作为自变量,多因素logistic回归分析结果显示,以TNM分期为Ⅰ期作参考,Ⅱ~Ⅳ期是促进CRT形成的危险因素(P<0.05),合并感染、高脂血症、血栓形成/高凝状态史、使用激素,以及较高的D-二聚体水平是促进CRT形成的危险因素(P<0.05)。见表3。

表3 影响CRT形成的多因素logistic回归分析结果
2.4CRT形成列线图模型的建立与评价结果 将TNM分期、合并感染、使用激素、高脂血症、血栓形成/高凝状态史和D-二聚体6个指标纳入构建列线图模型。见图3。模型的阳性预测概率阈值设为0.560时,预测模型灵敏度为79.00%,特异度为74.00%[AUC(95%CI)=0.856(0.824~0.889),P<0.001]。见图4。通过Hosmer-Lemeshow拟合优度检验评价预测模型的校准能力,结果显示,Hosmer-Lemeshowχ2<0.001,P=0.773。模型的校准图形显示,预测曲线与标准曲线基本拟合。见图5。进一步采用Bootstrap自助法重抽样1 000次,C指数为0.824。绘制临床决策曲线,提示该列线图预测模型有较好的临床预测及应用价值。见图6。
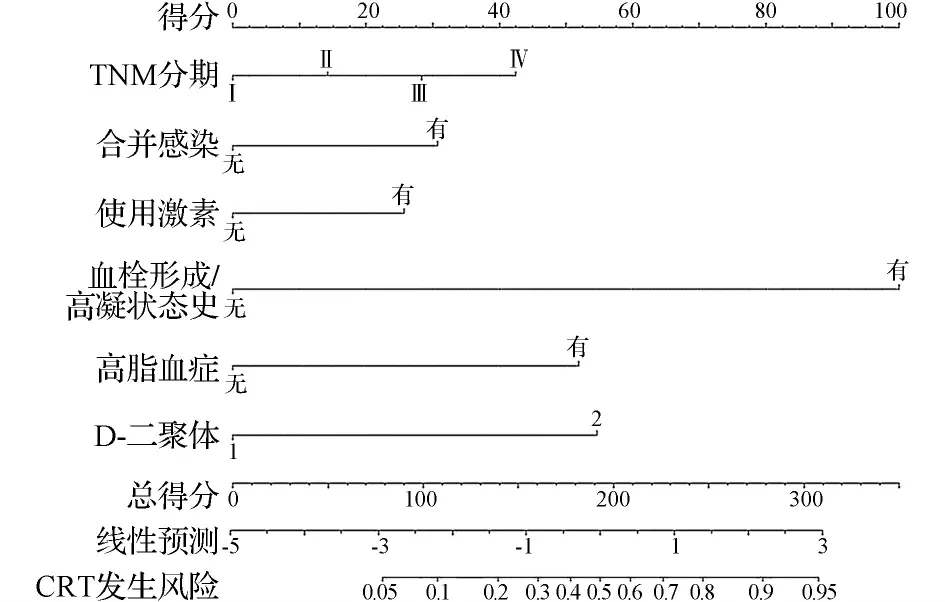
图3 肿瘤患者CVC置管后发生CRT的列线图模型
图4 肿瘤患者CVC置管后发生CRT的列线图模型的ROC曲线图

图6 肿瘤患者CVC置管后发生CRT的列线图模型的决策曲线图
3 讨论
3.1CVC在肿瘤治疗中被广泛用于化疗药物输注、输血、营养支持等。然而,反复穿刺所造成的静脉壁损伤以及导管置入后血流缓慢等因素会显著增加CRT形成风险[6]。相关研究表明,症状性CRT的发生率为1%~45.0%[7-9],而无症状CRT的发生率高达35%~71.9%[10-11]。本组病例中,CRT发生率为8.50%,与相关研究结果相似。Walshe等[12]的研究结果显示,70%的CRT都发生在置管后的第1周,另30%出现于置管后的第2周。在本研究中,患者发生CRT的时间距最后一次导管置入的中位时间为10.00 d。大多发生于导管置入后第1周内,与上述研究结果一致。提示肿瘤患者在CVC置管后2周内加强预防CRT形成的重要性。
3.2本研究结果显示,TNM分期、合并感染、使用激素、高脂血症、血栓形成/高凝状态史以及D-二聚体水平是肿瘤患者CVC置管后发生CRT的独立影响因素。有研究表明,约1/3的静脉血栓栓塞症(venous thromboembolism,VTE)与恶性肿瘤相关[13]。由于恶性肿瘤患者血液处于高凝状态,以及凝血系统活化等多方面因素的影响,这类患者发生静脉血栓的风险是普通住院患者的4~7倍[14]。D-二聚体是纤维蛋白单体经活化因子ⅩⅢ交联后,再经纤溶酶水解所产生的一种特异性降解产物,在诊断和预测血栓形成方面具有重要意义。血浆D-二聚体水平升高往往提示患者处于高凝或血栓前状态。本研究结果显示,与对照组相比,CRT组D-二聚体水平升高,CRT形成风险增加4.094倍。Wen等[15]的研究表明,中心静脉置管会引发凝血系统的激活,使血液处于高凝状态,从而促进CRT形成。其机制可能是由于置管时血管内皮部分损伤或血管内血流动力学的改变,导致PLT与血管内膜接触增加,从而引起凝血系统激活,导致血栓发生[16]。因此,临床医师宜加强对肿瘤患者CVC置入术后D-二聚体水平及相关凝血功能指标的监测,及早干预,预防CRT发生。多项研究表明肿瘤TNM分期与CRT形成具有关联性[17-18],分期较晚的患者通常存在更多合并症,整体情况较差,这些因素可能导致血管内皮损伤,刺激凝血机制启动,引发组织因子释放并最终导致血栓形成。黄云霞等[19]的研究也证实了这个观点,提示临床医师要特别注意高风险人群的干预,尤其是分期较晚的恶性肿瘤患者。一些研究发现感染增加了肿瘤患者CVC置入术后血栓形成的风险[20],而本研究结果亦显示合并感染是肿瘤患者CVC置入术后CRT形成的独立危险因素。笔者推测可能与感染时外周血WBC计数增多、部分凝血因子水平升高、PLT计数增加等多种因素有关。感染是导致深静脉血栓形成的常见原因,当中性粒细胞、嗜碱细胞或肥大细胞在受到炎症细胞因子或细菌细胞壁外的脂多糖(lipopolysaccharide,LPS)等刺激后释放核糖体,或在微生物结构刺激PLT Toll样受体与PLT相互作用后中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs)刺激凝血,导致血栓形成[21]。因此,在肿瘤患者治疗过程中,临床医师需要密切关注患者的感染状态,并及时采取有效的预防和治疗措施,降低CRT发生风险。
3.3肿瘤患者化疗及靶向治疗中经常使用激素药物,而长期应用这类药物是否会增加患者VTE发生的风险仍是研究者讨论的热点。本研究结果显示使用激素药物会增加CRT的形成风险,这与相关研究[22-23]结果相似。但目前关于激素水平如何影响PLT聚集仍有待研究,其机制可能是激素药物引起机体内脂质代谢异常,增加了血液黏稠度,从而导致血栓形成[24]。高脂血症会增加血液黏稠度,使得机体处于高凝状态。国内研究发现,高脂血症患者中凝血因子Ⅶ活性明显升高,且与甘油三酯、总胆固醇和低密度脂蛋白胆固醇水平密切相关,血液高凝状态有助于肿瘤生长、转移和血栓形成[25-26]。此外,肿瘤患者的血液微环境通常处于高凝状态,这也使其更易发生血栓,尤其在经历过多次抗肿瘤治疗后,血栓形成的风险更高[27-29]。本研究结果显示,有血栓形成/高凝状态史患者发生CRT的风险较对照组高12.788倍,这与相关研究[28-30]结果相似。
3.4本研究基于大样本数据,将多因素logistic回归分析筛选得到的6个因素建立列线图模型,ROC曲线分析表明,该模型具有较好的鉴别能力,灵敏度为79.00%,特异度为74.00%。拟合优度检验显示,该模型与标准曲线基本接近,证明其具有较为理想的预测效果。虽然本研究为单中心研究,存在一定的选择偏倚,但纳入样本量较大、纳入指标较为全面,所得模型灵敏度和特异度较高,结果值得肯定。在未来的临床研究中,需要进一步扩大样本量,增加指标因素数量,并对建立的风险预测模型进行适当修正和反复校准,通过内部或外部验证进一步提高其表现力和整体客观性,提高模型的临床应用价值。
综上所述,肿瘤患者CVC置管后CRT的发生时间主要集中在术后第1周,TNM分期、合并感染、使用激素、高脂血症、血栓形成/高凝状态史以及D-二聚体水平是CVC置管后发生CRT的独立影响因素。本研究构建的CRT形成列线图模型具有较好的鉴别能力和预测效果,能够为临床医师预防CRT形成提供指导。

