一株盐碱绿藻的SE培养基优化
陈 凤,董 宇,蔡宏宇,张苏江,雷曼红,孙 禹
(塔里木大学/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300)
0 引 言
【研究意义】塔里木河是我国最大内陆河[1-2]。塔里木河上游阶段水体具有溶解氧高、盐度高、矿化度高、酸碱度高、电导率高、温度较低,氧化还原电位较低的特征[3]。阿拉尔灌区塔南总排农田排水全年为咸水水质,排水属于Na-Cl型水质,Na+为主要的阳离子,平均占比为16.7%,平均浓度为1.4 g/L,Cl-为主要的阴离子,平均占比为35.6%,平均浓度为3.1 g/L[4]。江河湖泊,水库等淡水环境中出现水华现象是由于藻类在温度高低、光照强度、营养盐含量、氮磷含量、酸碱度等多种因素影响下,快速生长繁殖而形成的水质污染现象[5]。通常造成水体出现水华现象的3种藻类包括莱茵衣藻(Chlamydomonasreinhardtii)、绿球藻(Chlorococcum)、斜生栅藻(Scendesmusobliquue)[6]。【前人研究进展】近几年,关于阿拉尔的相关研究主要集中在高盐钠污坑塘水生态修复[7]、棉田灌排水水质特征[8]、水质演变规律及生态需水[9]、基于AHP的阿拉尔市水资源系统评价[10]、苦咸水水化学的特征、分布及成因分析[11]等方面。【本研究切入点】但关于阿拉尔的特殊水质中的相关藻类研究还未见报道。需针对位于阿拉尔市塔里木大学生东湖一株盐碱绿藻的SE培养基进行优化研究。【拟解决的关键问题】运用形态学观察、分子鉴定,研究盐碱藻生物学特性及生长最适CaCl2·2H2O、KH2PO4、NaCl、NaNO3、MgSO4·7H2O以及pH,为阿拉尔盐碱藻类在分子生物学和生态环境保护以及渔业饵料资源的研究提供基础性理论依据。
1 材料与方法
1.1 材 料
2021年4月16日,从塔里木大学校园内东湖(40°54′52″N,81°30′52″E)采集藻种。将采集的样品立即带回实验室,用50 mL 12 000 r/min冷冻离心2 min,浓缩成14 mL,各取2 mL置于盛有100 mL 的7种培养基的三角瓶中静置培养,温度(25±1)℃,光照强度7 000 lx,光暗比为12 h∶12 h,pH为8.20。采用水滴分离法和微管分离法分离纯化,直到分离出单一藻细胞,每天定时摇藻3次。
1.2 方 法
1.2.1 试验设计
将f/2、SE、D1、BBM、BG11、LB、Kuhl培养基进行筛选,筛选出的培养基为SE培养基。根据该培养基中不同成分设置不同浓度梯度,优化SE培养基。表1
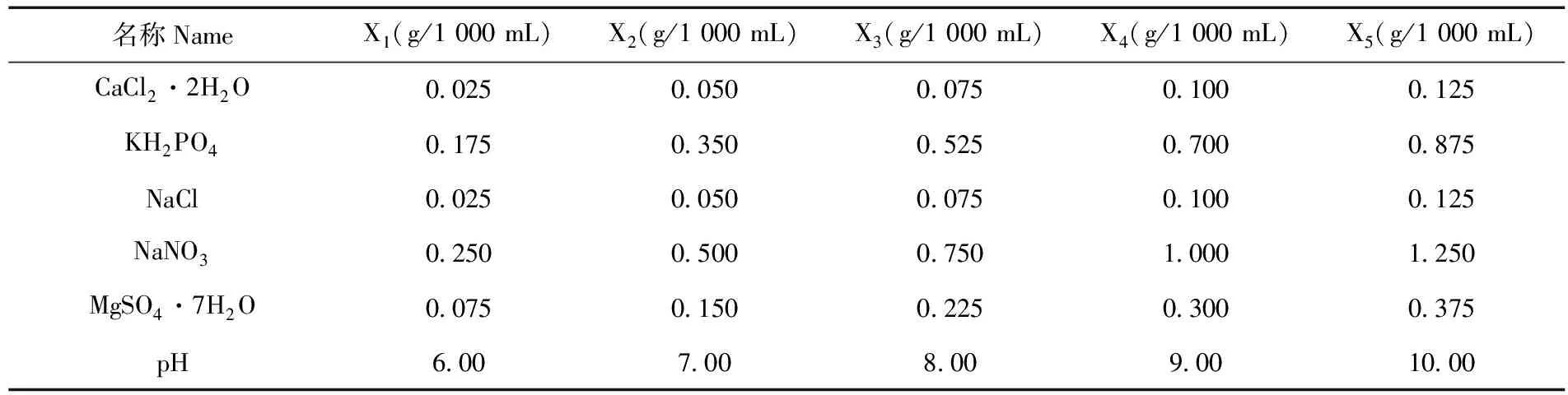
表1 SE培养基中各因素浓度
1.2.2 光学显微镜观察
定期观察藻细胞颜色、锥形瓶的附壁气泡量,并用光学显微镜观察各个培养基藻细胞的量以及运动状况,处于指数生长期的藻细胞,用显微镜观察并拍照。
1.2.3 基因组DNA的提取
用TIANGEN高效植物基因组DNA提取试剂盒来提取藻细胞基因组DNA。
1.2.4 PCR扩增
用于扩增真核绿藻的18S rDNA的引物:上游引物YM1(5′-CGGGATCCGGAGTCATATGCTTGTCTC-3′),下游YM2(5′-CGGAATTCCTTCTGCAGGTTCACC-3′);PCR反应体系为25 μL,dd H2O 8.5 μL,上下引物0.5 μL,DNA模板3 μL,2xTAP PCR MasterMix(TIANGEN)12.5 μL。PCR反应条件:95℃预变性5 min,95℃变性1 min,58℃退火1 min,72℃延伸2 min,30个循环;72延伸10 min,扩增结果为2%的琼脂糖进行28 min 100V 90A电泳。
1.2.5 系统发育进化树
测序结果与NCBI已知的数据库比较,利用BLAST搜索引擎中的Nucleotide blast获得所测序列的同源序列Genetyx 进行多重序列对比,采用Mega 11.0软件绘制出(Neighbor-Joining)系统发育树,重复1 000次计算bootstrap值。
1.2.6 测定指标
1.2.6.1 藻干重
拟合干重与吸光度的线性关系,藻干重测定:将待测藻液摇匀,移取呈梯度增加的不同体积藻液5份,超纯水稀释定容到同一体积,以培养液为空白,测定其在680 nm处吸光度值,而后将藻液经洁净恒重的微孔滤膜过滤,过滤后的藻液110℃烘干至恒重,并记录干重值。以吸光度为横坐标,干重为纵坐标即得藻干重与吸光度的线性回归方程G= 0.092A-0.000 9,R2= 0.997 1。
1.2.6.2 糖与蛋白
在9、14、19、24 d四个不同的时间点,采集各藻种10 mL于10 mL尖底螺口离心管,3 500 r/min离心10 min,向离心藻液中加入一定量PBS,超声破碎,时间视藻液的多少而定,保证细胞壁破碎,然后超声波提取1 h。处理后的藻液一部分用于蛋白质含量的测定,另一部分藻液加热煮沸10 min用于葡萄糖的测定,每种藻的蛋白含量和葡萄糖含量平行测定2次。
葡萄糖标准曲线的绘制:取7支20 mL试管,进行编号,配制成一系列不同浓度的标准葡萄糖溶液。在冰水浴下每管中均加入4 mL蒽酮试剂,摇匀后,打开试管塞,置沸水浴中煮沸10 min,取出冷却至室温,在625 nm波长下比色,测各管溶液的吸光度值,以标准葡萄糖浓度为横坐标,光密度值为纵坐标,作出标准曲线。表1
葡萄糖的标准曲线方程:A= 0.006 4C-0.014 4,R2=0.998 1。表2

表2 葡萄糖标准溶液配制
蛋白标准曲线的绘制:采用考马斯亮蓝法测定藻体内蛋白含量。
蛋白质标准曲线方程:A=0.007 3C+ 0.067 6,R2=0.997 7。表3

表3 蛋白质标准溶液配制
1.2.6.3 色素
在9、14、19、24 d四个不同的时间点,采集各藻种5 mL于10 mL尖底螺口离心管,3 500 r/min 离心10 min,去掉上清液,加入5 mL 90%的丙酮,过夜放置24 h。再次3 500 r/min离心10 min,将上清液扫描吸收曲线,测定特定波长的吸光度,计算色素含量。
叶绿素a的含量= 12.7OD663-2.69OD645.
叶绿素b的含量= 22.9OD645-4.86OD663.
总叶绿素含量= 8.02OD663+ 20.20OD645.
1.3 数据处理
用Excel 2010进行数据处理。
2 结果与分析
2.1 光学显微镜的观察结果及培养基筛选
研究表明,1号藻,单细胞,聚集成膜状团块或包被于胶质中。细胞球形,有时压扁,大小不一。随生长细胞结构发生变化:细胞壁不规则地增厚,并明显分层;色素体由杯状变成分散状充满细胞内部;蛋白核也由1个变成多个,并有多数淀粉颗粒。无性繁殖产生动孢子,有时可形成不动孢子。藻细胞在f/2、SE、D1、BBM、BG11、LB、Kuhl培养基中存在不同的状态,生长状态最佳的是SE培养基。表4,图1

图1 1号藻在40倍镜观察

表4 藻细胞在7种培养基中的不同状况
2.2 18S rDNA序列
研究表明,TIANGEN高效植物基因组DNA提取试剂盒提取DNA用核酸浓度检测仪检测其浓度为30.92 ng/μL,扩增出长度分别为1 730 bp的基因片段。图2,图3

图2 提取DNA的成像

图3 PCR扩增后的成像
1号藻的序列与GenBank上的Pseudochlorococcumsp.(MH683908.1)的同源性高,相似率达99.42%,比对序列中有2个碱基不同。1号藻与新颖拟绿球藻属聚簇成一支,与Pseudochlorococcumsp.(MH683908.1)的节点支持率为100,遗传距离值为0.00,1号藻与Pseudochlorococcumsp.(MH683908.1)亲缘关系很近。图4

图4 18S rDNA序列的系统发育树
2.3 不同因素的不同浓度对1号藻的可溶性糖的影响
研究表明,选择第3个时间点(19 d),此时间点是指数生长后期。在CaCl2·2H2O浓度为X1(0.025 g/L)、X2(0.050 g/L)、X3(0.075 g/L)、X4(0.100 g/L)、X5(0.125 g/L)时,可溶性糖浓度最高的是X2(0.050 g/L)CaCl2·2H2O,浓度为24.34%。在KH2PO4浓度为X1(0.175 g/L)、X2(0.350 g/L)、X3(0.525 g/L)、X4(0.700 g/L)、X5(0.875 g/L)时,可溶性糖浓度最高的是X1(0.175 g/L) KH2PO4,浓度为10.53%。在NaCl浓度为X1(0.025 g/L)、X2(0.05 g/L)、X3(0.075 g/L)、X4(0.100 g/L)、X5(0.125 g/L)时,可溶性糖浓度最高的是X4(0.100 g/L) NaCl,浓度为11.82%。在NaNO3浓度为X1(0.250 g/L)、X2(0.500 g/L)、X3(0.750 g/L)、X4(1.000 g/L)、X5(1.250g/L)时,可溶性糖浓度最高的是X1(0.250 g/L)NaNO3,浓度为10.64%。MgSO4·7H2O浓度为X1(0.075 g/L)、X2(0.150 g/L)、X3(0.225 g/L)、X4(0.300 g/L)、X5(0.375 g/L)时,可溶性糖浓度最高的是X5(0.375 g/L) MgSO4·7H2O,浓度为12.32%。当pH为X1(6.0)、X2(7.0)、X3(8.0)、X4(9.0)、X5(10.0)时,可溶性糖浓度最高的是X4(9.0)pH,浓度为16.57%。图5

图5 不同因素不同浓度下可溶性糖含量变化
2.4 不同因素的不同浓度对1号藻的可溶性蛋白的影响
研究表明,选择第3个时间点(19 d),此时间点是指数生长后期。在CaCl2·2H2O浓度为X1(0.025 g/L)、X2(0.050 g/L)、X3(0.075 g/L)、X4(0.100 g/L)、X5(0.125 g/L)时,可溶性蛋白浓度最高的是X2(0.050 g/L)CaCl2·2H2O,浓度为16.55%。在KH2PO4浓度为X1(0.175 g/L)、X2(0.350 g/L)、X3(0.525 g/L)、X4(0.700 g/L)、X5(0.875 g/L)时,可溶性蛋白浓度最高的是X1(0.175 g/L) KH2PO4,浓度为7.70%。在NaCl浓度为X1(0.025 g/L)、X2(0.050 g/L)、X3(0.075 g/L)、X4(0.100 g/L)、X5(0.125 g/L)时,可溶性蛋白浓度最高的是X4(0.100 g/L) NaCl,浓度为8.57%。在NaNO3浓度为X1(0.250 g/L)、X2(0.500 g/L)、X3(0.750 g/L)、X4(1.000 g/L)、X5(1.250g/L)时,可溶性蛋白浓度最高的是X1(0.250 g/L),含量为6.10%。MgSO4·7H2O浓度为X1(0.075 g/L)、X2(0.150 g/L)、X3(0.225 g/L)、X4(0.300 g/L)、X5(0.375 g/L)时,可溶性蛋白浓度最高的是X5(0.375 g/L) MgSO4·7H2O,浓度为9.90%。当pH为X1(6)、X2(7.0)、X3(8.0)、X4(9.0)、X5(10.0)时,可溶性蛋白浓度最高的是X4(9.0)pH,浓度为9.46%。图6

图6 不同因素不同浓度下可溶性蛋白含量变化
2.5 不同因素的不同浓度对1号藻的总叶绿素的影响
研究表明,在CaCl2·2H2O浓度为X1(0.025 g/L)、X2(0.050 g/L)、X3(0.075 g/L)、X4(0.100 g/L)、X5(0.125 g/L)时,总叶绿素含量浓度最高的是X2(0.050 g/L)CaCl2·2H2O,含量为2.000 mg/L。在KH2PO4浓度为X1(0.175 g/L)、X2(0.350 g/L)、X3(0.525 g/L)、X4(0.700 g/L)、X5(0.875 g/L)时,总叶绿素含量浓度最高的是X1(0.175 g/L) KH2PO4,含量为3.607 mg/L。在NaCl浓度为X1(0.025 g/L)、X2(0.050 g/L)、X3(0.075 g/L)、X4(0.100 g/L)、X5(0.125 g/L)时,总叶绿素含量浓度最高的是X4(0.100 g/L) NaCl,含量为3.385 mg/L。在NaNO3浓度为X1(0.250 g/L)、X2(0.500 g/L)、X3(0.750 g/L)、X4(1.000 g/L)、X5(1.250 g/L)时,总叶绿素含量最高的是X1(0.250 g/L) NaNO3,含量为2.731 mg/L。MgSO4·7H2O浓度为X1(0.075 g/L)、X2(0.150 g/L)、X3(0.225 g/L)、X4(0.300 g/L)、X5(0.375 g/L)时,总叶绿素含量浓度最高的是X5(0.375 g/L) MgSO4·7H2O,含量为1.790 mg/L。当pH为X1(6.0)、X2(7.0)、X3(8.0)、X4(9.0)、X5(10.0)时,总叶绿素含量浓度最高的是X4(9.0)pH,含量为1.985 mg/L。图7

图7 不同因素不同浓度下总叶绿素含量变化
2.6 优化后的各因素浓度对1号藻各个指标的影响
研究表明,以SE培养基为基础,将优化后的CaCl2·2H2O(0.050 g/L)、KH2PO4(0.175 g/L)、NaCl(0.100 g/L)、NaNO3(0.250 g/L)、MgSO4·7H2O(0.375 g/L)以及pH(9.0)配置培养基。在14 d已达到指数生长期,较前面单因素试验提前5 d;优化后的可溶性糖、可溶性蛋白以及总叶绿素含量明显高于优化前的相应指标含量。优化前的可溶性糖含量为10.55%,优化后的可溶性糖含量为25.32%;优化前的可溶性蛋白含量为6.86%,优化后的可溶性蛋白含量为18.15%;优化前的叶绿素含量为1.364 mg/L,优化后的叶绿素含量为3.863 mg/L。图8,图9

图8 优化前后的可溶性糖和可溶性蛋白含量变化

图9 优化前后总叶绿素含量变化
3 讨 论
3.1 钙对微藻生长的影响
钙离子能够参与调控生物生长发育的过程[12]。Ca2+还是胞内信使与调节蛋白的重要组成物质,调节生长和生理功能,Ca2+参与光合作用,胞外聚合物的形成,细胞钙化等生理代谢过程,同时也作为逆境信号传递者并对重金属毒害产生拮抗效应[13]。钙是构成细胞膜的主要成分,对碳水化合物的形成与转化起着至关重要的作用[14]。张哲等[15]研究发现,降低钙的浓度可以有效促进微藻Desmodesmussp.WC08生长和油脂的积累。何爽[16]研究发现,高钙时Shannona指数和Evenness指数在各个营养状态下均略大于低钙时的,高钙有利于物种均匀度和多样性的特征。王晋平等[17]研究发现,当固体剂CaCl2的浓度为300 mmol/L时,能提高藻酸钙凝胶的机械强度。试验研究结果与潘孝妍等[14]研究有相似之处,随着CaCl2·2H2O质量浓度的增加,微藻的生物量出现先升高后降低的趋势。由于藻种的不同,发生的转折点不同,潘孝妍等[14]研究出现在15 d,而试验的研究结果出现在19 d。潘孝妍等[14]研究显示,CaCl2·2H2O的质量浓度为0.072 g/L时,结果最佳;而试验的质量浓度为0.050 g/L,结果最佳。不同的结果可能是温度、pH、光照等不同因素所导致。
3.2 氮磷对微藻生长的影响


在氮磷比为32∶1时,普通小球藻(Chlorellavulgaris)的生长性能最好,叶绿素含量也最高。在氮磷比为64∶1时,波吉卵囊藻(Oocystisborgei)的生长速率达到最大值[35]。当氮、磷含量不同时,导致了细菌菌落结构的差异,微囊藻共栖的细菌群落对外界环境氮、磷营养元素的环境变化极为敏感[36]。
3.3 NaCl和镁离子对微藻生长的影响
梁英等[37]研究显示,盐度是影响微生物生长发育的重要因子。盐度主要是通过渗透压胁迫、离子胁迫以及改变细胞膜对离子的通透性等诸多方面来影响生物对氨氮的吸收[38]。在适宜盐度范围内,钠是一种微量必需元素,可以增加植物叶绿素的含量,提高原生质的吸水性,改善光合细胞水分状况,从而促进光合作用[39]。陈因等[40]研究,氯化钠对蓝藻固氮胁迫不仅会影响固氮酶的活性,也会影响酶的特性,其胁迫程度会不断增大。刘春光等[41]表明,在一定时期内低于3 g/L盐度对藻类的生长有促进作用,而高于6 g/L盐度有抑制作用。与试验结果相似,在NaCl浓度为0.125 g/L时最适,同时也是在较低盐度范围内并对藻类有促进作用。郑逸等[42]报道,抑制作用随盐度升高而增加,而试验NaCl在适宜浓度对藻类的生长趋势为先增加再降低,而不是一直增加。因为NaCl在适宜浓度对藻类的生长是促进作用。NaCl的浓度也不能太高,因为在高盐胁迫下会导致细胞内部溶质外渗以及藻体代谢过程紊乱[43]。Na+增加取代了质膜上的Ca2+会造成细胞膜通透性增加,Ca2+作为第二信使,其降低进一步抑制的钙调蛋白的活性,从而对细胞各类代谢活动产生影响,植物生长发育也会受到抑制[44-45]。
镁是限制浮游植物生长的主要因素之一,对浮游植物有效利用碳、氮和磷以及叶绿素的生物合成和光合作用等诸多方面都起着重要的作用[46]。Mg2+不仅是叶绿素的组分之一,而且还是酶的活性剂[47]。金属元素的适宜浓度范围对藻类的生长繁殖和群体形式存在起着至关重要的作用,只有在适宜浓度范围内,金属元素含量的增长才会促进藻类形成群体,反之则使群体解聚死亡[48]。Ankush等[49]发现较高的Mg2+浓度不利于Chlorococcuminfudionum生物量的积累。Kuan等[50]对ChlorellaprototheoidesUTEX 250的研究发现,和原始加镁的原始培养基相比,移除Mg2+的培养基对小球藻生物量和油脂积累都有积极的影响。刘建坤[51]认为当镁离子浓度为3mmol/L时,杜氏盐藻(Dunaliellasalina)胞内甘油含量最高,可达167.449 mg/L,当镁离子浓度为7 mmol/L时,杜氏盐藻(Dunaliellasalina)细胞可溶性蛋白含量最高,可达到346.664 mg/L。试验镁离子浓度为0.375 g/L时,可溶性蛋白、可溶性糖和总叶绿素均是最高,可能是培养基、藻种、藻种来源等因素不同所导致而成。
3.4 酸碱度对微藻生长的影响
只有在适宜的酸碱度范围内,藻细胞才能正常生长繁殖。另一方面影响碳酸盐平衡系统及不同形态无机碳分配关系,从而对藻类生长造成影响[52]。pH也影响藻类光合作用和呼吸作用速率,pH为8时,藻类光合速率和呼吸速率均达到最大值[53]。pH还影响细胞膜的渗透压及细胞内多种酶的活性,从而影响藻类的生长[54]。藻类有其适宜生长的pH范围,过高或者过低均会抑制藻类生长[55]。过量的H+降低碳酸酐酶活性,从而使CO2浓缩机制受到影响,导致藻类死亡[56]。过量的H+对藻细胞的内部结构有直接的破坏作用,从而使光合作用受到影响,特别是降低细胞质和叶绿体内pH值,阻止卡尔文循环,因此降低了开放式光合系统Ⅱ反应位点数量[57]。藻类喜欢生长于偏碱性水体(pH7.7~9.4),在一定的范围内,可以把养殖水体pH值调到偏酸性,进而可以抑制藻类生长[58]。该研究结果与试验结果相似,试验结果中1号藻适宜的pH 为9.0,其喜欢偏碱性水体生长。不同的藻类,其适宜的pH范围各不相同,铜绿微囊藻(Microcystisaeruginosa),水华鱼腥藻(Anabaenaflos-aquae),浮游颤藻(Oscillatoriales)适宜的pH 分别为9.0、8.0~9.0、7.0~8.0,斜生栅藻(Scenedesmsobliquus),绿球藻(Chlorococcum),雷氏衣藻(Chlamydomonas reinhardtii)适宜的pH分别为9.0~10.0、8.0~9.0、7.0[59]。1号藻是隶属于绿球藻属(Chlorococcum),pH为9.0,也是与其研究结果相同。各种藻类生长都有它适合的pH范围,改变pH会影响藻类的生长繁殖,进而影响到种类的演替[60]。pH对浮游植物的种类组成以及分布有着重要的影响[61-62]。
4 结 论
1号盐碱绿藻与新颖拟绿球藻属(Pseudochlorococcumsp.)聚簇成一支,以SE培养基为基础,在不同浓度的CaCl2·2H2O、KH2PO4、NaCl、NaNO3、MgSO4·7H2O以及pH中,0.050 g/L CaCl2·2H2O、0.175 g/L KH2PO4、0.100 g/L NaCl、0.250 g/L NaNO3、0.375 g/L MgSO4·7H2O、pH9.0 为最适浓度。

