低氧胁迫对鱼类的影响以及营养调控策略的研究进展
张雷敏 梁化亮,2 米海峰 任鸣春,2 *
(1.南京农业大学无锡渔业学院,无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,无锡 214081;3.通威农业发展有限公司,成都 610041)

1 低氧对鱼类的影响
1.1 低氧对鱼类生长发育的影响
作为鱼类生活环境中的重要理化因子之一,水体DO对鱼类的正常生长具有重要影响。水体低氧往往会导致鱼类的肠道消化能力、食物吸收转化能力以及代谢强度的下降,使鱼类摄食减少,生长速度减慢,最终生长不良甚至死亡。例如,当水体DO含量下降时,大口黑鲈(Micropterussalmoides)的体重增长率(weight growth rate,WGR)、特定生长率(specific growth rate,SGR)和摄食量(feed intake,FI)都呈下降趋势,且重度低氧组的终末长度和饲料效率(feed efficiency,FE)显著降低[7]。对吉富罗非鱼(Oreochromisniloticus)进行研究发现,DO含量的升高使得试验鱼的成活率、WGR、SGR、肝体比、脏体比等显著提高,而鱼体血液中白细胞(white blood cell,WBC)数量、血红蛋白(hemoglobin,Hb)含量等先下降后上升,表明低氧胁迫通过影响该鱼的肝脏脂肪酸的组成等,导致其生长缓慢[8]。设置常氧(7.9 mg/L)和低氧(4.5 mg/L)2个DO含量对虹鳟鱼(Oncorhynchusmykiss)进行试验,发现低氧处理会影响虹鳟鱼的生长状况,主要表现为试验鱼的FI、SGR、耗氧量以及能量和脂肪含量的降低[9]。当DO含量为3.5 mg/L时,草鱼(Ctenopharyngodonidella)对蛋白质、能量和干物质的表观消化率显著降低,摄食也会受到影响,与之相比,在6.0 mg/L DO含量下的草鱼在WGR、蛋白质存留率(protein retention rate,PRE)、蛋白质效率(protein efficiency ratio,PER)以及FE等方面均有显著提高[10]。与对照组相比,低氧处理的尼罗罗非鱼(Niletilapia)在FI、FE和生长性能等方面显著降低[11]。温度和盐度水平固定不变时,生活在饱和DO环境下的大西洋鲟鱼(Acipenseroxyrinchus)的死亡率接近于0,而当DO含量降为饱和DO的30%时,其估计死亡率是40%饱和DO的2倍和70%饱和DO的4倍[12]。综上所述,不同生长阶段的不同鱼类,均会受到低氧胁迫不同程度的影响,从而在生长方面表现异常。
1.2 低氧对鱼类行为活动的影响
低氧环境会引起鱼类应激并影响其生长。因此,当水中的DO含量降至鱼类生理需氧量的临界值附近时,鱼类会通过调整一系列个体行为来适应或逃离不良环境,从而减少或避免低氧的危害。常见的行为反应包括游离低氧区、跃出水面呼吸以及减少活动以降低代谢速率等。例如,常氧状态下,尼罗罗非鱼在水中的平均深度为(54.6±2.9) cm,当氧分压(partial pressure of oxygen,PO2)下降至2.1和1.3 kPa时,鱼在水中的平均深度分别上升至(42.6±1.6) cm和(23.1±9.9) cm,且后者有50%的鱼会到水体表面进行呼吸[11]。鱼类的临界游泳速度(critical swimming speed,Ucrit)是衡量鱼类有氧游泳能力的重要指标,通常会随DO含量波动而变化。在不同DO含量环境中,不同鱼类的游泳能力受到的影响各异。研究结果显示,当DO含量下降到常氧的12.5%时,鳊鱼(Parabramispekinensis)和中华倒刺鲃(Spinibarbussinensis)的Ucrit值下降幅度分别为53%和50%[13]。对红鳍东方鲀(Takifugurubripes)幼鱼进行研究,发现生活在DO含量分别为2.14、4.10和5.81 mg/L的鱼,其Ucrit值显著低于对照组(7.36 mg/L)[14]。当PO2值从19.9 kPa迅速降到13.2 kPa,然后逐渐稳定在8.4 kPa的过程中,作为一种初始的回避反应,大西洋鳕鱼(Atlanticcod,Gadusmorhua)的游动速度先提高了18%,然后下降了21%,并随着PO2值的下降而持续下降[15]。水中的DO含量由较高水平降为较低水平时,南方鲇鱼(Southerncatfish)幼鱼的FI和活动量都会随之减少[16]。令斑马鱼(Brachydanioreriovar)在0.5 mg/L的低氧环境中生活2 h,其游动姿态逐渐失去平衡,最终停止运动保持静止[17]。综上所述,低氧胁迫会通过促使鱼类改变行为活动而对其生活和生存状态产生影响。
1.3 低氧对鱼类生理生化的影响
生活在低氧水体中的鱼类,除了行为活动会为了适应环境而改变,其机体内环境也会进行调整,在生理生化层面对低氧胁迫产生响应,诱使鱼类发生应激反应。目前的研究结果表明,低氧环境中的鱼类在生理生化方面的变化主要表现在呼吸代谢、细胞增殖与凋亡、抗氧化能力以及免疫反应等方面。对斑石鲷的研究发现,处在低氧环境中时,其呼吸频率会增加,从而提高血液WBC、红细胞(red blood cell,RBC)数量以及皮质醇(cortisol,COR)、葡萄糖(glucose,GLU)和Hb浓度,并在临界PO2值处达到最大值[6]。在对鲻鱼(Mugilcephalus)幼鱼进行的试验发现,鱼体肝脏和鳃中的丙二醛(malondialdehyde,MDA)含量与DO含量呈明显的负相关关系,且在复氧30 d后仍高于对照组,表明低氧会加剧鲻鱼肝脏和鳃组织脂质过氧化反应[18]。对黄颡鱼(Pelteobagrusfulvidraco)进行急性低氧试验后,黄颡鱼肝脏和鳃中的5-羟基色氨酸(5-hydroxytryptophan,5-HTP)、COR和MDA的含量显著升高,在抗氧化方面,总超氧化物歧化酶(total superoxide dismutase,T-SOD)和过氧化氢酶(catalase,CAT)的活性显著升高[19]。对鲫鱼(Carassiusauratus)[20]和翘嘴鲌(Culteralburnus)[21]的研究表明,低氧胁迫可诱导其发生氧化应激反应,导致部分生化指标如Hb含量和乳酸脱氢酶(lactate dehydrogenase,LDH)活性等发生显著变化,从而对鱼体代谢功能产生影响。在对鲟鱼进行的试验中,低氧组鲟鱼的视网膜、视顶盖(optic tectum,OT)、垂体等的凋亡细胞水平显著高于常氧组,表明低氧对鱼类细胞有损伤影响并且可持续[22]。免疫反应方面,对东北鲟鱼(Acipensersinensis)进行低氧应激后发现,该鱼类的血液COR、GLU含量和其他血液参数在应激后显著升高,而脾指数(splenic index,SI)在低氧应激后有所下降[23]。综上所述,鱼类可以通过调整自身生理代谢水平来应对低氧胁迫,同时这也可能是抑制其生长的一种原因。
2 低氧作用的分子机理
当水体DO含量下降至威胁鱼类正常生活和生存的水平时,鱼类体内会有一套由众多蛋白分子参与的调控机制对低氧胁迫产生响应,即低氧信号传导途径[24]。在整个低氧应答体系中,低氧诱导因子(hypoxia-inducible factor,HIF)是低氧信号传导途径中的最关键因子,由低氧诱导因子-1α(hypoxia-inducible factor-1alpha,HIF-1α)亚基或低氧诱导因子-2α(hypoxia-inducible factor-2alpha,HIF-2α)亚基与低氧诱导因子-1β(hypoxia-inducible factor-1beta,HIF-1β)亚基2个亚单位所组成,在维持动态氧的平衡和低氧条件下的氧浓度变化等方面发挥着重要作用,在目前已知的后生动物中都有表达[25]。在DO含量正常时,脯氨酸羟化酶(prolyl hydroxylase,PHD)会以氧分子作为底物对HIF-α的特异脯氨酸位点进行羟基化[26],羟基化后的HIF-α被希佩尔林道肿瘤抑制蛋白(von-Hippel-Lindau tumor suppressor protein,pVHL)识别并结合,最终通过蛋白酶体降解[27]。在低氧条件下,氧分子的缺乏导致PHD的活性受到抑制,HIF-α不能被降解,进而转运至细胞核中与HIF-β结合形成异源二聚体,该二聚体会与靶标基因上的低氧反应元件(hypoxia response element,HRE)结合,连同一些转录激活因子(如CBP/p300)共同作用,激活下游基因的表达(图1)。这些下游基因涉及到细胞的分化与凋亡、糖代谢和血管再生等方面,从而引起鱼类的一系列生理生化和机体反应[25]。例如,对大口黑鲈进行的低氧试验发现,低氧使得其体内的HIF-1α水平升高并稳定表达,同时,鱼体会通过促进肝脏血管生成来应对低氧环境带来的不适[28]。由此可见,HIF-α的水平与环境DO含量密切相关,并在调控鱼类适应低氧的过程中发挥重要作用。
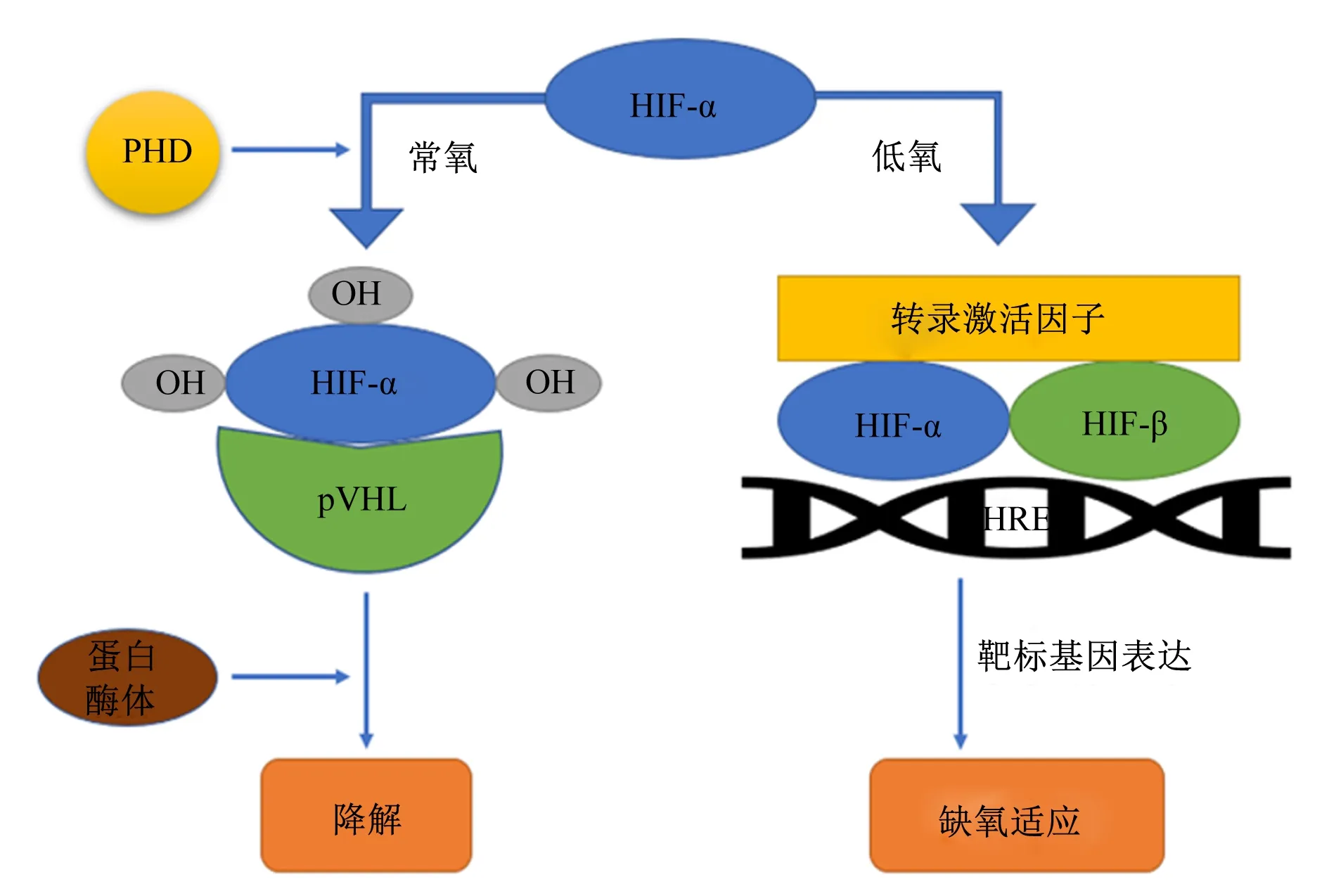
PHD: 脯氨酸羟化酶 prolyl hydroxylase; HIF:低氧诱导因子 hypoxia-inducible factor;pVHL:希佩尔林道肿瘤抑制蛋白 von-Hippel-Lindau tumor suppressor protein; HRE:低氧反应元件 hypoxia response element。
3 鱼类自身的适应机制
鱼类对低氧胁迫具有一定的适应能力。根据低氧的发生条件和鱼类对低氧进行反应的时间及结果,可以将适应机制分为急性应激反应和长期适应。
3.1 急性应激反应
急性低氧通常出现在较高养殖密度的水体中,当水温在短时间内发生变化或者水体成分发生改变时,DO含量会在短期内急剧下降,从而引起鱼类的急性应激。
首先是行为活动方面,鱼类在面对急性低氧应激时常出现的行为反应包括到水面直接呼吸、调整游动速率和改变呼吸方式等。例如,Kramer等[29]的研究表明,进行水生表面呼吸(aquatic surface respiration,ASR)是为数不多的能使鱼类在低氧条件下生存的呼吸替代方案之一,该行为极大地提高了鱼类在低氧水体中的存活率。对罗非鱼(Tilapia)的研究发现,低氧胁迫下,其游动速度会降低以作为减少能量和氧气消耗的一种适应行为[30]。多数鱼类面对低氧会增加无氧代谢,以补偿能量的减少。Virani等[31]以耗氧率(oxygen consumption rate,OCR)和血液乳酸含量为指标对大底鳉(Fundulusgrandis)进行研究,发现低氧胁迫使其OCR出现下降而血液乳酸含量有所增加,说明大底鳉在低氧状态下主要进行无氧代谢以应对DO的不足。此外,鲫鱼的视网膜光诱发反应和OT的相应诱发电位在低氧环境中下降,且在复氧后恢复正常,说明低氧会抑制其体内中枢神经系统(central nervous system,CNS)的活动,同时表明鲫鱼在低氧条件下可以通过暂时关闭视觉功能以减少能量的消耗[32]。
其次是形态方面,作为鱼类重要的呼吸器官,鱼鳃在鱼类应对低氧环境的过程中具有重要作用。当鲫鱼和金鱼(Carassiusauratus)处于低温常氧环境时,其鱼鳃的片层主要嵌入在片层间细胞团(interlamellar cell mass,ILCM)中,而当环境中的DO含量下降至Pcrit值附近时,ILCM退化,使得鱼鳃的呼吸表面积增大,从而提高了鱼类的摄氧能力[33-34],增强其对低氧胁迫的耐受性。
3.2 长期适应策略
面对急性低氧时,鱼类能够快速地作出反应来降低低氧的影响,并随着DO含量的升高而恢复正常状态。而当长期低氧时,为了适应低氧环境,鱼类往往会通过基因突变来使自身的组织器官以及生理生化水平等发生永久性的改变[25]。通过进化来改变或者发展其他器官以增强呼吸能力是一些鱼类应对长期低氧的自然选择结果。例如,泥鳅(Misgurnusanguillicaudatus)不仅用鳃呼吸,还进化出了肠气呼吸(gastrointestinal air breathing,GAB)和皮肤等器官进行辅助呼吸[35],该机制极大地提高了泥鳅的摄氧能力。类似的还有黄鳝(Monopterusalbus),其口腔、喉腔和肠道内壁表皮黏膜充满了毛细血管,吻端伸出水面就可以直接吸取空气中的氧气,把空气贮存在口腔,使口中的氧气逐渐与口腔内壁进行气体交换,因此黄鳝在DO含量很低的水中也能正常生活[36]。
在生理生化方面,鱼类会通过漫长的进化来改变代谢方案以加强适应低氧的能力。例如,鲫鱼具有极强的耐低氧能力,在北欧冬季的低温低氧水体中也能够存活数月并保持活跃[37]。低氧暴露48 h后发现,鲫鱼肌肉和肝脏的蛋白质合成速率急剧下降52%~95%,这一过程可以减少能量的消耗,提高其生存能力,恢复常氧后,蛋白质合成速率也逐渐恢复[38]。另外,当鲫鱼的大脑因低氧而缺乏能量时,会启动一种机制来释放γ-氨基丁酸(γ-aminobutyric acid,GABA),这可能会抑制足够量的神经元来恢复腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)水平[37]。此外,鲫鱼同样可以通过鳃的形态改变和无氧呼吸来提高耐低氧能力[39-40]。金鱼具有较强的低氧耐受性,其Hb对氧气具有极大的亲和力,在PO2值为0.35 kPa时,其Hb含量已经达到氧饱和度的50%,在中度低氧时,其动脉和静脉PO2值可分别低至0.24和0.03 kPa,且会随DO含量的恢复而恢复[41]。
4 营养调控研究
在应对水体养殖过程中出现的低氧胁迫时,除了鱼类通过自身反应进行适应外,还应当通过人工手段来加强鱼类对低氧环境的承受能力,缓解或消除低氧对养殖效果的影响,从而保证养殖效益。近些年来,随着研究水平不断向微观层面深入,越来越多的营养添加剂被发现且应用至水产行业,并取得了优良效果(表1)。
4.1 蛋白质和氨基酸
蛋白质是生命活动的物质基础,也是构成细胞的基本有机物,饲料蛋白质对鱼类的生长具有重要作用。慢性低氧会使蛋白质的分解代谢增加。因此,提高蛋白质的摄入量有利于维持鱼类在低氧环境中的正常生长。对斑马鱼进行的研究显示,在低氧条件下,高蛋白质摄入量能够促进斑马鱼对慢性低氧的适应,减轻由慢性低氧引起的体重和FE的降低,提高糖原和蛋白质的利用率,且能够通过激活HIF-1α及其下游糖酵解基因的转录来供应能量,除此之外还能缓解慢性低氧引起的肠道消化酶活性降低和微生物群失调[42]。另有研究表明,适宜饲料蛋白质水平(43.30%)有助于改善低氧对三倍体虹鳟造成的应激损伤,提高其抗应激能力并改善肌肉品质[43]。
氨基酸是一种含有氨基的有机酸,同时也是构成蛋白质的基本单位,能够有效增强各种水产生物的抗应激能力,从而降低水产养殖的风险与损失。在增强鱼类耐低氧能力方面,关于甘氨酸(glycine,Gly)、精氨酸(arginine,Arg)和牛磺酸(taurine,Tau)以及GABA的研究较为成熟。Gly是鱼类的一种非必需氨基酸,属于中枢神经系统中的抑制性神经递质,游离状态的Gly能够有效保护生物体细胞。Arg作为鱼类的一种必需氨基酸,是鱼类生理和病理方面的重要内源性信息高活性分子一氧化氮(nitric oxide,NO)唯一的供氮前体,对机体心血管系统、神经系统和免疫系统有着广泛影响[44]。Tau是一种含硫氨基酸,是动物机体的内源性物质,具有抗氧化和保护生物膜等作用。GABA是一种非蛋白质氨基酸,具有镇定作用,是一种重要的抑制性保护物质。以草金鱼(Carassiusaurutus)、圆尾斗鱼(Macropodusocellatus)和中华鳑鲏(Rhodeussinensis)为试验对象进行研究,发现当Gly含量为5.33~7.69 μg/mL和0.54~0.986 μg/mL时,分别可以显著提高圆尾斗鱼和中华鳑鲏的耐低氧能力;当Arg含量为14.13~14.89 μg/mL和8.93~10.65 μg/mL时,可以显著增强草金鱼和中华鳑鲏的耐低氧能力[45]。此外,急性低氧会使鲤鱼(Cyprinuscarpio)的免疫反应被抑制,从而易发生细菌性疾病,但是向饲料中补充适宜水平的Arg后,在不同的DO含量下,都可以提高鲤鱼的存活率[46]。红细胞渗透脆性试验的溶血率与急性低氧存活时间显著相关,研究发现,适宜水平的Tau能够显著改善草鱼的红细胞渗透脆性,且随着饲料中Tau添加水平的增加,草鱼的耐急性低氧能力改善更加明显[47]。另有研究结果表明,不同含量的Tau能不同程度地提高草金鱼的耐低氧能力,其中含量为0.5%和1.0%时效果最佳。究其原因为,Tau一方面可通过增加Hb含量来提高对氧分子的运输能力,另一方面还可以在PO2值下降时提高Hb与氧的亲和能力。除了Tau,该研究同时着眼于GABA对草金鱼耐低氧能力的研究,且得到了低含量(0.1%、0.3%和0.5%)的GABA能够提高草金鱼在低氧条件下的存活时间这一结论,说明GABA对受低氧胁迫的鱼具有保护作用[48]。相似的结果在对印度鲮(Cirrhinusmrigala)的研究中也有发现,向暴露于低氧环境中的印度鲮补充GABA,可以恢复急性低氧诱导的HIF-1α的表达水平、甲状腺激素(thyroxine,T4)水平和LDH活性。低氧会引起血清代谢物如GLU和乳酸含量等的增加,而补充GABA可以有效降低它们的水平。因此,GABA可以提高鱼类在低氧条件下的存活时间[49]。
4.2 脂肪
脂肪是组成生物体的重要成分,能够为生物体提供能量,具有重要的生物功能。对草鱼的研究结果显示,具有适当脂质水平的饲料可以缓解由低氧引起的不良后果,包括减轻低氧对草鱼造成的肝脏损伤并抑制肝脏细胞凋亡、减轻肝脏内质网应激并抑制肝细胞自噬,同时确定了耐低氧诱导肝脏损伤的最佳脂质水平分别为3.59%和3.05%[50]。在其他鱼类的研究中发现,适宜的饲料脂肪水平(22.80%)有助于提高三倍体虹鳟应对低氧应激损伤的能力,增强其免疫力[43]。在面对环境压力时,鱼类首先利用碳水化合物和脂类等储备能量来维持生命活动,由于鱼类对碳水化合物的利用率很低,故利用脂质提供能量是鱼类应对低氧环境的极佳选择。
4.3 维生素
维生素是生物为维持正常生理功能而需要从外部获取的一种微量有机物质,在生物的生长代谢和发育繁殖等生命活动中发挥着重要作用。有学者以卒死率为指标对条石鲷(Oplegnathusfasciatus)和斑石鲷进行研究,发现在饲料中添加适宜水平的维生素C(vitamin C,VC)可以降低鱼类在低氧环境中的卒死率,且所有低氧水平环境下鱼类的应激耐性与饲料中VC的添加量呈正相关关系[51]。而后在对异育银鲫(Carassiusauratusgibelio)的研究中揭示了这种保护机制,即VC可降低鱼类下丘脑的细胞凋亡指数,抑制低氧诱导的肝脏葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)表达和内质网应激以及细胞凋亡,通过核因子E2相关因子2/Kelch样ECH关联蛋白1(Nrf2/Keap1)信号通路减轻氧化损伤、炎症和急性低氧诱导的细胞凋亡,从而增强鱼类对低氧的耐受能力[52]。吕广祺等[53]进行联合试验发现,不同含量的Tau和VC联合使用,对提高麦穗鱼(Pseudorasboraparva)的耐低氧能力作用比VC和Tau单独作用时效果好,在Tau和VC的联合作用下,麦穗鱼的耐低氧能力得到提高效果比Tau与VC单独作用相比更明显,但其作用机理尚不明确,有待于进一步深入研究。
4.4 非营养性添加剂
除了一些常见的营养物质外,多种能够用于提高鱼类耐低氧能力的非营养性添加剂也被相继发现,并通过试验研究证实了其可行性。
β-葡聚糖是一种同型多糖,具有增强免疫的效果,可以提高鱼类的机体免疫力。MDA是一种有机化合物,能够作为指示抗氧化损伤的标志性产物,其含量的增加表明低氧胁迫对鱼体造成了氧化损伤[54]。王永红等[55]研究发现,注射β-葡聚糖可以降低低氧状态下大黄鱼(Larimichthyscrocea)幼鱼肝脏中MDA含量,说明β-葡聚糖能够在一定程度上缓解低氧胁迫引起的大黄鱼幼鱼氧化损伤。对罗非鱼的研究显示,水中添加0.1 mg/L的β-葡聚糖能够调节罗非鱼的血液GLU含量,增加其肠道细菌群落的丰富度,最大限度地减少低氧的影响,从而降低死亡率[56]。
此外,其他研究还发现在饲料中添加0.1%~0.3%的啤酒酵母菌提取物可提高花鲈幼鱼的生长性能,改善抗氧化状态,提高抗低氧胁迫的能力[57];三萜类苷元具有抗低氧作用,可以提高斑马鱼在低氧环境中的存活率[58];饲料中添加米曲霉益生菌(aspergillus oryzae,ASP)可以提高罗非鱼在低氧胁迫前后体内抗氧化酶如SOD和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的活性,并降低MDA的含量,从而显著提高罗非鱼对低氧胁迫的防御能力[59];使用8%的饲料咖啡因能够防治因低氧引起的一些不良反应,可作为低氧期间改善鳃内能量平衡的替代方案[60];在饲料中添加适宜浓度(57.21 g/kg)的桑叶提取物(extract of mulberry leaves,EML)可通过提高鱼鳃中谷草转氨酶(glutamate oxaloacetate transaminase,GOT)活性和红细胞中的Hb含量来改善鲫鱼的呼吸功能,抑制活性氧(reactive oxygen species,ROS)的产生和细胞成分的氧化,减少氧化损伤,提高耐低氧能力[61];对斜带石斑鱼(Epinepheluscoioides)进行研究发现,在饲料中添加适量的替普瑞酮(100、200 mg/kg)能够使斜带石斑鱼产生对低氧胁迫的抵抗力,证明这是一种有效的抗低氧添加剂[62];红景天作为一种传统的中药,具有一定的抗疲劳和抗低氧作用。研究发现,低浓度的(0.02 mg/L)红景天处理可以降低斑马鱼体内的血液乳酸含量,明显延长其低氧耐受时间[63]。
因此,由上述研究结果可知,通过营养调控来缓解或解决低氧胁迫导致的鱼类生存生长问题是切实可行的,并且具有广阔的应用前景。通过营养调控的途径来提高鱼类的耐低氧能力具有明显作用,但同时也存在一些局限性。例如,营养成分的含量、配比和摄入水平都有适宜的水平限度,超过或不足都会影响鱼类的生长和健康状况。此外,环境因素如水质、水温等也会对营养调控效果产生影响,只有在适宜的生态环境下鱼类才能更好地吸收与利用营养物质。
5 其他措施
5.1 养殖模式的改进
目前的水产养殖普遍采取集约化养殖模式。在该模式下,高密度的养殖鱼群和大量的饲料投入是低氧产生的重要原因。水体DO主要来自浮游植物的光合作用和大气交换,被鱼类和水中沉积物其他生物的呼吸消耗,当呼吸作用超过光合作用时会使DO含量下降。机械曝气可以避免DO含量大幅下降[64],因此,为解决集约化养殖模式带来的低氧问题,曝气系统如螺旋桨吸气泵等得到了一定的应用。适当的曝气不仅能够提高水中的DO含量,还可以改善水质和提高饲料利用率,但是目前曝气设备的使用成本较高且不能保证效果[65]。稻田养鱼是利用稻鱼共生原理,在种植水稻的田里养殖鱼类的生态种养模式。研究发现,与单养模式相比,混养模式中的水稻能够吸附水中有机物和悬浮物,降低池塘水体的总氮、总磷和钾的含量以及底泥呼吸速率,减少富营养化现象的发生,提高鱼类呼吸耗氧占比。此外,水稻还能够降低水温,提高水体中DO容纳量[66]。总的来说,稻鱼混养降低了水体DO的消耗,提高了鱼类的呼吸效率,并减少机械曝气设备的使用以降低成本,是缓解集约化养殖模式造成低氧的有效途径,具有应用至池塘养殖的可行性,值得进一步深入研究。
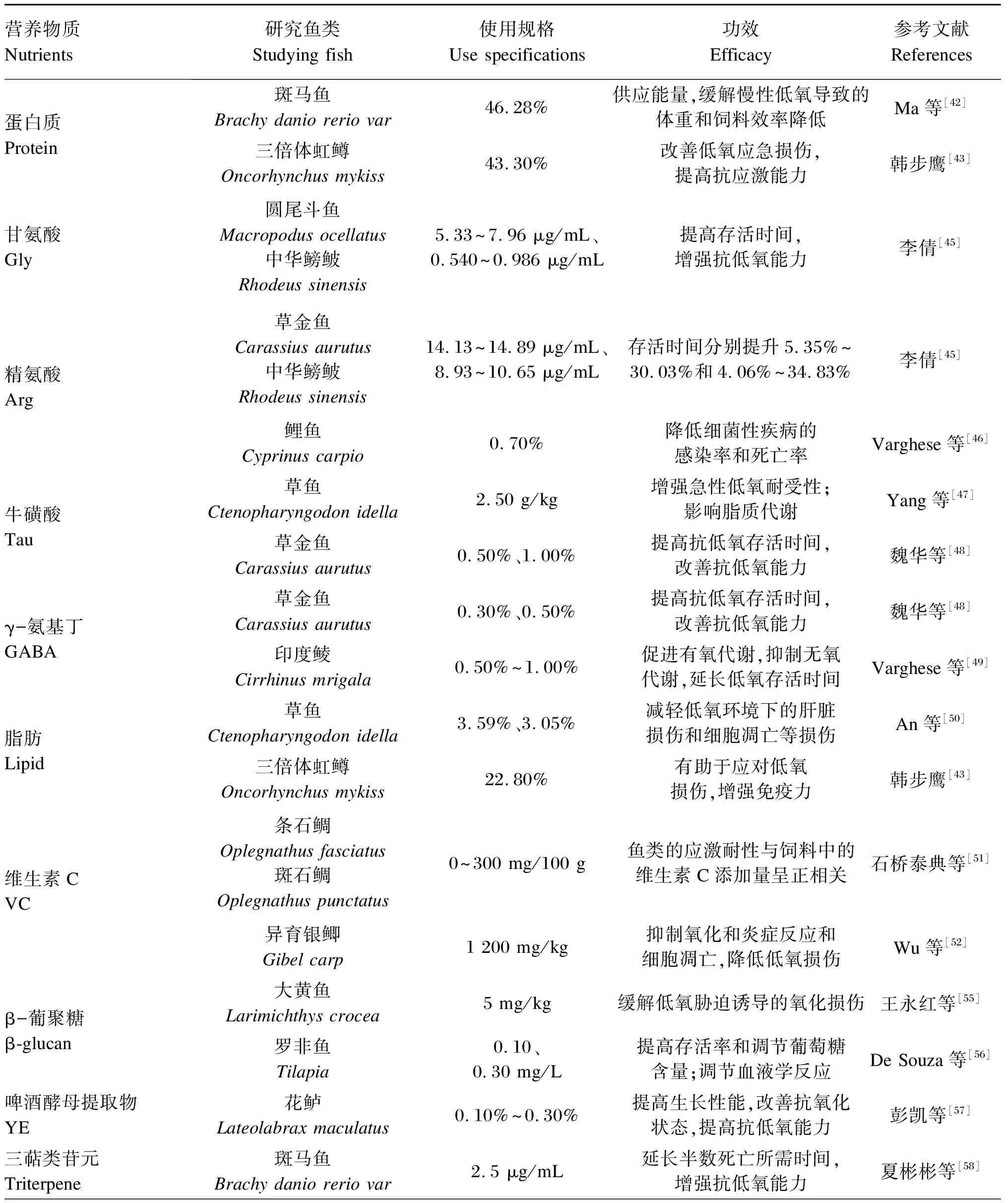
表1 各种营养物质对缓解鱼类低氧应激的作用

续表1营养物质Nutrients研究鱼类Studying fish使用规格Use specifications功效Efficacy参考文献References米曲霉益生菌 ASP罗非鱼Tilapia 1×106、1×108 CFU/g对鱼类具有免疫调节作用,提高其对低氧的防御能力Dawood等[59]咖啡因 Caffeine罗非鱼Tilapia8.00%防止无氧代谢发生,维持低氧环境的鱼类的能量平衡Baldissera等[60]桑叶提取物 EML鲫鱼Carassius auratus57.21 g/kg提高鱼体抗氧化剂的活性和水平,减轻低氧损伤Li等[61]替普瑞酮 Teprenone斜带石斑鱼Epinephelus coioides 100、200 mg/kg一种抗氧化状态诱导剂,诱导鱼类对低氧产生抗性Dong等[62]红景天 Rhodiola rosea L.斑马鱼Brachy danio rerio var 0.02、0.04 mg/L降低鱼体内血糖乳酸含量,具有抗低氧和抗疲劳效果范能全等[63]
5.2 培育耐低氧新品种
通过杂交技术对鱼类品种进行改良是另一种提高鱼类耐低氧能力的有效手段。杂交被广泛用于通过在后代中使用新的遗传构象来改善动物和农业种群的特定性状,应用在水产养殖中具有多种益处,如提高SGR、FE和抗逆性等[67]。以溶解氧断点(breakpoint of dissolved oxygen,BPDO)为参考指标对三向杂交鲍鱼进行的研究发现,该杂交鱼的BPDO分别为(1.85±0.41) mg/L和(1.84±0.36) mg/L,而其亲本的BPDO分别为(2.15±0.40) mg/L和(2.03±0.48) mg/L。根据BPDO与耐缺氧能力呈负相关关系可知,三向杂交鲍鱼比其亲本具有更好的耐缺氧性[68]。此外,对黄颡鱼和长吻鳄(Leiocassislongirostris)的杂交后代的研究结果显示,杂交种的鳃细胞间质扩大,肝脏中空泡和肝脏组织肿胀,肠道黏膜下层扩大以及HIF相关基因与抗氧化酶活性的快速反应和激活,表明形态学、分子学及生物化学调整的复杂组合共同促成了杂交种的耐低氧性[69]。因此,通过杂交技术培育具有优良耐低氧性能的新品种鱼类,对于缓解低氧的危害,保证鱼类的正常生长以及提高养殖效果具有广阔的应用前景。
6 小 结
综上所述,水体低氧作为水产养殖过程中一个普遍且不容忽视的问题,对鱼类的生长发育、行为活动和生理生化状态都会造成不利影响,严重时会导致鱼类大量死亡,使得渔获质量下降,养殖效果达不到预期,从而造成经济损失。因此,我们必须重视低氧问题并采取措施进行缓解或解决。在面对低氧胁迫时,鱼类自身具有一定的适应能力,可以通过调整呼吸和游泳方式、改变鳃的状态和调节代谢途径等来适应急性低氧应激和慢性低氧应激。然而近些年来随着水产养殖业的快速发展,集约化高密度养殖模式的广泛应用以及气候和天气变化的影响使得养殖过程中低氧出现的频率和程度均有所增加,仅靠鱼体自身的适应策略已不足以应对,因此养殖工作者也应当重视通过养殖策略的改进来提高鱼类的生活质量。在采取人工措施防治低氧方面,利用营养调控手段加强鱼类等水产动物的耐低氧能力是当前以及今后的一个重要方向。随着分子生物学技术的不断发展,对鱼类低氧胁迫的研究也由传统的探索结果规律深入到了细胞和基因水平,低氧胁迫相关的信号通路被相继发现,为从基因层面提高鱼类的耐低氧能力提供了理论依据。同时,越来越多的营养物质以及非营养性添加剂被发现并研究,证实了其可以作为饲料添加剂用以提高鱼类对低氧等环境胁迫的耐受性。
在未来的相关研究中,应当更加关注营养调控的机理研究、营养物质调控鱼类的普遍性和特异性、多种营养物质的联合作用以及营养物质与环境相互影响等方面,结合实际开发靶向营养调控技术,提高鱼类的耐低氧能力,以降低低氧对水产养殖造成的不利影响,从而促进水产行业的健康发展。

