基于常规MRI影像组学无创性诊断胶质细胞瘤IDH1基因型的研究
徐慰幸子 周维燕 文剑波 黎 元
1.复旦大学附属中山医院放射科 (上海 200030)
2.复旦大学附属华山医院PET中心 (上海 200040)
3.复旦大学附属华山医院放射科 (上海 200040)
胶质细胞瘤最常见的能量来源是无氧糖酵解,糖酵解中间产物对胶质瘤非常重要。异柠檬酸盐脱氢酶1(isocitrate dehydrogenase 1,IDH1)[1]基因突变的代谢产物2-羟戊二酸(2-HG),同时也是糖酵解的中间产物,IDH基因突变型胶质瘤相比野生型具有更好的预后和更长的生存期,因此术前无创性诊断胶质瘤的基因类型具有重要的临床指导意义。常规MRI检查在胶质瘤的诊断与鉴别诊断中有着广泛的应用,仍然作为胶质瘤术前诊断的首选方法[2-3]。
目前已经有研究将常规影像学与IDH1基因突变预测相结合的研究。Wang等[4]研究了常规MRI增强在胶质瘤预后及对IDH1基因型预测中的价值,认为增强后的强化方式可以作为IDH1基因型判断及预后评估的可靠手段。然而上述基于影像学的胶质瘤的IDH1基因研究缺乏系统性,且影像指标相对单一,另外统计分析方法均为单一的因素分析,缺乏整体性研究。因此,我们假设IDH1野生型与突变型胶质细胞瘤有不同的常规影像学特征及临床特征,本研究采用Feature Selection Library(FSLib)中的mrmr,relieff,mutinffs,fsv,laplacian,inffs,ecfs,udfs,cfs,llcfs等十种特征选择的常用方法,全面、系统性分析不同IDH1基因型胶质瘤患者常规影像学及临床一般特征,筛选出与IDH1基因相关性高的常规影像学特征。
1 资料与方法
1.1 临床资料及分组回顾性收集2014年1月1日至2018年12月31日华山医院胶质细胞瘤的一般临床资料和常规MRI影像。按照2016版WHO中枢神经系统肿瘤病理诊断[5],经由两位经验丰富的神经病理医生进行双盲阅片,统一诊断后,筛选出324例弥漫性胶质细胞瘤患者,再进行免疫组织化学检查,其中具有IDH1基因检查结果的病人共有305例胶质瘤患者纳入本次研究。
所有入组病人分为4组:组1:低级别胶质细胞瘤(WHOⅠ级和Ⅱ级) IDH1野生型;组2:低级别胶质细胞瘤(WHOⅠ级和Ⅱ级) IDH1突变型;组3:高级别胶质细胞瘤(WHOⅢ级和Ⅳ级) IDH1野生型;组4:高级别胶质细胞瘤(WHOⅢ级和Ⅳ级) IDH1突变型。
1.2 MRI扫描参数所有收集的入组患者MRI检查均使用3.0T MRI扫描仪(Discovery MR750,GE Medical Systems,Milwaukee,WI,USA),8通道头线圈。
T1WI:自旋回波序列(spin echo,SE),TR=1850ms,TE=24ms,NEX=1,FOV=240mm×240mm,矩阵288×288,带宽41.67Hz/Px,层厚6.0mm,层间距2.0mm;
T2WI:采用快速自旋回波(fast spin echo,FSE)序列,TR/TE=4296/97ms,NEX=1,FOV=240mm×240mm,矩阵256×256,带宽 62.5Hz/Px;
FLAIR:TR/TE=8800/145ms,NEX=1,FOV=240mm×240mm,矩阵256×256,带宽50Hz/Px,层厚6.0mm,层间距2.0mm;
DWI:TR/TE=3000/145ms,NEX=1,FOV=240mm×240mm,矩阵160×160,带宽250Hz/Px,层厚6.0mm,层间距2.0mm;
1.3 分析方法首先记录入组病人的一般临床资料(性别/年龄),两位放射科医师在双盲条件下对入组病人的影像资料进行回顾性分析,记录的主要影像指标包括:病灶分布、病灶数目等22个。
(1)病灶位置:对病变累计解剖位置进行记录,对于累及多个脑叶病灶均进行记录;
(2)病灶数目:分为单发与多发病变,单发记1分,多发记2分;
(3)病灶分布:将肿瘤累计脑灰白质情况分为:皮层、皮层下白质、深部白质及深部灰质四类,同时累及时的均作记录;
(4)病灶最大直径:以T2WI及FLAIR序列作为判断无强化或强化不明显病变肿瘤最大径的测量序列;用T1WI增强序列判断中重度强化病灶的肿瘤最大直径,单位为CM;
(5)水肿程度:水肿范围定义为水肿区域边缘和肿瘤实性部分边缘之间的距离。分为:无水肿0分;轻度水肿(小于肿瘤最大径的1/2)记录为1分;中度水肿(大于肿瘤最大径的1/2且小于1)记为2分;重度水肿(水肿范围大于肿瘤最大径线)记为3分;
(6)中线结构移位情况:移位记为1分,无移位记为0分;
(7)肿瘤的均质性:根据T1WI、T2WI、FLAIR及DWI序列,肿瘤均质评为0分;肿瘤不均质记为1分;
(8)囊变情况:分为有、无囊变两层,无囊变记为0分,有囊变记为1分;
(9)囊液信号:根据T1WI、T2WI、FLAIR序列,囊液信号均匀记为0分,不均匀为1分;
(10)肿瘤坏死:根据肿瘤T1WI、T2WI及增强后T1WI序列,分为无坏死(0分),有坏死(1分);
(11)坏死囊壁光整性:坏死壁光整记为0分,坏死壁不光整记为1分;
(12)病灶钙化:根据CT平扫及T1WI、T2WI序列,分为无钙化(0分),有钙化(1分);
(13)病灶出血:根据T1WI、T2WI、ADC及CT平扫,可判断肿瘤有无出血;病灶无出血记为0分,有出血记为1分;
(14)形态:根据轴位T1WI增强序列,肿瘤形态分为规则(0分)和不规则(1分);
(15)边界:根据T2WI、FLAIR序列上表现,将病灶边界分为:边界清楚(0分),边界不清楚(1分);
(16)T1WI信号:与正常脑白质T1WI信号比较,病灶实性部分信号分为低信号、等信号及高信号,分别记为0分、1分、2分;
(17)T2WI信号:与正常脑白质T2WI信号比较,病灶实性部分信号分为低信号、等信号及高信号,分别记为0分、1分、2分;
(18)DWI信号:与正常脑白质信号DWI信号比较,病灶实性部分信号分为低信号、等信号及高信号,分别记为0分、1分、2分;
(19)水肿均匀性:根据FLAIR序列,肿瘤周围水肿区信号分为:均匀(0分)和不均匀(1分);
(20)强化均匀性:增强后病灶均匀性分为:均匀强化病变(0分)和不均匀强化病变(1分);
(21)强化特征:根据T1WI增强后序列,强化特征分为:环形强化、团块状、结节状及片状等,分别记为0分、1分、2分;
(22)脑膜强化:根据T1WI增强后序列,分为软脑膜强化、室管膜强化及硬脑膜强化,同时伴随时均进行记录,分别记为0分、1分、2分。
使用Feature Selection Library(FSLib)进行特征选择。本文使用了FSLib中的mrmr,relieff,mutinffs,fsv,laplacian,inffs,ecfs,udfs,cfs,llcfs等十种特征选择的常用方法,同时计算在分别选择1到20个特征时,测试集合上的分类正确率(accuracy)。其中,所有数据中的80%用于数据训练,剩余20%的数据用于计算最后的分类正确率。为了保证分类结果和特征选择的鲁棒性,并计算所选择的特征的P值,上述数据集划分和特征选择算法被随机重复1000次。
2 结果
本研究共收集324例胶质瘤患者,具有IDH1基因资料的病例共305例入组,其中WHO Ⅱ级110例,其中IDH1突变型90例,IDH1野生型20例;WHO Ⅲ级共50例,IDH1突变型28例,IDH1野生型22例;WHO Ⅳ级共145例入组,IDH1突变型6例,IDH1野生型139例。低级别胶质瘤组共110例纳入本研究,男女比例为64/46,平均年龄41.4211.68岁。高级别胶质瘤共195例纳入本研究,男女比例为120/75,平均年龄51.34±13.23岁。
2.1 低级别胶质细胞瘤当选择1到20个特征时,在测试集合上的分类正确率(accuracy)(图1),分别计算出选择1-20个特征集时诊断正确率的柱状图(图2),得到对于诊断低级别胶质瘤组IDH1突变型与野生型的特征集,选择6个有效特征集时,正确率最高且特征集数目较少,入选的特征集为:年龄、脑干、块状强化、左侧额叶、岛叶、T2WI信号,经过1000次随机测试诊断正确率的平均值为79%,计算入选指标的p值,P<0.05,差异有统计学意义。
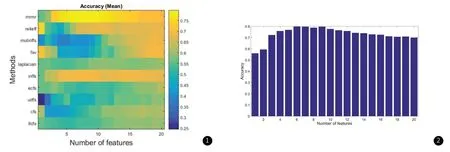
图1 低级别胶质瘤诊断IDH1基因型的正确率(accuracy),选择不同数量的特征(1-20个),使用十种常用特征提取算法,低级别胶质瘤在测试集合上的平均分类正确率(随机重复1000次)。纵坐标是常用数据特征提取方法,横坐标是选择特征集的数目。图2 低级别胶质瘤鉴别IDH1基因型的不同数量特征集的正确率柱状图,纵坐标是正确率,横坐标是特征集的数目。选择6个有效特征集时,正确率最高且特征集数目较少,正确率约79%。
年龄:IDH1野生型低级别胶质瘤的平均年龄约为48.35±16.7岁,IDH1基因突变型的平均年龄约为39.35±10.7岁,P<0.001。
块状强化:IDH1野生型块状强化的比例为(7/20),IDH1突变型块状强化的比例为(2/90),P=0.011。
T2WI实质信号:低级别胶质瘤IDH1野生型T2WI肿瘤实质信号分别为低信号(6/20)、等信号(7/20)、高信号(7/20),而IDH1突变型低级别胶质瘤T2WI均为高信号(90/90),P=0.057。
脑干:低级别胶质瘤中共6例发生在脑干,全部为IDH1基因野生型(图5)。P=0.001。岛叶:在低级别胶质瘤组中共7例累及岛叶,全部为IDH1基因突变型,P=0.017。
左侧额叶:低级别胶质瘤IDH1突变型位于左侧额叶的比例为(64/110),低级别胶质瘤IDH1野生型位于左侧额叶(12/110),P=0.012。
2.2 高级别胶质细胞瘤在选择1到20个特征时,计算在测试集合上的分类正确率(accuracy)如(图3),分别计算出1-20个特征集时诊断正确率的柱状图(图4),得到对于诊断高级别胶质瘤组IDH1突变与野生型特征集,当选择6个有效特征集(强化程度、水肿均匀性、坏死、强化均匀性、环形强化、钙化)时,1000次随机测试的较高的平均诊断正确率为82%。
强化程度:IDH1野生型重度强化的比例(133/167),中度强化(34/167);IDH1突变型重度强化(4/28)、中度强化(17/28),重度强化(7/28),P=0.009。
水肿均匀性:IDH1 野生型水肿情况:不均匀水肿(147/167)、水肿均匀(19/167)、无水肿(1/167);IDH1突变型水肿情况:不均匀水肿(12/28)、水肿均匀(16/28)。P=0.038。
坏死:IDH1野生型出现坏死比例(135/167)、无坏死(32/167);IDH1突变型出现坏死比例(4/28)、无坏死(24/28),P=0.043;
强化均匀性:IDH1野生型出现增强不均匀(159/167)、强化均匀(8/167);IDH1突变型出现不均匀强化(6/28)、均匀强化(21/28),另有一例未出现强化改变,P=0.046;
环形强化:IDH1野生型出现强化(141/167)、非环形强化(26/167);IDH1突变型出现环形强化比例(3/28)、非环形强化(25/28),P=0.048。
钙化:IDH1野生型全部未见钙化(167/167);IDH1突变型出现钙化(6/28)、未见钙化(22/28),P=0.018。
3 讨论
不同级别和IDH突变状态的胶质瘤的MRI表现也有其特点。MRI可为胶质瘤的诊断和预后评估提供丰富的信息。在这项研究中,我们通过结合多个常规MRI特征及一般临床资料来区分低级别和高级别胶质瘤以及有无IDH突变。近年来,经典的机器学习方法和深度学习方法已经显示出识别预测特征和执行的能力。深度学习技术在识别图像内容方面实现了超越人类的性能。
3.1 低级别胶质瘤常规影像学诊断IDH1基因状态的价值衰老通常与胶质瘤预后不良有关。低级别胶质瘤中,IDH1野生型平均年龄更大[6-7],这与本研究的结果相一致。胶质瘤的位置决定了肿瘤的手术方式和可切除性,位于人脑关键部位(如脑干)疗效较差且大多不可切除。Metellus等[8]报道IDH1基因野生型WHOⅡ级星形细胞瘤更易发生在额叶和颞叶等可切除的区域,对比IDH1基因突变型具有更大的体积,我们的研究表明突变型低级别胶质瘤多位于额叶,这与Nakae[9]等人发现单侧额叶的肿瘤位置与IDH突变胶质瘤高度相关一致,岛叶病灶全部为IDH1突变型。我们的研究中脑干低级别胶质瘤全部为IDH1基因野生型,与既往报道一致。此外,在本研究中基于应用大数据的分析方法,以更大的样本大小和更全面的分组方法分析IDH1基因状态和肿瘤位置之间的相关性,具有更好的准确性。
IDH1野生型低级别胶质瘤T2WI等低信号的比例更高。文献并未有相关的报道,对于这一征象,我们认为可能的原因是IDH1野生型胶质瘤相对突变型肿瘤细胞排列更加致密导致的,提示IDH1基因突变型胶质瘤具有抑制肿瘤细胞增殖的能力,因为野生型胶质瘤不具备这种抑制能力,所以相对于IDH1突变型胶质细胞瘤具有更高的肿瘤细胞密度。此外,Sonoda等[10]观察到IDH基因突变的肿瘤倾向于表现出较高的单侧生长模式,这与我们的研究存在一定的矛盾,我们的研究发现肿瘤的数目在IDH1基因型鉴别诊断中没有表现明确的价值。
3.2 高级别弥漫性胶质瘤常规影像学诊断IDH1基因状态的价值间变性胶质细胞瘤往往表现出IDH基因状态不同而截然不用的预后。IDH1基因野生型间变性星形细胞瘤表现出与胶质母细胞瘤相同的预后。然而,对于上述结果的机制还不清楚。基于IDH1基因野生型WHO Ⅲ级胶质瘤与胶质母细胞瘤相似的临床特征,本研究将IDH1野生型WHO Ⅲ级间变性胶质细胞瘤和WHO Ⅳ级的胶质母细胞瘤归为一组,目的是检查间变性胶质瘤,特别是那些IDH野生型,关于其恶性特征的进一步探讨。我们的研究表明在高级别胶质瘤中,发病部位和IDH1基因型无相关性,这与既往研究存在一定的矛盾,Sonoda等[10]研究表明影像学特征及发病位置IDH1基因之间具有相关性,间变性胶质细胞瘤最常见发病部位是额叶。此外,间变性胶质细胞瘤IDH1基因突变型只发生在白质区域。IDH1基因突变的频率颞叶肿瘤低于其他脑叶。有研究[11]显示肿瘤位置的分布在IDH1基因野生型的间变性胶质瘤类似于胶质母细胞瘤。
我们的研究表明在IDH1野生型高级别胶质瘤中,环形强化更常见,而在突变型高级别胶质瘤中非环形强化更常见,这与既往研究存在一定的矛盾,强化方式中,Wang等[12]报道IDH1突变型高级别胶质瘤中具有更高概率的环状增强模式,这可能是由于与野生型IDH1肿瘤相比,突变型IDH1肿瘤具有侵袭性较小的生物学行为[13-15]。因为IDH1突变被认为是肿瘤发生的早期遗传事件,可能驱动其他遗传肿瘤细胞的变化,伴随IDH1突变的肿瘤可能因此与不伴随的肿瘤相比具有不同的遗传特征,进而影响生物学行为。IDH1基因突变型高级别胶质瘤强化程度更高、更加均匀,这可能是由于IDH1基因突变型胶质瘤的生长速度较慢有关。Diehn等[16]提出血管内皮生长因子的产生与肿瘤新生血管的产生和注射造影剂后的对比强化相关。血管内皮生长因子和IDH1之间的关系仍然不确定。然而,这些结果表明肿瘤血管和IDH1突变状态之间可能存在相关性。在本研究中,我们还发现了肿瘤的对比增强与IDH1状态相关。Wang等[12]研究表明虽然胶质瘤对比增强模式与IDH1突变与否没有明显相关性,增强方式在突变IDH1患者是重要的独立预后因素。我们的研究表明肿瘤的强化均匀性、环形强化及强化程度均属于预测高级别胶质瘤IDH1基因状态的重要特征集,这个结果提示肿瘤增强方式可能是反映IDH1胶质瘤突变生物学特征的一个特别重要的因素。
Yamashita等[17]的研究中,IDH1野生型胶质母细胞瘤具有更高的坏死率,这与我们的研究一致,我们的研究中,IDH1野生型高级别胶质瘤出现环形强化的比例明显高于IDH1基因突变型,可能的原因是缺氧介导的凝血系统的激活引起血管内血栓形成,这将进一步增加肿瘤内缺氧,同时会导致异常的血管内皮细胞增殖和肿瘤细胞的坏死。以前的研究[18]表明,大面积的坏死在原发性胶质母细胞瘤较继发性中更常见,同时研究发现在IDH1基因野生型中坏死引起的环形强化较IDH1基因突变型更常见[19]。我们的研究结果与既往的报道一致。Carlson等[20]研究表明肿瘤坏死与高水平的血管内皮生长因子生成具有显著相关性。
我们的研究中,IDH1突变型高级别胶质瘤周围水肿更加均匀,肿瘤边缘轮廓更加清晰。这与之前Qi等[21]研究IDH1突变胶质瘤具有单侧生长模式,肿瘤边缘清晰,信号更均匀的研究基本一致。这可能和IDH1突变型胶质瘤侵袭性较弱有关。另外我们的研究表明IDH1野生型高级别胶质瘤肿瘤周围水肿大多不均匀,提示IDH1野生型胶质瘤更易出现周围的浸润。
钙化在含有少突胶质细胞成分的弥漫性胶质瘤中比较常见,IDH1基因突变在少突胶质细胞肿瘤的病例中的发生率更高[22],本研究钙化作为一个重要的被筛选出来的特征集,并且全部发生于IDH1突变型高级别胶质瘤,我们认为可以作为诊断高级别胶质瘤IDH1突变与否的重要依据。
4 结论
综上所述,常规影像学在无创性诊断胶质细胞瘤IDH1基因状态表现出较高的价值,在低级别胶质细胞瘤中,年龄、块状强化、发病位置(脑干、左侧额叶、岛叶)、T2WI信号等组成的影像特征集合有助于预测IDH1基因状态;在高级别胶质细胞瘤中,强化均匀性、环形强化、钙化、强化程度、水肿均匀性、坏死等所组成的影像特征集合有助于无创性诊断IDH1基因状态。

