广西杉木优良无性系组培繁育技术研究
郭秀丽

摘 要 为建立杉木无性系发育技术体系,以广西杉木为试验材料,选择树势基本相同、生长健壮、无病虫害的杉木为外植体进行组培快繁技术试验研究。结果表明:(1)外植体最佳消毒方案是使用70%酒精浸泡15 s,灭菌后采用无菌水洗涤3次,再用0.1%升汞浸泡消毒8 min后采用无菌水洗涤5次;(2)初代诱导最佳培养基为1/2MS+6-BA0.6 mg·L-1,该培养基有利于增加培养基的诱导率和萌芽率,提高培养基的培养效果;(3)增殖诱导最适培养基为1/2MS+6-BA0.6 mg·L-1+IBA0.3 mg·L-1,获得的组培苗芽多,茎粗壮;(4)生根最适培养基为1/2MS+IBA0.8 mg·L-1+IAA0.1 mg·L-1;(5)杉木组培苗移栽的最适基质是泥炭土∶菜园土∶蛭石=4∶2∶1,其幼苗成活率达到91.93%,幼苗健壮,叶色深绿。
关键词 广西杉木;组织培养;培养基;增殖培养
中图分类号:S791.27.05文献标识码:A doi:10.13601/j.issn.1005-5215.2023.06.012
Research on Tissue Culture and Breeding Technology of Superior Clones of Guangxi Fir
Guo Xiuli
(Guangxi Zhuang Autonomous Region State-owned Huangmian Forest Farm, Liuzhou 545600, China)
Abstract In order to establish a technical system for the development of Guangxi fir clones, the experiment took Guangxi fir as the research material, and selected Guangxi fir with basically the same vigor, robust growth, and no pests and diseases as explants to carry out tissue culture rapid propagation technology research.The results showed as the following five aspects. (1) The optimal disinfection scheme of explants was to soak in 70% alcohol for fifteen seconds, wash with sterile water for three times after sterilization, soak and disinfect with 0.1% mercuric chloride for eight minutes, and then wash with sterile water for five times. (2) The best medium for primary induction was 1/2MS+6-BA0.6mg·L-1, which was beneficial to increasing the induction rate and germination rate of the medium and improving the culture effect of the medium. (3) The optimal medium for proliferation induction was 1/2MS+6-BA0.6mg·L-1+IBA0.3mg ·L-1, the obtained tissue culture seedlings had many buds and thick stems. (4) The optimal medium for rooting was 1/2MS+IBA0.8mg·L-1+IAA0.1mg·L-1. (5) The most suitable substrate for transplanting Guangxi fir tissue culture seedlings was peat soil: vegetable garden soil: vermiculite = 4:2:1, by which survival rate of seedlings reached 91.93%. Guangxi fir seedlings were robust and the leaves were dark green.
Key words Guangxi fir; tissue culture; culture medium; proliferation culture
杉木(Cunninghamia lanceolata)是我國特有的造林树种,具有生长速度快、树干通直、产量高、材质软、易加工等特点,是重要的建筑原料和木纤维工业原料[1]。广西壮族自治区是杉木种质资源的重要保护区,广西杉木种子园大多建于20世纪70年代末,现保留面积约333.3 hm2。近年来,广西大力发展杉木用材林,现有杉木林119.17万hm2,蓄积10 565.22万m3,杉木的发展为广西林业产业发展和林业产值增加发挥了重要作用[2,3]。目前,广西杉木仍以常规育种为主,传统的实生苗因抗逆能力差、成活率相对较低等自身因素的影响,始终制约着杉木产业的健康发展[4]。无性系繁殖是无性系育种的一部分,能够充分发掘母株的遗传潜能,获得最大限度的遗传增益[5,6]。随着生物工程技术的发展,国内外学者对无性系繁育技术与组织培养技术相结合建立快繁育苗体系做了大量工作,为林木优良无性系选育和无性系造林提供了技术支撑[7-9]。为进一步提高杉木良种选育效率,促进广西林业又好又快发展,试验立足于广西本地优质杉木种源区,筛选种源和家系优良、单株表型性状优良的杉木并对其进行扩繁,通过对杉木无性系组培繁育技术的研究,旨在为推动广西杉木良种化进程提供物质基础和技术支撑。
1 材料与方法
1.1 试验材料
在广西壮族自治区国有黄冕林场选择优良无性系杉木作为试验材料进行组培繁育技术研究。
1.2 试验方法
1.2.1 杉木组培外植体灭菌
选择杉木树势基本相同、生长健壮、无病虫害的杉木外植体,用无菌剪刀剪去全部针叶,剪切成1~2 cm的带芽茎段。用10 mL·L-1洗洁精溶液浸泡洗涤30 min,流水冲洗2~3 h。放入超净工作台,用75%酒精和0.1%升汞进行灭菌处理试验:酒精灭菌试验设置10、15、20和25 s 4个灭菌时间梯度,灭菌后采用无菌水洗涤3次;升汞灭菌试验设置4、6、8和10 min 4个时间梯度,灭菌后采用无菌水洗涤5次。试验共16个处理,每个处理接种50个外植体,重复3次。培养温度25 ℃,湿度50%~70%,光照时間12~14 h·d-1,光照强度1 500~2 000 lx,培养30 d后统计外植体的成活率和污染率。
1.2.2 初代诱导培养基筛选与优化
筛选出最佳外植体灭菌处理后,将无菌外植体接入到诱导培养基中进行腋芽诱导培养,以筛选出最适宜的基本诱导培养基。基本培养基采用1/2MS,添加不同浓度的6-BA进行单因子试验,6-BA设置0.2 mg·L-1(A1)、0.4 mg·L-1(A2)、0.6 mg·L-1(A3)、0.8 mg·L-1(A4)和1.0 mg·L-1(A5)5个浓度处理,每个处理接种50个外植体,重复3次。培养温度25 ℃,湿度50%~70%,光照时间12~14 h·d-1,光照强度1 500~2 000 lx,培养40 d后观察培养效果,并统计外植体萌芽率、诱导率。
1.2.3 增殖培养及培养基优化
将初代培养基培养40 d的无菌苗接种到增殖培养基上观察增殖效果。基本培养基采用1/2MS、3%蔗糖、0.7%卡拉胶,添加不同浓度的6-BA(0.4、0.6、0.8和1.0 mg·L-1)和不同浓度的IBA(0.4、0.8和1.2 mg·L-1)进行增殖培养试验。试验采用完全随机试验设计,共12个处理,每个处理接种20瓶,每瓶接种5株无菌苗,重复3次。培养温度25 ℃,湿度50%~70%,光照时间12~14 h·d-1,光照强度1 500~2 000 lx,培养40 d后观察组培苗的生长情况,统计不同处理增殖倍数、有效芽率和平均株高,并根据试验结果对培养基进行调节和优化。
1.2.4 生根培养及培养基优化
采用无菌剪刀剪取2 cm以上生长基本一致、叶色翠绿的增殖苗进行生根试验。生根试验培养基采用1/2MS、2%蔗糖、0.7%卡拉胶,添加IBA(0.4、0.8和1.2 mg·L-1)和IAA(0.1、0.3和0.5 mg·L-1),共9个处理,每个处理接种50瓶,每瓶接种单苗2株,重复3次。培养温度25 ℃,湿度50%~70%,光照时间12~14 h·d-1,光照强度1 500~2 000 lx,不同处理培养30 d后统计杉木组培苗的生根率、根长和生长情况,并对生根培养基进行调节和优化。
1.2.5 炼苗与移栽基质的优化
生根培养30~40 d,当幼苗根长为2 cm左右时进行炼苗试验。将瓶盖拧松并置于室外散射光环境下进行炼苗,以增强组培苗适应环境的能力,提高组培苗的成活率。炼苗时间为10 d,然后取出用清水漂洗根部的培养基,准备移栽。移栽基质采用本地菜园土和泥炭土相结合的方式,设置(1)菜园土,(2)泥炭土∶菜园土=2∶1,(3)泥炭土∶菜园土∶蛭石=2∶1∶1,(4)泥炭土∶菜园土∶蛭石=4∶2∶1,共设置12个处理,每个处理移栽苗木100株,重复3次。根据生产实际,移栽时间为4月5日,移栽后浇灌定植水,并覆盖小拱棚以保温保湿,移植60 d后统计苗木的成活率和幼苗质量。
1.3 数据统计与分析
采用Excel2007进行数据统计,采用DPS7.05进行数据分析,采用LSD法进行多重比较。
2 结果与分析
2.1 外植体消毒试验
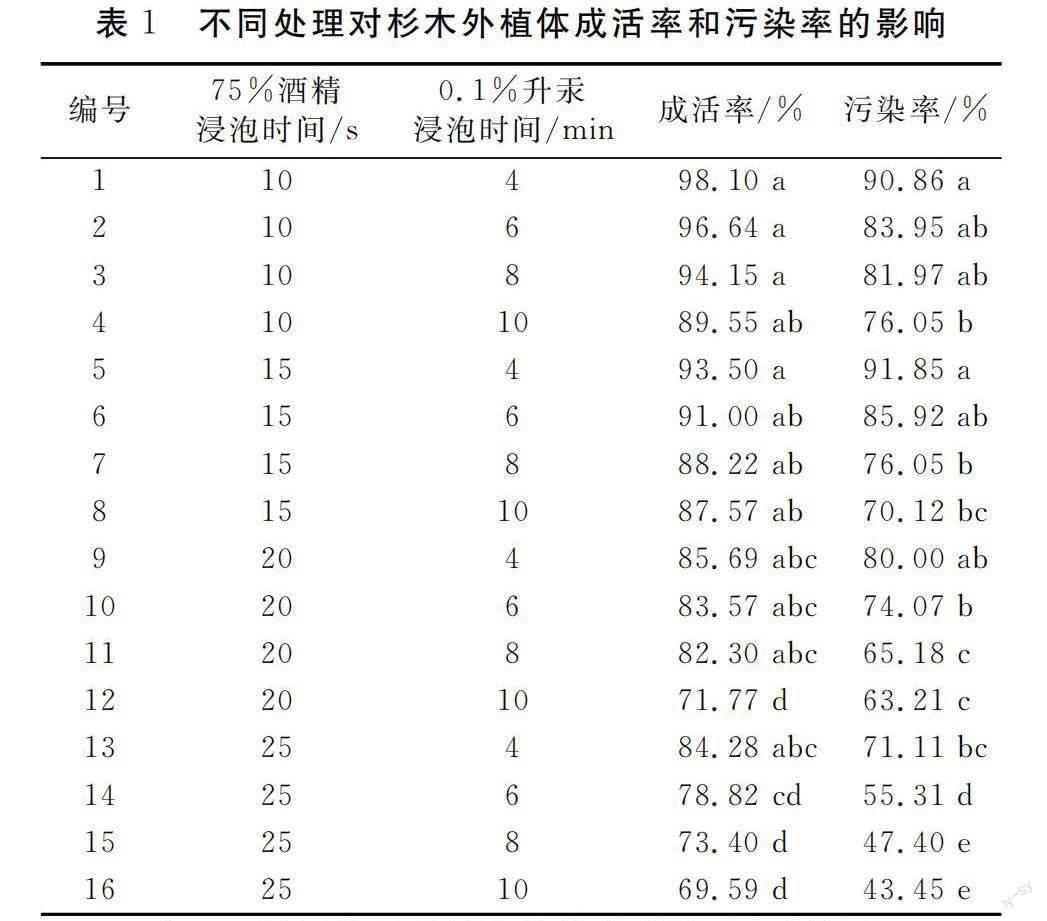
由表1可知,酒精浸泡时间和升汞浸泡时间对杉木外植体的成活率和污染率影响较大,外植体的成活率、污染率随着酒精和升汞浸泡时间的增加呈逐渐降低趋势,两者对外植体成活率和污染率影响的主次因素均为酒精>升汞。
通过极差分析,4个酒精浸泡时间水平以浸泡10 s处理的成活率和污染率均达到最大值,平均成活率和污染率分别达到94.61%和83.21%(表2)。与浸泡15 s处理相比,外植体的成活率和污染率增加不显著,但与浸泡20 s和浸泡25 s的处理相比,外植体成活率分别增加了17.05%和23.64%,污染率分别增加了17.84%和53.18%,差异达到显著水平。4个升汞浸泡时间水平以浸泡4 min处理的成活率和污染率达到最大值,平均成活率和污染率达到90.39%和83.45%(表2)。该处理的外植体成活率分别比浸泡8 min和10 min处理增加了6.95%和13.53%;污染率分别比浸泡8 min和10 min处理增加了23.36%和32.02%,差异均达到显著水平。浸泡4 min处理的成活率和污染率与浸泡6 min处理相比均略有增加,但差异未达到显著水平。
由此可见,杉木外植体的成活率与污染率成正比,在保证成活率的前提下,合理控制污染率极为重要,试验条件下,以使用70%酒精浸泡15 s用无菌水洗涤后,再用0.1%升汞浸泡消毒8 min的消毒效果最佳,此方式可避免酒精长时间对外植体的浸染伤害,也可避免升汞在外植体表面残留过多造成外植体后期死亡,污染率控制在76.05%,且成活率为88.22%。
2.2 初代诱导培养基筛选与优化
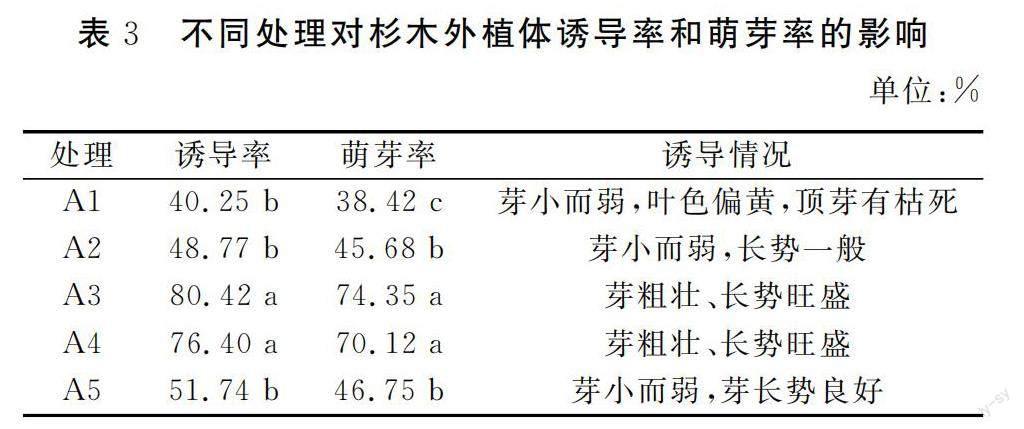
由表3可知,杉木的诱导率和萌芽率均随6-BA浓度的增加呈先增加后降低趋势,并以A3处理效果最佳,其诱导率和萌芽率分别达到80.42%和74.35%。与A1、A2和A5处理相比,A3处理的诱导率分别增加了99.80%、64.90%和55.43%;萌芽率分别增加了93.52%、62.76%和59.04%,差异均达到显著水平。与A4处理相比,A3处理的诱导率和萌芽率虽略有增加,但差异未达到显著水平。从诱导情况来看,A3和A4处理的幼芽粗壮、长势旺盛;A1、A2和A5处理的芽小而弱,长势一般,特别是A1处理叶色偏黄,顶芽有枯死现象。
由此可见,选用1/2MS作为基本培养基时,添加0.6 mg·L-1的6-BA有利于提高培养基的培养效果,增加培养基的诱导率和萌芽率,进而为培育壯芽打下基础。
2.3 增殖培养及培养基优化
由表4可知,在基本培养基采用1/2MS+3%蔗糖+0.7%卡拉胶的基础上,添加不同浓度的NAA和IBA对杉木幼苗的影响差异显著,杉木幼苗的增殖系数、有效芽数和平均株高均随着NAA浓度的增加呈先增加后降低趋势,并随着IBA浓度的增加先增加后降低,试验条件下以0.6 mg·L-1NAA+0.8 mg·L-1IBA的培养基效果最佳,其增殖系数达到3.76,有效芽率达到78.16%,平均株高达到2.4 cm,且芽多,茎粗壮。
由表5可以看出,基本培养基内添加NAA0.6 mg·L-1处理的增殖系数达到3.20,有效芽率达到59.69%,平均株高为2.00 cm,为最佳处理。与添加NAA0.6 mg·L-1处理相比,添加NAA0.8 mg·L-1处理的有效芽率和平均株高降低不显著,但是增殖系数降低了17.81%,差异达到显著水平。添加NAA0.4 mg·L-1和NAA1.0 mg·L-1处理的增殖系数、有效芽率和平均株高与添加NAA0.6 mg·L-1的处理相比,差异均达到显著水平。基本培养基内添加IBA0.3 mg·L-1的效果最佳,增值系数为2.62,有效芽数为56.50%,平均株高为1.85 cm,与添加IBA0.1 mg·L-1和0.5 mg·L-1的处理相比,差异达到显著水平,但0.1和0.5 mg·L-1之间的差异不显著。
由此可见,对于杉木增殖培养来讲,试验以添加NAA0.6 mg·L-1+IBA0.3 mg·L-1为最佳培养基配方。
2.4 生根培养及培养基优化
由表6可知,杉木组培苗生根率以添加IBA0.8 mg·L-1+IAA0.1 mg·L-1的处理效果最佳,生根率达到82.00%,除与添加IBA0.8 mg·L-1+IAA0.3 mg·L-1处理差异不显著外,与其他处理差异均达到显著水平。平均根数以添加IBA0.8 mg·L-1+IAA0.3 mg·L-1处理最高,添加IBA0.4 mg·L-1+IAA0.3 mg·L-1处理次之,两者之间的差异不显著,但显著高于其他处理。平均根长以添加IBA0.8 mg·L-1+IAA0.3 mg·L-1处理最佳,平均根长达到2.95 cm;以添加IBA1.2 mg·L-1+IAA0.1 mg·L-1处理次之,平均根长达到2.82 cm。
由表7可知,通过极差分析,影响杉木组培苗生根率、平均根数和平均根长的主次因素均为IBA>IAA。对于IBA而言,杉木组培苗生根率和平均根长均以IBA0.8 mg·L-1处理的生根率最佳,与其他浓度相比差异达到显著水平;平均根数以IBA0.8 mg·L-1处理最多,IBA0.4 mg·L-1处理次之,两者之间的差异不显著,但与IBA1.2 mg·L-1处理相比,差异达到显著水平。对于IAA而言,随着IAA浓度的增加,杉木组培苗生根率和平均根长呈逐渐降低趋势,并以IAA0.1 mg·L-1处理达到最大值,IAA0.3 mg·L-1处理次之,两者之间的差异不显著,但与IAA0.5 mg·L-1处理相比,差异均达到显著水平。杉木组培苗的平均根数以IAA0.1 mg·L-1最少,与IAA0.3 mg·L-1、IAA0.5 mg·L-1处理相比,差异达到显著水平。
由此可见,降低IAA浓度有利于提高杉木组培苗的生根率和平均根长,但却降低了根系数量。总的来说,杉木试管内生根的最佳理论培养基为在基本培养基中添加IBA0.8 mg·L-1+IAA0.3 mg·L-1,可用于杉木组培苗的生根诱导。
2.5 移栽基质优化试验
由表8可知,杉木组培苗的成活率和株高均以泥炭土∶菜园土∶蛭石=4∶2∶1处理最高,成活率达到91.93%,与菜园土处理和泥炭土∶菜园土=2∶1处理相比,差异达到显著水平;与泥炭土∶菜园土∶蛭石=2∶1∶1处理相比,差异不显著。从生长情况来看,泥炭土∶菜园土∶蛭石=4∶2∶1和泥炭土∶菜园土∶蛭石=2∶1∶1处理的杉木幼苗健壮、叶色深绿,而菜园土的幼苗弱、生长慢,后期叶色偏黄。由此可见,泥炭土∶菜园土∶蛭石=4∶2∶1的基质更适合杉木幼苗的生长。
3 结论与讨论
自然条件下,植物组织培养阶段容易带菌导致组培苗污染现象的发生。酒精和升汞是外植体常用的消毒剂,两者搭配使用增强了酒精的消毒杀菌效果,但因升汞较强的杀菌效果,使用后难以清洗,易引起外植体褐化[11]。本研究结果也表明,杉木外植体的污染率随着酒精和升汞浸泡时间的增加呈逐渐降低趋势,但成活率也随之降低,这与田广玉等[12]的研究结果相似。因此,在使用消毒剂时要根据消毒剂的优缺点,合理搭配,试验条件下以使用 70% 酒精浸泡 15 s用无菌水洗涤后,再用0.1%升汞浸泡消毒8 min的消毒效果最佳,此方式可避免酒精长时间对外植体的浸染伤害,也可避免升汞在外植体表面残留过多造成外植体后期死亡。
植物组织培养离不开植物生长调节剂,但激素的长期大量使用会对植物产生伤害。比如高浓度的生长素易使植物发生愈伤化和褐化现象,而高浓度的分裂素容易产生玻璃化现象。试验选择1/2MS作为基本培养基,添加不同浓度的植物生长调节剂以诱导愈伤组织、生根培养、促进植物生长。(1)在初代诱导培养基筛选时,选用1/2MS作为基本培养基时,添加0.6 mg·L-1的6-BA有利于提高培养基的培养效果,增加培养基的诱导率和萌芽率,进而为培育壮芽打下基础。(2)继代培养时,杉木幼苗的增殖系数、有效芽数和平均株高均随着NAA浓度的增加呈先增加后降低趋势,并随着IBA浓度的增加先增加后降低,试验条件下以0.6 mg·L-1NAA+0.8 mg·L-1IBA的培养基效果最佳,其增殖系数达到3.76,有效芽率达到78.16%,平均株高达到2.4 cm,且芽多,茎粗壮。这一试验结果与张佳宁等[13]的研究结论相似。(3)在杉木生根试验中,影响杉木组培苗生根率、平均根数和平均根长的主次因素均为IBA>IAA。降低IAA浓度有利于提高杉木组培苗的生根率和平均根长,但却降低了根系数量,这与陈煌等[14]的研究结论一致,试验条件下以添加IBA0.8 mg·L-1+IAA0.1 mg·L-1的处理效果最佳,生根率达到82.00%。
组培育苗摆脱了时间的限制,实现了林木种苗的周年生产,但组培苗的移栽成活率受自然条件的影响较大,其中移栽基质是影响组培苗移栽成活率及生长的重要因素。前人研究认为,黄心土、菜园土因自身带有部分细菌,影响组培苗的成活率。本试验结果也表明,降低菜园土的比例有助于提高组培苗的成活率,促进杉木幼苗的生长,以泥炭土∶菜园土∶蛭石=4∶2∶1更适合杉木幼苗的生长,幼苗生长健壮,叶色深绿。
综上所述,组培技术与传统繁殖方式相比,具有繁殖速度快、周期短、管理方便等特点。本试验条件下,杉木组培苗的各项指标达到了快繁育苗的要求,可进行规模化育苗生产,也可大面积进行移栽推广。组培工厂化育苗对移栽后的管理技术要求较高[15],本研究仅探讨了栽培基质,对水肥管理、病虫害防治等管理技术方面尚待进一步研究。
参考文献:
[1] 戴俊,陈代喜,黄开勇,等.广西杉木第二代良种林分生长量调查分析[J].广西林业科学,2020,49(2):237-240
[2] 韦连尤.广西杉木良种化的途径和方法[J].农业与技术,2016,36(2):178-179
[3] 蔡玲,黄艳,吴幼媚,等.广西杉木良种组培容器苗移栽和施肥技术[J].西部林业科学,2016,45(6):156-160
[4] 贾盛强.广西杉木优良家系丰产栽培技术及抚育分析[J].绿色科技,2021,23(5):153-154
[5] 何丽玲.杉木优良无性系组培繁育技术的研究[J].农业技术与装备,2020(7):114-115
[6] 刘海鹰,万雪琴,刘均利,等.杉木优良无性系组培繁育技术研究[J].四川林业科技,2016,37(5):1-6
[7] 张建华.云南省杉木优良无性系组培快繁育苗技术研究[J].绿色科技,2014(4):77-82,83
[8] 王港,陈骏,侯娜,等.杉木无性系规模化组培繁育技术研究[J].湖北林业科技,2014,43(5):7-9,63
[9] 許琪.光皮树扦插苗繁育及优良无性系组培快繁技术研究[D].长沙:中南林业科技大学,2012
[10] 陈芳,白平,李勇杰,等.西南桦优良无性系组培快繁技术[J].西部林业科学,2015(5):8-12
[11] 刘海龙,陈晓明,覃子海,等.杉木优良无性系组培生根技术优化[J].林业科技开发,2015,29(5):67-69
[12] 田玉广,张金练,杨明臣,等.甜樱桃砧木茎尖组培繁育技术[J].河南林业科技,2021,41(4):53-54
[13] 张佳宁,田茂琳,周祥云,等.濒危名贵药材白芨组培繁育技术研究[J].甘肃科技,2016,32(24):122-124
[14] 陈煌,王园园,邱晓婷,等.巴戟天良种组培繁育技术体系的建立[J].宁德师范学院学报(自然科学版),2015,27(4):403-406
[15] 闫朝福,李艳霞.蓝靛果忍冬组培及栽培管理实用技术[J].林业勘查设计,2021,50(5):22-25

