气相色谱测定小麦和稻米中11种多溴联苯醚
张 炜, 杨永坛, 蔡 娣, 张洁琼, 李 森, 李 丽
(国家粮食和物资储备局科学研究院, 北京 100037)
多溴联苯醚(Polybrominated diphenyl ethers, PBDEs)是一类添加型溴代阻燃剂,在20世纪70年代大量生产并商品化,广泛应用于电子、化工、建材、纺织、石油、采矿等多个领域[1]。工业生产的多溴联苯醚包括五溴联苯醚、八溴联苯醚和十溴联苯醚,其中,十溴联苯醚是世界上使用量最大的阻燃剂品种之一[2]。然而,越来越多的研究表明多溴联苯醚具有潜在的神经毒性,肝毒性,可能造成人和动物的内分泌失调,免疫障碍,并可能导致癌症[3-6]。多溴联苯醚的分子结构稳定,是典型的持久性有机污染物,可以在环境中长期存留,并通过生物链在人体和其他生物体中进行蓄积[7-9]。食品是人体内多溴联苯醚曝露的主要途径[10,11],因此,对食品中多溴联苯醚的检测分析备受关注[12,13]。
小麦和稻米是我国人们生活中最主要的主食[14],保障主粮质量安全对人们身体健康和社会稳定具有重要意义。多溴联苯醚作为新兴有机危害物,目前针对其在谷物中的研究相对较少[15-24],对小麦和稻米中多溴联苯醚进行分析时,样品前处理主要采用索氏提取-复合硅胶/氧化铝柱净化、加速溶剂萃取-复合硅胶/氧化铝柱净化和直接提取-复合硅胶/氧化铝柱净化等方式进行。这些前处理方法的时间较长,操作复杂,而且溶剂用量较大。在已有的方法中,检测均使用气相色谱-质谱法。气相色谱-电子捕获检测器法(GC-ECD)是常用于负电性的物质检测的仪器方法,相比于气相色谱-质谱仪器,其经济性好,操作简单,而且灵敏度极高,是进行多溴联苯醚的快捷检测方法。
本研究采用直接提取法,结合酸性硅胶固相萃取柱对小麦和稻米样品进行前处理,并采用气相色谱-电子捕获检测器对其中的11种多溴联苯醚进行分析。方法操作简单,经济高效,适用于谷物样品中多溴联苯醚的检测。
1 材料与方法
1.1 试剂与标准品
乙酸乙酯、异辛烷(农残级);无水氯化钠(分析纯);44% (m∶m)硫酸酸化硅胶净化柱。
11种多溴联苯醚(BDE-25(2,3′,4-三溴联苯醚)、BDE-28(2,4,4′-三溴联苯醚)、BDE-47(2,2′,4,4′-四溴联苯醚)、BDE-99(2,2′,4,4′,5-五溴联苯醚)、BDE-100(2,2′,4,4′,6-五溴联苯醚)、BDE-153(2,2′,4,4′,5,5′-六溴联苯醚)、BDE-154(2,2′,4,4′,5,6′-六溴联苯醚)、BDE-183(2,2′,3,4,4′,5′,6-七溴联苯醚)、BDE-203(2,2′,3,4,4′,5,5′,6-八溴联苯醚)、BDE-206(2,2′,3,3′,4,4′,5,5′,6-九溴联苯醚)、BDE-209(十溴联苯醚))的单独标准溶液(质量浓度为50 μg/mL,溶于异辛烷)。
1.2 谷物样品
选择采集自我国主要粮食产区的小麦、稻米样品各10份。样品均选择作物成熟后,待农户收割储存不久上门收集,每个采样点采集4个样品混合为1个样品,每个采样点采集1.0~2.0 kg样品。小麦样品经除杂、清洗、晾干后,用粉碎机直接粉碎成粉。稻谷样品经除杂、清洗、晾干后,砻谷脱壳制成糙米,用粉碎机粉碎成粉。全麦粉,糙米粉分别装入自封袋中常温密封避光保存。
1.3 仪器与设备
7890A气相色谱仪配有电子捕获检测器,5810R低温高速离心机,AutoEVA-60全自动浓缩氮吹仪,Fotector Plus自动固相萃取仪,Rotavapor R-300旋转蒸发仪,ML3002T天平(精度0.01 g)。
1.4 实验方法
1.4.1 标准溶液、基质匹配标准溶液的配制
分别精确移取11种多溴联苯醚单独标准品进行混合,加入异辛烷稀释,配制每个单体的质量浓度均为2.0 μg/mL的混合标准储备液,并置于-18 ℃下避光保存。
将11种多溴联苯醚的混合标准储备液用异辛烷进行稀释,配制成溶剂标准曲线梯度溶液,质量浓度为0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0、500.0 ng/mL。
向小麦和稻米空白基质的异辛烷溶液中加入11种多溴联苯醚的混合标准储备液,配制成质量分数为0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、50.0 ng/g的基质匹配标准溶液。
1.4.2 样品前处理
准确称取10.00 g粉状样品,置于50 mL聚丙烯离心管中,加入10 mL蒸馏水并充分振荡均匀,再向该水化样品中加入15 mL乙酸乙酯后,剧烈振摇1 min。向混合物中加入3 g氯化钠并充分振摇1 min进行盐析。在10 ℃下,将混合物以10 000 r/min转速离心5 min后,取上层有机相待净化。将有机提取液的溶剂蒸发近干,使用约1 mL正己烷复溶剩余油状物。采用固相净化柱对其进行净化。固相净化柱用5 g 44% (m∶m)酸性硅胶装填,并用15 mL正己烷/二氯甲烷混合液(3/1,体积比)和10 mL正己烷依次淋洗。将复溶样品加载到固相净化柱上,依次使用6 mL正己烷和20 mL正己烷/二氯甲烷混合液(3/1,体积比)进行淋洗,收集上样后所有淋洗液。将收集的溶液样品使用旋转蒸发仪去除溶剂后,使用约1 mL正己烷/二氯甲烷(3/1,体积比)混合液将剩余物转移至2 mL样品瓶中,在氮气流下吹干。准确加入1.0 mL异辛烷复溶并混匀,待气相色谱分析。
1.4.3 气相色谱分析条件
采用加压不分流进样模式,压力为25 psi,维持1 min;进样口温度设为295 ℃;进样量为1.0 mL;采用DB-5MS(95%甲基5%苯基聚硅氧烷)毛细管色谱柱(15 m×0.25 mm×0.1 μm)分离;载气为高纯氮气;流速为1.5 mL/min。升温程序:初始温度为90 ℃,保持1.0 min,以8 ℃/min升至320 ℃,保持5 min。
电子捕获检测器:温度为325 ℃;补偿气为高纯氮气,流速为30 mL/min。
1.4.4 空白基质加标实验
向空白全麦粉和糙米粉中添加11种多溴联苯醚的混合标准溶液,使样品中的质量分数为0.1、0.5、2.0、5.0 ng/g 4个水平。经前处理后进行测定,每个水平平行测定6次。采用基质匹配标准曲线定量,计算回收率和精密度(RSD)。
1.4.5 实际样品测定
样品检测前,先测定标准工作液,至目标分析物的保留时间与响应稳定后进行样品测定。样品分别按照实验方法进行前处理和分析测定。
2 结果与分析
2.1 色谱条件优化
多溴联苯醚的沸点较高,不同单体的沸点差异大,在进样口容易发生“质量歧视”效应。另一方面,多溴联苯醚的稳定性较差,尤其是高取代溴联苯醚,在较高温度下容易发生分解。据报道,十溴联苯醚在300 ℃即发生分解[25]。研究将气相色谱进样口温度设为295 ℃进行色谱优化。
2.1.1 色谱柱优化
多溴联苯醚为弱极性化合物,一般采用弱极性的DB-5色谱柱进行分析。本研究比较了柱长分别为30 m和15 m,固定相膜厚分别为0.25 μm和0.1 μm 2根DB-5MS色谱柱。结果显示,11种多溴联苯醚在15 m色谱柱上可实现基线分离,且在15 m色谱柱上响应更好,尤其是对高取代溴联苯醚,使用短色谱柱有效降低其分解程度(图1)。因此,选择15 m长,0.10 μm固定相膜厚的DB-5MS色谱柱进行分析。

图1 多溴联苯醚在不同色谱柱上的响应值
2.1.2 进样模式
加压不分流进样模式可以快速地将目标分析物加载到温度较低的色谱柱柱头上,以减少目标分析物的质量歧视和分解。比较不分流进样模式和加压(25 psi)不分流进样模式,在加压进样模式下,高取代多溴联苯醚的响应均有小幅度提高,其中十溴联苯醚BDE-209的响应值提高15%左右。
2.1.3 升温速率
程序升温是多组分样品快速分离的有效方法。比较20、15、8 ℃/min 3种升温速率,根据结果,11种多溴联苯醚标准品在3种模式下均可基线分离(图2),并且响应没有明显差别。但是,对基质加标样品分析后发现(图3),采用20 ℃和15 ℃的升温速率,基质中痕量杂质干扰BDE-47与BDE-209的分析,而采用8 ℃/min升温速率可以将干扰杂质与目标物基线分离。因此,采用8 ℃/min升温速率进行样品分析。
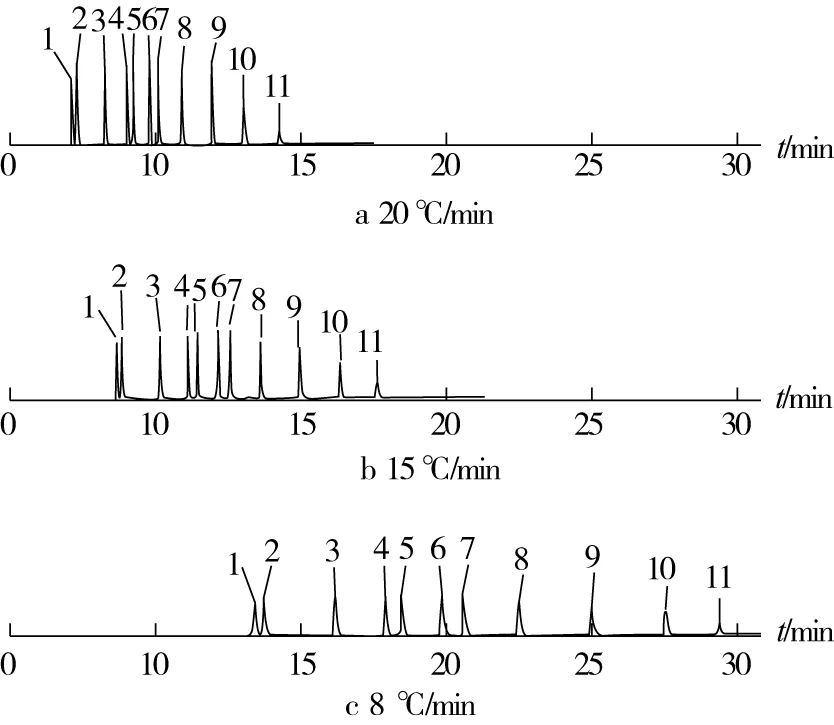
注: 1 BDE-25;2 BDE-28;3 BDE-47;4 BDE-100;5 BDE-99;6 BDE-154;7 BDE-153;8 BDE-183;9 BDE-203;10 BDE-206;11 BDE-209。

注: 1 BDE-25;2 BDE-28;3 BDE-47;4 BDE-100;5 BDE-99;6 BDE-154;7 BDE-153;8 BDE-183;9 BDE-203;10 BDE-206;11 BDE-209。
2.2 样品前处理条件
小麦和稻米样品中含有大量碳水化合物、蛋白质和脂质物质,这些物质都会干扰多溴联苯醚的分析。参考前期研究[23,24],研究采用乙酸乙酯为提取剂,并以酸性硅胶(44%,m:m)净化柱对提取物进行净化。根据对空白基质添加样品的分析结果(图4),酸性硅胶可以有效去除小麦和稻米基质中的干扰物质。酸性硅胶是大量硫酸固载在硅胶上的固体强酸,通过化学反应破坏脂肪、色素等有机物,而不会对多溴联苯醚产生影响。对比使用浓硫酸为净化剂的方法,酸性硅胶的操作更加安全。
2.3 方法学验证
2.3.1 线性范围与基质效应
测定一系列标准溶液和基质匹配标准溶液,以多溴联苯醚的浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归拟合,分别制作标准曲线和基质匹配标准曲线,并对基质效应进行评价。结果显示(表1),在小麦和稻米基质中,BDE-25、28在0.5~50 ng/g范围内线性关系良好,BDE-203、209在0.2~50 ng/g范围内线性关系良好,其他7种多溴联苯醚在0.1~50 ng/g范围内线性关系良好,线性相关系数R2均大于0.998。

表1 小麦和稻米基质中11种多溴联苯醚的定量范围和基质效应
基质效应(Matrix Effect,ME)采用式(1)进行计算:
ME=基质匹配标准曲线斜率/溶剂标准曲线斜率
(1)
基质效应一般在0.8~1.2之间可接受。结果如表1所示,小麦样品基质效应在0.91~1.25之间,其中,中低取代溴联苯醚(BDE-25、28、47、99、100、153、154)为轻度基质减弱效应,高取代溴联苯醚(BDE-203、206、209)为较强的基质增强效应。稻米样品中,基质效应在0.98~1.38之间,其中,高取代溴联苯醚(BDE-183、203、206、209)为较强的基质增强效应,其余多溴联苯醚的基质效应不明显。因此,采用基质匹配标准溶液进行校正,以补偿基质带来的影响。
2.3.2 方法检出限和定量限
采用一系列低水平加标回收实验,以3倍和10倍信噪比(S/N)来确定检出限(LOD)和定量限(LOQ),各组分的方法检出限及定量限见表2。在小麦和稻米样品中,11种多溴联苯醚的方法检出限在0.03~0.15 ng/g之间,方法定量限为0.1~0.5 ng/g。其中BDE-25、28受基质影响较大,检出限最差;BDE-203、209因分解造成其检出限稍差。目前,国内几乎没有针对食品中多溴联苯醚的的限量标准,根据美国环境署EPA的建议[26],商用五溴联苯醚、八溴联苯醚、十溴联苯醚每人每日可摄入限量分别为每千克体质量2、2、7 μg;其中,单体BDE-47、BDE-99、BDE-153、BDE-209的每人每日摄入限量分别为每千克体质量0.1[27]、0.1[28]、0.2[29]、0.7[30]μg。按照我国成人体质量60 kg,每日摄入小麦和稻米类食品300 g计算,方法的定量限能够满足EPA建议多溴联苯醚摄入量的检测要求。
2.2.3 加标回收率(准确度和精密度)
根据空白基质加标实验,4个加标水平下,多溴联苯醚的平均回收率在67.6%~99.7%之间,RSD在0.4%~17.8%之间。其中,稻米基质中多溴联苯醚分析的精密度稍差,更容易受到基质的干扰。由于研究采用外标法进行定量时只进行了基质干扰的补偿,而没有考虑提取净化过程的损失,因此方法的回收率略低,但在可接受范围内。
2.4 实际样品分析
采用本研究建立的分析方法对采集自我国主要小麦和稻米产区的样品进行检测分析。在小麦和稻米样品中仅检出十溴联苯醚(BDE-209),没有检出其他单体(表3)。其中,小麦样品中BDE-209的检出率为70%,最高含量为0.79 ng/g;稻米样品中只有一个样品含有痕量BDE-209。我国曾是多溴联苯醚的主要生产国家,其中主要产品为十溴联苯醚[31]。小麦和稻米样品的检测结果与我国实际多溴联苯醚的生产情况相符。从检出含量来看,小麦和稻米样品中的十溴联苯醚含量不高,远低于目前EPA规定的人体摄入量[26-30]。但是,在小麦和稻米中检出多溴联苯醚,说明其可在植物体中进行蓄积。由于近年来才在全球范围内对多溴联苯醚进行限制生产和使用,因此,粮食中的多溴联苯醚仍然需要引起关注并进行监测。

表3 小麦和稻米样品中十溴联苯醚(BDE-209)的含量/ng/g
3 结论
本研究建立了谷物中11种代表性多溴联苯醚的检测分析方法。样品通过乙酸乙酯提取,酸性硅胶净化,采用气相色谱-电子捕获检测器进行检测分析。样品前处理的操作简单,净化效果好,谷物基质对分析的影响小。方法灵敏度、准确度和精密度均较好,回收率满足应用要求,对分析仪器要求低,适用于谷物样品中多溴联苯醚的的筛查分析。对我国小麦、稻米样品进行检测分析,其中主要污染物为十溴联苯醚,但总体含量低,可持续关注。

