不同添加剂处理笋壳对其发酵品质及湖羊瘤胃微生物的影响
覃娟清,党浩千,金华云,郭宇康,张富,刘庆华
(福建农林大学动物科学学院(蜂学学院),福建 福州 350002)
我国竹子种类达500 多种,位居世界之首;竹林面积占600 万~700 万hm2[1-2]。笋壳是竹笋(Bambuseaespp.)加工过程中产生的主要废弃物,笋壳年产量超3000 万t,其利用率极低[3-4]。笋壳一般指竹笋的鞘和基部区域,占竹笋的70%,具有丰富的木质纤维、粗蛋白和易酵解的膳食纤维[5-6]。笋壳易被反刍动物消化,总可消化营养物质高达68.5%[7]。笋壳高温处理发酵后,可提升蛋白质等营养成分含量,是优良的反刍动物粗饲料来源[8]。因此,合理开发利用笋壳,不仅能变废为宝,还可以缓解饲料资源短缺,降低生产成本,提高经济效益。
至今,在饲料开发方面,主要采用干燥、青贮和微贮对笋壳进行加工处理,从而实现饲料化利用[9-10]。青贮是通过微生物发酵产生有机酸,使饲料得以长期保存。不同类型的青贮添加剂对青贮品质改善作用不同,常见的发酵青贮添加剂有酶类、有机盐类、有机酸类和益生菌复合制剂等[11-13]。甲酸是一种结构简单、用途广泛的复合有机酸,可抑制有害菌,降低pH 值,提升有氧稳定性,常与其他酶制剂等混合青贮,改善饲料发酵品质[14]。在青贮饲料过程中添加外源性纤维素酶能降低pH 值、氨态氮含量,与乳酸菌联合使用,可显著降低酸性洗涤纤维、中性洗涤纤维含量,并能提高青贮品质,抑制有害菌生长[15]。EM(effective microorganisms)菌是一种以光合细菌群、酵母菌群等为主的有益微生物群,其能够对抗致病菌群,改善消化系统微生物平衡及肉质[16-17]。研究表明,在青贮笋壳发酵过程中,适当添加乳酸菌、玉米粉等可不同程度地提升笋壳发酵品质和营养价值[18-19]。目前,单一青贮笋壳的研究甚多,不同添加剂处理笋壳对其发酵品质及肉羊瘤胃微生物的影响研究较少,降低了笋壳在生产中的有效利用率。因此,本试验以当季新鲜的马蹄笋(Bambusa oldhami)笋壳为材料,并以断奶期湖羊为试验动物,研究分析不同添加剂小罐青贮笋壳对其营养成分及发酵品质的影响,随之开展青贮笋壳饲喂湖羊试验,探究青贮笋壳营养品质及其在湖羊上的饲用效果,为优化笋壳的加工方式及其在肉羊生产中的应用提供依据。
1 材料与方法
1.1 笋壳青贮试验
1.1.1 试验材料 2021 年2 月于宁德市龙林牧业有限公司选取新鲜马蹄笋壳进行本试验。甲酸(85%)和纤维素酶(1.0×104U·g-1)150 g 均为分析纯,购自福州佰泉生物技术有限公司。在河南农富康生物科技有限公司购买EM 菌300 mg(10 g·瓶-1,其主要成分为枯草芽孢杆菌、地衣芽孢杆菌、乳酸菌、酵母菌、粪肠球菌等多种微生物组群及生物酶,复合菌剂活菌总数≥1×1010CFU·g-1)。在市场购买拉伸筋膜。
1.1.2 试验设计 采用单因素随机试验设计,将试验分为8 组,分别是甲酸组(formic acid, FA)(10 mL·kg-1)、 EM 菌组(effective microorganisms, EM)(20 mg·kg-1)、纤维素酶组(cellulase enzyme, CE)(150 mg·kg-1)、甲酸+EM 菌组(formic acid+effective microorganisms, FM)(10 mL·kg-1+20 mg·kg-1)、甲酸+纤维素酶组(formic acid+cellulase enzyme, FC)(10 mL·kg-1+150 mg·kg-1)、纤维素酶组+EM 菌组(cellulase enzyme+effective microorganisms, CM)(20 mg·kg-1+150 mg·kg-1)、甲酸+纤维素酶组+EM 菌组(formic acid+cellulase enzyme+effective microorganisms, FCM)(10 mL·kg-1+20 mg·kg-1+150 mg·kg-1),对照组(control group, CK)不添加青贮剂。每组3 个重复,每个发酵罐中装2.5 kg 笋壳。
2021 年2 月采集新鲜笋壳,将其除去泥土后用粉碎机(26 型,浙江)粉碎至约3 cm,各处理组定量喷洒添加剂。发酵前,活化菌剂,即按1 kg 温水+0.5 kg 白糖+10 g 菌剂的剂量活化24 h,随后根据所需添加量稀释原液。每个发酵罐装填2.5 kg 笋壳,充分混匀青贮剂与笋壳,之后层层紧密压入塑料发酵罐中,常温储存于无强光照处,厌氧发酵80 d 后开封取样测定分析,进行饲养试验。
1.1.3 测定指标与方法 80 d 后,根据刘建新等[20]所示方法对各组青贮品质进行评定(表1)。
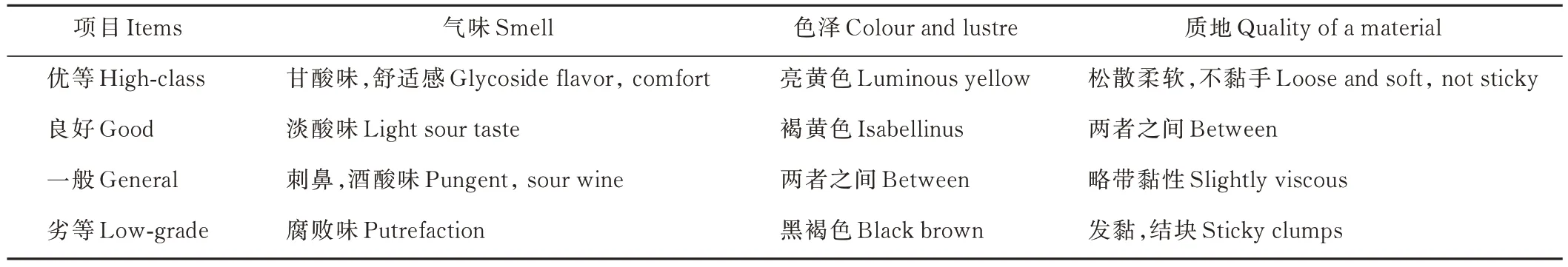
表1 青贮饲料质量评定标准Table 1 Quality evaluation standard of silage
常规营养成分的测定:用常规方法[21]测定样品粗蛋白(crude protein, CP)含量,用Van Soest[22]所示方法测定酸性洗涤纤维(acid detergent fiber, ADF)和中性洗涤纤维(neutral detergent fiber, NDF)含量;ADF-NDF=半纤维素(hemicellulose, HC)含量;原料经105 ℃烘干至恒重后,即为干物质(dry matter, DM)含量。
发酵参数测定:发酵参数主要测定pH、乳酸(lactic acid, LA)、总氮(total nitrogen, TN)、氨态氮(ammoniacal nitrogen, AN)。用pH 测定仪(pHS-3D 型,上海)测定pH 值;采用高效液相色谱仪(LC-20AT 型,日本岛津)测定乳酸含量[23];采用凯氏定氮法[24]测定总氮含量;采用苯酚-次氯酸钠比色法[25]测定氨态氮含量。
1.2 湖羊饲养试验
1.2.1 试验设计及饲粮配方 2021 年7-9 月在宁德市古田县黄田镇龙林牧业有限公司羊场进行试验,选取3月龄[初始体重(16.68±1.05) kg]健康公湖羊30 只,采用单因素随机试验设计,将试验羊随机分为3 组(CK、FM和FCM 组),每组10 只。CK、FM 和FCM 组分别饲喂基础日粮、甲酸+EM 菌和甲酸+EM 菌+纤维素酶,试验期间饲粮按照党浩千等[26]所示基础饲粮组成及营养水平表进行配制。
1.2.2 饲养管理 试验开始前对栏舍、器具清洁并消毒,统一对试验羊进行编号和驱虫。预饲期7 d,正饲期60 d。采取全舍饲由专人饲养,每天饲喂两次(8:00 和16:00),每次投喂日饲喂量的1/2,定时清理消毒羊舍,自由饮水。
1.2.3 样品采集与保存 用瘤胃管采集瘤胃液,后用4 层纱布进行过滤,随之分装于15 mL 冻存管中;之后清空瘤胃,剪取约2 cm2厚的瘤胃背囊部组织(2 片),用生理盐水冲洗干净存放于15 mL 平底试管中,并于4%多聚甲醛溶液中固定。
1.2.4 测定指标与方法 瘤胃乳头长度和肌层厚度:4%多聚甲醛固定,按照“修剪、脱水、包埋、切片、染色、封片”的顺序制作石蜡切片,最后镜检筛选出合格的样片。用正置白光拍照显微镜(Eclipse Ci-L, Nikon, 日本)观察并测量瘤胃乳头长度和瘤胃肌层厚度。
瘤胃微生物的测定:解冻瘤胃液样品,根据十六烷基溴化铵裂解缓冲液法(cetyl trimethyl ammonium bromid,CTAB)[27]提取瘤胃液DNA,按照基因组提取试剂盒说明书对样品进行提取,之后在1%琼脂糖凝胶上依次进行浓缩与纯化。使用引物序列(5′-3′)为341F:CCTAYGGGRBGCASCAG;806R:GGACTACNNGGGTA TCTAAT,使用Phusion® High-Fidelity PCR Master Mix with GC Buffer 和高效高保真酶进行PCR 扩增。根据PCR 产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳对PCR 产物进行检测,对目的条带使用胶回收试剂盒(购自Qiagen 公司)回收产物。再使用TruSeq® DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和q-PCR 定量,文库合格后,使用Illumina NovaSeq PE 250 平台(美丽莎生物科技有限公司,上海)进行16S rRNA 高通量测序。
基于有效数据进行操作分类单元(operational taxonomic units,OTUs)聚类和物种分类分析[28],同时,对OTUs 进行丰度、Alpha 多样性计算、绘制Venn 图,以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs 信息;通过主坐标分析(principal co-ordinates analysis, PCoA)展示样本群落结构;选用LEfSe 分析检测各组间的物种差异。
1.3 数据分析
采用Excel 2019 统计软件整理数据,采用SPSS Statistics 21 进行单因素方差分析及Duncan 氏法多重比较,结果用平均值±标准差表示,以P<0.05 作为差异显著判断标准。
2 结果与分析
2.1 不同添加剂处理对笋壳青贮感官的影响
由表2 可知,CE 和CM 组青贮笋壳腐败味较浓郁,颜色变褐发黑,腐败严重且散发出刺鼻性霉味,茎叶结构较为紧凑完整,青贮品质较差,为劣等。
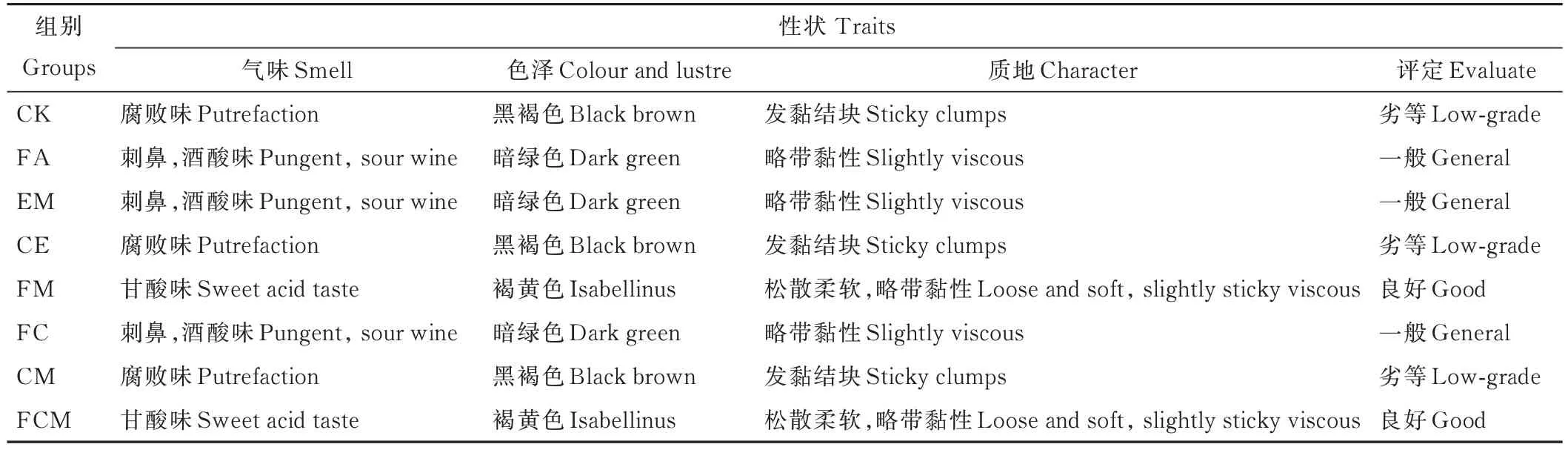
表2 不同添加剂处理笋壳青贮的感官评定Table 2 Sensory evaluation of silage treated with different additives
FA、EM 和FC 组青贮笋壳有酒酸味,较为刺鼻,颜色暗绿,笋壳保存基本紧凑完整,略微黏连,无明显腐败味,青贮品质一般。与对照组相比,各项指标提升明显,青贮品质改善显著。
FM 和FCM 组笋壳芳香果味和甘酸味浓郁,结构完整,青贮品质良好,明显优于对照组。
2.2 不同添加剂处理对笋壳营养成分的影响
根据上述笋壳青贮质量感官评定标准,对一般、良好的各处理组及对照组进行营养成分测定,劣等处理组不予以测定。
由表3 可知,试验组干物质(DM)和CP 含量均显著高于CK 组(P<0.05),FM 和FCM 组均显著高于其他试验组(P<0.05);试验组NDF 含量均显著低于CK 组(P<0.05),且FCM 组显著低于其他试验组(P<0.05);FM、FCM 和FC 组ADF 含量显著低于CK 组(P<0.05);FA 组半纤维素(HC)含量显著低于CK 组(P<0.05)。
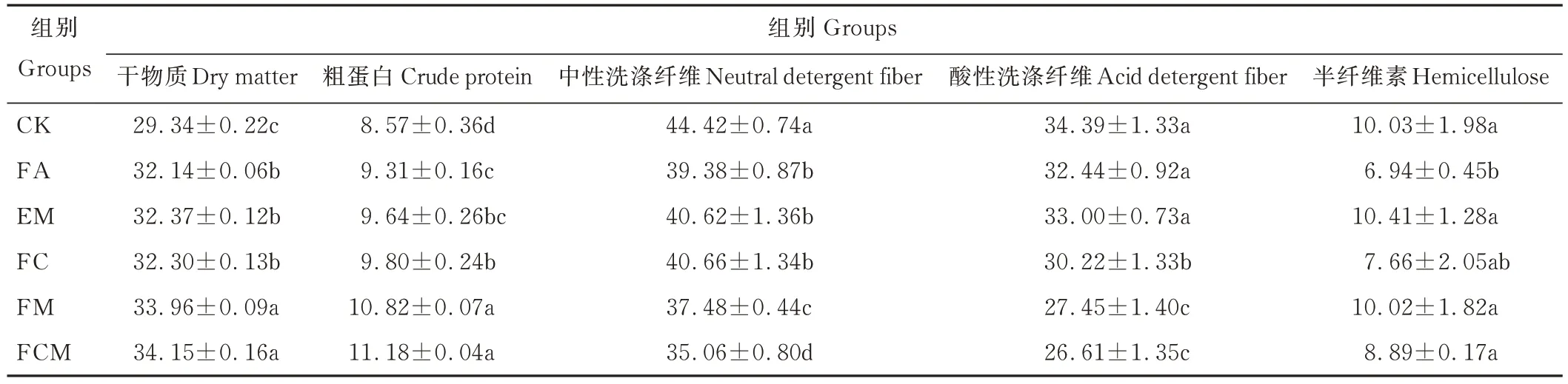
表3 不同处理青贮80 d 对笋壳饲料营养成分的影响Table 3 Effects of 80 days silage with different treatments on nutrient composition of bamboo shell feed(%)
2.3 不同添加剂青贮笋壳80 d 对青贮发酵品质的影响
由表4 可知,除EM 组pH 值与对照组差异不显著外(P>0.05),其他组pH 值均显著低于CK 组(P<0.05),且FA 和FCM 组显著低于FM 和FC 组(P<0.05);试验组乳酸(LA)含量显著高于CK 组(P<0.05),且FCM 和FM 组显著高于其他试验组(P<0.05);除EM 组氨态氮/总氮(AN/TN)值与对照组差异不显著外(P>0.05),其他组均显著低于CK 组(P<0.05)。

表4 不同处理青贮80 d 对笋壳pH 和青贮品质的影响Table 4 Effects of different treatments on pH and silage quality of bamboo shell silage for 80 days
2.4 不同添加剂裹包混贮笋壳对湖羊瘤胃形态的影响
由图1 和表5 可知,FCM 和FM 瘤胃乳头长度分别比CK 组显著提高了39.84%、34.38%(P<0.05);FM 和CK 组肌层厚度显著低于FCM 组(P<0.05)。

图1 不同添加剂青贮笋壳对湖羊瘤胃上皮组织结构的影响Fig.1 Effects of silage bamboo shoot shells with different additives on rumen epithelial tissue structure of Hu Sheep(×200)
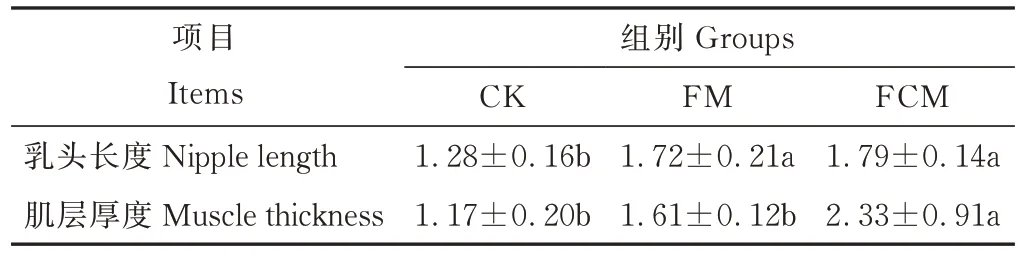
表5 不同添加剂青贮笋壳对湖羊瘤胃形态的影响Table 5 Effects of different additives on rumen morphology of Hu Sheep (mm)
2.5 不同添加剂裹包混贮笋壳对湖羊瘤胃微生物的影响
2.5.1 OTU 分析 测序后,以97% 的一致性(identity)将序列聚类成为OTUs,共得到15191 个OTUs。CK、FM 和FCM 组共有1174 个OTU,占总OTU 的7.73%(图2)。

图2 不同组别之间Venn 图Fig.2 Venn diagram of different groups
2.5.2 瘤胃微生物Alpha 多样性分析 由表6 可知,FCM 和FM 组Chao1 指数均显著高于CK 组(P<0.05);各组Shannon 和Simpson 指数均无显著差异(P>0.05)。

表6 Alpha 多样性指数Table 6 Alpha diversity index
2.5.3 瘤胃微生物Beta 多样性分析 由图3 可知,第一主成分的贡献率为52.2%、16.4%,第二主成分的贡献率为20.4%、13.8%,各组之间分布相距间隔较近,说明不同组之间瘤胃微生物菌群结构差异不大。
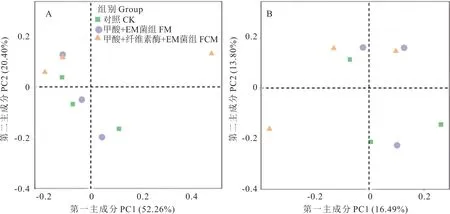
图3 基于Unweighted Unifrac (A)和Weighted Unifrac (B)距离的瘤胃微生物群落结构的主坐标分析Fig. 3 Principal coordinate analysis of rumen microbial community structure based on Unweighted Unifrac (A) and Weighted Unifrac distance (B)
2.5.4 瘤胃微生物菌群门、科和属水平相对丰度分析 如表7 所示,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)起主导作用,占细菌总丰富度的90%以上。厚壁菌门相对丰度CK 组最高,为58.18%;FM组最低,为52.24%;拟杆菌门相对丰度CK 组最低,为37.26%,最高为FM 组,为39.95%。
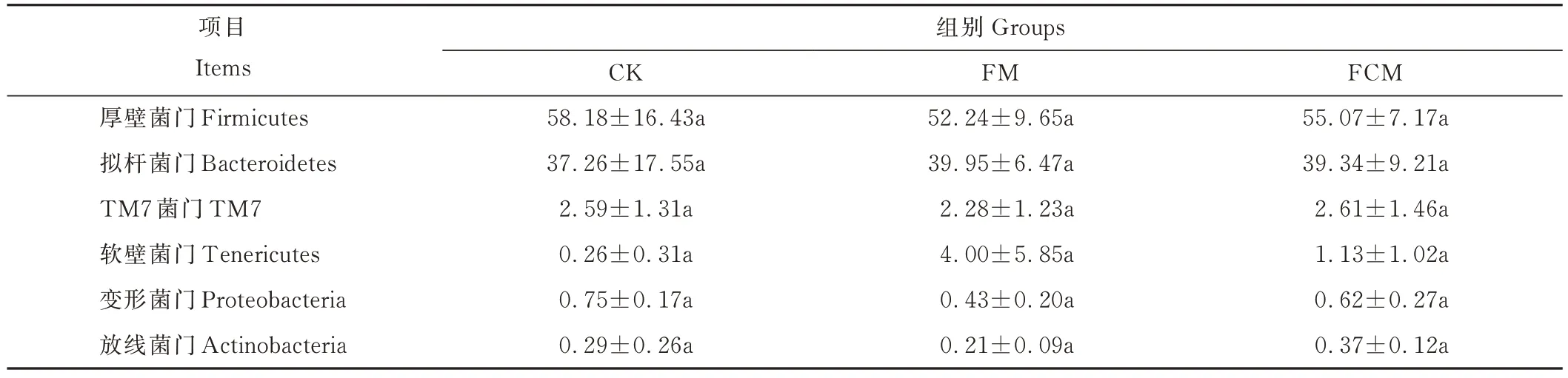
表7 门水平微生物相对丰度Table 7 Relative abundance of microorganisms at phylum level (%)
由表8 可知3 组中最丰富的科水平类别,占主导作用的是未鉴定的拟杆菌科(unidentified_Bacteroidales),瘤胃球菌科(Ruminococcaceae)、未鉴定的梭菌科(unidentified_Clostridiales)、毛螺菌科(Lachnospiraceae)。瘤胃球菌科相对丰度FM、FCM 组高于CK 组,其中FM 组最高,为20.98%,但均无显著性差异(P>0.05)。
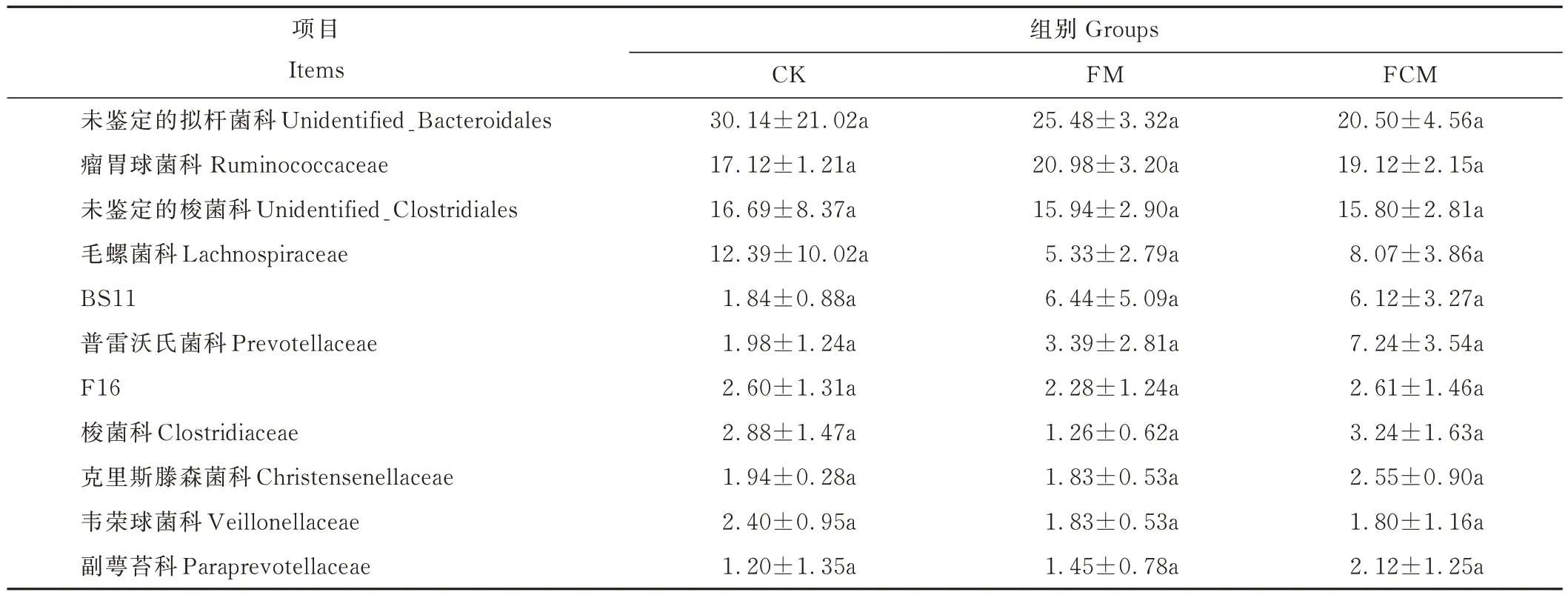
表8 科水平微生物相对丰度Table 8 Relative abundance of microorganisms at family level (%)
由表9 可知,各组中属水平微生物相对丰度类别,未鉴定的拟杆菌属(unidentified_Bacteroidales)、未鉴定的瘤胃球菌属(unidentified_Ruminococcaceae)、未鉴定的梭菌属(unidentified_Clostridiales)、未鉴定的毛螺菌属(unidentified_Lachnospiraceae)这4 个菌属起主导作用,其中FM 组未鉴定的瘤胃球菌属(unidentified_Ruminococcaceae)最高,CK 组最低,但均无显著性差异(P>0.05)。
2.5.5 组间差异物种分析 如图4 所示,由LEfSe 分析(LDA score>4)可知,FM 组生物标志物是鞘脂菌属(Sphingobium),CK 组是RF16 和细菌属(Bacteria)。
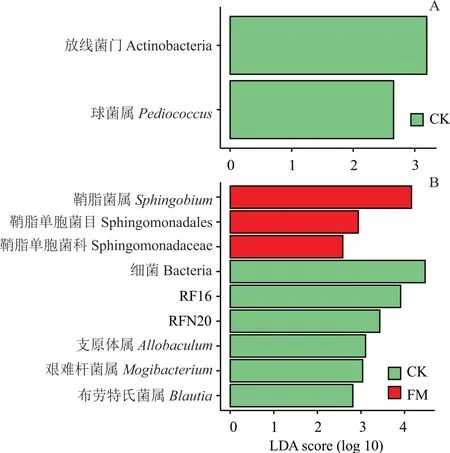
图4 CK 和FM 组,CK 和FCM 组基于LEfSe分析的组间差异物种Fig. 4 Different species of CK and FM group, CK and FCM group based on LEfSe analysis
3 讨论
3.1 不同添加剂处理对笋壳营养成分和发酵品质的影响
笋壳含水量高达90%以上[29],营养物质丰富,且粉碎后容易被氧化。因此,自然条件下笋壳的储存和发酵易产生霉变,从而造成青贮失败。然而,适当使用青贮剂可有效改善发酵品质,提升营养价值[30]。本研究发现添加纤维素酶组均腐败严重,有强烈刺鼻性气味,发黏结块,可能是因为EM 菌中的乳酸菌和纤维素酶在青贮发酵过程中无法产生协同作用,抑制了乳酸菌等有益菌活性,导致乳酸含量降低,从而导致青贮严重腐败。黄小云等[31]在添加乳酸菌和纤维素酶对狼尾草(Pennisetumspp.)和圆叶决明(Chamaecrista rotundifolia)混合青贮效果的试验中发现,其青贮品质没有得到明显提升。杨烈等[32]在探究乳酸菌与纤维素酶对‘Tifton 85’狗牙根(Cynodonsp. cv.Tifton 85)青贮发酵品质影响的结果表明,乳酸菌和纤维素酶之间可能存在拮抗作用,降低了青贮效果。
采用小罐青贮笋壳,层层压实笋壳排出空气,降低氧气浓度,减缓笋壳自身氧化速率[33]。在本研究中,添加青贮剂后笋壳DM 含量显著升高,其营养物质在一定程度上得到了有效保留。此外,在感官品质鉴定、营养成分方面,添加甲酸组均显著优于其他各单独处理组,其pH 值明显降低,CP 含量显著增加,这主要是因为甲酸可有效抑制腐败微生物的活性,降低pH 值,提高青贮成功率[34]。本研究中,与甲酸+EM 菌组相比,甲酸+EM 菌+纤维素酶组CP 含量更高,NDF 含量更低,可能是因为纤维素酶能将笋壳中的纤维分解成可溶性多糖(water soluble carbohydrate, WSC),从而为EM 菌中厌氧菌的生长繁殖提供更多可利用的底物,促进了乳酸菌发酵,青贮中LA含量增加,有效改善了青贮品质。这与赵小雪等[35]的研究结果基本一致。说明适量添加甲酸、纤维素酶和EM 菌混合青贮笋壳能提升青贮品质,降低ADF 和NDF 含量。
青贮发酵过程是众多微生物复杂动态变化过程,添加甲酸、纤维素酶和EM 菌可为笋壳发酵营造良好的环境,促进乳酸菌和枯草芽孢杆菌等优势菌种生长繁殖[36-37]。LA 含量越低,发酵物的pH 值越高,营养物质损失越多,发酵效果越差[38]。AN/TN 是反映青贮饲料蛋白质降解的重要指标,AN/TN 值越低,说明青贮品质越好[39]。在本试验中,添加甲酸组能够迅速酸化青贮笋壳,降低pH 值,从而抑制有害菌生长繁殖。研究表明,pH 值与LA含量密切关联,pH 值小于3.5 时,乳酸菌基本上停止生长,最终导致乳酸浓度降低[40]。本研究结果显示,试验组pH 值显著低于CK 组,LA 含量显著高于CK 组,AN/TN 显著低于CK 组,其中FM、FCM 组LA 含量较高,且FCM 组pH 值最低,AN/TN 最小,表明添加剂混合青贮发酵效果最佳,能够明显改善青贮发酵品质,这与周迪等[41]的研究结果一致。
3.2 不同添加剂处理对湖羊瘤胃发育的影响
瘤胃是营养物质消化、吸收、存储的主要场所,瘤胃组织形态学中瘤胃乳头长度、宽度和肌层厚度是衡量瘤胃发育的关键指标[42-43]。瘤胃乳头长度是最重要的指标,其次为瘤胃乳头宽度及肌层厚度[44]。瘤胃乳头长度越长,瘤胃上皮与瘤胃内容物的接触表面积越大,因而,瘤胃上皮对营养物质的吸收能力增强,利于瘤胃的健康发育[45]。合理的精粗比可维持瘤胃乳头正常形态,可增加瘤胃蠕动,促进肌层发育,促进瘤胃乳头发育[46]。本试验表明,FM 和FCM 组瘤胃乳头长度显著大于CK 组,FCM 组肌层厚度显著高于FM 和CK 组,表明不同添加剂处理青贮笋壳能促进湖羊瘤胃形态发育。
3.3 不同添加剂裹包处理笋壳对湖羊瘤胃微生物多样性的影响
瘤胃中分布着丰富的微生物,且微生物菌群处于一定的动态平衡中。Alpha 多样性分析主要反映瘤胃微生物菌群的丰富度和均匀度,Chao1 指数反映微生物丰度,数值越大,说明群落的丰富度越高,Shannon 和Simpson指数反映物种多样性,数值越高,说明群落多样性越高。瘤胃细菌多样性和丰度是影响瘤胃功能的关键因素[47]。在本试验中,FM 和FCM 组Chao1 指数均显著高于CK 组,说明不同添加剂青贮笋壳可在一定程度上改变试验羊瘤胃菌群丰富度,其中FCM 组高于FM 组,这是由于添加纤维素酶青贮笋壳改善了试验羊瘤胃发酵功能,体内建立了优势菌群,增加了瘤胃内活菌总数,提升了微生物多样性[48-49]。陈宇[50]研究表明添加木聚糖酶和纤维素酶可以提高培养液中细菌总浓度,促进纤维降解菌繁殖,与贾鹏[51]研究结果相近。由Beta 多样性分析可知,各组间瘤胃微生物菌落结构差异不大,表明不同添加剂青贮笋壳增加瘤胃微生物群落多样性的作用不明显,与姜碧薇[52]采用酶菌青贮粗饲料提高了试验羊瘤胃内微生物多样性的研究结果不一致。
3.4 不同添加剂裹包处理笋壳对湖羊瘤胃微生物菌群的影响
反刍动物瘤胃微生物由细菌、原生动物、真菌、古细菌和病毒组成,构成了复杂的共生网络,菌群受日龄、品种、精粗比、添加剂以及日常管理方式等因素影响,菌群的动态平衡对于维持宿主反刍动物的免疫功能和整体生产效率至关重要[53]。反刍动物瘤胃微生物菌群丰富多样,其中优势菌门是拟杆菌门和厚壁菌门,且其丰度较高,厚壁菌门可以降解纤维生成挥发性脂肪酸,而拟杆菌门可以降解蛋白质和非纤维素植物多糖[54]。在本试验中,试验组湖羊瘤胃内主要为厚壁菌门和拟杆菌门,占比约90%,与陈丽娟等[55]采用体外发酵法研究不同比例构树(Broussonetia papyrifera)与苜蓿(Medicago sativa)混合对安格斯母牛瘤胃细菌多样性影响的结果一致。瘤胃球菌科可水解纤维素、木质素等大分子物质,转化成糖类物质。本试验表明,试验组瘤胃球菌科相对丰度高于CK组,且FM 组相对丰度最大,这是由于EM 菌中的枯草芽孢杆菌等提高了笋壳在瘤胃内粗纤维的降解速率。普雷沃氏菌也是反刍动物瘤胃内的优势菌群之一,主要参与淀粉、纤维素、蛋白质的分解转化,促进营养物质降解[56]。在本试验结果中,FCM 组普雷沃氏菌科、瘤胃球菌科相对丰度均与CK 和FM 组相比无显著差异,表明添加剂处理笋壳增加瘤胃内菌群结构及微生物多样性的作用不太明显。
4 结论
单一或复合添加青贮剂发酵笋壳可提高CP、乳酸含量,降低pH 值,提升发酵品质,同时能降低ADF、NDF 以及HC 含量,其中甲酸+EM 菌组和甲酸+纤维素酶+EM 菌组青贮笋壳感官品质、发酵特性和营养品质较好,用于饲喂湖羊,但改善瘤胃微生物组成和结构的作用不太明显。

