小肠结肠炎耶尔森氏菌噬菌体的研究进展
紫绍贵,张海鹏,钟佑宏
(1.大理大学公共卫生学院,云南 大理 671000;2.云南省地方病防治所/云南省自然疫源性疾病防控技术重点实验室,云南 大理 671000)
噬菌体是感染细菌的病毒,最早于1915 年被发现,最初10 年起步阶段噬菌体被尝试用于治疗细菌感染,但由于当时噬菌体具体疗效尚未被探明以及抗生素的出现,导致噬菌体疗法被抛弃[1]。细菌对抗生素的耐药性日益严峻,噬菌体疗法又重新引起了人们的关注。噬菌体被用于食品初加工、生物灭菌和生物保鲜三大食品工业领域,并被用来控制食品质量,比如对抗食源性致病微生物如大肠埃希氏菌、空肠弯曲菌、沙门氏菌、单增李斯特菌,也用来对付引起人畜共患的病原菌[2,3]。噬菌体不仅是杀灭细菌的武器,而且可以作为食源性病原菌存在的指示器应用于食品、水和环境污染预警系统中[4,5]。小肠结肠炎耶尔森氏菌噬菌体正是对抗食源性病原菌——小肠结肠炎耶尔森氏菌的利器。
1 小肠结肠炎耶尔森氏菌噬菌体
小肠结肠炎耶尔森氏菌属于耶尔森菌属,革兰氏阴性杆菌,由此菌引起的疾病称为耶尔森氏菌病,人类感染多呈自限性,临床症状包括发热、胃肠消化功能紊乱伴随急性腹泻肠道炎症等,然而在动物身上通常表现为无症状带菌[6]。小肠结肠炎耶尔森氏菌广泛分离于人、圈养的猪和野猪的排泄物,但在食品、自然环境和临床标本上分离率较低[7]。猪是该致病菌株的主要储存宿主,除猪肉制品为主要感染来源外,输血和饮用被污染的水源也可能导致感染[8]。根据小肠结肠炎耶尔森氏菌菌体O 抗原的结构已鉴定出60 多种不同的血清型,其分别归属于6 种生物分型——1A、1B、2、3、4、5[9-11]。属于生物型1A 的菌株被确定为无致病性,通常分离于环境、健康的动物和人的样本。而生物型1B 即美洲型,是该菌种中最危险的生物型。生物型2、3、4、5 被称为欧洲型,致病性弱,在中国主要的致病生物血清型是2/O∶9、3/O∶3[12,13]。
小肠结肠炎耶尔森氏菌噬菌体是一类专性感染小肠结肠炎耶尔森氏菌的病毒。用不同的血清型宿主菌从污水、粪便里分离不同的小肠结肠炎耶尔森氏菌噬菌体,已发现的小肠结肠炎耶尔森氏菌噬菌体,大部分属于短尾病毒和肌尾病毒(表1),有些分离到的噬菌体还可感染假结核耶尔森氏菌及其他一些对人类不致病的耶尔森氏菌[1,14-17]。小肠结肠炎耶尔森氏菌噬菌体不仅可以从污水、粪便中分离得到,还可以从溶源宿主菌中诱导出。 Liang 等[18]通过丝裂霉素C 诱导小肠结肠炎耶尔森氏菌分离得到6 株温和噬菌体,其基因型不仅具有多样性,而且在同种血清型菌株中分离到的噬菌体基因高度保守。Hammerl 等[19]从102 株致病性菌株中诱导分离得到10 株温和噬菌体,都属于肌尾病毒,依据基因组系统进化树可以分为3 个组,仅在室温下(约22 ℃)表现出裂解性。约有75%的小肠结肠炎耶尔森氏菌是溶源菌,用丝裂霉素C 诱导分离的噬菌体在不携带同源原噬菌体的小肠结肠炎耶尔森氏菌的培养基上出现混浊的噬斑,诱导获得的噬菌体裂解性弱。通过诱导获得的方式增加了噬菌体的获取来源,有助于从更广阔的群体中筛选目标。
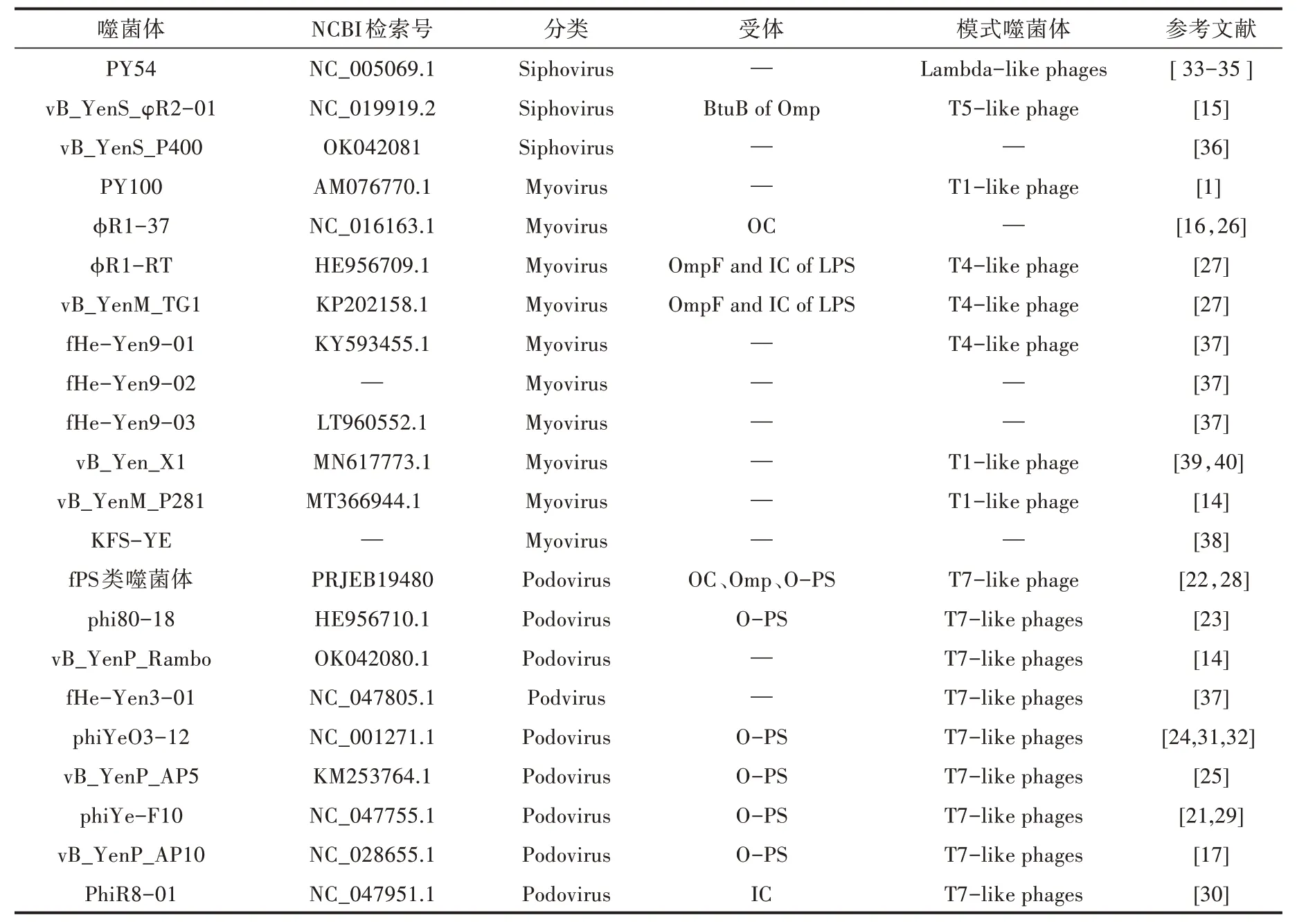
表1 小肠结肠耶尔森氏菌噬菌体
2 小肠结肠炎耶尔森氏菌噬菌体受体
噬菌体感染宿主具有严格的特异性,有尾噬菌体通常由受体结合蛋白(Receptor binding protein,RBP)介导与宿主受体结合进入细胞内[20]。受体成分包括细菌的鞭毛/菌毛、脂多糖(Lipopolysaccharides,LPS)、荚膜多糖(Capsular polysaccharides,CPS)和外膜蛋白(Outer membrane proteins,Omp)[21]。脂多糖是革兰氏阴性菌细胞壁的组成成分,由类脂(Lipid A,LA)、内核(Inner core,IC)、外核(Outer core,OC)、O 特异抗原(O-antigen,O-ag)构成[22]。由表 1 可知,fPS-59、phi80-18、phiYeO3-12、vB_YenP_AP5、phiYe-F10、vB_YenP_AP10 利用脂多糖O 特异抗原成分(O-PS)为受体[17,21-25],vB_YenS_φR2-01、φR1-RT、vB_YenM_TG1、fPS-54-ocr 受体是Omp[15,16,22,26],φR1-RT 和vB_YenM_TG1则同时利用IC of LPS、OmpF 为受体成分[27],φR1-37、fPS-53、fPS-85、fPS-89 受体为OC[22,26]。
3 小肠结肠炎耶尔森氏菌噬菌体研究情况
3.1 短尾病毒噬菌体
根据噬菌体的受体类型和基因序列同源度把所属噬菌体分为fPS 样噬菌体和大肠杆菌T7 样噬菌体。Salem 等[22,28]于2010—2012 年在14 家荷兰养猪场中分离到fPS 类噬菌体,并从中选取了16 株具有代表性的噬菌体(Group Ⅰ:fPS-52、fPS-50、fPS-21、fPS-16、fPS-9、fPS-64、fPS-10、fPS-19、fPS-7、fPS-86、fPS-26;Group Ⅱ:fPS-89、fPS-85、fPS-53、fPS-54-ocr;Group Ⅲ:fPS-59),都属于短尾病毒,均能够感染小肠结肠炎耶尔森氏菌血清型O∶3、O∶5,27、O∶9 菌株和假结核耶尔森氏菌血清型O∶1a、O∶1b、O∶3 菌株,总体基因组织结构与大肠杆菌T7样的噬菌体相似。除fPS-54-ocr 可能以细菌外膜蛋白为受体外,其余噬菌体均以细菌脂多糖为受体。Salem 等[22]的完整基因组序列系统进化树研究表明,fPS 类噬菌体代表3 组类别,核苷酸序列高度重复。 大肠杆菌T7 样的噬菌体有phi80-18、vB_YenP_Rambo、fHe-Yen3-01、phiYeO3-12、vB_YenP_AP5、phiYe-F10、vB_YenP_AP10 和PhiR8-01(表1)。phiYe-F10 分离自河南省登封市猪肛拭子,高度专性裂解O∶3 血清型菌株,对O∶5、O∶9 及其他菌株均不裂解[29]。研究表明其在25 ℃时裂解谱较窄,原因是受体由负责O 型抗原生物合成的DTDP-鼠李糖末端转移酶RfbF 调节,推测O-抗原生物合成蛋白前体与phiYe-F10 受体吸附能力相关导致裂解效力下降[21]。PhiR8-01 在37 ℃生长的细菌上几乎不产生噬斑,而在22 ℃下感染O 特异抗原和外核阴性的小肠结肠炎耶尔森氏菌O∶3,表明PhiR8-01的受体并不突出于外膜[30]。phiYeO3-12、vB_YenP_AP5 和phiYe-F10 能裂解致人类耶尔森氏菌病的小肠结肠炎耶尔森氏菌血清型O∶3 菌株,对耶尔森氏菌病的研究具有应用价值[25,29,31,32]。
3.2 长尾病毒噬菌体
综述3 株感染小肠结肠炎耶尔森氏菌的长尾噬菌体。PY54 是从德国农场粪便中采用不致病的小肠结肠炎耶尔森氏菌血清型O∶5 菌株在丝裂霉素C 的诱导下分离得到。PY54 作为溶源性耶尔森氏菌的质粒,其基因为线性双链闭环分子结构,具有与大肠杆菌噬菌体N15 类似的特性[33-35]。vB_YenS_φR2-01 于1998 年分离自荷兰图尔库城市污水处理厂,利用外膜蛋白BtuB 为受体,能够裂解许多小肠结肠炎耶尔森氏菌血清型和克氏耶尔森氏菌O∶3[15]。vB_YenS_P400 分离自德国东北部的野鹿粪便中,其宿主范围窄,仅感染120 株测试株中的B4/O∶3 菌株2 株,且其基因组不与其他噬菌体同源,是继vB_YenS_φR2-01 后发现的第2 株烈性长尾噬菌体[36]。
3.3 肌尾病毒
PY100 从德国农场猪粪中分离得到,其宿主范围广,除能够裂解小肠结肠炎耶尔森氏菌血清型菌株O∶3、O∶5、27、O∶8、O∶9 和一些生物分型1A 菌株外,还可裂解假结核耶尔森氏菌、鼠疫耶尔森氏菌及其他耶尔森氏菌。衣壳蛋白和DNA 代谢相关蛋白与大肠杆菌噬菌体T1 同源,推测尾部蛋白与伴放线杆菌噬菌体AaΦ23 同源,PY100 ORF2 推测的基因产物与沙门氏菌噬菌体P22 的基因产物显示出明显的同源性[1]。φR1-37 是通过小肠结肠炎耶尔森氏菌血清型O∶3 衍生物质粒毒性固化O 抗原阴性菌株YeO3-R1 分离得到的,以小肠结肠炎耶尔森氏菌脂多糖外核多聚己糖为受体,该受体也存在于假结核耶尔森氏菌血清型O∶9 菌株中[16]。TG1 和φR1-RT分离于加拿大猪粪和芬兰污水里,它们的核苷酸序列相似度为91%。低于25 ℃培养时,它们能裂解小肠结肠炎耶尔森氏菌血清型O∶3、O∶5、27 和O∶9,不能感染其他属类细菌,对宿主的选择有严格的特异性。vB_YenM_TG1 和φR1-RT 均以细菌脂多糖内核七碳糖残基和外膜蛋白OmpF 为受体,而OmpF 受体依赖温度表达,孵育温度与OmpF 表达呈负相关。定量蛋白组学分析表明,OmpF 受体在22 ℃比37 ℃产生更高的蛋白丰度,且37 ℃下的蛋白丰度几乎没有超过测定的阈值[27]。fHe-Yen9-01、fHe-Yen9-02 和fHe-Yen9-03 是2013 年在芬兰赫尔辛基污水处理厂中使用宿主菌小肠结肠炎耶尔森氏菌O∶3 6471/76 和O∶9 Ruokola/71 菌株分离得到的。fHe-Yen9-01 宿主范围比其他2 种更广,在选用的测试菌株中三者的感染率分别为61.3%、42.4%、25.4%。Jun 等[37]首次将fHe-Yen9-01 用于食品、厨房用具和人工手污染模型试验中,取得了一定的杀菌效果。vB_YenM_P281 分离自德国东北部野鹿粪便中,该噬菌体具有宽阔的宿主范围和较强的裂解能力,裂解小肠结肠炎耶尔森氏菌O∶3、O∶5、O∶8 和O∶9 等血清型菌株。在28 ℃和37 ℃条件下,加入钙、镁离子后可裂解假结核耶尔森氏菌[14]。KFS-YE 是使用菌株ATCC23715 在韩国家禽养殖场水样中分离得到的肌尾噬菌体,只裂解42 株测试株中的小肠结肠炎耶尔森氏菌(ATCC55075、ATCC9610)2 株,具有在pH 4~11、温度4~50 ℃条件下保持稳定的特性[38]。vB_Yen_X1 分离自中国吉林省长春市一家污水处理厂,能够在pH 4~11、温度4~60 ℃条件下保持活性,并具有一定耐受性,裂解试验有27 株O∶3 和O∶8 菌株[39]。vB_Yen_X1 基因组与PY100 具有同源性,它们之间有10 个基因组编码的蛋白存在差异[40]。通过研究小肠结肠炎耶尔森氏菌定殖小鼠肠道导致肠炎的模型,发现vB_Yen_X1 能够有效缓解小肠结肠炎耶尔森氏菌对肠道的病理损伤[39,40]。
4 小肠结肠炎耶尔森氏菌噬菌体的应用
小肠结肠炎耶尔森氏菌噬菌体在治疗疾病、分离检测致病菌和清除食源性病原菌中取得了理想的效果,展现出其在食品安全领域的应用潜力。利用噬菌体宿主受体结合蛋白分离食品中的小肠结肠炎耶尔森氏菌,可以达到提高检测效率的目的。从phi80-18、v_YenP_AP5、vB_YenM_TG1 中提取的受体结合蛋白表达在大肠埃希菌中,从中获得与原生蛋白具有相同功能的Gp47、Gp17、Gp37,涂在磁性微粒表面与CIN 琼脂结合使用,对小肠结肠炎耶尔森氏菌O∶3、O∶5、27、O∶8 和O∶9 菌株的分离特异度达85%,与CAY 琼脂结合使用特异度高达95.7%。基于噬菌体识别结合蛋白的磁分离技术(RBP-MS)应用于人工接种的碎猪肉样品检测与直接在CIN 或CAY平板上分离相比,其特异度提高了2 log10CFU/mL。RBP-MS 作为浓缩细菌的手段,提高了食品中致病性小肠结肠炎耶尔森氏菌的分离率[17]。利用phi-YeO3-12 尾蛋白结合双抗免疫金标记ELISA 试验,在透射电镜下观察小肠结肠炎耶尔森氏菌,该方法能够特异识别致病性血清型O∶3,是一种基于噬菌体黏附蛋白识别病原菌的应用前景广阔的方法[41]。小肠结肠炎耶尔森氏菌噬菌体用来治疗食源性肠道致病菌,可以减少病菌在肠道中的定植量,并减轻肠炎症状。薛一冰[39]给小鼠口服vB_Yen_X1 制剂,6 h 后小鼠肠道内的小肠结肠炎耶尔森氏菌消除率达33.3%,细菌数量在18 h 后减少至103 CFU/g,而未处理组则为107 CFU/g。Xue 等[40]通过肠道组织病理学观察,发现噬菌体治疗法对肠道组织有明显的改善作用,而且促炎症细胞因子水平明显减少。噬菌体可以作为生物防治剂应用于食品和厨具去污场景,如模拟小肠结肠炎耶尔森氏菌常见的感染途径,用fHe-Yen9-01 对接种有小肠结肠炎耶尔森氏菌O∶9 的生肉、速食肉和牛奶进行除菌,发现食品中的菌量分别降至2.12×102CFU/g、3.8×10 CFU/g、<10 CFU/mL。噬菌体用在砧板、刀具和外科手套上,同样能抑制细菌的生长[37]。还可以利用其控制微生物,如利用PY100 使小肠结肠炎耶尔森氏菌在4 ℃肉汤中24 h 后减少3 log10单位,37 ℃中1.5 h 后减少5 log10单位,在4 ℃肉汤中48 h 后减少2 log10单位[42]。
5 展望
小肠结肠炎耶尔森氏菌噬菌体是对抗食源致病菌的有力武器,可以帮助人们提高检出致病菌的能力,控制食源病菌的传播。大多数的应用研究尚属于试验阶段,成果未转化,有待开发出可用于食品安全领域的产品及检测试剂。分离噬菌体的主要来源是污水和排泄物,标本来源途径相对局限。有必要分离和鉴定出新的噬菌体,以扩大用于食品安全领域噬菌体的候选范围。通过诱导获得噬菌体可拓宽其来源渠道,或有助于从多个候选者中选择宿主谱宽、潜伏期短、暴发量高的目标噬菌体。小肠结肠炎耶尔森氏菌有众多血清型,单个噬菌体难以覆盖多种菌,需联合使用多种噬菌体方能获得理想的效果。广泛应用噬菌体还需要进一步深入研究。

