香蕉中ABA 醛氧化酶基因家族的鉴定及其表达分析
曾坚,周洁薇,王舒婷,胡伟
(1. 韶关学院广东省粤北食药资源利用与保护重点实验室/英东生物与农业学院,广东 韶关 512005;2. 中国热带农业科学院热带生物技术研究所,海南 海口 571101)
脱落酸(abscisic acid,ABA)属于六种植物激素之一,1963 年首次在脱落果实中被鉴定为生长抑制剂[1],随后发现其在种子休眠、萌发、气孔开合、果实发育等多种生理过程中发挥着重要作用[2-4],在水杨酸介导的生物胁迫以及高盐、干旱和寒冷等非生物胁迫中也起着关键作用[3,5]。ABA 的代谢过程已有相关研究综述进行了详细总结[6]。 ABA 合成过程主要涉及玉米黄质环氧化酶(zeaxanthin epoxidase,ZEP)、9-顺环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenases,NCEDs)、短链醇脱氢酶/还原酶(short-chain dehydrogenases/reductases,SDR)、ABA 醛氧化酶(abscisic aldehyde oxidase,AAO)[7],其中AAO 参与ABA 合成途径中的最后一步。 虽然ABA 合成相关基因的研究比较多[8],但关于AAO基因的研究较少,目前只对少数几个物种如拟南芥[9]、水稻[10]、小麦[11]等的AAO基因家族进行了鉴定分析。 如:在拟南芥中,AtAAO3基因的突变会导致ABA 含量降低[9];番茄ABA 缺陷型突变体中的AAO 活性远低于野生型的[12],大麦中也存在类似的AAO 缺失或活性降低的现象[13]。
香蕉(Musassp.)是世界上重要的热带水果之一,也是重要的粮食作物之一[14]。 香蕉在生长过程中会遭受到低温、干旱、香蕉枯萎病等不同逆境的影响,对其产量和最终果实品质产生重要影响[15-16]。 ABA 在这些过程中都扮演着重要的角色,因此,研究香蕉AAO家族基因种类及其在不同逆境处理下的表达情况具有重要意义。 本研究从香蕉基因组中鉴定得到了AAO家族基因,并分析了它们的进化关系、基因结构和蛋白结构域,同时分析了其在不同组织、果实发育和成熟的不同阶段及对非生物/生物胁迫响应的表达模式,以期为进一步明确MaAAOs基因在香蕉生长发育和胁迫反应过程中的功能提供参考。
1 材料与方法
1.1 试验材料
选用口味优良的香蕉品种粉蕉(MusaABB Pisang Awak,FJ) 进行试验。 将粉蕉组培苗种植于塑料盆中(无菌土壤),培养于生长室(28 ℃,70%湿度,光周期为16 h 光/8 h 暗,光照强度为200 μmol·m-2·s-1)。 组培苗种植取样周期为2015 年6 月—2016 年8 月。
1.2 试验处理与样品采集方法
(1)不同组织样品采集:组培苗种植约70 天后达到五叶期,此时选取叶和根;组培苗种植约10 个月开始开花,于开花后0 天(0 DAF)、20 DAF 和80 DAF 选取果实;组培苗种植12 ~13 个月后采收,选取采收后3 天(3 DPH)和6 DPH 的果实。 每个样本进行两次生物学重复,用于分析基因在不同组织和果实发育不同阶段的表达情况。
(2)非生物胁迫处理方法及取样:分别用300 mmol·L-1NaCl 和200 mmol·L-1甘露醇灌溉五叶期香蕉幼苗,进行盐胁迫和渗透胁迫处理,处理7 d 后取样;将五叶期香蕉幼苗置于4 ℃生长室(70%湿度,光周期为16 h 光/8 h 暗,光照强度为200 μmol·m-2·s-1)进行冷胁迫处理,22 h 后取样。 采集对应处理时间后的叶片样本进行非生物胁迫处理下基因的表达分析。
(3)尖孢镰刀菌侵染处理及取样:将五叶期香蕉幼苗根部浸泡在F. oxysporumrace 4(Foc4)孢子悬液(106个分生孢子/mL)中2 h,以浸入无菌蒸馏水(ddH2O)中的为对照;然后移栽到装有无菌土壤的塑料盆中,在生长室中培养(28 ℃,70%湿度,光周期为16 h 光/8 h 暗,光照强度为200 μmol·m-2·s-1);培养2 d 后,采集根系样品进行基因表达分析。 每份样本包含两个生物重复样本。
1.3 香蕉AAO 基因家族的鉴定及系统发育分析
利用拟南芥AtAAOs基因的序列构建HMM模型,从香蕉A 基因组中搜索得到香蕉AAOs序列;利用得到的香蕉AAOs序列构建新的HMM 模型,利用新的HMM 模型从A 基因组中搜索鉴定MaAAOs基因。 使用保守结构域数据库(http:/ /www.ncbi.nlm.nih.gov/cdd/)和PFAM 数据库(http:/ /pfam.sanger.ac.uk/)验证得到的MaAAOs基因。 利用下载得到的AtAAOs 和水稻OsAAOs 蛋白序列,以MEGA-X 中的MUSCLE 方法进行序列比对,使用Neighbor-joining 法构建系统发育树,Bootstrap 值设置为1 000。
1.4 香蕉AAO 基因家族的蛋白质特性和序列分析
通过ExPASy 数据库(http:/ /expasy.org/)对分子质量和等电点等理化性质进行预测。 利用MEME 软件和InterProScan 数据库对蛋白结构域序列进行鉴定。 采用GSDS 数据库对基因结构进行分析(http:/ /gsds.cbi.pku.edu.cn/)。
1.5 转录组分析
RNA 测序中的RNA 提取、文库制备和测序等工作均由美吉生物技术有限公司(中国上海)完成。 RNA-seq 分析样本的收集过程参考前人的研究[17]。 每个样本包含两个生物重复序列。测序平台为Illumina GAII (Illumina, San Diego,CA, USA)。 FASTX(http:/ /hannonlab.cshl.edu/fastx_toolkit/)和FastQC(http:/ /www.bioinformatics.babraham.ac.uk/projects/fastqc/)用于删除接头序列和低质量序列。 通过Tophat V.2.0.10 将粉蕉样本的clean reads 与香蕉基因组进行比对[18],使用Cufflinks 进行转录组组装[19]。 基因的表达值使用FPKM 值表示。 使用DEGseq 工具鉴定差异表达基因(DEGs) (log2-based fold change>1;log2-based fold change<-1)。
2 结果与分析
2.1 MaAAOs 基因的鉴定
利用香蕉AAO基因序列的保守结构域构建HMM 模型,从香蕉A 基因组中鉴定得到了3 个MaAAOs基因,分别命名为MaAAO1、MaAAO2、MaAAO3(表1),其氨基酸残基数量分别为1 365、1 393、1 399 个,编码蛋白的分子量范围为15.05~15.26 ku,等电点范围是6.59 ~6.62。 为分析MaAAOs 的进化关系,分别下载了水稻和拟南芥AAO基因家族的蛋白质序列(表1),采用NJ 法构建了系统发育树(图1)。 可见,所有AAO 蛋白可以分成两类,MaAAO2 和MaAAO3 与所有AtAAOs及大部分OsAAOs 聚在一个亚类,而MaAAO1 则与两个OsAAOs 聚成一个亚类。

图1 AAO 家族蛋白系统进化树

表1 AAO 基因信息
2.2 MaAAOs 基因家族的结构域和基因结构分析
利用MEME 数据库从MaAAOs基因中鉴定得到10 个保守结构域,并用InterPro 数据库进行了注释。 由结果(图2、表2)可见,3 个MaAAOs基因表现出类似的结构域组成,仅MaAAO1缺少了Motif8;除了Motif7,其余9 个Motif 都含有结构域IPR016208,其功能被注释为醛氧化酶/黄嘌呤脱氢酶。 随后对MaAAOs基因结构进行分析,MaAAO2和MaAAO3有类似的基因结构,都有10个内含子;而MaAAO1的内含子则是14 个(图3)。 表明相同聚类有类似的结构域组成和基因结构,与系统发育树的分析结果相一致。
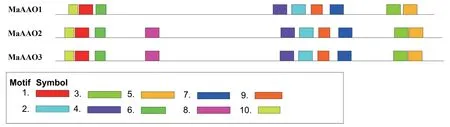
图2 MaAAOs 基因结构域

图3 MaAAOs 基因的结构分析

表2 MaAAOs 基因结构域的注释
2.3 MaAAOs 在粉蕉不同组织中的表达
如图4A 所示,粉蕉根中MaAAO1和MaAAO3基因高表达(FPKM>5),叶中3 个MaAAOs基因都表现出高表达,而果实(80 DAF)中则只有MaAAO1表现出高表达。 3 个MaAAOs基因中,只有MaAAO1在粉蕉根、叶和果实中都呈现出高表达。
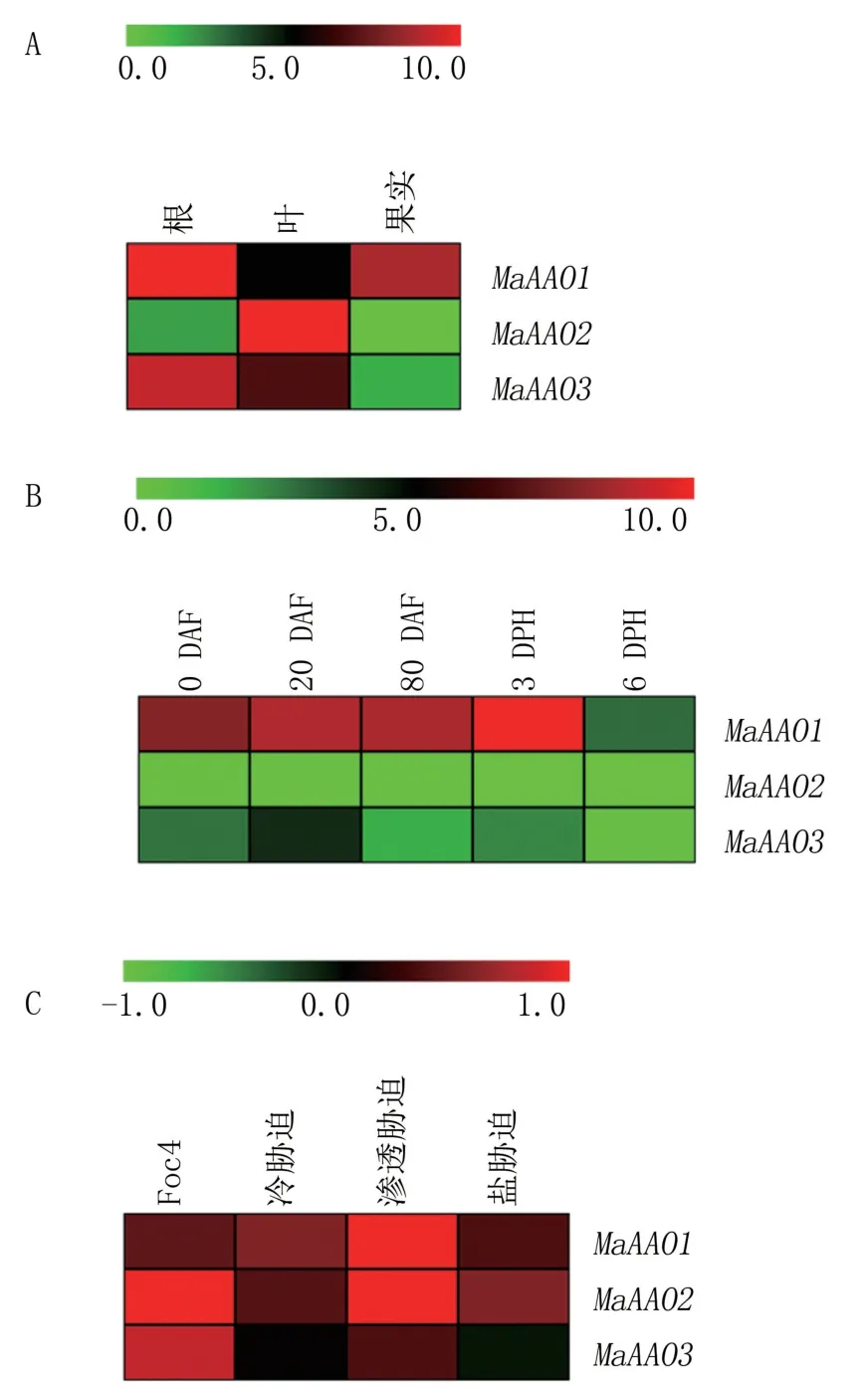
图4 MaAAOs 基因在香蕉不同组织(A)、果实不同发育阶段(B)、不同逆境处理(C)中的表达分析
2.4 MaAAOs 在粉蕉果实不同发育阶段中的表达
为明确MaAAOs基因在香蕉果实发育过程中的功能,对其在不同发育阶段果实中的表达情况进行了分析,结果(图4B)显示,只有MaAAO1在果实发育早期(0 DAF 和20 DAF)和后期(80 DAF、3 DPH)中表现出高表达(FPKM>5),且以3 DPH 果实中的表达量最高;MaAAO2在果实发育整个阶段的表达都极低;MaAAO3在果实各发育阶段的表达水平相比MaAAO2要高,但除20 DAF外均没有达到高表达。 因此推测MaAAO1可能在果实发育过程中发挥着重要作用。
2.5 MaAAOs 在不同逆境处理下的表达
为分析MaAAOs基因在粉蕉应对逆境胁迫中的功能,设置生物和非生物胁迫处理,分析3 个MaAAOs基因在粉蕉植株根中的表达情况,结果(图4C)显示,在Foc4 处理下,MaAAO2基因表现出上调(log2-based fold change>1);在渗透胁迫下,MaAAO1和MaAAO2基因表现出上调;在冷和盐胁迫下,3 个基因均未表现出明显的上调表达;MaAAO3基因在所有逆境处理中都没有表现出显著变化。
3 讨论
香蕉既是一种重要的热带和亚热带水果,也是全球130 多个国家的主粮,但其研究进展相比其它作物要慢[20]。 ABA 在植物的生长发育和生物/非生物胁迫响应中起着重要作用[21],而AAO是ABA 合成途径中的重要合成酶,但香蕉AAO基因家族的情况仍不清楚。 本研究从香蕉A 基因组中鉴定出3 个MaAAOs基因,保守结构域分析证明这3 个基因属于AAO家族,并根据系统发育树将其分为两个亚类, 其中MaAAO2和MaAAO3聚为一类。 拟南芥的AAO基因数量是4个[9],水稻中可能是5 个[10],小麦中是3 个[11],数量均较少,表明AAO 蛋白可能属于小基因家族编码的蛋白质。
香蕉果实的发育和成熟过程决定着果实的品质和产量[14]。 研究表明,ABA 信号参与了果实的生长发育并影响着果实的成熟过程和最终品质;未成熟水果中的内源ABA 含量通常较低,施加外源ABA 能促进果实成熟及果肉软化;果实成熟过程中ABA 合成相关基因的表达上调导致内源ABA 大量积累[22]。 这些结果表明ABA 在水果成熟过程中发挥着重要作用。 在本研究中,不同MaAAOs基因在粉蕉果实不同发育阶段表现出不同的表达模式,MaAAO1基因在早期和晚期都表现出高表达,而MaAAO2和MaAAO3几乎不表达;此外,MaAAO1在粉蕉叶、根、果实中均表现出高表达,推测MaAAO1基因在香蕉果实发育和成熟过程中可能具有重要作用。
香蕉生长过程中常会遇到干旱、盐、寒冷以及枯萎病菌感染等非生物和生物逆境,对果实品质及产量造成影响[15-16]。 在拟南芥中,AtAAO3和AtAAO1基因表达明显受到干旱胁迫的诱导[9,23];在拟南芥中过表达花生AhAAO2基因也能显著提高植株抵抗干旱胁迫的能力[24]。 本研究发现,MaAAO1和MaAAO2基因受渗透胁迫诱导上调表达,但受冷和盐胁迫的影响很小;MaAAO3基因的表达在3 种胁迫下均无显著变化。 表明MaAAO1和MaAAO2基因可能在香蕉响应干旱胁迫中发挥作用。 香蕉的种植生产也受到香蕉枯萎病的严重影响。 有研究表明ABA 能负向调控水杨酸(SA)介导的病原体反应,例如,提高植株中ABA 的含量,会显著促进细菌的生长[25]。 在本研究中,仅MaAAO2基因的表达显著受到Foc4 处理的诱导,表明这个基因可能参与了响应Foc4 侵染的过程。
4 结论
本研究从香蕉A 基因组中鉴定得到了3 个MaAAOs基因,经系统发育分析、蛋白结构域和基因结构分析,确定属于AAO基因家族。MaAAOs基因参与了香蕉的生长发育、果实成熟和对生物/非生物胁迫的响应等过程。 其中,MaAAO1基因在果实发育早期和成熟阶段都表现出高表达;MaAAO1和MaAAO2基因对渗透胁迫有响应;MaAAO2基因的表达被Foc4 诱导,可能响应该病菌的侵染。

