UTMD 联合抑制CREB基因促进动脉粥样硬化斑块稳定性的实验研究
邱勤,徐萍,刘旭东
随着人们生活水平的提高和饮食习惯的改变,各种心肌梗死和缺血性脑卒中等致死性疾病正在逐渐年轻化且发病率显著上升[1]。动脉粥样硬化(AS)易损斑块的破裂与心脑血管疾病的发生密切相关[2]。研究发现,炎症因子、基质金属蛋白酶(MMPs)和血管内皮生长因子(VEGF)在斑块的形成和促进不稳定性中起着重要的作用;因此,抑制上述因子是增加斑块稳定性的重要方法[3]。环磷腺苷效应元件结合蛋白(CREB)是细胞内第二信使的转录因子,参与炎症因子、斑块内新生血管和MMP 的调节[4-7],调节CREB的表达有望成为稳定斑块治疗AS的新方法。超声靶向微泡破坏技术(UTMD)是一种新型的基因转染方法,具有安全、无创、靶向性和可重复使用性好等优点,已广泛应用于基因和药物的靶向治疗[8]。本研究将UTMD 与RNA 干扰技术相结合,构建针对CREB 的shRNA,以超声微泡为载体释放shRNA后用超声辐照兔颈动脉斑块组织,观察其是否能通过抑制颈动脉斑块中白介素(IL)-17A、MMP-2、MMP-9 和VEGF的表达,达到减促进斑块稳定性的目的,报道如下。
1 资料与方法
1.1 动物模型的建立及分组 健康雄性新西兰兔(4~5月龄)20 只购自宁波大学动物实验中心,体质量2.0 ~2.5 kg。完全随机分为空白组(n=5),模型组(n=5),对照组(单纯CREB 质粒组,n=5)和治疗组(UTMD 联合CREB 质粒组,n=5)。用液氮损伤右侧颈总动脉(RCCA)后,采用含10%胆固醇的高胆固醇血症饮食喂养10 周建立AS 模型,食物摄入量限制在100 g/d。本研究中的新西兰兔于宁波大学实验动物研究中心饲养,动物实验按照宁波大学《动物实验规定》进行。研究结束后,通过耳缘静脉(150 mg/kg)注射戊巴比妥钠对实验动物实施安乐死。本研究经宁波大学实验动物伦理委员会审批通过(申请编号:12698)。
1.2 超声仪器及方法 彩色多普勒超声诊断仪选用西门子Accuson S2000 超声诊断仪,探头频率为6 ~18 MHz,用于斑块的二维测量;麦瑞Resona7S 超声诊断仪,探头频率为5 ~14 MHz,用于斑块的弹性成像和造影;融海低功率聚焦超声实验装置用于超声辐照。分别在第0、56 和70 天对仰卧位兔子的右侧颈总动脉进行了B-型超声、实时剪切波弹性成像(SWE)和超声造影检查,评估斑块的形状、大小、回声、硬度、微血管密度和颈总动脉内膜-中层厚度(CIMT)。同时治疗组给予超声辐照(输出频率650 kHz、输出能量2.5 W/cm2、辐照时间3 min)。
1.3 超声微泡和质粒转染 GV102 质粒(6.4 kb)购自吉凯基因(中国上海),将质粒转化为大肠杆菌TOP10 感受态细胞(吉凯基因,中国上海),并根据质粒提取试剂盒(中国北京天根)说明书提取纯化。通过分光光度法(1 mg/ml)测量所得质粒DNA 的浓度,并在260 nm处测量质粒DNA的吸光度。OD260/OD280 在1.8 ~2.0 之间表明质粒DNA 中没有污染,然后将产物保存于-20 ℃。声诺维购自Bracco Imaging(意大利米兰)。用0.9%氯化钠注射液制备声诺维微泡悬浮液,然后倒置或振动使微泡以(2 ~5)×108/ml 的密度和5 mg/ml 的浓度均匀分布。实验前,将5 ml 声诺维与1 ml 质粒DNA 溶液(含1 mg质粒)混合,在4 ℃下保存15 min 后,通过耳静脉将混合物注射入AS 模型兔,然后对AS 模型兔右侧颈动脉斑块处进行3 min的超声脉冲辐照(2.5 W/cm2)。
1.4 血脂测定 新西兰兔禁食24 h后,通过耳缘静脉抽取血液样本后放入普通干燥试管中。采用自动生化分析仪分别测定第0 和56 天的血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDLC)和高密度脂蛋白胆固醇(HDL-C)水平。
1.5 血清超敏C反应蛋白(hs-CRP)和IL-17A测定分别于第56 和70 天抽取3 ml 新西兰兔空腹静脉血,放入普通干燥试管中,立即行乳胶增强免疫比浊测定,测量血清hs-CRP 和IL-17A 水平。
1.6 蛋白质印迹分析 获得组织提取物并在12%SDS-聚丙烯酰胺凝胶上分离蛋白质,转移到PVDF膜上。用5% BSA 封闭后,将膜与适当稀释的特异性一抗[抗CREB 抗体,抗VEGF,抗MMP-9,抗MMP-2 和GAPDH(购自上海爱必信)]在4 ℃下共孵育过夜。然后,将膜与辣根过氧化物酶标记的二抗(博斯特,中国武汉)一起孵育后,使用增强型化学发光试剂可视化蛋白质条带。
1.7 逆转录和实时荧光定量PCR(qRT-PCR)分析使用Trizol 试剂从新西兰兔右侧颈总动脉中提取总RNA,使用分光光度法测量总RNA 量,并使用逆转录试剂盒将总RNA 逆转录为cDNA。RNA 定量是通过qRT-PCR 进行的,引物如下:-actin(正义链:5’-ATCAGCAAGCAGGAGTAT-3’,反义链:5’-CAATCTCGTCTCGTTTCTG-3’),兔CREB(正义链:5’-TCAGCTCCTCAATCAGCGTCT-3’,反义链:5’-AGTTGTTATGGCTTCCTCCCC-3’),兔MMP-9(正义链:5’-CCACCACAACATCACGTACTGGA-3’,反义链:5’-ACTGGATGACAATGTCTGCGTCC-3’),兔MMP-2(正义链:5’-CTTCGTGTAGGTGTAAATGGG- 3’,反义链:5’-TTCCTGGGCAACAAGTATGAG-3’)和兔VEGF(正义链:5’-GGTGACGTTGAACTCCTCGGT-3’,反义链:5’-GGAGACAATAAACCCCACGAA-3’)。qRT-PCR 数据的分析通过比较2- CT方法进行。
1.8 组织学和免疫组织化学 切除新西兰兔右侧颈总动脉的组织块,在4%多聚甲醛中固定48 h,嵌入石蜡中,切片用苏木精/伊红(HE)染色。使用的一抗为抗CREB 抗体、抗MMP-9、抗MMP-2 和抗-VEGFR 抗体,按1∶500 稀释。二抗为辣根过氧化物酶-山羊抗-兔IgG。二氨基联苯胺用于产生信号。切片用苏木精轻轻复染。
1.9 统计方法 实验数据通过Graphpad Prism 6.0软件进行分析,计量资料以均数±标准差表示,两组比较用独立样本t 检验和Menn-Whitney 检验,多组比较用单因素方差分析和Kruskal-Wallis检验,多重比较用LSD-t 和Dunnet t 检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 建立AS动物模型 喂养10 周后,模型组体质量高于空白组(t=12.34,P <0.05),见图1a。模型组TC、HDL-C 和LDL-C 显著增加,特别是血清TC 和LDL-C 浓度与空白组相比分别上调了15 和12 倍,见图1b。模型组RCCA 中可观擦到斑块回声形成(图1c),同时,与空白组相比,模型组的颈动脉内中膜厚度(CMIT)显著增加(t=10.19,P <0.05),见图1d,证明AS 动物模型建立成功。
2.2 4组新西兰兔CREB mRNA 水平比较 4组CREB mRNA水平差异有统计学意义(F=14.15,P<0.05)。其中治疗组CREB mRNA 水平和表达显著低于模型组和对照组(t=4.88、7.50,均P <0.05);模型组和对照组的CREB mRNA 水平和表达均较高,但两组间差异无统计学意义(P >0.05),见图2。
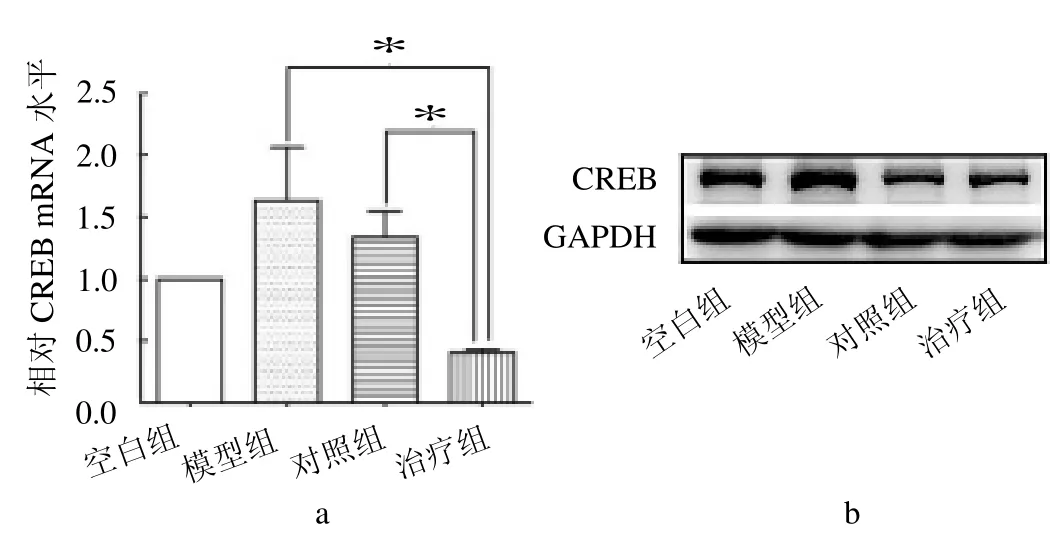
图2 qRT-PCR 和Western blot 评估转染效率
2.3 4组新西兰兔hs-CRP、IL-17A 水平比较 4组hs-CRP、IL-17A 水平差异有统计学意义(F=107.30、73.81,均P <0.05)。其中模型组hs-CRP 和IL-17A水平高于其他组(t≥13.51,均P <0.05);治疗组hs-CRP 和IL-17A 水平低于对照组(t=2.50、7.18,均P <0.05),见图3。
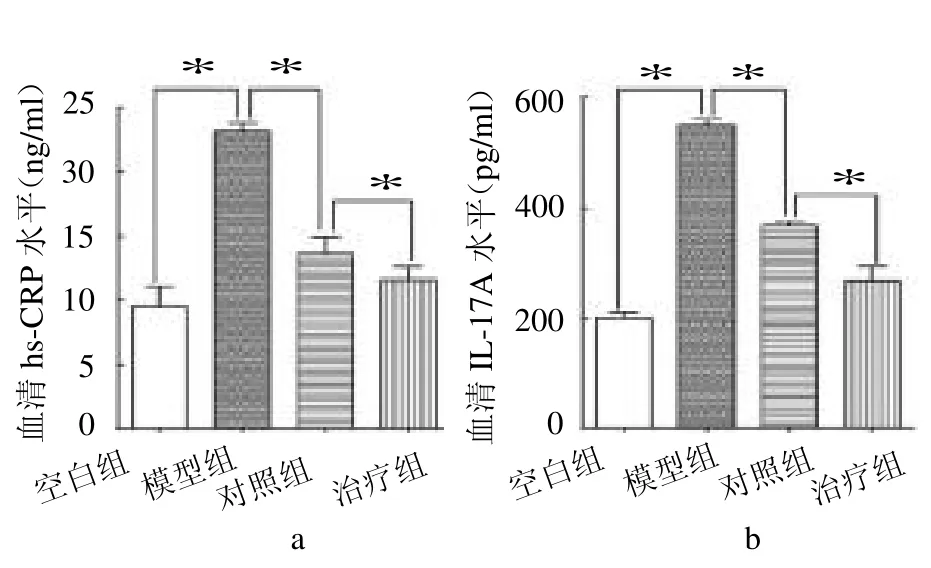
图3 4组血清hs-CRP 和IL-17A 水平比较
2.4 4组新西兰兔VEGF、超声造影峰值强度和杨氏模量值水平比较 4组VEGF mRNA 差异有统计学意义(F=213.61,P <0.05),其中模型组VEGF mRNA 水平高于其他组(t≥13.10,均P <0.05);治疗组VEGF mRNA 水平低于对照组(t=28.50,P <0.05),见图4a、b。治疗组斑块组织的杨氏模量值明显高于其他两组(t=7.96、4.60,均P<0.05),见图4c、d;而治疗组斑块的超声造影峰值强度低于模型组和对照组(t=8.54、5.54,均P <0.05),见图4e、f。治疗组VEGF 表达阳性细胞数明显低于模型组和对照组,见图4g。
2.5 4组新西兰兔MMP-2、MMP-9 水平比较 4组MMP-2 和MMP-9 的mRNA 水平差异有统计学意义(F=93.78、41.66,均P <0.05),其中模型组MMP-2 和MMP-9 的mRNA 水平高于其他组(t≥6.72,均P <0.05),治疗组MMP-2 和MMP-9的mRNA 水平低于对照组(t=4.95、4.59,均P <0.05),见图5a ~d。与模型组和对照组相比,定位于细胞质中的MMP-2 和MMP-9 在治疗组中的表达显著降低,见图5e、f。
3 讨论
AS 不稳定斑块的形成与以下三个方面密切相关:(1)炎症。炎症是引起斑块不稳定的关键因素,斑块破裂及糜烂几乎与炎症共存,在斑块的不稳定状态时炎症总是上调的[9-11]。(2)MMP。斑块纤维帽的主要成分是细胞外基质,MMP是降解细胞外基质最重要的酶类;不稳定斑块的MMP 活性增加,纤维帽强度减弱,斑块变得易破裂[12-14]。(3)新生血管。活化的巨噬细胞可产生VEGF,导致内膜新生血管的形成;新生血管主要分布在斑块的肩部和基底部,成为炎性细胞和脂质成分进入斑块的通路;此外,新生血管发育不完善基底膜不完整,故易于破裂和出血,导致斑块的不稳定[15]。因此寻找能抑制以上三方面的靶点并进行干预来促进斑块的稳定性是本实验的研究基础。
CREB是细胞中第二信使的转录因子。Westbom等[16]发现CREB 可以上调炎症因子,参与体内的炎症过程。有研究报道,CREB 可参与某些病理生理过程中MMP 的调节[17]。还有研究发现CREB 与VEGF 的表达密切相关[4]。这提示CREB 可通过调控炎症因子、MMP和VEGF的表达促进斑块的不稳定性。本研究通过建立新西兰兔AS 斑块模型并在此基础上进行了CREB-shRNA 质粒的转染。结果发现,CREB-shRNA 质粒可沉默AS 斑块模型血清中炎症因子hs-CRP 和IL-17A 表达;同时AS 斑块中MMP-2、MMP-9 及VEGF 的表达也随之下调;超声弹性成像显示斑块的杨氏模量值上升,超声造影显示斑块的造影峰值强度下降。这证实了CREB 对斑块不稳定性的促进作用,沉默CREB 可增加斑块的稳定性。
UTMD治疗性超声已显示出其作为靶向破坏肿瘤脉管系统的巨大潜力。研究较多且具有潜力的策略是用治疗剂加载微泡,在超声治疗区域内靶向破坏微泡时能够局部释放有效载荷。该技术正在探索用于局部基因转染、靶向药物递送和释放、血脑屏障破坏和溶栓等方面。本研究微泡与CREB 质粒结合作为靶向治疗的是一种具有潜力且可行性高的新方法。
综上所述,用UTMD 递送和靶向CREB 质粒释放比单纯的CREB 质粒转染可以更有效地沉默CREB 基因,更能有效降低CREB、VEGF、MMP-2、MMP-9 和炎症因子hs-CRP、IL-17A的表达,且拥有更高的杨氏模量值和更低的超声造影峰值强度,达到稳定斑块的目的。
利益冲突 所有作者声明无利益冲突
作者贡献声明 邱勤:论文撰写、统计学分析、数据整理;刘旭东:实验操作、数据整理;徐萍:研究指导、论文修改、经费支持

