超声辅助醇沉法制备淀粉纳米颗粒同步包埋叶黄素
史永桂,姚先超,焦思宇,刘 鑫,廖如杏,林日辉
(广西民族大学化学化工学院 广西多糖材料与改性重点实验室 林产化学与工程国家民委重点实验室广西林产化学与工程重点实验室/协同创新中心 南宁 530006)
叶黄素,分子式C40H56O2,是胡萝卜素中的一种,主要存在于绿色蔬菜和万寿菊中,具有多种生物活性功能,是天然的食品着色剂和抗氧化剂[1]。在预防动脉粥样硬化、癌症和神经性损伤以及延缓衰老等方面具有重要的影响[2-3]。Fred等[4]研究发现,叶黄素可激活人视网膜色素上皮细胞的转录因子Nrf2,有效预防白内障等眼疾。马晓雨[2]在大米蛋白与叶黄素构建的纳米级输送体系中发现,每日叶黄素摄入量在18 mg,不会产生任何不良反应且无任何毒副作用,这为叶黄素的体内给药提供了可靠的理论参考。Wallace等[5]也发现,人体口服10 mg/d 叶黄素,可显著降低老年黄斑的形成,可见叶黄素在医药和食品添加剂方面的应用可行。然而,叶黄素是一种长脂链、含两个酮环的分子,水溶性差,对给药及人体有效吸收带来困难;且分子中具有多个共轭双键,易被氧化破坏,稳定性差[6]。为了进一步提高叶黄素在医药、食品等领域的应用,研发适宜载体对叶黄素进行包埋或负载是有效的技术途径,特别是使用生物相容性好、可降解的纳米级天然产物材料作为载体[7]。
淀粉作为一种天然的高分子材料,在药物载体方面有广泛的应用,其中纳米淀粉(Nanometer starch,SNPs)是将天然淀粉经物理或化学方法制备成颗粒小于1 μm 的淀粉颗粒,因具有较小的粒径和较大的比表面积且能在药物传递系统中表现出良好的药物结合能力和有效释放吸收而受到关注[8]。刘占军等[9]制备了SNPs,并与疏水性药物虾青素(类胡萝卜素)混合制成虾青素纳米粒,研究虾青素纳米粒在不同的温度、pH 值、不同的光照条件下虾青素的稳定性,结果表明,在不同条件下虾青素的稳定性有所提高,其中光照条件下的保留率相比丙酮溶液提高了58.1%。寇宗亮等[10]将SNPs 置于姜黄素(疏水性药物)的醇溶液中,通过物理吸附制成SNPs-姜黄素,结果表明:相比姜黄素原料药,SNPs-姜黄素在5 h 的缓释由95%降至15%,具有明显的缓释效果,且提高了姜黄素的生物活性。Narayanan等[11]采用交联沉淀法制备平均粒径为160 nm 的羟乙基淀粉纳米颗粒,在沉降过程包埋两种疏水性分子——吲哚美辛和布洛芬,结果发现包埋后的纳米颗粒在体外血液/细胞环境中均表现出比原料药更好的细胞通透性,表明淀粉纳米载体在控制药物传递中的潜力。综上可知,纳米级淀粉颗粒在食品和药物输送体系中能有效提高疏水性分子的生物利用度和稳定性。
醇沉法操作简单,将糊化淀粉乳通入乙醇溶液,在溶剂置换过程中经搅拌剪切可产生SNPs,是制备SNPs 的主要方法之一[12]。冯涛等[13]对淀粉糊化过程的研究表明,糊化后淀粉多聚糖链由双螺旋结构解旋成一种具有疏水性的、空腔和亲水性外部的单螺旋结构,这种疏水性空腔可与疏水性分子形成稳定的包合物,这是淀粉负载疏水性分子的结构基础。Arvisenet等[14]将己酸乙酯和乙酸异戊酯芳香化合物加入糊化淀粉中,研究其对风味化合物的作用,结果表明糊化的淀粉可与芳香化合物形成包合物,对芳香化合物的保留有显著得影响。Zhu等[15]研究了糊化后淀粉与小分子萘酚的络合作用,结果表明:直链淀粉含量与萘酚的络合指数呈正相关。Tan等[16]研究了SNPs 在乙醚溶液中对疏水性药物芘的负载过程,荧光光谱分析表明芘逐渐在SNPs 表面转移向内部,说明SNPs 内部存在极性较低的区域,与芘发生较强的疏水相互作用。由此可初步判断,糊化后淀粉颗粒中的淀粉分子链和SNPs 的内部非极性区域对疏水性药物具有一定的包埋和负载作用。本文拟在SNPs 沉降过程中同步完成对疏水性药物叶黄素的包埋。之前,本课题组已成功进行SNPs 对小分子疏水性药物山奈酚的包埋负载,包埋率可达62.94%[17]。为进一步研究SNPs 对长链大分子疏水性药物的包埋负载,本文选择叶黄素为模型分子,在SNPs 制备过程中同步完成对叶黄素的包埋,并对SNPs-叶黄素进行表征,为SNPs 用于疏水性药物的负载提供参考。

图1 醇沉法同步包埋叶黄素原理图Fig.1 Schematic diagram of simultaneous embedding of lutein by alcohol precipitation method
1 材料与方法
1.1 材料与试剂
木薯淀粉(纯度95%以上,直链淀粉含量10%),食品级,广西岑溪市三角淀粉责任有限公司;叶黄素BR(纯度80%),阿拉丁试剂有限公司;1,1-二苯基-2-三硝基苯肼BR,上海源叶生物科技有限公司。
1.2 设备与仪器
超声波细胞粉碎机(JY92-IIN),宁波新芝生物科技股份有限公司;冷冻干燥机(FD-A10N-50),上海皓庄仪器有限公司;紫外-可见分光光度计(UV23II),上海天美科学仪器有限公司;傅里叶变换红外光谱仪(Nicolet is10),美国赛默飞世尔科技公司;X-射线衍射仪(MiniFlex600),日本理学公司;场发射扫描电子显微镜(SUPRA 55 Sapphire),德国卡尔蔡司公司;纳米激光粒度及电位分析仪(Nicomp380ZLS),美国PSS 粒度仪公司。
1.3 方法
1.3.1 SNPs-叶黄素制备 参考Hu等[18]配制为质量分数3%的淀粉分散液,置恒温磁力搅拌器中以冷凝器进行回流,在90 ℃恒温1 h 至淀粉完全糊化。将糊化淀粉液于超声波细胞粉碎机中以功率600 W 超声处理10 min,降低黏度。将低黏度淀粉液8 000 r/min 离心5 min,取上清液,即淀粉乳。在超声波运行条件下,将1,3,5,10 mL 叶黄素溶液(质量浓度0.5,1.0,2.0,3.0 mg/mL )分别通入处于超声波细胞粉碎机下的10 mL 淀粉乳中,得叶黄素与SNPs 混合液。8 000 r/min 离心5 min,取沉淀,冷水冲洗,置-20 ℃冰箱冷冻10 h,最后于-45℃冷冻干燥至恒重,制得SNPs-叶黄素颗粒。
参考上述步骤分别制备4%,5%,6%淀粉乳溶液,将5 mL 叶黄素溶液(0.5,1.0,2.0,3.0 mg/mL)分别通入10 mL 淀粉乳中,得叶黄素与SNPs混合液。离心,冷冻干燥至恒重,得SNPs-叶黄素颗粒。
1.3.2 叶黄素含量分析 采用紫外分光光度计法波长445 nm 处SNPs 对叶黄素的包埋量[19]。以叶黄素质量浓度(mg/mL)为横坐标X,吸光度为纵坐标Y,标准曲线为Y=1.13X-0.037(R2=0.9985)。取1.3.1节制备的叶黄素与SNPs 的混合溶液,12 000 r/min 离心5 min,取上清液,量取体积V1(mL)。用紫外分光光度计测定吸光度,计算得到叶黄素上清液质量浓度C1(mg/mL),计算被包埋的叶黄素质量为M叶黄素(g),称量冷冻干燥至恒重的SNPs-叶黄素质量为M(g)。包埋量计算公式:
1.3.3 场发射扫描电镜观察(SEM)用毛细管取少量的SNPs-叶黄素均匀撒到双面导电胶上,轻轻吹去多余的浮样,置真空镀膜仪下喷镀钯金,制成电镜观察样品,在扫描电镜下20 000 倍拍照观察。
1.3.4 粒径检测(DLS)取适量样品溶于冷超纯水中制得混合悬浊液,在冰浴条件下,将混合液在超声波细胞粉碎机中超声分散10 s。取适量分散液放入比色皿中,设定仪器参数,温度25 ℃、水折射率1.33、淀粉折射率1.53,在此条件下测量粒度[20]。
1.3.5 X-射线衍射检测(XRD)用XRD 测定结晶性。设置测定条件:电压40 kV,电流20 mA,使用单色Cu-kα 射线和Ni 片滤波,以0.02°为扫描步长,以4°/min 为扫描速率,以4°~40°为2θ 的扫描范围[21]。
1.3.6 傅里叶红外光谱检测(FT-IR)将SNPs-叶黄素、叶黄素、SNPs 样品与KBr 按1∶50 比例均匀研磨,取适量混合粉末压成透明薄片,用红外光谱仪在400~4 000 cm-1扫描范围测定红外光谱。
1.3.7 碘-淀粉络合物UV 分析 为研究叶黄素与淀粉形成的复合物,根据复合指数(CI)评价淀粉与碘的结合能力强弱[22]。在90℃,将SNPs-叶黄素在去离子水中糊化成质量分数0.2%的淀粉乳。冷却至室温后取1 mL 淀粉乳,用去离子水定容25 mL,搅拌均匀,8 000 r/min 离心5 min,得上清液。将10 mL 上清液和0.1 mL 碘液(质量分数2.0% KI 和1.3% I2分散到去离子水中)混匀,静置5 min。以SNPs 为对照组,在690 nm 处测定吸光值,在300~900 nm 范围扫描波长。CI 计算公式:
式中:ASNPs——SNPs 吸光度;ASNPS-叶黄素——SNPs-叶黄素吸光度。
1.3.8 抗氧化活性的测定 根据先前报道[23]的方法并稍作修改,以对DPPH 自由基清除率评价SNPs-叶黄素的抗氧化活性。采用无水乙醇配制50 μg/mL DPPH 溶液。取10 mg SNPs-叶黄素和0.5 mL 1 mg/mL 叶黄素溶液加入10 mL DHHP 溶液中,在血液混凝器上避光混合10,20,40,60,120 min。离心取上清液,用紫外分光光度计波长515 nm 处测定样品的吸光度。以不加DPPH 的SNPs-叶黄素的乙醇溶液作对照组,DPPH 乙醇溶液作空白。计算DPPH 的自由基清除率D(%):
式中:A空白——DPPH 乙醇溶液吸光度;A样品——SNPs-叶黄素吸光度;A对照——未加DPPH 的SNPs-叶黄素的乙醇溶液。
1.3.9 贮藏稳定性的测定 SNPs-叶黄素在冷藏(5 ℃)、室温(25 ℃)、升温(50 ℃)条件下分别避光储存1~30 d。定时取0.5 g 不同贮藏条件下的SNPs-叶黄素分散在10 mL 去离子水中,加入5 mL 1 mol/L NaOH 混合,在55 ℃下持续搅拌1 h。将混合液冷却至室温,用1 mol/L HCl 中和至pH 7.0。向中性溶液中加入10 mL 乙酸乙酯,持续剧烈搅拌萃取叶黄素,直至水相为无色,分离上层得叶黄素乙酸乙酯溶液。将上层叶黄素乙酸乙酯溶液与5 mL 饱和NaCl 溶液混合去除乙酸乙酯中微量水分,分层即得叶黄素乙酸乙酯溶液[24]。按照1.3.2 节步骤,用紫外分光光度计计算叶黄素含量。
1.3.10 数据分析 所有试验重复3 次,使用Microsoft Excel 2010 对数据统计和线性相关进行分析。采用Origin 2018 绘图,Photoshop 对图片进行排版。
2 结果与分析
2.1 SNPs-叶黄素制备
表1 显示淀粉纳米颗粒对叶黄素的包埋率和包埋量与叶黄素溶液体积和浓度的关系。SNPs-叶黄素包埋量随叶黄素浓度的增加而增加,这是因为淀粉分子链的单螺旋内腔与叶黄素会发生络合作用,在沉降体系中,随叶黄素浓度的升高,叶黄素分子与淀粉分子链空腔结合的几率增大,更多的叶黄素分子与空腔结合,生成的络合物量增加[22]。此外,体系内较多游离的叶黄素分子也与淀粉分子链交联在一起,随沉降过程被包裹在淀粉纳米颗粒内部,使淀粉纳米颗粒对叶黄素的包埋量提高[25]。当叶黄素质量浓度增到2 mg/mL 时,包埋量增加不明显,此时,淀粉分子链与叶黄素分子的结合位点趋于饱和,包埋量达到最高(63.86 mg/g)。相比Fu等[24]研究淀粉纳米颗粒对叶黄素的最高包埋量为13.2 mg/g 显著提高。而包埋率随叶黄素浓度的增加而减小,这归结于乙醇溶液体积一定,可沉降淀粉的质量保持恒定,淀粉沉降体系中淀粉分子链与叶黄素的结合位点保持恒定,因此在高浓度叶黄素溶液中,沉降过程中较多的叶黄素溶解在乙醇中,导致叶黄素包埋率下降。

表1 3%淀粉乳对叶黄素的包埋量和包埋率Table 1 The embedding amount and embedding rate of lutein in 3% starch milk
值得注意的是,叶黄素的酮环结构决定其疏水性较强,难溶于水,可溶于乙醇,因此叶黄素醇溶液与淀粉乳体积比对包埋量也有较大的影响[26]。当叶黄素醇溶液体积增加时,包埋量逐渐降低,归结于在乙醇溶液通入淀粉乳中时,增加乙醇溶液使淀粉分子链对叶黄素的络合能力降低,形成的络合物减少,且淀粉沉降时较多的叶黄素溶解在乙醇中,不能将其包裹在颗粒内部,包埋量下降。然而,随着乙醇体积的增加,沉降体系中更多的淀粉纳米颗粒沉降出来,提高了叶黄素包埋率。
在沉降过程中,较低质量分数(3%)的淀粉乳,虽然包埋量较高,但是SNPs-叶黄素得率和叶黄素包埋率并不理想,为获得较高的SNPs-叶黄素得率,采用提高淀粉乳浓度的方法。SNPs-叶黄素的包埋率和包埋量与淀粉乳浓度的关系见表2。SNPs-叶黄素中叶黄素包埋量随淀粉乳浓度的增大而减小,这是因为沉降体系中较高浓度的淀粉乳沉降时,淀粉纳米颗粒中叶黄素的含量下降,降低了SNPs-叶黄素中叶黄素的含量。而较高浓度的淀粉乳,使更多的淀粉分子链与叶黄素分子结合,更多的叶黄素随着淀粉纳米颗粒的沉降被包埋到颗粒内部,使SNPs-叶黄素对叶黄素的包埋率显著提高。当淀粉乳质量浓度5%时包埋率提高至62.45%,而淀粉乳浓度再升高包埋率不再明显提高。此时,部分叶黄素存留乙醇中,而淀粉分子链亲和力不足以将叶黄素从乙醇中夺取并置换出来,包埋率增加不明显。

表2 不同淀粉乳浓度对叶黄素包埋量和包埋率影响Table 2 The influence of different starch milk concentration on the embedding amount and embedding rate of lutein
综上所述,通过优化叶黄素浓度、淀粉乳浓度和叶黄素乙醇溶液添加量,可以制备出较高的包埋量和较高的包埋率的SNPs-叶黄素纳米颗粒,提高叶黄素的利用率。
2.2 SEM 分析
木薯淀粉颗粒主要呈圆形和少许不规则形,颗粒的尺寸为微米级[27]。由图2 可知,经沉降法制备的SNPs 和SNPs-叶黄素的形貌和尺寸改变较大。形成纳米级别的淀粉颗粒,颗粒均保持圆形或椭圆形,尺寸分布较均匀。对比SNPs 可知,SNPs-叶黄素颗粒仍具有良好的结构完整性,添加表明叶黄素不会影响沉降过程中淀粉颗粒的形成。这与Yuan等[28]在研究玉米醇溶蛋白纳米颗粒对叶黄素包埋时,叶黄素添加量对蛋白纳米颗粒的形貌和结构没有影响的结果相似。

图2 SNPs 和SNPs-叶黄素的SEM图Fig.2 SEM images of SNPs and SNPs-lutein
2.3 DLS 分析
图3 为SNPs 和SNPs-叶黄素在去离子水中的尺寸分布图。制备的颗粒尺寸分布较集中,主峰均在200~600 nm 之间,表明成功制备纳米级淀粉颗粒,印证了SEM 的结果。

图3 SNPs 和SNPs-叶黄素的DLS图Fig.3 DLS images of SNPs and SNPs-lutein
相对SNPs 的单峰尺寸分布,SNPs-叶黄素的粒径出现增大的趋势,可能是淀粉分子链与叶黄素形成络合物后增加了淀粉分子链的极性,增强了淀粉分子链间的氢键作用力,从而在沉降过程中更多的淀粉分子链发生聚合,形成的淀粉颗粒尺寸偏大,粒径较大。这与Fu等[24]在淀粉纳米颗粒制备过程中添加疏水性药物分子,也发现淀粉纳米颗粒尺寸增大的结果相似。SNPs-叶黄素颗粒产生两个峰,根据纳米颗粒的沉降过程推测,尺寸分布中较小的峰,可能是纯淀粉颗粒。
2.4 XRD 分析
图4 显示不同包埋量的SNPs-叶黄素纳米颗粒的X 射线衍射图。经沉降法制备的SNPs 的A型特征峰消失,衍射峰为大包峰,为无定型结晶[29]。而同步包埋的SNPs-叶黄素的衍射峰随包埋量的增加出现差异。包埋量为14.57 mg/g 的SNPs-叶黄素衍射峰仍为大包峰,未显示特征峰,这可能是因为包埋量太低,主要衍射峰仍为SNPs衍射峰。当包埋量增至33.4 mg/g 时,SNPs-叶黄素在13.1 和20.9 产生新的特征衍射峰。据前人研究表明,该处衍射峰为V 型淀粉结构特征衍射峰,而V 型淀粉的形成是由淀粉分子链俘获疏水性客体分子形成的特殊晶体结构配合物[30-31]。综上,在纳米颗粒沉降过程中,淀粉分子链可有效与叶黄素分子结合形成络合物,完成对疏水性药物叶黄素的包埋。当包埋量增至65.61 mg/g 时,在7.8 处出现新的V 型结构特征峰,这是因为随着包埋量的增加,更多的叶黄素分子进入淀粉分子链中,络合物含量增加,增强衍射强度,显示淀粉分子链对叶黄素分子的络合作用。此外,当包埋量较高时,在15.8 和17.2 处有新的微弱衍射峰,这可能是由交缠在淀粉颗粒内部的叶黄素产生。其原因是叶黄素溶解在乙醇中,原有的结晶结构被破坏,在冷冻干燥过程中,重新形成新的晶体结构,使衍射峰的位置发生一定的偏移。
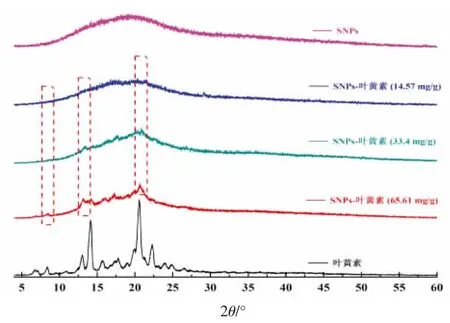
图4 SNPs 和SNPs-叶黄素的XRD图Fig.4 XRD images of SNPs and SNPs-lutein
2.5 FT-IR 分析
傅里叶变换红外光谱广泛应用于对淀粉结构和淀粉分子链间相互作用的分析[32]。通过比较叶黄素、SNPs 和SNPs-叶黄素红外谱图发现没有产生新的特征峰,也没有特征峰消失,说明沉降过程中,淀粉颗粒和叶黄素仍能保持本身性质。Nalawade等[33]研究表明,叶黄素在2 856 cm-1为上的-CH2-的C-H 伸缩振动产生的特征吸收峰,淀粉颗粒在该处无吸收峰,通过该处特征峰强度可判断SNPs-叶黄素中叶黄素含量的高、低。SNPs-叶黄素(14.57 mg/g)在该处未检测到明显的吸收峰,推测可能是叶黄素含量较低和叶黄素分子进入淀粉分子链的疏水空腔,无法被检测到。这表明较低包埋量时,纳米颗粒对叶黄素的负载可能由淀粉分子链与叶黄素分子的相互作用引起。当包埋量提至33.4 mg/g 时,在该处出现吸收峰,且随包埋量的提高,SNPs-叶黄素在该处吸收峰逐渐增强,此时较多的叶黄素被包裹在淀粉纳米颗粒内,产生叶黄素的特征吸收峰。综上,通过红外光谱证明淀粉纳米颗粒成功对叶黄素进行包埋。
受淀粉分子链与叶黄素分子间相互作用的影响,SNPs-叶黄素在1 645 cm-1处的吸收峰相对SNPs 发生蓝移。根据Fan等[34]的研究表明,1 645 cm-1处吸收峰由淀粉无定型区的结晶水分子的H-O-H 弯曲振动引起。H-O-H 键的弯曲振动与所需激发能量有关,当峰向高波数偏移时,需要较高的能量才能激发键的振动。由图5 可知,随着包埋量的增加,该处吸收峰逐渐向高波数偏移,推测原因是叶黄素分子与淀粉分子链结合后,形成V型晶体结构,增强了淀粉分子链间的氢键作用力,使无定型区淀粉分子链上结晶水分子含量减少,使该处需要较高的能量激发振动。因V 型晶体结构生成,增强了淀粉分子链间的氢键作用力,减弱了淀粉分子链与水分子间的氢键作用力,使3 360 cm-1处的-OH 的振动也向高波数偏移。
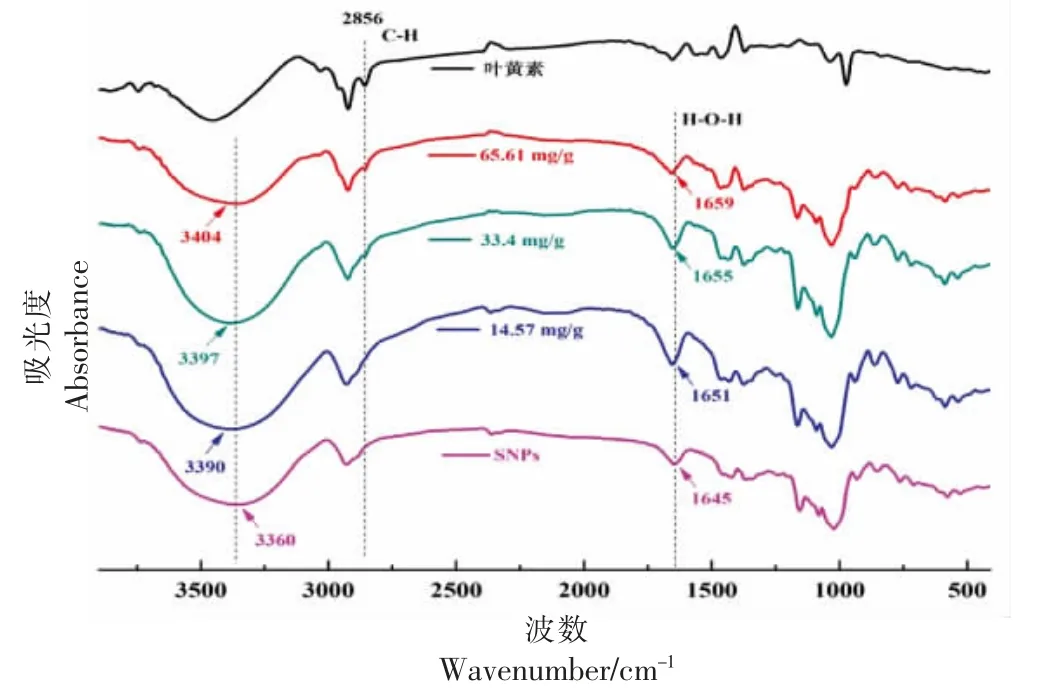
图5 SNPs 和SNPs-叶黄素的FT-IR图Fig.5 FT-IR images of SNPs and SNPs-lutein
2.6 碘-淀粉络合物的UV 分析
碘离子可与淀粉分子链上裸露在外部的羟基作用,嵌入淀粉分子链的螺旋体的轴心部位,形成一种蓝色包合物。从图6 可看出,随着SNPs-叶黄素中包埋量的增加,CI 值逐渐增加,表明包埋量增加,淀粉分子链与碘离子的结合能力降低,这是因为叶黄素分子已存于淀粉分子的单螺旋内腔中,阻碍了碘离子与淀粉分子链的结合,进一步证明叶黄素与淀粉分子链发生络合作用。Kawai等[22]通过淀粉与碘结合能力评价淀粉中的脂肪酸含量,也发现随着脂肪酸含量的增加,CI 指数升高。
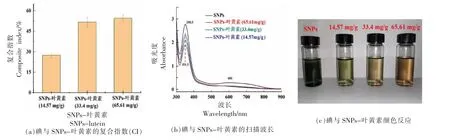
图6 碘对SNPs 和SNPs-叶黄素的影响Fig.6 The effect of iodine on SNPs and SNPs-lutein
从图6 可知SNPs 与碘作用呈深蓝色,SNPs-叶黄素(14.57 mg/g)与碘作用呈浅蓝色,且随包埋量的增加,颜色逐渐变化。这可能是因为SNPs 与叶黄素络合,使SNPs 结构发生变化,从而显色不同[35]。结合扫描波长分析,SNPs-叶黄素的UV 吸收,与SNPs 相比,λmax发生红移,偏移至351.5 nm附近,而红移的产生通常是淀粉分子的空间结构发生变化所致。初步推测,这可能是SNPs-叶黄素形成的V 型晶体结构,使淀粉颗粒的空间结构发生改变引起的。李贺[36]用酶催化制备松香淀粉酯,发现引入松香酰基基团破坏了淀粉的螺旋结构,使λmax也发生红移。综上分析可知,叶黄素分子可与淀粉分子链发生络合作用,并对淀粉的结构产生一定的影响,印证了XRD 与FT-IR 的结果。
2.7 抗氧化能力分析
DPPH 醇溶液在遇到氢供体时,会生成DPPH-H,使醇溶液颜色褪去,通过记录吸光值准确计算自由基的清除率,该测定方法已广泛应用于评价各类天然药物的自由基清除能力[37]。叶黄素原料药和SNPs-叶黄素对自由基的清除率如图7 所示。叶黄素原料药与DPPH 反应较快,在20 min 时基本与DPPH 发生完全反应,这是由于叶黄素分子的共轭结构能快速消除自由基,表明叶黄素可作为抗氧化剂[38]。相比叶黄素原料药,SNPs-叶黄素自由基清除率低于叶黄素原料药,这是因为SNPs-叶黄素中叶黄素含量低于叶黄素原料药和颗粒内部的叶黄素不能完全释放有关[17]。SNPs-叶黄素在60 min 内具有持续的抗氧化性,且自由基消除率不断增加,印证了其具有缓释的功能。SNPs-叶黄素不仅具有延长抗氧化的作用,还可以保护叶黄素的抗氧化活性。SNPs-叶黄素表现出较高的释放率和释放速率,这与叶黄素易溶于乙醇,对乙醇具有更好的相亲性有关。在乙醇溶液中,乙醇作为极性分子更易到达淀粉分子的单螺旋内腔,能快速将叶黄素分子置换出来,表现出较快的释放速率。

图7 DPPH 自由基清除率Fig.7 DPPH free radical scavenging rate
2.8 稳定性分析
叶黄素为不饱和结构,化学稳定性较差,在温度、光照和氧气等因素下容易发生降解,颜色逐渐变浅,吸光值降低,通过记录吸光值的变化可以计算叶黄素的保留率[39]。由图8 可知,30 d 内,低温保存的叶黄素原料药和SNPs-叶黄素的保留率均在90%以上,有良好的稳定性,说明淀粉纳米颗粒对叶黄素具有良好的生物兼容性,不会使叶黄素的稳定性降低。贮藏30 d 时,室温条件下的叶黄素原料药保留率降至64.91%,SNPs-叶黄素(14.57,33.4,65.61 mg/g)分别降至81.35%,76.73%,75.26%;升温条件下叶黄素原料药降至44.91%,SNPs-叶黄素(14.57,33.4,65.61 mg/g)分别降至66.14%,59.12%,56.66%。

图8 不同储藏条件下的稳定性图Fig.8 Stability diagram under different storage conditions
可见,SNPs-叶黄素中叶黄素的保留率均高于叶黄素原料药,叶黄素的稳定性有较大提高,表明淀粉纳米颗粒对叶黄素有良好的保护作用。结合XRD 和UV 结果分析,叶黄素分子与淀粉分子链形成络合物而被包裹进淀粉颗粒内部,叶黄素处于淀粉分子链的保护作用下,使稳定性得到提高。同时,淀粉本身具有阻隔氧气进入颗粒内部的性质,进而保护叶黄素不被氧气氧化[40]。常丰丹[41]研究淀粉与疏水性脂质类物质形成的复合物,发现淀粉颗粒对包裹的客体脂质分子具有良好的保护作用,这与本研究结果相似。
3 结论
在无任何稳定剂和有毒溶剂情况下,采用超声波搅拌法制备形貌较好,颗粒尺寸分布均匀的SNPs。在SNPs 沉降过程中,完成对疏水性大分子叶黄素的包埋和负载,制备出纳米级别的SNPs-叶黄素颗粒。研究表明叶黄素分子主要与淀粉分子链单螺旋空腔内的疏水性和SNPs 内部的疏水性微质发生络合作用,可形成稳定的络合物。通过调节淀粉乳与乙醇的体积比、叶黄素浓度以及淀粉乳浓度制备出包埋量为(57.62±0.36)mg/g 和包埋率为(40.33±0.56)%的SNPs-叶黄素颗粒。这为SNPs 对疏水性药物的负载提供了方法,为SNPs在药物负载和食品方面的应用提供参考。

