千金子制霜前后提取物通过调控脂筏介导Caco-2细胞中TLR4信号通路的作用机制研究
王慧楠,魏晓彤,石双慧,王梦琳,马思媛,胡宇峰,姜明瑞,张婧秋,王英姿
千金子制霜前后提取物通过调控脂筏介导Caco-2细胞中TLR4信号通路的作用机制研究
王慧楠,魏晓彤,石双慧,王梦琳,马思媛,胡宇峰,姜明瑞,张婧秋,王英姿*
北京中医药大学中药学院,北京 102488
探究千金子制霜前后提取物通过调控脂筏介导Caco-2细胞中Toll样受体4(Toll-like receptor 4,TLR4)信号通路的作用机制。将Caco-2细胞分为千金子生品低、中、高剂量(50、200、800 µg/mL)组及千金子霜品低、中、高剂量(50、200、800 µg/mL)组和对照组,利用流式细胞术检测Caco-2细胞膜脂筏丰度;采用激光共聚焦实验检测Caco-2细胞中TLR4与脂筏的共定位;利用Western blotting检测Caco-2细胞中TLR4、核因子-κB p65(nuclear factor-κB p65,NF-κB p65)、p-NF-κB p65和NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)的蛋白表达;ELISA检测Caco-2细胞上清液中白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量;Caco-2细胞转染后检测IL-1β和TNF-α的含量变化。与对照组比较,千金子生品提取物可以显著增加Caco-2细胞膜脂筏的丰度(<0.01),促进TLR4向脂筏的募集(<0.01),提高TLR4、NF-κB p65、p-NF-κB p65和NLRP3的蛋白表达以及诱导IL-1β和TNF-α的释放(<0.05、0.01、0.001)。相同剂量下,与千金子生品提取物相比,千金子霜品提取物对Caco-2细胞膜脂筏丰度、TLR4向脂筏募集、TLR4介导的信号通路传导和促炎因子分泌的影响均明显减弱(<0.05、0.01、0.001)。体外si转染试验结果进一步证实,Caco-2细胞转染后TNF-α和IL-1β的含量显著降低(<0.05、0.01、0.001)。千金子制霜减毒的作用机制可能与通过调控脂筏丰度干扰TLR4向脂筏募集,最终影响脂筏中包含的TLR4信号蛋白的传导有关。
千金子;制霜减毒;脂筏;Toll样受体4;Caco-2细胞;千金子甾醇
千金子为大戟科植物续随子L.的干燥成熟种子,具有泻下逐水、破血消癥之效,可用于水肿、二便不通、痰饮、积滞胀满、血瘀经闭,历代多采用去油制霜法炮制以降低毒性、缓和泻下作用[1-2]。脂筏是细胞膜内富含脂质以及蛋白质的动态微结构域,主要由胆固醇、鞘磷脂和脂筏连接信号蛋白构成,在物质运输和细胞内信号转导中扮演着重要的角色[3-4]。研究表明,胆固醇外流是调控脂筏的主要途径,胆固醇从胞内流出的变化会极大地改变脂筏的丰度,影响脂筏中包含的Toll样受体4(Toll-like receptor 4,TLR4)下游的信号通路传导[5]。课题组前期研究结果显示,千金子制霜后可能通过肝X受体α(liver X receptor α,LXRα)-腺苷三磷酸结合盒转运体A1(ATP binding cassette transporter A1,ABCA1)途径调控人结直肠腺癌Caco-2细胞胆固醇外流[6]。体内实验进一步发现,千金子制霜后对TLR4/核因子-κB p65(nuclear factor-κB p65,NF-κB p65)/NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)通路传导及促炎因子分泌的上调作用弱于生品[7],提示千金子制霜减毒的作用机制可能与通过LXRα-ABCA1途径调节胆固醇外流,以及干预TLR4/NF-κB/NLRP3信号通路有关,但胆固醇外流调控的细胞微区脂筏是否参与千金子制霜减毒的过程,以及其与TLR4介导的信号通路之间的关联性有必要深入研究。因此,鉴于膜脂成分胆固醇、动态微结构域脂筏与TLR4下游信号通路之间的密切联系,本研究拟采用流式细胞术、免疫荧光、Western blotting、ELISA、基因沉默等技术,系统探讨千金子制霜前后提取物通过调控脂筏丰度对Caco-2细胞中TLR4通路传导的影响差异,以期从分子水平解析千金子制霜减毒的作用机制,为其临床安全有效应用奠定科学依据。
1 材料
1.1 药材
千金子饮片(批号1203070692)购自安徽亳州,经北京中医药大学刘春生教授鉴定为大戟科续随子L.的干燥成熟种子;千金子霜由同一批千金子饮片按《中国药典》2020年版制霜法(通则0213)制得,经测千金子脂肪油质量分数为48.61%,千金子霜脂肪油质量分数为19.21%。
1.2 细胞
Caco-2细胞(批号BNCC350769)购自北纳生物BNCC。
1.3 药品与试剂
PBS溶液(批号C10010500BT)、DMEM高糖培养基(批号C11995500BT)、0.25%胰酶-EDTA(批号25200-056)购自美国Gibco公司;重组霍乱毒素亚基B(CT-B)、AlexaFluor™488偶联物(批号C22841)购自美国Thermo Fisher Scientific公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号EMC102a)、白细胞介素-1β(interleukin-1β,IL-1β)试剂盒(批号EMC001b)购自北京欣博盛生物科技有限公司;Lipo8000™转染试剂(批号C0533FT)购自上海碧云天生物技术有限公司;DAPI染色液(批号r20276-10mL)购自上海源叶生物科技有限公司;TLR4单抗(批号66350-1-Ig)、NF-κB p65单抗(批号66535-1-Ig)购自美国Proteintech公司;p-NF-κB p65抗体(批号ab76302)、NLRP3单抗(批号ab263899)、Alexa Fluor®594 IgG抗体(批号ab150080)购自英国Abcam公司;β-actin单抗(批号AH11286487)、HRP标记的羊抗兔IgG抗体(批号BJ08079044)、TLR4多抗(批号bs-20379R)购自北京博奥森生物技术有限公司。
1.4 仪器
Heracell™ VIOS 160i型CO2培养箱、Attune NxT型流式细胞仪(美国Thermo Fisher Scientific公司);SpectraMax i3x型酶标仪(美国MD公司);Tanon 1600型凝胶成像系统(上海天能科技有限公司);Countstar®RigelS5型智能图像流式细胞计数仪(上海睿钰生物科技有限公司);TCS SP8 STED型激光共聚焦显微镜(德国Leica公司);Direct-Q3型超纯水仪(德国Millipore公司)。
2 方法
2.1 千金子生品与千金子霜品提取物的制备
称取50 g千金子生品,加入300 mL 95%乙醇加热回流提取3次,每次提取2 h,合并3次提取液,减压回收乙醇,再用等体积石油醚萃取3次,减压回收,即得千金子生品提取物;称取50 g千金子霜品,重复上述操作,即得千金子霜品提取物,4 ℃保存备用。实验时稀释,最终得到生药质量浓度为3.17 g/mL的千金子生品和千金子霜品提取物。经HPLC检测千金子生品和千金子霜品提取物中千金子甾醇的质量分数分别为(3.81±0.03)、(2.03±0.01)mg/g。
2.2 细胞培养
Caco-2细胞接种于培养瓶中,用含10%胎牛血清、1%青霉素-链霉素的DMEM培养基,置于37 ℃、5% CO2恒温培养箱中培养,待细胞密度达到80%~90%时传代。根据课题组前期千金子制霜前后提取物对Caco-2细胞存活率影响的结果[6],本研究选择50、200、800 µg/mL作为后续实验质量浓度。
2.3 流式细胞术检测Caco-2细胞膜脂筏丰度
取对数生长期的细胞,以1×105个/孔接种于6孔板中,培养至细胞贴壁,设置千金子生品(50、200、800 µg/mL)组,千金子霜品(50、200、800 µg/mL)组和对照组,每组设3个复孔,孵育48 h后,收集细胞,4 ℃、1000 r/min离心5 min,弃上清,用AlexaFluor™488标记的CT-B染色液(1 μg/mL)冰上避光染色10 min,4 ℃、1000 r/min离心4 min,弃上清,加入400 μL PBS分散细胞,使用流式细胞仪检测荧光,对细胞膜上的脂筏进行定量分析。
2.4 激光共聚焦实验检测Caco-2细胞中TLR4与脂筏的共定位
取对数生长期的细胞,以1×105个/孔接种于共聚焦小皿中,培养至细胞贴壁,设置千金子生品(800 µg/mL)组、千金子霜品(800 µg/mL)组和对照组,每组设3个复孔,孵育48 h后,用AlexaFluor™488标记的CT-B染色液(1 μg/mL)冰上避光染色10 min,随后加入4%多聚甲醛冰上固定15 min,加入5%牛血清白蛋白室温封闭1 h;然后滴加TLR4抗体(1∶200),4 ℃孵育过夜,再滴加Alexa Fluor®594标记的二抗(1∶1000),避光孵育1 h后,加入DAPI溶液避光染色5~10 min;随后滴加少量甘油,使用激光共聚焦显微镜拍照获取图像,其中AlexaFluor™488标记为绿色荧光,Alexa Fluor®594标记为红色荧光,DAPI标记为蓝色荧光;使用Image J软件中的Coloc2插件进行TLR4与脂筏的共定位分析。
2.5 Western blotting检测Caco-2细胞中TLR4、NLRP3、NF-κB p65、p-NF-κB p65蛋白表达
将对数生长期的细胞,按2×105个/孔接种于6孔板中,培养至细胞贴壁,设置千金子生品(50、200、800 µg/mL)组,千金子霜品(50、200、800 µg/mL)组和对照组,每组设3个复孔,孵育48 h后,吸弃上清,加入细胞裂解液裂解,收集细胞,4 ℃、12 000 r/min离心10 min,BCA法进行蛋白定量。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭;TBST洗涤后,加入一抗,4 ℃孵育过夜;TBST洗涤后,加入二抗,室温孵育1 h,TBST洗涤后,采用凝胶成像系统显色,使用Image J软件分析Caco-2细胞中TLR4、NLRP3、NF-κB p65、p-NF-κB p65的蛋白表达。
2.6 ELISA检测Caco-2细胞上清液中IL-1β和TNF-α水平
取对数生长期的细胞,以2×105个/孔接种于6孔板中,培养至细胞贴壁,设置千金子生品(50、200、800 µg/mL)组,千金子霜品(50、200、800 µg/mL)组和对照组,每组设2个复孔,孵育48 h后,收集细胞上清液,4 ℃、3000 r/min离心25 min,按照试剂盒说明书检测细胞上清液中IL-1β和TNF-α水平。
2.7 TLR4转染后检测Caco-2细胞上清液中IL-1β和TNF-α水平
将对数生长期的细胞,以2×105个/孔接种于6孔板中,培养至细胞贴壁,实验所用的siRNA(上游引物5’-CCAAGUAGUCUAGCUUUCUUAdTd-3’,下游引物5’-UAAGAAAGCUAGACUACUUGGAdTd-3’)由生工生物工程(上海)股份有限公司合成,按照脂质体转染试剂说明书进行转染。转染24 h后,设置千金子生品(50、200、800 µg/mL)组,千金子霜品(50、200、800 µg/mL)组和对照组,每组设2个复孔,孵育48 h后,收集细胞上清液,按照“2.6”项下方法检测Caco-2细胞上清液中IL-1β和TNF-α水平。
2.8 统计学分析
3 结果
3.1 千金子制霜前后提取物对Caco-2细胞膜脂筏丰度的影响
如图1所示,与对照组比较,千金子生品与霜品提取物均可显著提高Caco-2细胞膜中脂筏丰度(<0.05、0.01、0.001),且呈剂量相关性;相同质量浓度下,与千金子生品组比较,千金子霜品可显著减轻对Caco-2细胞膜中脂筏丰度的上调作用(<0.05、0.01)。
3.2 千金子制霜前后提取物对Caco-2细胞中TLR4与脂筏共定位的影响
采用激光共聚焦显微镜对Caco-2细胞中TLR4与脂筏的共定位进行观察,结果如图2和表1所示,与对照组比较,千金子生品提取物可使Caco-2细胞中TLR4与脂筏的共定位显著增加(<0.01);千金子霜品提取物作用于Caco-2细胞后,TLR4与脂筏的共定位程度略有增加,但与对照组相比无统计学意义;与千金子生品组相比,千金子霜品组对Caco-2细胞中TLR4与脂筏的共定位的影响显著减轻(<0.01)。
3.3 千金子制霜前后提取物对Caco-2细胞中TLR4、NLRP3、NF-κB p65、p-NF-κB p65蛋白表达的影响
如图3所示,与对照组比较,各剂量的千金子生品提取物能够显著提高Caco-2细胞中TLR4和NLRP3的蛋白表达(<0.05、0.001),低、高剂量的千金子生品提取物能够显著提高Caco-2细胞中NF-κB p65的蛋白表达(<0.001),中、高剂量的千金子生品提取物能够显著提高Caco-2细胞中p-NF-κB p65/NF-κB p65的蛋白表达(<0.001);相同剂量下,与千金子生品提取物比较,千金子霜品提取物对Caco-2细胞中TLR4、NLRP3、NF-κB p65和p-NF-κB p65/NF-κB p65蛋白表达水平的调控作用均明显减轻(<0.01、0.001)。
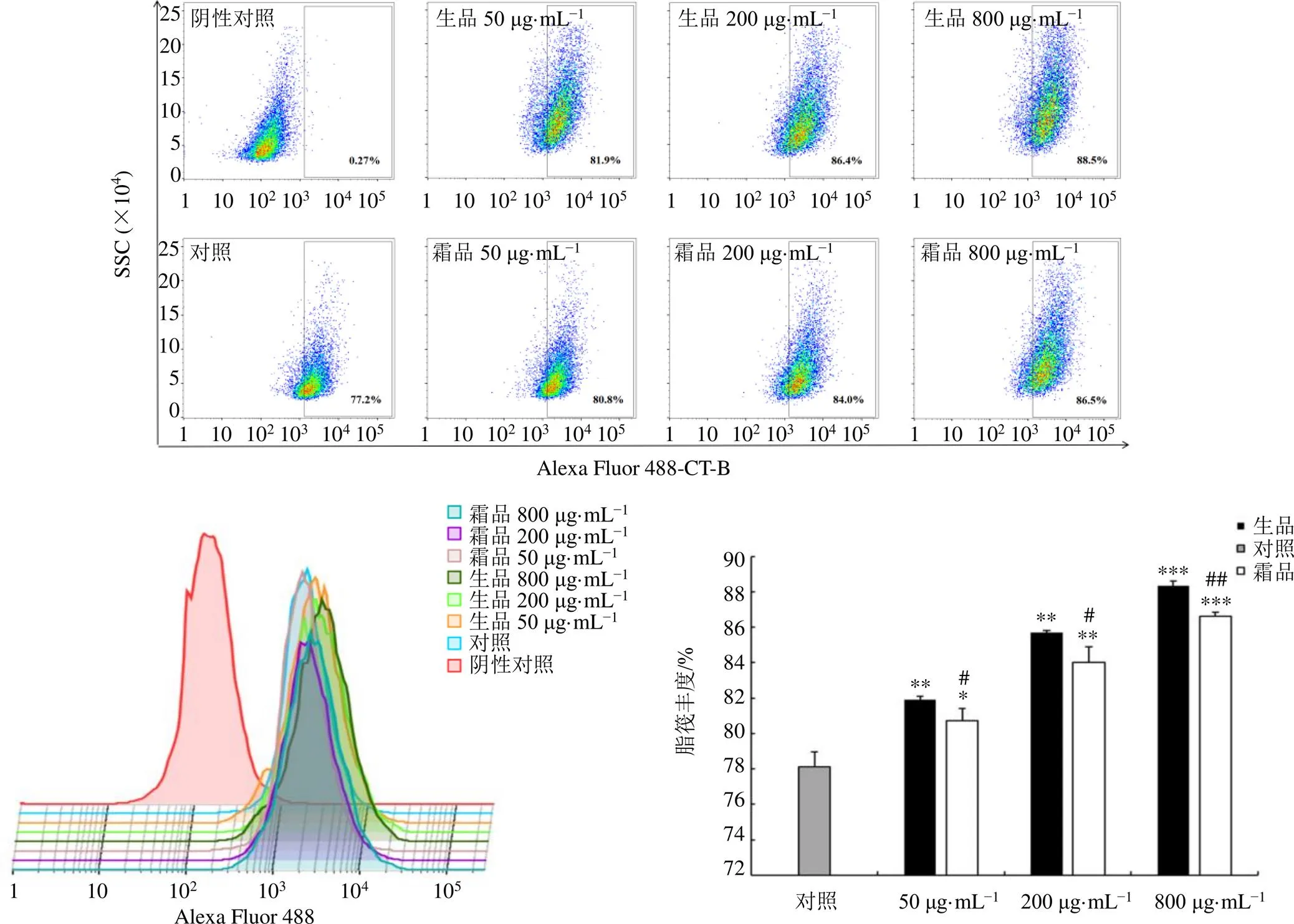
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与千金子生品组比较:#P<0.05 ##P<0.01 ###P<0.001,图3同
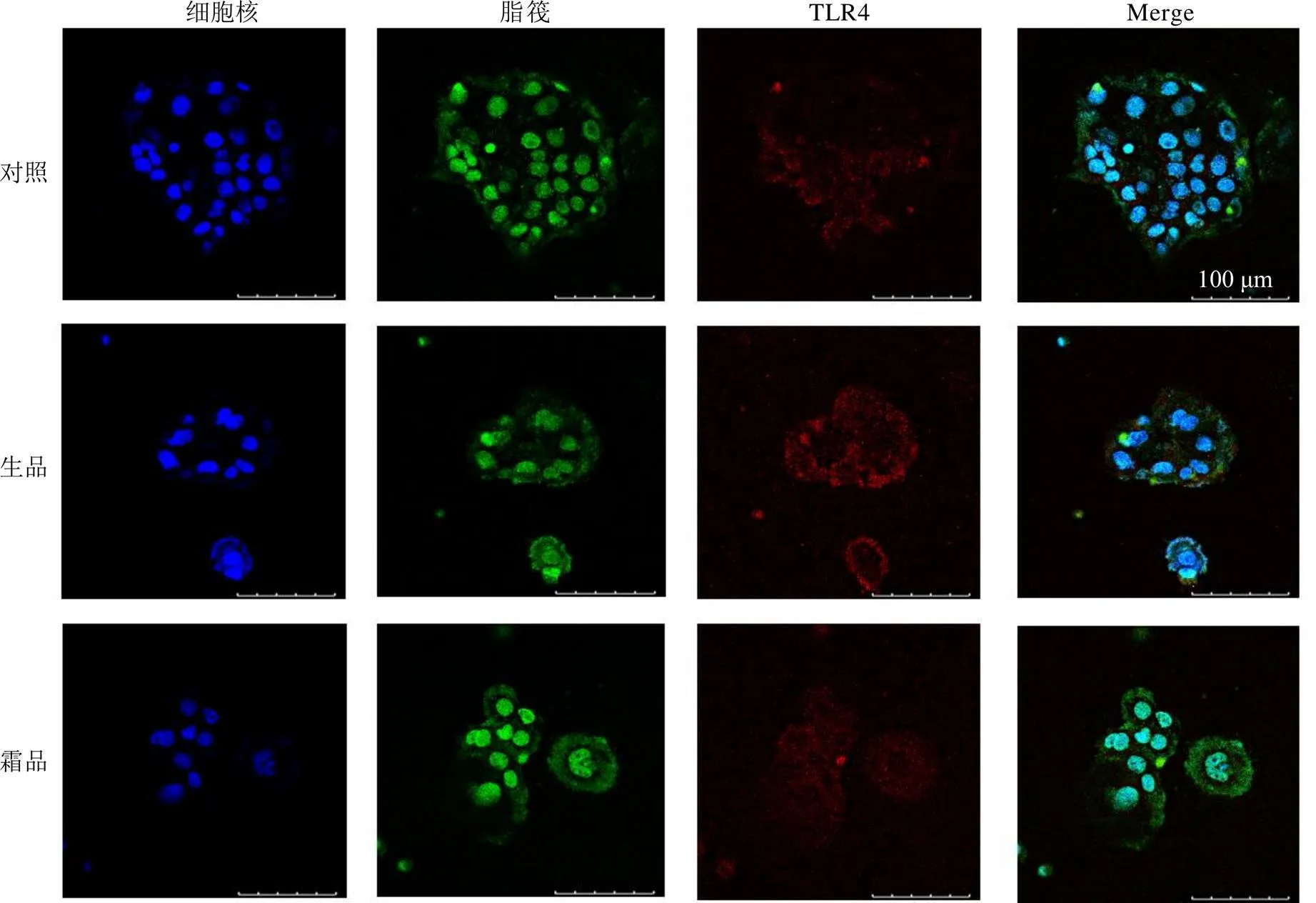
脂筏富集区表现为绿色荧光,TLR4表现为红色荧光,细胞核表现为蓝色荧光
表1 Caco-2细胞中TLR4与脂筏的共定位系数(, n = 3)
与对照组比较:**<0.01;与千金子生品组比较:##<0.01
**< 0.01control group;##< 0.01group
3.4 千金子制霜前后提取物对Caco-2细胞上清液中IL-1β和TNF-α分泌的影响
如图4所示,千金子制霜前后提取物干预Caco-2细胞48 h后,与对照组(NC)比较,千金子生品和霜品各剂量组均可显著上调Caco-2细胞上清液中IL-1β和TNF-α的含量(<0.05、0.01、0.001),且呈剂量相关性;相同剂量下,与千金子生品比较,千金子霜品提取物对上清液中IL-1β和TNF-α含量的上调作用明显减弱(<0.05、0.01)。
3.5 TLR4基因沉默后对Caco-2细胞IL-1β和TNF-α分泌的影响
如图4所示,用siRNA-1772转染Caco-2细胞24 h后,给予千金子生品与霜品提取物刺激48 h,与对照组(-siRNA)比较,千金子生品各剂量组及霜品中、高剂量组均可促进Caco-2细胞分泌TNF-α和IL-1β(<0.05、0.01、0.001);相同剂量下,与千金子生品比较,千金子霜品提取物可以显著减弱对TNF-α和IL-1β含量的上调(<0.05、0.01),这与沉默前千金子制霜前后提取物对Caco-2细胞IL-1β和TNF-α含量的影响趋势一致。与相同剂量下的未转染组(NC)比较,沉默后,Caco-2细胞上清液中TNF-α和IL-1β的含量显著降低(<0.05、0.01、0.001)。
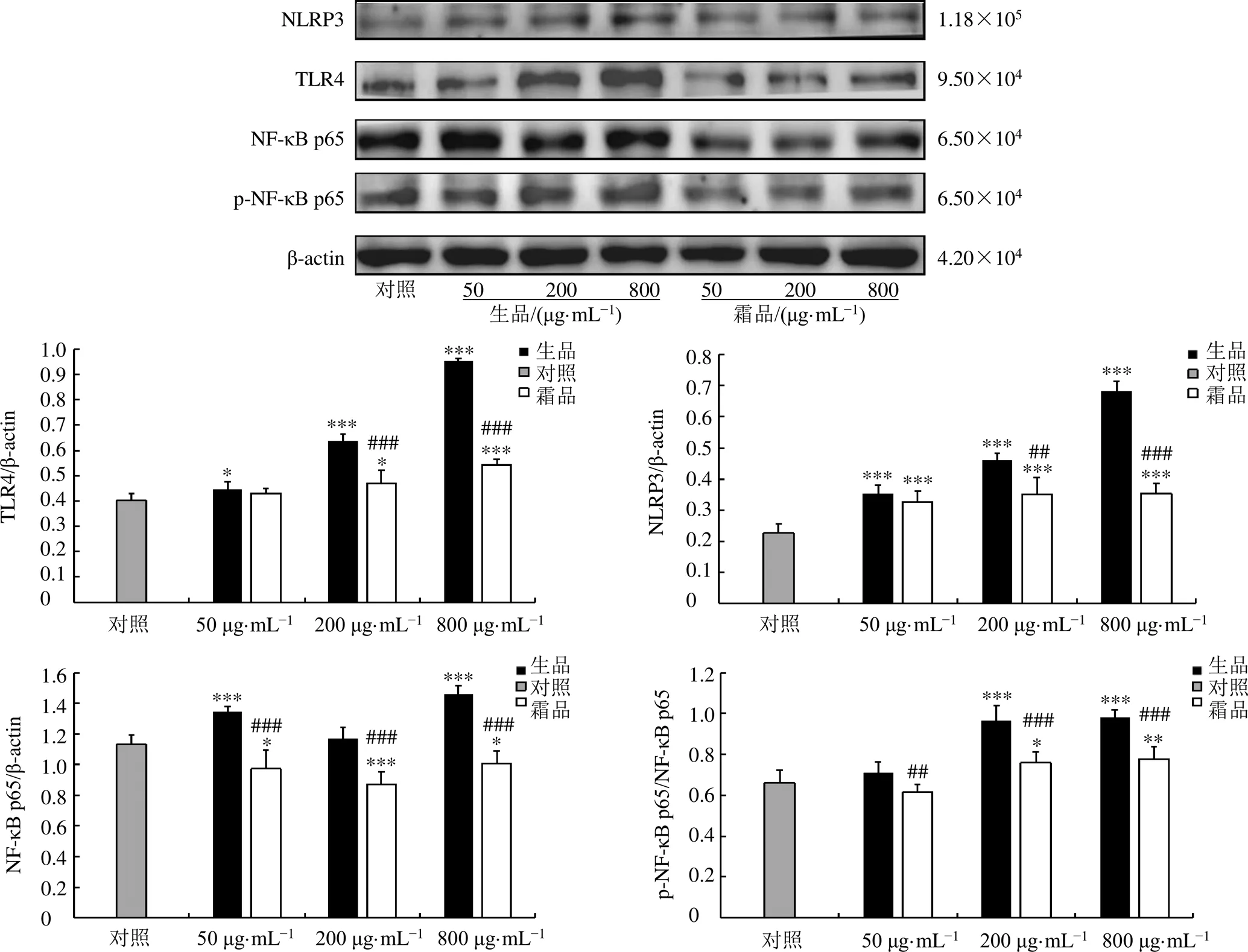
图3 千金子制霜前后提取物对Caco-2细胞中TLR4、NLRP3、NF-κB p65、p-NF-κB p65蛋白表达的影响(, n = 3)

与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与千金子生品组比较:#P<0.05 ##P<0.01;与未转染(NC)组比较:△P<0.05 △△P<0.01 △△△P<0.001
4 讨论
课题组前期研究发现,千金子制霜前后提取物可通过LXRα-ABCA1影响Caco-2细胞中胆固醇外流[6]。由于胆固醇是脂筏的主要组成成分,其在脂筏的形成中发挥关键作用,脂筏的含量受细胞胆固醇外流途径的高度调节[8-9]。因此,本研究采用流式细胞术进一步考察千金子制霜前后对Caco-2细胞膜脂筏丰度的影响,结果表明千金子制霜前后提取物均可显著增加Caco-2细胞膜脂筏丰度,而制霜后对Caco-2细胞膜脂筏含量的上调作用较生品减弱,说明千金子制霜前后可能通过LXRα-ABCA1途径调节胆固醇外流,进而影响脂筏的丰度及其功能,制霜后可以减轻对Caco-2细胞膜脂筏丰度的影响。
脂筏作为质膜上的重要功能平台,在TLR4介导的信号转导和靶向促炎因子表达中扮演关键角色[10-11]。脂筏含量的增加会导致TLR4受体在脂筏中占据时间变长、信号增强,进而引起炎症[12-15]。为探究千金子制霜前后是否会通过调控Caco-2细胞膜脂筏丰度影响TLR4向脂筏的募集,本研究应用激光共聚焦显微镜考察千金子制霜前后对TLR4和脂筏共定位的影响,结果显示千金子制霜前后提取物均可促进TLR4向脂筏的募集;而制霜后对Caco-2细胞中TLR4向脂筏中募集的促进作用明显弱于生品。此结果进一步表明,千金子制霜减毒作用是通过调控细胞膜微区脂筏丰度影响Caco-2细胞中TLR4向脂筏的募集实现的。
此外,课题组前期研究结果还表明,千金子制霜减毒的作用机制与致炎能力下降以及干预小鼠结肠组织中TLR4/NF-κB/NLRP3信号通路有关[7]。为了更深入地研究千金子制霜前后是否能够通过影响TLR4向脂筏募集进一步干扰Caco-2细胞中TLR4下游信号通路传导,本研究利用Western blotting和ELISA分别检测千金子制霜前后提取物对TLR4、NF-κB p65、p-NF-κB p65、NLRP3蛋白表达和IL-1β、TNF-α释放的影响,结果表明千金子生品可以提高Caco-2细胞脂筏中所含有的TLR4、NLRP3、NF-κB p65、p-NF-κB p65蛋白表达,促进IL-1β和TNF-α的释放;而制霜后可不同程度地逆转千金子诱导的TLR4、NF-κB p65、p-NF-κB p65、NLRP3、IL-1β和TNF-α水平的增高,与体内实验结果一致,提示千金子生品可以促进TLR4向脂筏的募集,诱导TLR4复合物进入细胞质中,使得NF-κB p65从细胞质转移到细胞核,并提高NLRP3蛋白和炎症因子的表达;千金子制霜后可通过调控细胞膜微区脂筏丰度影响TLR4向脂筏的募集,进而干预脂筏中包含的TLR4信号级联,降低Caco-2细胞体外毒性。体外siRNA沉默技术显示Caco-2细胞转染后,IL-1β和TNF-α的含量显著降低,进一步证实千金子制霜前后对Caco-2细胞中IL-1β和TNF-α含量的上调作用与TLR4信号通路有关。但除了TLR4介导的NF-κB/NLRP3途径外,TLR4还可介导丝裂原活化蛋白激酶、磷脂酰肌醇3-激酶/丝苏氨酸激酶、干扰素调节因子3等多种信号途径[16],本研究结果尚不能揭示千金子制霜前后提取物对其他途径的调控作用,后续将对TLR4介导的其他炎症信号通路开展研究。
综上,本研究发现千金子生品可以显著改善Caco-2细胞脂筏丰度,促进TLR4向脂筏募集,从而诱导TLR4/NF-κB/NLRP3途径的激活和TNF-α和IL-1β的释放,而制霜后对脂筏丰度、TLR4向脂筏募集、TLR4/NF-κB/NLRP3通路传导以及下游促炎因子分泌的影响均明显减弱,提示千金子制霜减毒的作用机制可能与影响细胞膜微区脂筏丰度从而干扰Caco-2细胞中TLR4信号通路传导有关,此结果可为深入探讨千金子制霜减毒机制提供重要依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 36-37.
[2] 朱娟娟, 辛义周, 马传江. 千金子炮制减毒机理的研究进展 [J]. 药学研究, 2020, 39(3): 153-155.
[3] 郭均, 黄燕燕, 刘冬梅, 等. 植物乳杆菌DMDL 9010制剂调控SD大鼠脂质水平的研究 [J]. 食品工业科技, 2018, 39(8): 285-290.
[4] 陈岚, 许彩民, 袁建刚, 等. 脂筏的结构与功能 [J]. 生物化学与生物物理进展, 2003, 30(1): 54-59.
[5] Morgan P K, Fang L H, Lancaster G I,. Hematopoiesis is regulated by cholesterol efflux pathways and lipid rafts: Connections with cardiovascular diseases [J]., 2020, 61(5): 667-675.
[6] 王佩华, 岳珠珠, 魏晓彤, 等. 千金子制霜前后提取物通过肝X受体-腺苷三磷酸结合盒转运体A1信号通路对Caco-2细胞中胆固醇外流的影响 [J]. 中国临床药理学杂志, 2023, 39(2): 201-205.
[7] 王慧楠, 姜明瑞, 王志成, 等. 千金子制霜前后提取物对TLR4/NF-κB/NLRP3信号通路的影响研究 [J]. 北京中医药大学学报, 2023, 46(6): 780-789.
[8] Pattnaik G P, Chakraborty H. Cholesterol alters the inhibitory efficiency of peptide-based membrane fusion inhibitor [J]., 2019, 1861(12): 183056.
[9] Biswas A, Kashyap P, Datta S,. Cholesterol depletion by MβCD enhances cell membrane tension and its variations-reducing integrity [J]., 2019, 116(8): 1456-1468.
[10] Fu J L, Shi Q, Song X F,. From the cover: Tetrachlorobenzoquinone exerts neurological proinflammatory activity by promoting HMGB1 release, which induces TLR4 clustering within the lipid raft [J]., 2016, 153(2): 303-315.
[11] Sun M L, Han X D, Zhou D I,. BIG1 mediates sepsis-induced lung injury by modulating lipid raft-dependent macrophage inflammatory responses [J]., 2021, 53(8): 1088-1097.
[12] Wei X C, Song H W, Yin L,. Fatty acid synthesis configures the plasma membrane for inflammation in diabetes [J]., 2016, 539(7628): 294-298.
[13] Gajate C, Mollinedo F. Lipid raft isolation by sucrose gradient centrifugation and visualization of raft-located proteins by fluorescence microscopy: The use of combined techniques to assess Fas/CD95 location in rafts during apoptosis triggering [J]., 2021, 2187: 147-186.
[14] Li B R, Qin Y, Yu X J,. Lipid raft involvement in signal transduction in cancer cell survival, cell death and metastasis [J]., 2022, 55(1): e13167.
[15] Mollinedo F, Gajate C. Lipid rafts as signaling hubs in cancer cell survival/death and invasion: Implications in tumor progression and therapy [J]., 2020, 61(5): 611-635.
[16] 陈俊利, 裴明, 周豪坤, 等. Toll样受体4信号通路在纤维化中的研究进展 [J]. 河北医药, 2022, 44(13): 2044-2048.
Mechanism of extracts frombefore and after frosting mediating TLR4 signaling pathway in Caco-2 cells via regulating lipid rafts
WANG Hui-nan, WEI Xiao-tong, SHI Shuang-hui, WANG Meng-lin, MA Si-yuan, HU Yu-feng, JIANG Ming-rui, ZHANG Jing-qiu, WANG Ying-zi
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To study the mechanism of extracts from Qianjinzi () and Qianjinzishuang () mediating Toll-like receptor 4 (TLR4) signaling pathway in Caco-2 cells via regulating lipid rafts.Caco-2 cells were divided intolow-, medium- and high-dose (50, 200, 800 µg/mL) groups,low-, medium- and high-dose (50, 200, 800 µg/mL) groups and control group. Flow cytometry was used to detect the lipid rafts abundance of Caco-2 cells membrane. Confocal laser scanning microscope was used for studying the co-localization of TLR4 and lipid rafts in Caco-2 cells. Western blotting was applied to detect TLR4, nuclear factor-κB p65 (NF-κB p65), p-NF-κB p65 and NOD-like receptor family pyrin domain containing 3 (NLRP3) protein expressions in Caco-2 cells. Furthermore, ELISA was applied to determine the levels of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) in the supernatant of Caco-2 cells. And the levels of IL-1β and TNF-α were detected in Caco-2 cells after transfection with.Compared with control group,extracts could increase the content of lipid rafts (< 0.01), promote the recruitment of TLR4 to lipid rafts (< 0.01), increase the protein expressions of TLR4, NF-κB p65, p-NF-κB p65 and NLRP3, as well as induce the release of IL-1β and TNF-α in Caco-2 cells (< 0.05, 0.01, 0.001). However, the effects ofextracts on the abundance of lipid rafts, the recruitment of TLR4 to lipid rafts, the conduction of TLR4-mediated signaling pathways and the secretion of pro-inflammatory factors were significantly weaker than those ofextracts at the same dose (< 0.05, 0.01, 0.001). In addition, the results of sitransfectionfurther confirmed that the content of IL-1β and TNF-α were significantly decreased after transfection ofin Caco-2 cells (< 0.05, 0.01, 0.001).The attenuation mechanism of processing formay be closely related to interfering the recruitment of TLR4 to lipid rafts by regulating lipid rafts abundance, and ultimately affecting the cascade of TLR4 signaling protein contained in lipid rafts.
; attenuating toxicity of frosting; lipid rafts; Toll-like receptor 4; Caco-2 cells; euphobiasteroid
R285.5
A
0253 - 2670(2023)22 - 7474 - 08
10.7501/j.issn.0253-2670.2023.22.024
2023-07-10
国家自然科学基金资助项目(82074021)
王慧楠(1997—),女,博士研究生,从事中药制剂新技术与中药炮制原理研究。E-mail: 2672667045@qq.com
通信作者:王英姿(1975—),女,博士,教授,博士生导师,从事中药制剂新技术与中药炮制原理研究。Tel: (010)84738615 E-mail: wangyzi@sina.com
[责任编辑 李亚楠]