SrF2:Tb3+的水热合成及其对Fe3+离子检测研究
王智毅,王冬梅,胡珊珊,杨 骏
(西南大学 化学化工学院,重庆 北碚 400715)
1 引言
目前,重金属离子的检测已成为检测领域的研究热点,其中铁是人体内一种不可缺少的微量元素,在人体内能够起到参与氧的储存与转运、维持正常的造血功能、参与电子转移和氧化酶活性以及能量代谢等关键作用[1-3]。正常情况下,人体中铁元素含量处于相对稳定的范围,如果体内的铁含量过高则会出现铁超载,导致器官损伤甚至器官衰竭;若体内的铁含量过低则会出现缺铁性贫血,临床上主要表现为食欲低下、疲乏、头晕以及儿童的智力发育迟缓[4-6]。
如今,大多数Fe3+的检测方法仍然存在着一些缺点,例如电感耦合等离子体法运行成本高昂,分光光度法的准确度不高,原子吸收光谱法容易受到干扰[7-9]。然而,稀土离子具有能级丰富、化学稳定性良好和激发态电子寿命长等优异特性[10-12],使得稀土离子在离子检测领域有着广阔的应用前景。将稀土离子用于构建无机荧光探针,具有制备方法简单、灵敏度高和检测响应速度快等优点[13],因此受到了广泛关注。
采用简便的水热法一步合成了一系列SrF2:Tb3+荧光粉,研究了其物相结构,深入研究了其作为Fe3+荧光探针检测的选择性、灵敏度以及抗干扰能力,最后对实际水样中的Fe3+进行了检测。
2 实验部分
2.1 实验试剂
Tb4O7(质量分数大于99.99%)购于赣州市广利高新技术材料有限公司;其他试剂均购于重庆市钛新化工有限公司,纯度为分析纯;SrCl2溶液、NH4F、Tb(NO3)3溶液以及去离子水均为自制。
2.2 实验过程
2.2.1 SrF2:Tb3+荧光粉的水热制备。首先配制稀土硝酸盐溶液。称取一定质量的Tb4O7加入浓硝酸中,加热搅拌至溶液完全澄清,继续加热搅拌除去余酸,转移至容量瓶中定容,即可得到Tb(NO3)3溶液。以SrF2:1.5%Tb3+荧光粉的制备为例,称取0.10 g聚乙烯吡咯烷酮(PVP)于25 mL溶去离子水中,依次加入SrCl2(0.985 mmol)、Tb(NO3)3(0.015 mmol)以及NH4F(4 mmol),在搅拌的条件下反应30 min,得到均匀的白色悬浊溶液,转移至50 mL反应釜中,在200 ℃的条件下反应24 h。待反应结束并冷却至室温后,使用去离子水和无水乙醇离心洗涤沉淀。最后,在60 ℃下烘干12 h即得到白色的SrF2: 1.5%Tb3+荧光粉。
2.2.2 Fe3+检测溶液的制备。称取0.10 g SrF2:1.5%Tb3+样品放入10 mL去离子水中,超声分散30 min,得到白色悬浊液,即Fe3+检测溶液。Fe3+检测溶液即配即用。
2.2.3 样品表征。使用X-射线粉末衍射仪(MSALXD3,北京普析通用仪器公司)测试样品的物相组成;使用荧光光谱仪(FS5, 英国爱丁堡仪器公司)测试样品发光性能,激发波长为253 nm,检测波长范围为450~650 nm;使用透射电子显微镜(TEM,Talos F200X,美国FEI公司)测试样品的微观形貌,电压为200 kV;使用电感耦合等离子发射光谱仪(iCAP7000, 美国热电公司)测试实际水样中Fe3+的浓度,分析波长为259.9 nm。所有表征均在室温下进行。
3 实验结果
3.1 物相表征
SrF2:x%Tb3+(x= 0.5, 1.0, 1.5, 2.0)样品的X-射线粉末衍射(XRD)谱图如图1(a)所示,其衍射峰与SrF2标准PDF卡片(JCPDS No. 86-2418)的衍射峰一致,没有出现杂相峰,这表明制备得到了纯相的SrF2晶体。同时,样品衍射峰半峰宽较窄,表示具有较高的结晶度。为了解荧光粉的形貌特征,进一步对SrF2:1.5%Tb3+荧光粉进行透射电子显微镜(TEM)测试,如图1(b)所示。可以观察到,SrF2:1.5%Tb3+纳米晶粒的平均粒径约为39 nm,样品呈哑铃状,粒径大小均匀,具有较好的分散性。
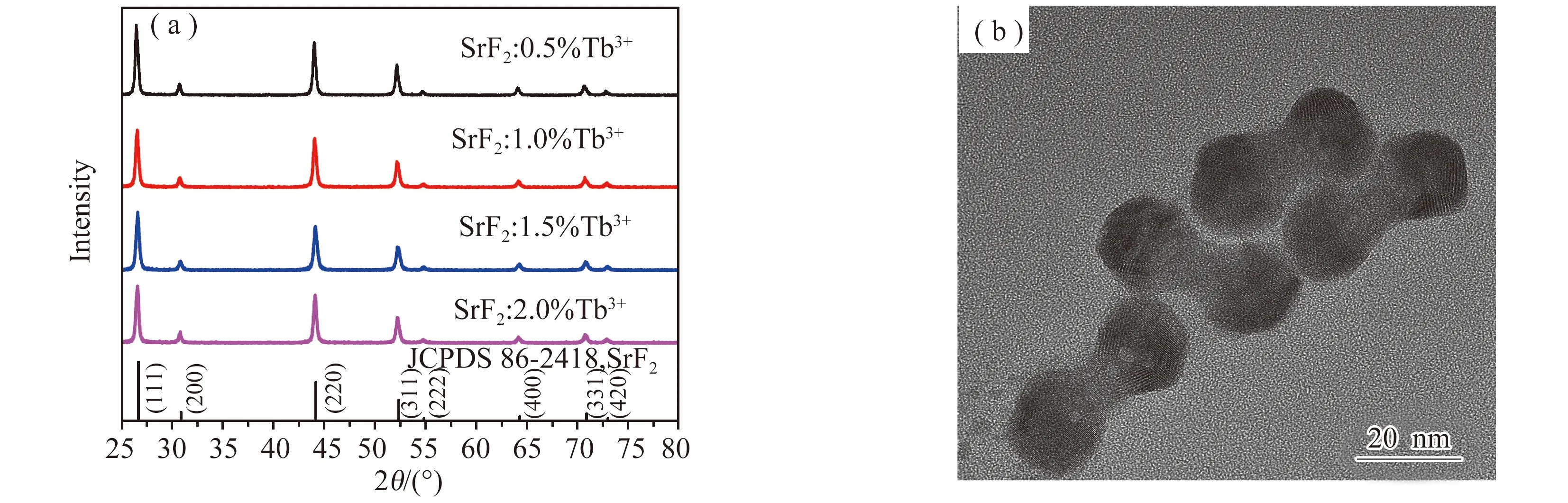
图1 (a) SrF2:x%Tb3+ (x = 0.5, 1.0, 1.5, 2.0)样品的XRD谱图; (b) SrF2:1.5%Tb3+样品的TEM图
3.2 下转换发光性质
图2(a)为SrF2:1.5%Tb3+的激发光谱与发射光谱。从激发光谱可以看出,SrF2:1.5%Tb3+荧光粉的最大激发波长在253 nm左右,其发射光谱由一个浅蓝色发射峰(488 nm)、一个强绿色发射峰(541 nm)和两个相对较弱的红色发射峰(582 nm和621 nm)组成,分别对应于Tb3+离子的5D4→7F6、5D4→7F5、5D4→7F4和5D4→7F3能级辐射跃迁。其中Tb3+最强的发射峰出现在541 nm,因此Tb3+单掺杂的SrF2样品呈现出绿光发射。同时,对比了四个样品的发射光谱,如图2(b)所示。可以看出随着Tb3+掺杂浓度的增加,Tb3+的四个发射峰呈现出先增强后急剧下降的趋势,从而确定Tb3+的最佳掺杂浓度为1.5%。进一步分析可知,Tb3+离子的浓度猝灭表明SrF2中主晶格与Tb3+离子之间存在一定的相互作用,由于Tb3+掺杂的浓度过大发生浓度猝灭,从而出现了Tb3+的发射强度先增加后急剧降低的现象[14]。
3.3 选择性研究
首先,对荧光探针的选择性进行了研究。图3(a)为将500 μL浓度为0.1 mol/L的不同金属离子溶液(Fe3+, Al3+, Cu2+, Na+, Li+, Cr3+, Sr2+, Mg2+, Mn2+, Fe2+, Co2+, Ni2+)加入到10 mL检测溶液后的发射光谱图。可以观察到,只有在Fe3+的存在下检测溶液的荧光才出现明显的猝灭现象,而其他金属离子并未对Tb3+的特征荧光产生猝灭,说明荧光探针对Fe3+有较好的选择性,而对其他离子的选择性较低。从图3(b)可以看出,加入Fe3+后检测溶液中SrF2:Tb3+在541 nm处的荧光强度减弱到了空白样品的33.39%,出现了非常明显的荧光猝灭,而加入其它金属离子后除了Fe2+的猝灭略强(减弱至74.40%),其它大部分金属离子对SrF2:Tb3+荧光强度的猝灭程度并不明显,其荧光强度基本上都为空白样品荧光强度的89%以上,从而直观地说明了SrF2:Tb3+作为荧光探针对于Fe3+的良好选择性。

图3 (a) 加入不同金属离子后检测溶液的发射光谱图; (b) 检测溶液荧光在541 nm处猝灭程度的柱状图
3.4 对不同浓度Fe3+的响应
通过研究在检测溶液中加入不同浓度Fe3+后的荧光发射光谱,确定了检测溶液对Fe3+的工作曲线。图4(a)为Fe3+浓度为1×10-5~6×10-5mol/L时检测溶液的发射光谱图,可以发现检测溶液的荧光强度随Fe3+浓度的增加而降低。将加入Fe3+的浓度与541 nm处的荧光强度进行线性拟合,如图4(b)所示。根据Stern-Volmer公式[15]
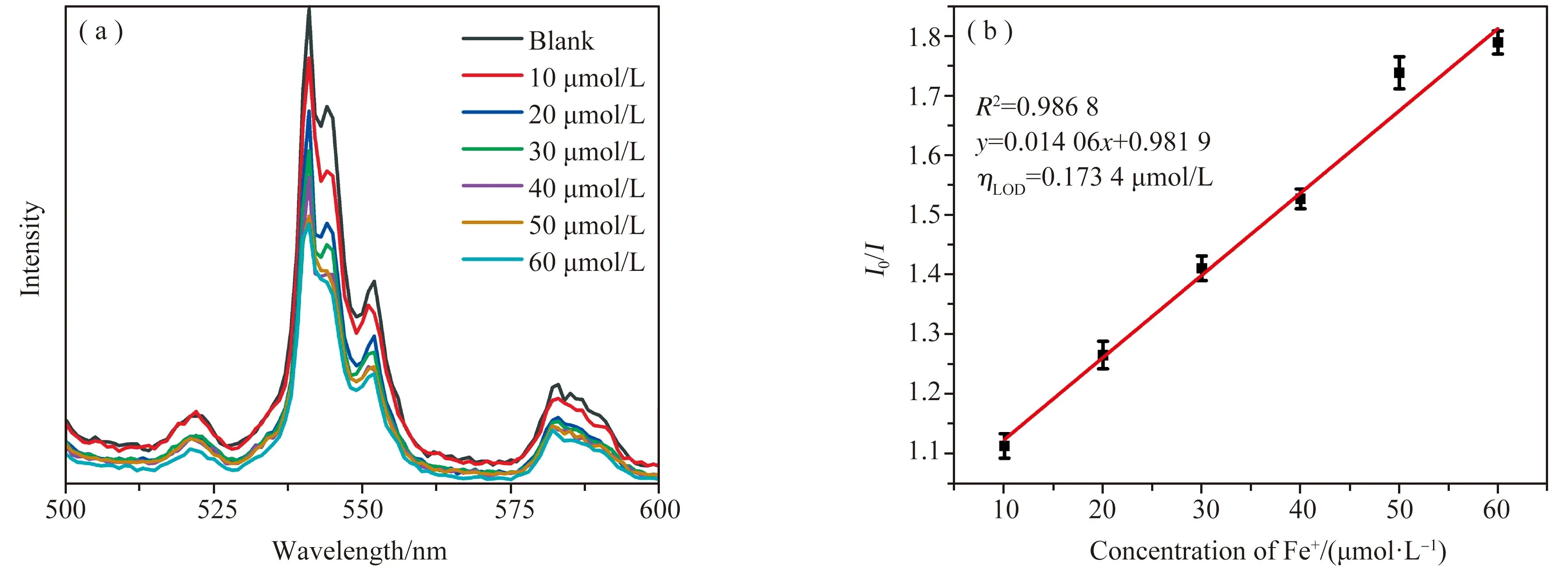
图4 (a) 加入不同浓度Fe3+溶液后检测溶液的发射光谱图; (b) 检测溶液荧光强度与Fe3+浓度之间的线性拟合图
I0/I=C+Ksv×c(Fe3+),
(1)
式中I0为空白样品的荧光强度,I为测试样品的荧光强度,Ksv为拟合曲线的斜率,C为常数,得到检测溶液对Fe3+的工作曲线:I0/I=0.981 9+0.014 06 ×c(Fe3+),相关系数R2=0.986 8,数据显示出良好的线性关系。根据检出限计算公式[16]
ηLOD= 3σ/S,
(2)
式中ηLOD代表检出限,σ为空白样品的标准偏差,S为根据Stern-Volmer公式作图曲线的斜率,计算得到了检测溶液的检出限为0.173 4 μmol/L。
3.5 抗干扰能力研究
为了探究其他金属离子对Fe3+离子检测的干扰,选择了废水中常见的金属离子(Fe3+, Al3+, Cu2+, Na+, Li+, Cr3+, Sr2+, Mg2+, Mn2+, Fe2+, Co2+, Ni2+)进行干扰实验。将500 μL浓度为0.1 mol/L的不同金属离子水溶液与500 μL相同浓度的Fe3+水溶液加入检测溶液,结果如图5(a)与图5(b)所示。结果表明,在含有Fe3+的检测溶液中加入其他离子的水溶液,并不影响对Fe3+的检测,说明检测溶液对Fe3+的检测具有特异性。同时,由于SrF2几乎不溶于水,在加入少量含金属离子的水溶液后,合成的SrF2晶体的结构几乎不会被破坏。基于以上分析,可以得出SrF2:Tb3+可以用于检测水中的Fe3+。
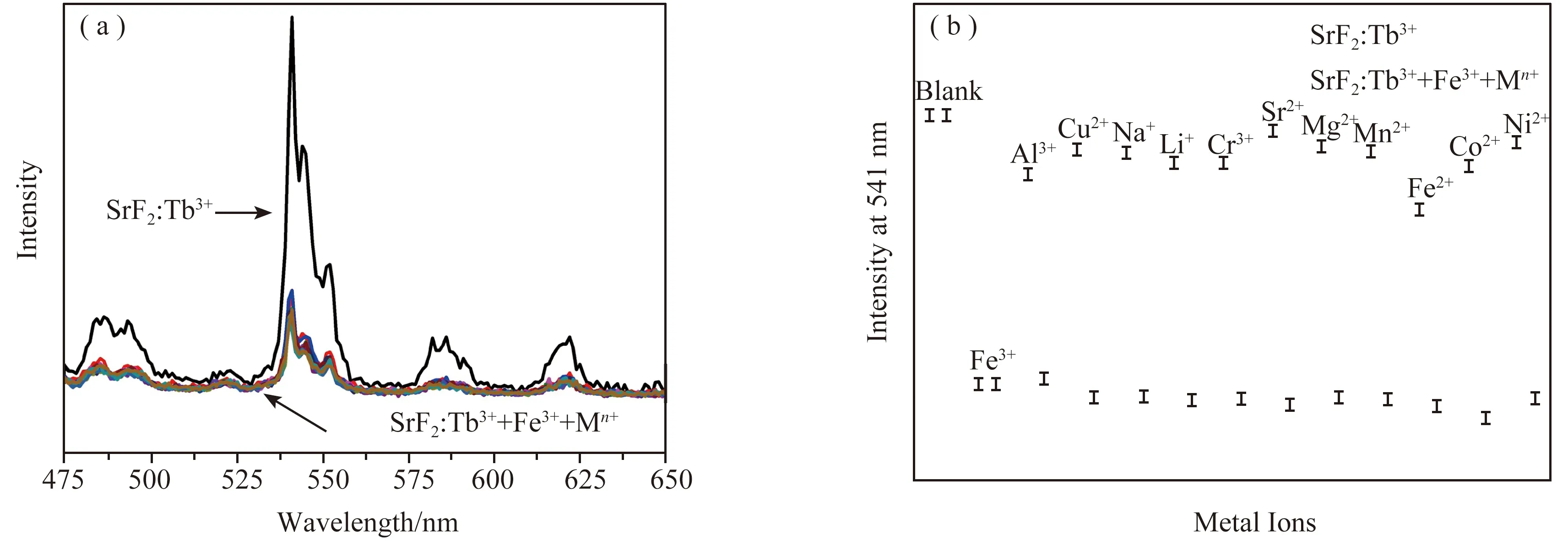
图5 (a) 加入Fe3+溶液与干扰离子后检测溶液的发射光谱图; (b) 检测溶液荧光在541 nm处猝灭程度的柱状图
3.6 荧光猝灭机理研究
对Fe3+猝灭SrF2:Tb3+检测溶液荧光的机理进行了分析。首先,将SrF2:1.5%Tb3+在0.1 mol/L的Fe3+水溶液中浸泡12 h后,离心、烘干后进行XRD测试,结果如图6(a)所示,可以发现在Fe3+水溶液中的浸泡并没有使SrF2:1.5%Tb3+样品的结构坍塌,从而排除了结构塌陷引起淬灭的可能性。一个比较合理的原因是Fe3+的紫外-可见吸收光谱与Tb3+的激发光谱相似,两者都位于200~400 nm的范围内,这导致Fe3+与Tb3+之间存在竞争吸收关系。当使用氙灯光源激发检测溶液时,能量会从光源直接转移到Fe3+,而不是Tb3+,从而导致Tb3+的荧光发生动态猝灭。图6(b)给出了SrF2:Tb3+中Tb3+的激发光谱和Fe3+水溶液的紫外-可见吸收光谱,可以看出,Tb3+的激发光谱和Fe3+水溶液的紫外吸收光谱有明显的重叠,从而验证了我们提出竞争吸收机理的合理性[17]。进一步,测试了不同金属离子(Fe3+, Cu2+, Li+, Sr2+, Mn2+, Co2+, Al3+, Na+, Cr3+, Mg2+, Fe2+, Ni2+)在200~500 nm范围内的紫外-可见吸收光谱,如图6(c)所示,只有Fe3+在200~500 nm范围内具有强烈的吸收,其他金属离子的吸收相对较弱,这也解释了SrF2:Tb3+检测溶液对Fe3+的优异选择性和抗干扰性的原因。
3.7 实际水样检测
使用检测溶液分别对西南大学崇德湖湖水与自来水进行检测,其荧光发射光谱图如图7所示。根据上述得到的Stern-Volmer公式计算得到湖水中c(Fe3+)=9.15 μmol/L,自来水中c(Fe3+)=11.80 μmol/L。为了验证检测结果的准确性,使用电感耦合等离子体方法对湖水和自来水水样中的铁离子浓度进行了检测,检测结果为湖水中c(Fe3+)=10.40 μmol/L,自来水中c(Fe3+)=10.46 μmol/L,与荧光猝灭法的结果相近,这验证了本方法能够用于实际水样中Fe3+的检测。
4 结论
通过一步水热法合成了一系列SrF2:x%Tb3+(x= 0.5, 1.0, 1.5, 2.0)荧光粉,确定了Tb3+的最佳掺杂浓度为1.5%,对其进行了物相、形貌以及发光性质表征。由于在Fe3+的存在下SrF2:Tb3+的荧光会出现明显的猝灭,所以SrF2:Tb3+可以作为检测Fe3+的荧光探针。将SrF2:Tb3+荧光粉在超声波分散法的辅助下均匀分散至去离子水中,制备得到Fe3+检测溶液,在1×10-5~6×10-5mol/L浓度范围的Fe3+开展检测,确定了荧光探针荧光强度与Fe3+浓度之间的线性关系I0/I=0.981 9+0.014 06×c(Fe3+),并计算得到最低检出限为0.173 4 μmol/L。此外,发现荧光探针在检测Fe3+时具有较好的选择性与抗干扰性,并对实际水样展开了检测。因此,本方法有望成为检测Fe3+的一种有力的方法。

