丹参提取物对大鼠心肌缺血后血管新生的保护作用研究
洪艺勤 唐炳华 陈旭 于藜爽 王慧 解涵滟 郭冬青
缺血性心脏病是指当血液减少或者停止流向心脏的某个部位时,心肌就会因为缺氧而受伤,如果病情严重,则会导致急性心肌梗死[1]。本病的直接治疗包括服用阿司匹林、硝酸甘油和吸氧[2],另外还有恢复心脏血液循环的再灌注疗法,以及血管成形术。血管成形术效果显著,但也具有较高的风险[3]。
缺血性心脏病最根本的原因是心肌缺血,因此最根本的治疗就是增加缺血心肌的血流量。血管新生这种不伤害机体又增加血管从而增加血流量的方法,近些年来受到越来越多的关注和研究。血管新生是指从已有的血管中生成新的毛细血管,是一个复杂的过程,在生长发育、组织和器官再生以及许多病理状况中都起着重要作用[4-5]。
骨形态发生蛋白(bone morphogenetic proteins, BMPs)属于转化生长因子-β(transforming growth factor-β, TGF-β)家族成员,在血管内稳态和血管新生中发挥重要作用[6]。其中骨形态发生蛋白2(bone morphogenetic protein-2, BMP2)已经证实能够在血管生物学中起作用[7],而且可以激活内皮细胞并促进血管新生[8]。Notch信号是一种高度保守的细胞间信号通路系统[9],Delta-Like配体蛋白-4(Delta-like 4, Dll4)是唯一由血管内皮细胞表达的Notch配体[10-12],可以通过抑制内皮“尖端”细胞的进一步形成和“柄”细胞的增殖作为血管内皮生长因子(vascular endothelial growth factor, VEGF)作用的负调节因子[13]。Dll4/Notch1的结合激活会导致Notch受体的蛋白裂解,Notch胞内结构域从细胞膜释放到细胞核,并与CSL转录因子和共激活因子结合,诱导下游靶基因转录[9],从而调节血管新生。
丹参具有活血祛瘀、通经止痛的功效,可用于治疗胸痹心痛、痛经经闭等[14]。丹参作用平和,能够活血祛瘀而不伤正气,如复方丹参片可用于治疗心绞痛引起的胸痛[15]。面对心肌缺血再灌注大鼠,丹参饮可以改善心功能、减少心肌凋亡,对心脏发挥保护作用[16]。因此本研究基于BMP2-Dll4/Notch1通路探究丹参提取物对心肌缺血后血管新生的作用及机制。
1 材料与方法
1.1 实验动物及实验细胞
SPF级雄性SD大鼠48只,体质量(220±20)g,购于北京斯贝福生物技术有限公司,于北京中医药大学动物房中普通饲料饲养,温度:(22±2)℃,湿度:45%±5%,每日12小时光照与黑暗循环,正常饮水。
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)来自北京安贞医院。
1.2 实验药物
丹参提取物来自上海源叶生物科技有限公司,批号:S27206-25g,是通过水萃取和酒精沉淀对丹参进行制备而得。为确保药物质量,课题组通过HPLC-PDA建立了指纹图谱,鉴定出了丹参的17个特征峰[17]。
瑞舒伐他汀来自阿斯利康药业(中国)有限公司,10 mg/片,批号:502705。
1.3 主要试剂与仪器
ALC-V8S小动物呼吸机,Visual Sonics小动物超声影像系统,moorFLPI-2血流成像仪。CCK-8检测试剂(同仁,日本),BMP2抗体(1∶1 000,Immunoway),Dll4抗体(1∶1 000,Bioss),Notch1抗体(1∶1 000,Proteintech),GAPDH抗体(1∶1 000,Proteintech),山羊抗兔单克隆二抗(1∶2 000,Proteintech),ECL超敏发光液(上海雅酶生物医药科技有限公司),BMP2 ELISA试剂盒(泉州市睿信生物科技有限公司)。Molecular Devices SpectraMax i3x全波长酶标仪,BIO-RAD制胶、电泳及电转设备与凝胶成像仪及图像分析系统。
1.4 动物分组、造模及给药
将48只大鼠适应性饲养1周,腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉,用气管套管进行插管,确认通气后连接小动物呼吸仪,设置仪器参数为80次/分钟,潮气量3.0,呼吸比1∶2,于左胸前第3、4肋间开胸,伤口约1 cm左右,在距离左心耳1~1.5 mm处进行结扎,其中随机选取8只大鼠仅开胸穿线,不结扎,作为后续假手术组。结扎完毕后,于心脏表面点滴1~2滴呋塞米,随后逐层关胸,于腹腔注射利多卡因注射液0.1 mL,置于预热的电热毯上,待其恢复自主呼吸后自行脱离气管插管,待苏醒后放回笼中。
术后将存活的40只大鼠随机分为假手术组、模型组、丹参提取物组(0.292 8 g/kg)和阳性药组(瑞舒伐他汀1 mg/kg)。假手术组和模型组给予空白溶剂(生理盐水),丹参提取物和瑞舒伐他汀的给药剂量根据临床治疗剂量等效换算。术后24小时后灌胃给药,每天1次,灌胃体积为1 mL/100 g,持续4周。在实验过程中所有死亡的大鼠均被剔除出组,保证最后每组动物存活数不少于6只。
1.5 细胞培养、分组与造模
培养条件:37℃,5% CO2,湿度70%~80%;完全培养基:90% 1640+10%胎牛血清+1%青霉素/链霉素。根据丹参提取物的药物作用浓度,将HUVECs分为:空白对照组、模型组、400 μg/mL丹参提取物组、600 μg/mL丹参提取物组和800 μg/mL丹参提取物组。空白对照组HUVECs在常规培养条件下培养,再更换完全培养基培养8小时。模型组常规培养后,更换Earle平衡盐溶液氧-葡萄糖剥夺法(oxygen-glucose deprivation,OGD)刺激8小时。
400 μg/mL丹参提取物组常规培养后,更换Earle平衡盐溶液配制的400 μg/mL丹参提取物OGD刺激8小时。
600 μg/mL丹参提取物组常规培养后,更换Earle平衡盐溶液配制的600 μg/mL丹参提取物OGD刺激8小时。
800 μg/mL丹参提取物组常规培养后,更换Earle平衡盐溶液配制的800 μg/mL丹参提取物OGD刺激8小时。
1.6 检测指标
1.6.1 超声检测 大鼠末次给药24小时后,经腹腔注射1%戊巴比妥钠麻醉,将左胸备皮。使用小动物超声检测各组大鼠的左室舒张末期内径(left ventricular end-diastole diameter, LVID;d)、左室收缩末期内径(left ventricular end-systole diameter, LVID;s)、左心室舒张末期容积(left ventricular end-diastolic volume, LVIDV)和左室收缩末期容积(left ventricular end-systole volume, LVISV)等指标。根据公式计算短轴缩短率(fractional shortening, FS)和射血分数(ejection fraction, EF)。
FS(%)=(LVID;d-LVID;s)/LVID;d×100%
EF(%)=(LVIDV-LVISV)/LVIDV×100%
1.6.2 心脏微血流扫描 药物干预28天,禁食12小时后,将大鼠麻醉,备皮,气管插管,插上呼吸机。打开左胸,露出心脏,用纱布擦去心脏表面多余的血液,将moorFLPI-2血流成像仪的扫描探头平行于心脏表面5 cm处放置并固定,探头内的光束照射到组织0.5 mm的深度测量心脏的血流。从蓝色到红色的图像表示低到高的血流量。
1.6.3 心肌组织苏木精—伊红(hematoxylin-eosin,HE)染色 将石蜡切片依次放入二甲苯、无水乙醇、酒精及蒸馏水中脱蜡,随后使用苏木素染细胞核、伊红染液染细胞质,最后脱水封片,图像采集并分析。
1.6.4 CCK-8检测细胞增殖活性 CCK-8工作液配制比为CCK-8∶1640培养基=1∶9,96孔板每孔加入100 μL工作液,37℃培养箱中孵育2小时,酶标仪波长450 nm检测OD值。
将HUVECs接种到96孔板中,每孔接种6×103个,贴壁培养到所需密度时,弃去原培养基,加入完全培养基配制的不同浓度(10、50、100、200、400、600、800、1 000、2 000 μg/mL)丹参提取物刺激24小时,使用CCK-8试剂确认丹参提取物的无毒范围。
将HUVECs接种到96孔板中,每孔接种6×103个,贴壁培养到所需密度时,弃去原培养基,加入Earle平衡盐溶液配制的不同浓度(10、50、100、200、400、600、800、1 000、2 000 μg/mL)丹参提取物OGD刺激8小时,使用CCK-8试剂确认丹参提取物的起效浓度。
1.6.5 细胞成管实验 在置于冰上的96孔板上每孔加入35 μL Matrigel,37℃培养箱中孵育30分钟,使其均匀凝固于孔底。将经过不同处理的各组HUVECs以1×106个/mL的密度接种到Matrigel上。于37℃培养箱中孵育5小时后,弃上清,PBS冲洗细胞3次。加入Calcein-AM染料(5 μg/mL)并避光染色5分钟。使用倒置显微镜拍照。使用Image-Pro Plus 6.0软件计算图中管的总长度和分支点总数,进而比较各组细胞的成管能力。
1.6.6 蛋白免疫印迹法(Western blots)检测HUVECs中BMP2、Dll4、Notch1表达情况 将HUVECs培养皿置于冰上,将先前配制好的RIPA裂解液加入培养皿中,使用细胞刮刀将细胞刮至皿一侧,取细胞于EP管中,充分裂解20分钟,离心机12 000 r/min,离心10分钟,取上清;采用BCA蛋白定量法进行定量,加入loading buffer调整蛋白浓度,98℃金属浴10分钟,使蛋白充分变性,自然冷却后使用;向配制好的浓缩胶上样孔中分别加入5 μL Marker和10 μL蛋白样品,80 V电泳90分钟,300 mA电转90分钟,5%牛奶封闭液封闭2小时,将膜放入BMP2一抗、Dll4一抗、Notch1一抗、GAPDH一抗中4℃孵育过夜,二抗常温孵育1小时,将膜置于凝胶成像仪中,将ECL发光液均匀地滴在膜上,设置合适的曝光时间,得到图像并保存,使用Image Lab对条带灰度进行计算分析。
1.6.7 酶联免疫吸附法(ELISA)检测HUVECs上清液中BMP2表达情况 收集不同处理后的各组HUVECs培养基,根据制造商的说明,4 000 r/min离心20分钟,提取上清液。于96孔板设置标准品孔、空白孔和样本孔,标准品孔加入不同浓度的标准品各50 μL,空白孔不加,样本孔分别加待测样本50 μL,然后标准品孔和样本孔都各加入检测抗体100 μL,37℃恒温箱避光孵育60分钟。弃去液体,加入洗涤液静置20秒,重复5次。将底物A和B按1∶1体积充分混合,每个孔加入混合液100 μL,37℃恒温箱避光孵育15分钟,随后每个孔加入终止液50 μL,在酶标仪上读取各孔吸光度。通过标准品孔的OD值得到标准曲线y=aln(x)+b,再将样本孔的OD值代入标准曲线中,从而得到每个样本的浓度值。
1.7 统计学处理

2 结果
2.1 丹参提取物对心肌缺血大鼠心功能的影响
左冠状动脉前降支结扎28天后进行超声检测,模型组大鼠的EF值和FS值显著下降(P<0.01),提示模型组大鼠的心功能严重受损,LVID;d值增加(P<0.01),提示左心室扩张。药物干预28天后,与模型组相比,丹参提取物组的大鼠EF值和FS值显著升高(P<0.01),LVID;d值和LVID;s值显著降低(P<0.01),阳性药组EF值和FS值亦升高(P<0.05),LVID;d值和LVID;s值亦降低(P<0.05),表明丹参提取物可以恢复心肌缺血大鼠的射血功能,改善心功能。见表1。
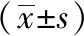
表1 各组心肌缺血模型大鼠心脏超声检测结果
2.2 丹参提取物对心肌缺血大鼠心脏血流量的影响
使用激光多普勒直观评估丹参提取物对心脏血流的影响,结果显示模型组心肌红色信号明显弱于假手术组(P<0.01),提示心肌血流量减少,血供不足。丹参提取物组血流信号明显强于模型组,说明心肌血流量明显增加(P<0.01),证明丹参提取物确实有促进心肌缺血大鼠血管新生的作用,而阳性药组促心脏血流的效果不明显。见图1,表2。
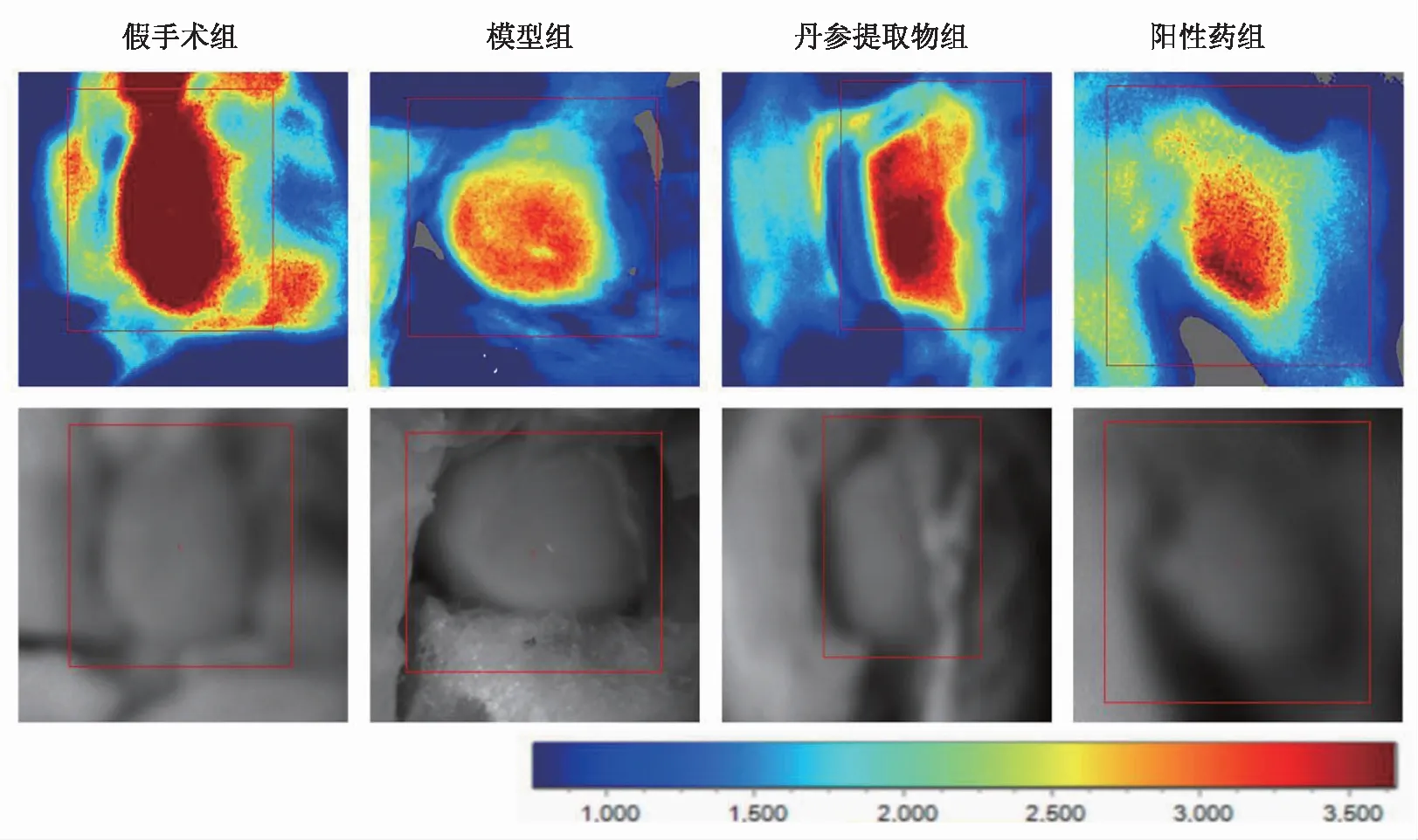
图1 各组心肌缺血模型大鼠心脏血流量比较

表2 各组心肌缺血模型大鼠心脏血流量比较
2.3 丹参提取物对心肌缺血大鼠心肌细胞染色的影响
HE染色结果显示,假手术组大鼠心肌细胞无结构性改变且无炎细胞浸润,模型组心肌形态变化严重,结构异常并出现炎性细胞浸润。丹参提取物干预后,心肌细胞排列较为整齐,炎性细胞浸润减少,证明丹参提取物具有明显改善心肌细胞形态和炎症的作用。见图2。
图2 各组心肌缺血模型大鼠心肌组织HE染色结果(×400)
2.4 丹参提取物对HUVECs无毒范围的确定
为了筛选丹参提取物对HUVECs的毒性范围,将丹参提取物作用于HUVECs细胞24小时。CCK-8结果显示,丹参提取物在浓度为10~800 μg/mL时对HUVECs细胞活力几乎没有影响,证明此浓度范围内丹参提取物对细胞无毒副作用,而1 000~2 000 μg/mL丹参提取物明显降低了细胞活力(P<0.05,P<0.01)。见表3。
表3 不同浓度丹参提取物对HUVECs细胞活力的影响
2.5 丹参提取物对OGD损伤的HUVECs细胞活力的影响
将内皮细胞进行OGD处理的同时,给予不同浓度的丹参提取物刺激,8小时后使用CCK-8实验检测细胞活力。结果显示,模型组与空白组相比,细胞活力明显下降(P<0.01);而与模型组相比,100~2 000 μg/mL的丹参提取物能提高细胞活力,整体呈现先升高后降低的趋势(P<0.05)。见表4。
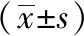
表4 不同浓度丹参提取物对OGD损伤HUVECs细胞活力的影响
2.6 丹参提取物对HUVECs体外成管的影响
采用Matrigel成管实验来观察HUVECs的成管能力。与空白组相比,模型组几乎没有分支点和成管能力;与模型组相比,400 μg/mL、600 μg/mL和800 μg/mL丹参提取物能增加管的总长度及分支点的数目,其中600 μg/mL成管效果最佳,提示丹参提取物对OGD损伤的HUVECs的成管能力有促进作用。见图3。

图3 不同浓度丹参提取物对OGD损伤HUVECs细胞成管的影响
2.7 丹参提取物对BMP2-Dll4/Notch1通路的影响
与模型组比较,各组HUVECs细胞中BMP2的表达变化没有统计学意义;各组HUVECs细胞上清液中,模型组分泌的BMP2含量显著减少(P<0.01),而400 μg/mL、600 μg/mL和800 μg/mL丹参提取物能增加BMP2的分泌,600 μg/mL时增加最明显(P<0.01)。见表5~6。

表5 各组HUVECs细胞中BMP2的蛋白表达水平比较
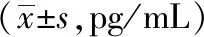
表6 各组HUVECs上清液中分泌的BMP2含量比较
通过Western blots检测BMP2下游蛋白Dll4和Notch1的表达变化,发现OGD刺激能够激活Dll4/Notch1,使Dll4、Notch1表达增加(P<0.01)。而丹参提取物能够显著降低Dll4、Notch1的表达(P<0.01),抑制Dll4/Notch1通路。见表7。
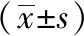
表7 各组HUVECs中Dll4、Notch1的蛋白表达水平比较
3 讨论
缺血性心脏病由流向心脏的部分血流减少或停止引起,目前的治疗方法不仅包括通过介入手术促进缺血动脉的快速再灌注,还包括使用适当的辅助抗血小板药物保持血管畅通,使用他汀类药物以降低低密度脂蛋白胆固醇和其他药物以改善血管壁和心肌的愈合,从而减少其他缺血后并发症的发生率,包括心律失常和心力衰竭[18]。而中医药则可以通过中药配伍从减少炎症、减少纤维化、促进血管新生等多个方面调节保护心肌,从而恢复心脏血流。近年来,血管新生这一促进恢复的治疗方法在众多通过减少损伤来达到治疗目的的方法中脱颖而出,成为一个新的研究热点。
BMPs最初是因其诱导骨和软骨形成的能力而被发现。BMPs信号通路不仅参与骨发育,还参与原肠胚形成、胚胎模式形成和器官发生[19]、血管生成与血管完整性[7]、铁稳态[20]、炎症[21]和有性生殖[22]。在不同的BMPs中,BMP2、BMP4、BMP6和BMP7已被证明在血管生物学中起作用[7],其中BMP2已经被报道可以激活内皮细胞并促进血管新生[8],而且心肌梗死后血清中BMP2从第一天就开始下降,与左心室重构过程相吻合[23]。
研究证实,血管新生需要多种信号级联的协调整合,包括VEGF、成纤维细胞生长因子、Notch/Dll4、血管生成素、TGF-β和BMP通路[18]。Dll4/Notch1信号通路是调节血管新生的重要通路,Dll4是血管新生的负调控因子[24],可被BMP2诱导[25],Notch1是一种高度保守的受体,广泛存在于细胞表面,受Dll4的受体配体模式的调控[26]。
目前临床前实验探究中药促进缺血心肌血管新生,多是通过检测血液或心脏组织中血管生长因子含量以及对内皮特异性标记物CD31的免疫组化染色来间接评估心肌组织的血管新生情况,缺乏整体水平对心脏血流的评估。在本研究中,笔者使用moorFLPI-2血流成像仪直观评估了各组大鼠的心脏血流量。通过超声检测、激光多普勒和HE染色证明丹参提取物不仅能够改善心肌缺血大鼠的心功能,还能增加心脏血流量,改善心肌细胞形态和炎症。
在离体细胞层面,本研究验证了丹参提取物能够增加细胞活力,增加内皮细胞的体外成管,佐证了丹参提取物对血管新生的调节作用。实验结果显示,丹参提取物不能明显改变内皮细胞中BMP2蛋白的表达,但是能够增加HUVECs上清中BMP2的分泌量,同时降低细胞中Dll4和Notch1的蛋白表达,提示丹参提取物可能通过BMP2抑制Dll4/Notch1信号通路,这可能是丹参提取物通过促进血管新生发挥心肌保护作用的机制之一。
综上,丹参提取物可通过调节BMP2-Dll4/Notch1信号通路,促进心肌缺血后血管新生,进而发挥心功能保护作用。

