多模态磁共振成像联合预后因子在HER-2低表达乳腺癌中的诊断价值分析
邹紫勤,黄艳芳,杨宇
0 前言
2021 年发布的中国临床肿瘤学会乳腺癌诊疗指南定义了一个新概念,人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)低表达。HER-2 低表达乳腺癌是指在免疫组化及荧光原位杂交技术(fluorescence in situ hybridization, FISH)检验中呈HER-2弱阳性(HER-2+或HER-2++/FISH-)的乳腺癌。GAMPENRIEDER等[1]进行的囊括1729名乳腺癌患者的研究显示,HER-2低表达乳腺癌与完全HER-2阴性(HER-2-0)的乳腺癌患者病理完全缓解率(29.2% vs.39.0%)、3 年无病生存率(83.4% vs.76.1%)与3 年总生存率(91.6% vs.85.8%)存在明显差异。这一结果表明HER-2 低表达乳腺癌可能具有特殊的生物学特性以及独特的治疗后病理反应,提示HER-2低表达乳腺癌或许能够作为一种全新的乳腺癌亚型而存在。而PEREZ等[2]研究的结果表明,HER-2 低表达乳腺癌对常规抗HER-2 治疗并不敏感,似乎也在一定程度上验证了这一猜测。但目前临床上对HER-2 低表达乳腺癌并没有针对性的治疗方案,早期的无创性准确诊断也难以达成,在临床工作早期实现HER-2 低表达乳腺癌的准确诊断及有效治疗成为了现如今临床工作的一大难题。常规预后因子雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、HER-2及增殖标志物Ki-67(marker of proliferation Ki-67, Ki-67)是确立乳腺癌分子分型的关键指标,并在指导乳腺癌全期治疗、手术方案的制订方面起着至关重要的作用。而多参数MRI则是诊断、鉴别及评价乳腺癌治疗反应的重要工具,在乳腺癌临床工作中应用广泛。因此本文把目标放置在通过MRI 找出HER-2 低表达乳腺癌的常规MRI 特征,并分析其与预后因子ER、PR 与Ki-67 之间可能存在的内在联系,旨在为临床前期有效诊断HER-2 低表达乳腺癌并实现个体化精细治疗提供帮助。
1 材料与方法
1.1 临床资料
本研究遵守《赫尔辛基宣言》,经湖南中医药大学第一附属医院伦理委员会批准,免除受试者知情同意(批准文号:HN-LL-LW-2023-015)。回顾性分析2014 年1 月1 日 至2022 年4 月12 日102 例 在 我 院 被病理确诊为HER-2低表达乳腺癌的患者。纳入标准:(1)均为住院患者,且相关临床病理及影像学资料完整;(2)在我院术后病理确诊为HER-2低表达乳腺癌;(3)动态对比增强MRI(dynamic contrast-enhancement MRI, DCE-MRI)图像上肿瘤病灶可测量最大直径≥10 mm;(4)术 前 行3.0 T 乳 腺MRI 检 查 者[包 括DCE-MRI、弥散加权成像(diffusion-weighted imaging,DWI)序列]。排除标准:(1)进行MRI 检查前,存在乳腺癌手术、激素替代治疗或放化疗者;(2)图像质量不合格、伪影过重对诊断分析结果存在干扰者;(3)截至本次MRI 检查前发现合并其他恶性疾病;(4)DCE-MRI上病灶为非肿块强化型患者。
1.2 检查方法
MRI 扫描使用美国GE 公司的GE 3.0 T Signa HDxt 超导MR 扫描仪,配备乳腺专用相控阵线圈。患者取俯卧位,双乳自然下垂置于乳腺专用相控阵线圈中。扫描序列及参数设置如下:(1)横断面T2非对称回波的最小二乘估计法迭代水脂分离序列,矩阵320×192,采集2 次,层间距1 mm,层厚4 mm,FOV 32 cm×32 cm,TR 8200 ms,TE 35 ms;(2)横断面Tl快速自旋回波序列,矩阵320×192,采集2次,层间距1 mm,层 厚4 mm,TE 7.8 ms, TR 400 ms, FOV 32 cm×32 cm;(3)横断面DWI,矩阵128×128,采集2 次,b 值分别取0 s/mm²及1000 s/mm²,TR 6000 ms,TE 62.5 ms,层间距1 mm,层厚4 mm,FOV 32 cm×32 cm;(4)乳腺评估容积成像梯度回波序列,FOV 37 cm×37 cm,翻转角12°,矩阵352×320,TE 2.1 ms,TR 4 ms,层间距0.7 mm,层厚1.4 mm。造影前先进性横断面的预扫,后经肘静脉注射钆双胺注射液[欧乃影,通用电气药业(上海)有限公司]作对比剂,流速为2 mL/s,共给予15 mL,扫描同时进行数字减影(注射对比剂30 s 后),采集连续的6 次图像,每一时相扫描时间均为60 s。
1.3 后处理操作及相应指标生成
患者的所有MRI 图像均在与检查设备配套的后处理工作站GE ADW 4.5 的Functool 软件上进行乳腺的后处理操作。感兴趣区(region of interest,ROI)的选择标准:在病灶实质强化最高的层面、范围最大的区域进行选取,范围为3~4 mm,ROI的选取区域应注意避开囊变、坏死及相应的正常组织,连续进行三次测量,表观弥散系数(apparent diffusion coefficient, ADC)值的结果取三次测量的平均值,之后在系统内生成相应的时间-信号强度曲线(time-signal intensity curve, TIC)。
1.4 MRI特征分析
由两名分别在乳腺影像诊断方面具有5年(住院医师)和8年(主治医师)诊断经验的放射科医师采取双盲法独立进行图像分析及测量。内容包括病灶基本情况(病灶分布、病灶个数、肿块最大直径)、MRI 征象(肿块边缘、肿块形态、内部强化特征、TIC 类型、ADC 值)。如果记录结果存在争议,则邀请从事乳腺诊断工作近20 年放射科主任医师一同进行讨论分析,并由三人协商得出最终结论。
1.5 免疫组化分析
根据免疫组化结果确定肿瘤内部ER、PR、HER-2 与Ki-67 表达信息,其标准依据中国临床肿瘤学会乳腺癌诊疗指南2021。
HER-2低表达标准为:(1)HER-2免疫组化为(+)。(2)HER-2免疫组化为(++)时,则进行FISH检验,FISH检验为基因未扩增(-)时,则为HER-2 低表达。ER 阳性标准:阳性表达为癌细胞核染色≥1%。PR 阳性标准:阳性表达为癌细胞核染色≥1%。Ki-67 阳性标准:阳性表达为细胞核中出现棕色或棕褐色颗粒≥14%。
1.6 统计学分析
使用SPSS 25.0 统计分析软件进行各项临床或影像学指标的数据分析。采用组内相关系数(intra-class correlation coefficient, ICC)用于检测两个观察者内和观察者间的一致性。根据免疫组化结果,在预后因子的阳性组与阴性组中,比较患者临床病例、DCE-MRI表观形态学特征、DCE-MRI或DWI 定量/半定量参数等。计量资料根据正态性及方差齐性的满足情况,可采用独立样本t检验、独立样本近似t检验或Wilcoxon 符号秩和检验三种方法。计数资料根据最小期望计数T及总例数大小,可采用Fisher 确切概率法、Yates 校正卡方检验或Pearson检验。等级资料统计分析主要以Mann-WhitneyU检验为主,最后通过二分类logistic 回归分析探讨各组间的基本临床病理及MRI 征象特点差异,P<0.05为差异有统计学意义。
2 结果
2.1 患者基本病理情况
在严格入组筛选过后,本研究最终排除50 例未达标病例,总计纳入了52名乳腺癌患者,均为肿块型强化乳腺癌。年龄29~74(51.10±10.67)岁,病理学类型非特殊型浸润性乳腺癌占绝大多数(50/52,96.2%),其余有1 例导管内癌以及1 例浸润性神经内分泌癌。乳腺癌的组织学分级以Ⅱ~Ⅲ为主(47/54, 87.0%),其中有2例患者存在可能的两种组织学分级(Ⅰ-Ⅱ、Ⅱ-Ⅲ),我们将两种可能性均纳入。根据ER(+/-)、PR(+/-)、Ki-67(+/-)以及HER-2(+/++)表达情况将所有病例进行四次分组,分别进行临床病理与影像学特征的分析。
2.2 观察者之间一致性
ICC 检验显示各特征变量在观察者之间的一致性(可重复性)良好,8 个特征参数ICC 在0.883~0.972之间(表1)。
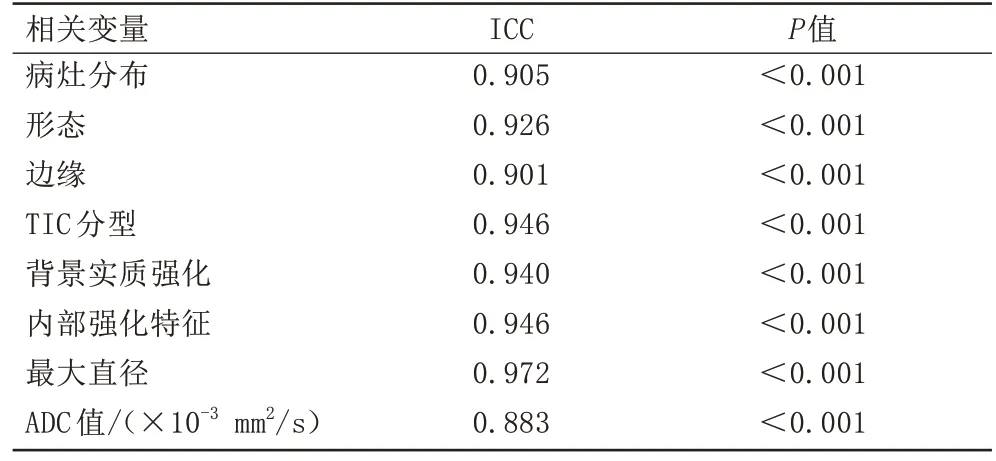
表1 组间一致性检验Tab.1 Inter-group consistency test
2.3 HER-2低表达乳腺癌常见的MRI特征
HER-2 低表达乳腺癌MRI 征象多表现为:单个病灶(41/52, 78.8%),边缘毛刺(33/52, 63.5%),肿块见分叶征(30/52, 61.5%),内部不均匀强化(36/52,69.2%),TIC类型以Ⅲ型为主(46/52, 88.5%),几乎无或少量背景实质强化(33/52, 63.5%),ADC 值均值约为(0.767±0.143)×10-3mm2/s,取值范围为(0.512~1.200)×10-3mm2/s,示例见图1。

2.4 预后因子与临床病理及MRI特征的相关性分析
预后因子与临床病理及MRI 特征的统计学分析结果总结见表2、3。研究结果可见,ER 与PR 之间相关的临床病理及MRI特征表现十分相似。ER、PR阳性组,肿块边缘多见毛刺征(ER 与PR: 72.1%,P=0.008),内部强化多不均匀(ER: 76.7%,P=0.030,PR: 79.1%,P=0.003),组 织 学 分 级 较 低(ER:P=0.008, PR:P=0.003)。ER、PR 阴性组,多边缘模糊(ER 与PR: 55.6%,P=0.008),内部强化以环形为主(ER: 66.7%,P=0.030, PR: 77.8%,P=0.003)。Ki-67阳性组与阴性组相比,肿块形态多呈分叶征(68.2%,P=0.034),肿块组织学分级较高(P=0.003)。而年龄、背景实质强化程度、TIC类型等临床病理MR 特征在各组间差异均无统计学意义。尽管ER、PR 阴性组中肿块最大直径>2 cm 亚组的比例和ADC 值要大于ER、PR 阳性组[肿块最大直径>2 cm, ER: 88.9% vs.48.8%,PR: 55.6% vs.53.5%;ADC 值,ER: (0.791±0.092)×10-3mm2/s vs.(0.761±0.153)×10-3mm2/s,PR: (0.787±0.104)×10-3mm2/s vs.(0.762±0.152)×10-3mm2/s],Ki-67 阳性组中肿块最大直径>2 cm的亚组比例要高于阴性组,ADC 的值要低于阴性组[肿块最大直径>2 cm: 56.8% vs.37.5%;ADC值: (0.761±0.137)×10-3mm2/s vs.(0.800±0.189)×10-3mm2/s]。但这些结果差异均无统计学意义。

表2 ER、PR组间临床病理及MRI特征比较Tab.2 Comparison of clinicopathologic and MRI features between ER and PR groups
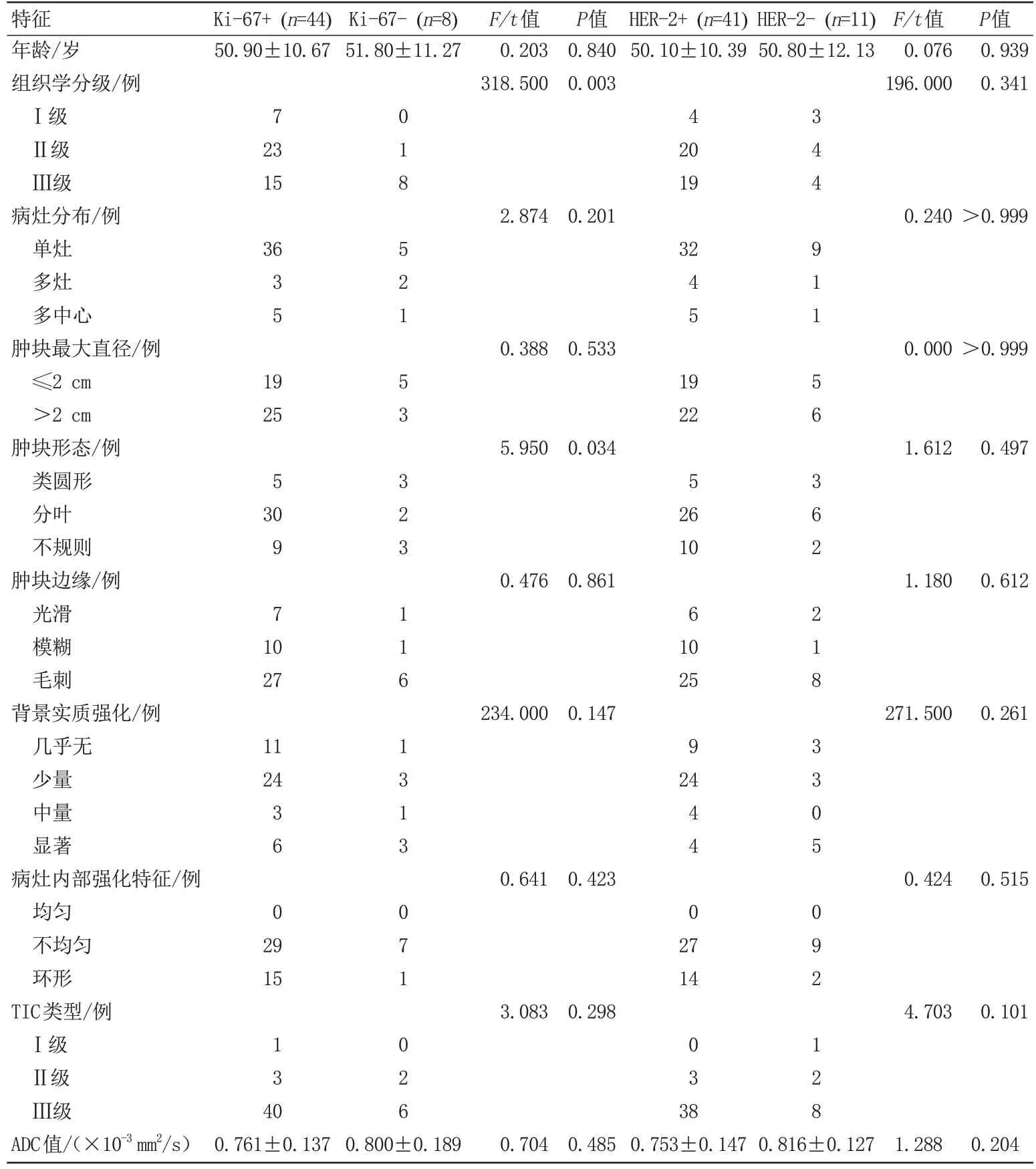
表3 Ki-67、HER-2组间临床病理及MRI特征比较Tab.3 Comparison of clinicopathologic and MRI features between Ki-67 and HER-2 groups
2.5 二分类logistic回归分析
本研究将单因素分析中所有有意义的参数纳入二元logistic 回归分析当中(由于HER-2 组单因素分析中未得出有意义的参数,因此未纳入分析),结果提示组织学分级是预测HER-2低表达乳腺癌中ER、PR、Ki-67 表达的独立相关因素(P=0.032,P=0.022,P=0.003),内部强化特征是预测HER-2低表达乳腺癌中ER、PR 表达的独立相关因素(P=0.041,P=0.014),具体结果见表4。

表4 各因素对组间基本临床病理及MRI征象特点预测价值的logistic回归分析Tab.4 Logistic regression analysis of the predictive value of factors on basic clinicopathological and MRI sign characteristics between groups
3 讨论
本研究应用单因素分析以及二分类logistic回归分析建立联合诊断模型,得出HER-2低表达乳腺癌常见的MRI 征象特点以及其与预后因子的相关性。结果显示HER-2低表达乳腺癌的临床病理(病理学分型、组织学分级)与MRI特征(病灶分布,边缘情况,肿块形态,内部强化特征,TIC 类型,背景实质强化)具有一定的特异性,二分类logistic 回归分析提示组织学分级、内部强化特征是HER-2低表达乳腺癌中部分相关预后因子的独立相关因素,为临床早期诊断HER-2 低表达乳腺癌以及后续治疗方案的制订与调整提供帮助。
3.1 HER-2 低表达乳腺癌病理特征与预后因子的关系
组织学分级是反映乳腺癌恶性程度的常规指标之一,与腺管的形成、细胞核多形性以及核分裂计数等因素相关。SHIN 等[3]与PAN 等[4]等研究结果指出,乳腺癌肿块较高的组织学分级与高的Ki-67 状态密切相关。而王晓敏等[5]的研究也指出,HER-2 低表达患者ER/PR 表达阴性者乳腺癌组织学分级比阳性组更高。这也与本研究结果一致。Ki-67 是一种细胞内的分裂增殖的结合蛋白,在乳腺癌中的增殖活性通常高于正常乳腺细胞,其过度表达常导致肿瘤细胞的高增殖性[4],而较高肿瘤细胞增殖性意味着肿瘤的高恶性程度、高浸润能力以及较差的预后。ER/PR阴性组更丰富的血供也能加快肿块的分裂、生长以及转移速度,肿瘤的恶性程度较高[3]。因此,Ki-67的阳性与ER/PR 阴性状态可能与乳腺癌肿瘤组织的高组织学分级存在一定的一致性。这也预示着预后因子Ki-67 与ER/PR 表达状态的有效判别对肿瘤组织组织学分级的高低具有一定的预测价值。
3.2 HER-2低表达乳腺癌DCE-MRI特征与预后因子的关系
本研究发现,在HER-2 低表达乳腺癌中ER 与PR阳性表达与否之间存在高度的一致性,且ER 与PR 之间相关的临床病理及MRI 特征研究结果高度吻合。推测其原因,可能是由于PR 的表达在一定程度上依赖于ER的表达,是雌激素作用下的产物,且两者在发挥功能上常常是处于协同状态[6],因此临床上多数PR阳性表达的乳腺癌患者中均出现ER的阳性表达。
本研究结果显示,病灶出现环形强化者,多为ER/PR 阴性表达,而ER/PR 阳性者则以不均匀强化多见。这也与NET 等[7]研究部分一致,NET 等在回顾性研究中发现,ER 的阴性表达与肿瘤内部的环形强化存在显著的相关性。而在徐丽娜等[8]的研究指出,ER/PR 表达阴性者,病灶更易出现环形强化。ER/PR能够通过抑制血管内皮因子的生成从而对肿瘤血管的产生进行抑制,因此ER/PR表达阴性者相比阳性组肿瘤新生血管更丰富,而新生的肿瘤血管多趋向于出现在生长更迅速的外周区域,肿瘤中心区域也容易因为缺血缺氧出现坏死或纤维化,故而ER/PR表达阴性者更易出现环形强化[9]。ER/PR阳性者因为新生血管较少,肿瘤生长发育速度较慢,则更易出现均匀/不均匀的强化。
卢艳丽等[10]研究发现,乳腺癌肿块周围出现毛刺征的患者,ER/PR阳性率较高,且毛刺征与ER/PR的阳性表达成正比。这一点跟IKINK 等[11]研究结果类似。毛刺征的形成机制可能与肿块周围纤维结缔组织与癌周乳腺导管增生相关,其中也可能存在少许癌细胞的浸润。国内外对于毛刺征是否能有效预测乳腺癌恶性程度仍存在争议。但在本研究中,毛刺征多出现在ER/PR 阳性表达组,其相比于阴性组,生长速度及转移速度较慢,恶性程度较低,预后较好。这可能也提示了毛刺征在HER-2 阴性乳腺癌中是恶性程度更低的象征。而ER/PR 表达阴性组更易出现模糊的肿块边缘,这可能是ER/PR 表达阴性组血供丰富,恶性程度更高,浸润性强的体现。这两者对ER/PR表达阳性与阴性之间的鉴别有一定价值。
本研究发现Ki-67 阳性组中分叶征比例明显高于Ki-67阴性组。肿块表面不光滑,呈现凹凸不平样改变被称为分叶征,其形成可能与某些因素有关,如肿瘤各个方向的生长速度不一、存在周围结构阻碍向外生长、多个病灶之间存在相互重叠融合等[12-13]。由于Ki-67 的阳性能有效促进肿瘤细胞的分裂、生长,而肿块越大,周围各部分肿瘤血管分布出现差异的可能性就越大,各部分生长速度更容易出现不一致,从而导致分叶征的发生。
在CHEN 等[14]的研究结果中,ER/PR 阴性组乳腺癌肿块最大直径明显大于阳性组。这与NET 等[7]、黄伟[15]研究结果相似。YUAN等[16]的研究也指出,ER/PR阳性组肿块最大直径更小(P<0.001)。原因可能在于,相比于阳性组,ER/PR 的阴性表达肿瘤新生血管更多,以至于肿瘤血供及氧供丰富,生长速度加快,肿瘤尺寸增大[9],而Ki-67 的阳性状态也能够促进肿瘤细胞的高增殖[4],对肿瘤的生长起到积极的促进作用。SHIN 等[3]对Ki-67 的研究结果显示,较高的Ki-67 状态与较大的肿瘤直径高度相关,在一定程度上体现了这一点。而这一研究结果也与多数国内研究一致[17-19]。但在本研究中,尽管ER/PR 阴性组与Ki-67阳性组肿块的最大直径均大于ER/PR阳性组与Ki-67 阴性组,但两组之间差异均无统计学意义。出现这一状况的原因可能与纳入患者的个体间差异以及纳入研究的病例样本量不足等因素相关。更加客观的结论仍需多中心、大样本的进一步实验来得出。
3.3 HER-2低表达乳腺癌DWI特征与预后因子的关系
ADC值是DWI序列量化活体组织内部水分子弥散受限程度的常用指标。通常而言,乳腺癌细胞恶性程度高,繁殖速度快,排列紧密,细胞核大,核质比高,细胞内外水分子运动受限程度大,ADC 值往往偏低[20-22]。LUO 等[23]研究指出,Ki-67 阳性组相比于阴性组ADC 值偏低,这也与FAN 等[24]的研究结果一致。且SHIN等[3]的研究结果显示Ki-67表达状态与ADC值呈明显的负相关。这可能是因为Ki-67 阳性的细胞可能拥有更大的体积和核质比,从而导致Ki-67阳性组细胞群细胞内外空间减小,水分子弥散受限明显,ADC 值降低。当谈及ER/PR 表达状态对乳腺癌ADC 值的影响,国内外多数学者[25-27]一致认为ER/PR 阴性组ADC 值要高于ER/PR 阳性组。由于常规ADC 值的测量难免受到组织内毛细血管内灌注的影响,而ER/PR阴性组组织内部毛细血管更丰富,这会加重灌注因素对ADC 值的影响,导致测量的ADC 值偏高。而CHOI等[28]的早期研究也表明,ER 阳性组乳腺癌病灶的细胞密度相比于ER阴性组更高。以上两个因素均可以导致ER/PR阴性组ADC值高于ER/PR阳性组。本研究结果与上述研究部分相似,ER/PR 阴性组ADC 值要高于ER/PR 阳性组,Ki-67 阳性组相比于阴性组ADC 值偏低,但两组差异均无统计学意义,究其原因,可能与入组病例的病理分型,组织学分级等不完全一致造成的患者间内部的异质性以及纳入研究的病例样本量不足等因素相关。未来仍需进一步标准化入组标准及试验流程、纳入更大的样本量的大规模研究以得出更准确的结论。
3.4 HER-2低表达乳腺癌中HER-2表达状态差异的结论与思考
MODI 等[29]对HER-2 低表达乳腺癌的预后分析试验发现:HER-2(2+)表达的患者会有更差的预后,患者生存期较短。尽管此研究规模小、患者数量很少,且对ER/PR 的表达状态存在一些限制。但这仍提出了HER-2(1+)与HER-2(2+)肿瘤生物学特性存在显著差异的可能性。但GAMPENRIEDER 等[1]对608 例HER-2 低表达乳腺癌患者的大规模预后调查中发现,HER-2(1+)与HER-2(2+)这两个HER-2 低表达组亚型之间不存在任何预后差异。MODI 等[30]一项使用曲妥珠单抗治疗HER-2低表达患者的Ⅱb期临床试验中也提出,HER-2表达1+和2+的肿瘤临床治疗反应基本一致。而本研究也没有发现HER-2(1+)与HER-2(2+)组的临床病理及MRI特征表现存在任何差异。因此,我们 猜 测,HER-2 低 表 达 乳 腺 癌 中HER-2(1+)与HER-2(2+)肿瘤的发生、发展、治疗反应及预后存在很大的相似性。
3.5 本研究的局限性
本研究仍存在一些局限性:首先,样本量还不够大,预后因子的阴性组样本量较少,尽管本研究的纳入标准以及试验分析步骤十分严格,但结果依旧容易受随机误差的影响;其次,本研究中所有患者均为肿块型乳腺癌,后续仍需对非肿块病变患者进行更多的研究,以调查治疗前MRI在这些患者中的应用。
4 结论
综上所述,多序列MRI 对HER-2 低表达乳腺癌的检出以及预后因子的鉴别与评估存在一定的价值,HER-2 低表达乳腺癌的MRI 表现存在一定的特征性,预后因子(ER、PR 及Ki-67)与HER-2 低表达乳腺癌中部分临床病理与MRI特征存在良好的相关性,能够为早期临床诊断及治疗方案的制订提供一些帮助。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:邹紫勤、杨宇设计本研究的方案,对稿件的重要内容进行了修改;邹紫勤起草和撰写稿件,获取、分析或解释本研究的数据;黄艳芳、杨宇获取、分析或解释本研究的数据,对稿件的重要内容进行了修改;杨宇获得了湖南省自然科学基金项目资助。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

