不同浓度丙氨酰谷氨酰胺用于胃肠肿瘤术后患者肠外营养比较的随机对照临床试验
梁宏岩,葛杰,刘婷,赵庭雨,谢凯强,刘合利,唐密密
[中南大学湘雅医院 1.药学部 3.胃肠外科,湖南 长沙 410008;2.国家老年疾病临床医学研究中心(湘雅医院),湖南 长沙 410008]
消化道肿瘤在恶性肿瘤中占据重要位置,胃癌(gastric carcinoma,GC)和结直肠癌(colorectal carcinoma,CRC)居高不下的发病率和病死率严重影响人们生活水平并威胁生命健康[1],外科手术仍是主要的治疗方法[2-3],术后患者需要给予必要的营养支持。肠外营养[4]是为不能口服、重症患者提供营养支持的重要途径。肠外营养由脂肪乳、氨基酸、葡萄糖、微量元素、电解质等几十种组分混合组成,此外,免疫营养素谷氨酰胺(glutamine,Gln)、精氨酸等,也在临床营养中得到广泛认可[5]。
Gln 是机体最丰富的游离氨基酸,约占血液中游离氨基酸总量的20%。Gln 被认为是“免疫系统的燃料”[6-7],是机体的条件必需氨基酸[8]。研究[9-11]表明,围手术期补充Gln 有助于改善GC、CRC 患者营养水平,提高患者术后血清白蛋白(albumin,ALB) 和前白蛋白(prealbumin,PAB)浓度,提高患者术后血清免疫球蛋白G(immunoglobulin G,IgG)、 免 疫 球 蛋 白 M(immunoglobulin M,IgM)、 免 疫 球 蛋 白 A(immunoglobulin A,IgA)水平以及CD4+T 淋巴细胞和辅助性T 细胞/抑制性T 细胞比值(Th/Ts),降低患者TNF-α 水平。由于Gln 溶解度低且在水溶液中不稳定,多数肠外和肠内营养中所使用的氨基酸溶液中并不含有Gln[8]。丙氨酰谷氨酰胺(alanyl glutamine,Ala-Gln)易溶于水,体内可分解为Gln和丙氨酸,这使得肠外营养补充Gln 成为可能[12]。
丙氨酰谷氨酰胺注射液是一种高浓度溶液,不可直接输注。在输注前,必须与可配伍的氨基酸溶液或含有氨基酸的载体溶液混合。我国药品说明书表明“通过丙氨酰谷氨酰胺供给的氨基酸量不应超过全部氨基酸供给量的20%[13]”。而欧洲说明书表明,通过Dipeptiven(Ala-Gln 注射液商品名)供给的氨基酸量则不应超过总氨基酸量30%。此外,多数临床研究[13-16]显示,Ala-Gln 占全部氨基酸量超过20%,甚至达30%。临床药师在Ala-Gln肠外营养处方审核方面将Ala-Gln 占全部氨基酸不超过20%作为处方审核的内容。调取某三甲医院肠外营养处方分析结果显示,Ala-Gln 超说明书规定剂量(占全部氨基酸不超过20%) 使用高达98.4%。因此,本研究旨在探究在肠外营养中Ala-Gln 占总氨基酸比例不同,对胃肠肿瘤患者营养水平、肝肾功能、免疫指标、术后感染及并发症发生情况、术后住院时间及住院费用等的影响,为Ala-Gln 规范使用提供科学依据和药学指导。
1 资料与方法
1.1 研究对象
本研究为随机对照研究,受试者来源于2021年6月—2022年4月中南大学湘雅医院胃肠外科,胃肠肿瘤接受手术治疗,且术后需要肠外营养的患者。入选标准:⑴ 胃肠肿瘤预接受手术治疗患者;⑵年龄18~82 周岁;⑶ 存在营养风险(NRS2002 评分≥3 或PG-SGA 评分≥4);⑷ 神志清楚,生命体征平稳;⑸ 术后需要肠外营养支持。排除标准:⑴ 肝脏功能不全或疾病;⑵ 肾脏功能不全或疾病,艾滋、梅毒、乙肝、丙肝等检测结果呈阳性;⑶ 入院前4 周内出现严重感染,包括但不限于需住院治疗的感染并发症、菌血症、重度肺炎等;⑷ 具有高血压危象或高血压脑病病史、重大心血管疾病的患者,包括:心肌梗死或不稳定型心绞痛史;⑸ 纽约心脏病协会(NYHA)≥Ⅱ级的充血性心力衰竭(CHF);⑹ 妊娠及哺乳期女性患者;⑺ 先天氨基酸代谢异常、有严重药物过敏史或其他过敏体质的患者;⑻ 其他研究者认为不适合进入该研究的情况。
本研究通过中南大学湘雅医院伦理委员会伦理审批[伦理GCP 第(科202107126) 号],所有入组患者均获得知情同意。
1.2 研究方法
1.2.1 试验分组及给药方法根据上述入选与排除标准纳入术后给予肠外营养支持患者,并按照随机化方案将患者随机分为低占比组(肠外营养中添加Ala-Gln 按照我国说明书使用剂量占总氨基酸20%)与高占比组(肠外营养中添加Ala-Gln 按照欧洲药品说明书剂量占总氨基酸30%)。本试验参考两项既往使用不同浓度Ala-Gln 的临床研究[17-18],以监测指标PAB 计算[19]得出样本量不应少于40 例,即每组不少于20 例。试验期间,患者术后肠外营养所用药品包括脂肪乳氨基酸(17)葡萄糖(11%)注射液、丙氨酰谷氨酰胺注射液、ω-3 鱼油脂肪乳注射液、氯化钾10%注射液、胰岛素、注射用多种维生素(12)、葡萄糖酸钙和复合磷酸氢钾等(表1)。已知脂肪乳氨基酸(17)葡萄糖(11%)注射液(1 440 mL)中含有氨基酸34 g,低占比组患者肠外营养中应添加Ala-Gln 8 g(Ala-Gln 占总氨基酸19.0%,近似为20%)[19],高占比组患者肠外营养中应添加Ala-Gln 15 g (Ala-Gln 占总氨基酸30.6%,近似为30%)[20]。本研究除调整Ala-Gln 剂量外,两组患者肠外营养处方中其他内容均一致。两组患者均在术后第1 天开始通过中心静脉给予以上肠外营养制剂支持,1 次/d,持续输注8~12 h。
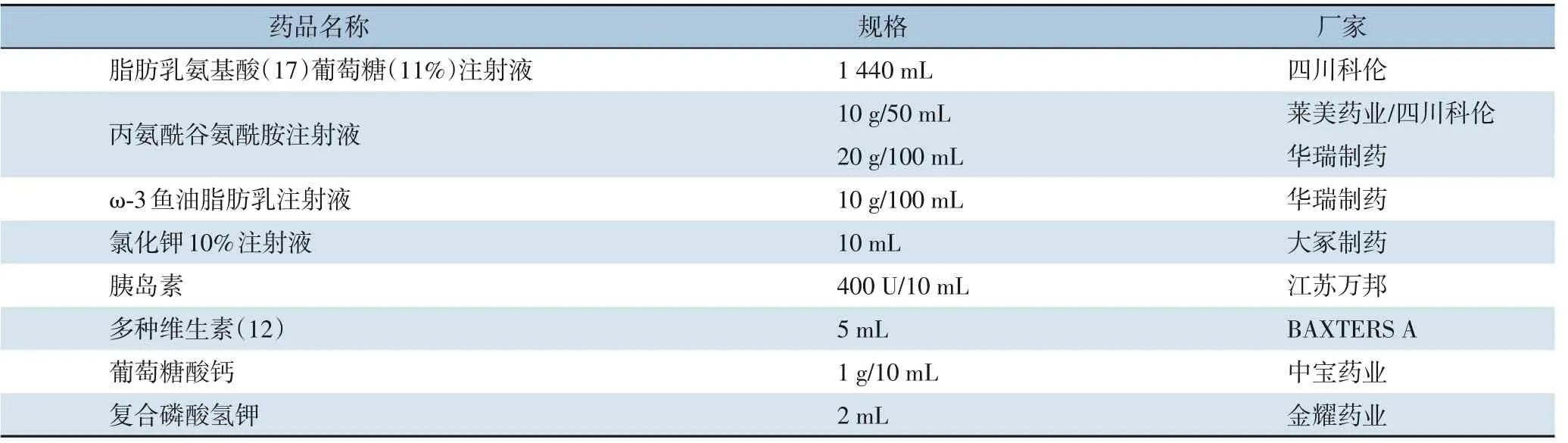
表1 肠外营养所用药品Table 1 Drugs used in parenteral nutrition
1.2.2 监测指标及方法本研究主要监测指标为PAB;次要指标包括:ALB、总蛋白(total protein,TP)、血红蛋白(hemoglobin,Hb);总胆汁酸(total bile acid,TBA)、 丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、 直接胆红素(direct bilirubin,DBIL);尿素 (urea,Ure),肌酐(creatinine,Cr);C 反应蛋白(C-reactive protein,CRP)、白细胞介素6 (interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α);IgG、IgM、IgA、CD3+T 淋巴细胞、CD4+T 淋巴细胞、CD8+T 淋巴细胞、Th/Ts、补体C3、补体C4;术后感染发生率、术后住院时间、住院费用等。在术前和肠外营养结束后1 d 监测以上指标。通过HIS病历系统提取患者基本信息,及检验信息,通过入院营养风险筛查与评估获得患者体格检查信息,通过病历系统收集患者术后感染及恢复情况。
1.3 不良事件报告
丙氨酰谷氨酰胺注射液药品说明书显示,正确使用时,尚未发现不良反应。当本品输注速度过快时,将出现寒战、恶心、呕吐,出现这种情况应当立即停药。药品不良反应判断依据卫健委因果判断准则评定法(1994年) 进行判断并上报[21-22]。本试验期间发生严重药物不良反应时,应当及时通知研究医生,采取停药、对症治疗等措施,最大程度减少对受试者伤害。同时,填写《不良反应事件报告表》及时报告我院药事管理委员会、报伦理备案。
1.4 统计学处理
采用SPSS 26.0 统计软件进行数据处理。计数资料用例数(百分比)[n(%)]描述,两组构成的比较采用χ2检验;对计量资料用Shapiro-Wilk 法进行正态性检验(P>0.05 为符合正态分布),符合正态分布的资料用均值±标准差(±s) 描述,使用独立样本t检验进行组间比较,不符合正态分布的计量资料用中位数(四分位间距)[M(IQR)]描述,使用Wilcoxon 秩和检验进行组间比较。采用重复测量方差分析比较两组医学检验值随时间的变化,采用多元线性回归分析差异影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
本研究纳入77 例患者,高占比组38 例,男女比例21∶17,平均年龄(61.42±8.58)岁,体质量指数(BMI)为(22.25±2.53)kg/m2,手术类型包括全胃切除17 例,胃病损切除2 例,直肠癌根治术6 例,结肠癌根治术8 例,小肠癌根治术5 例;NRS2002 评分≥3 的30 例,PG-SGA 评分4~8 的22 例,≥9 的10 例,肠外营养中位时间为5(2~7)d。低占比组39 例,男女比例24∶15,平均年龄(60.64±8.75)岁,BMI 为(22.56±2.10)kg/m2,手术类型包括全胃切除11 例,胃病损切除6 例,直肠癌根治术9 例,结肠癌根治术9 例,小肠癌根治术4 例;NRS2002 评分≥3 的33 例,PG-SGA 评分4~8 的23 例,≥9 的13 例,肠外营养中位时间为5(3~7)d。两组的一般资料差异均无统计学意义(均P>0.05)(表2)。
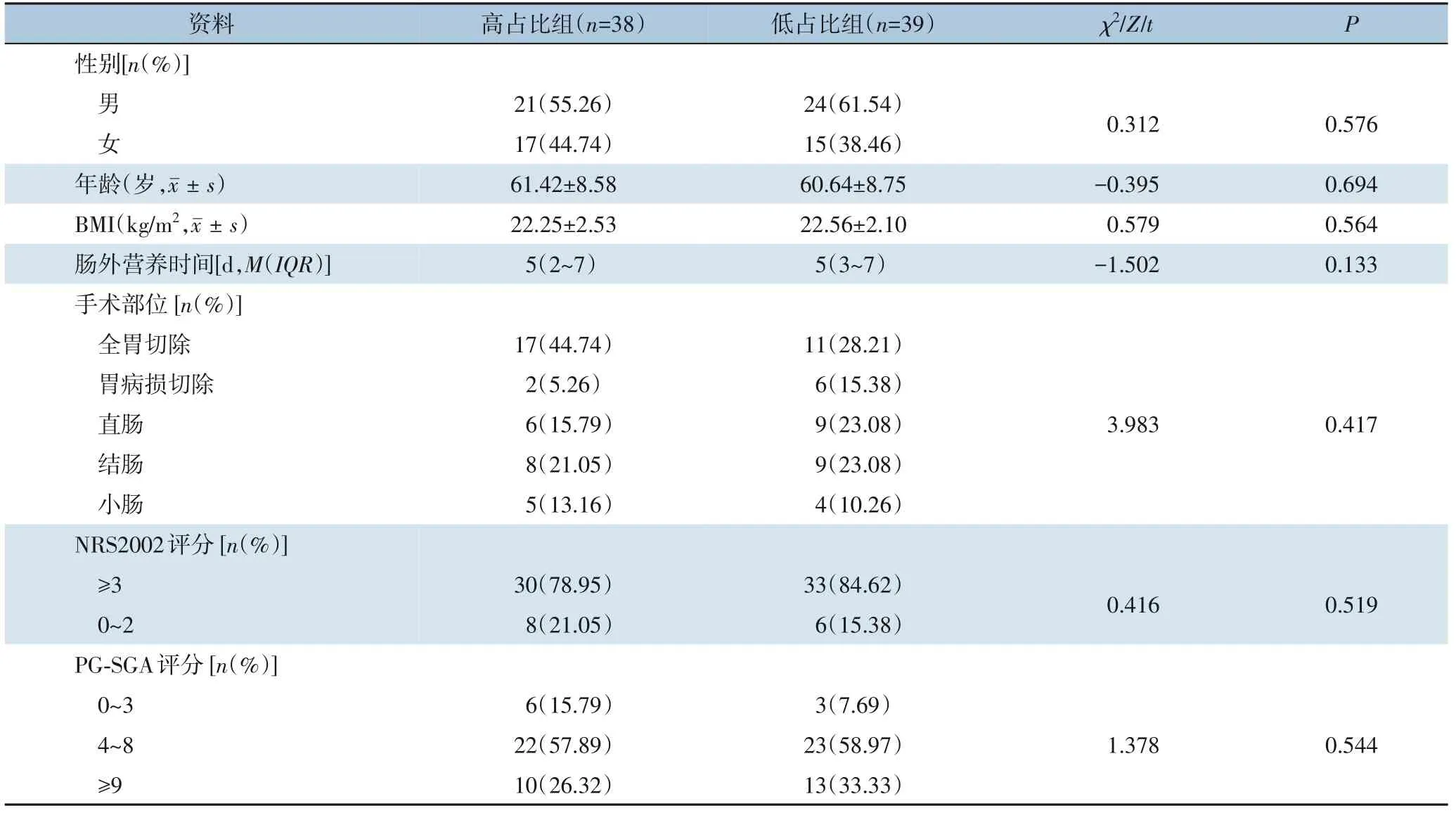
表2 患者一般资料Table 2 General information of patients
2.2 两组术前相关指标比较
2.2.1 营养指标及肝肾功能对两组患者术前所有营养及肝肾功能指标(PAB、 TP、 ALB、 Hb、TBIL、DBIL、TBA、ALT、AST、Ure、Cr)进行统计学分析,结果显示,两组间所有指标差异均无统计学意义(均P>0.05)(表3)。
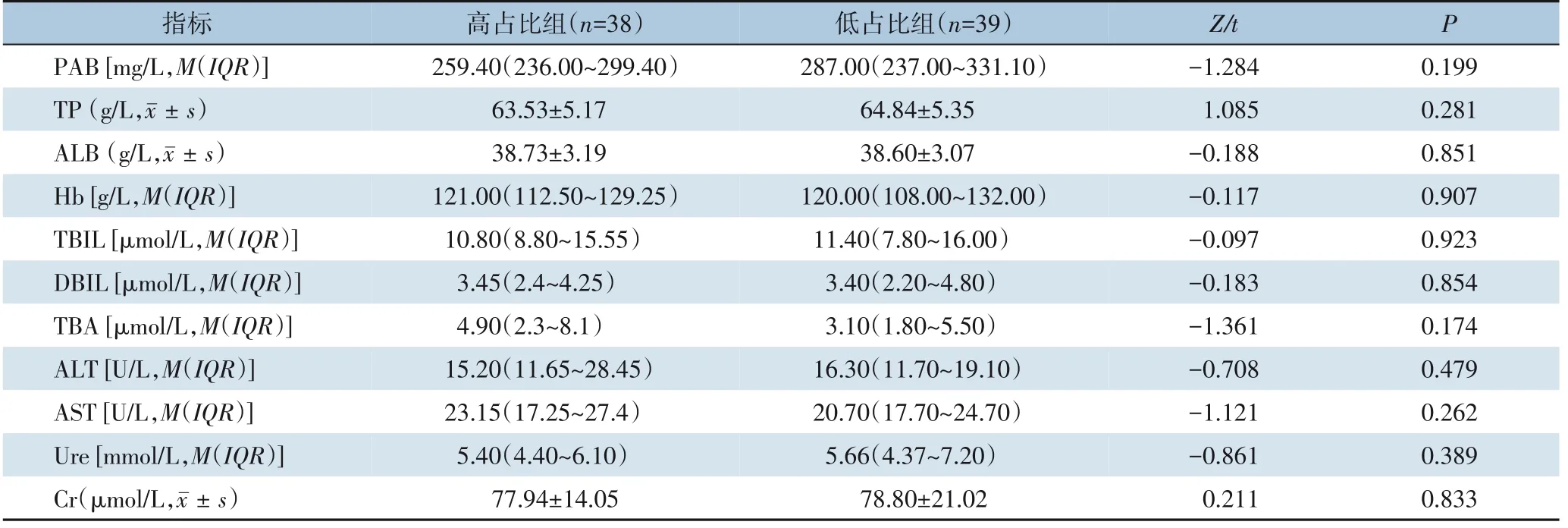
表3 两组患者术前营养指标及肝肾功能指标比较Table 3 Comparison of preoperative nutritional and liver/kidney function parameters between the two groups of patients
2.2.2 炎症/免疫指标对两组患者术前炎症/免疫指标(CRP、TNF-α、IL-6、Th/Ts、补体C4、补体C3、IgG、IgM、IgA 及CD3+、CD8+、CD4+细胞水平)进行统计学分析,结果显示,所有指标在两组间的差异均无统计学意义(均P>0.05)(表4)。
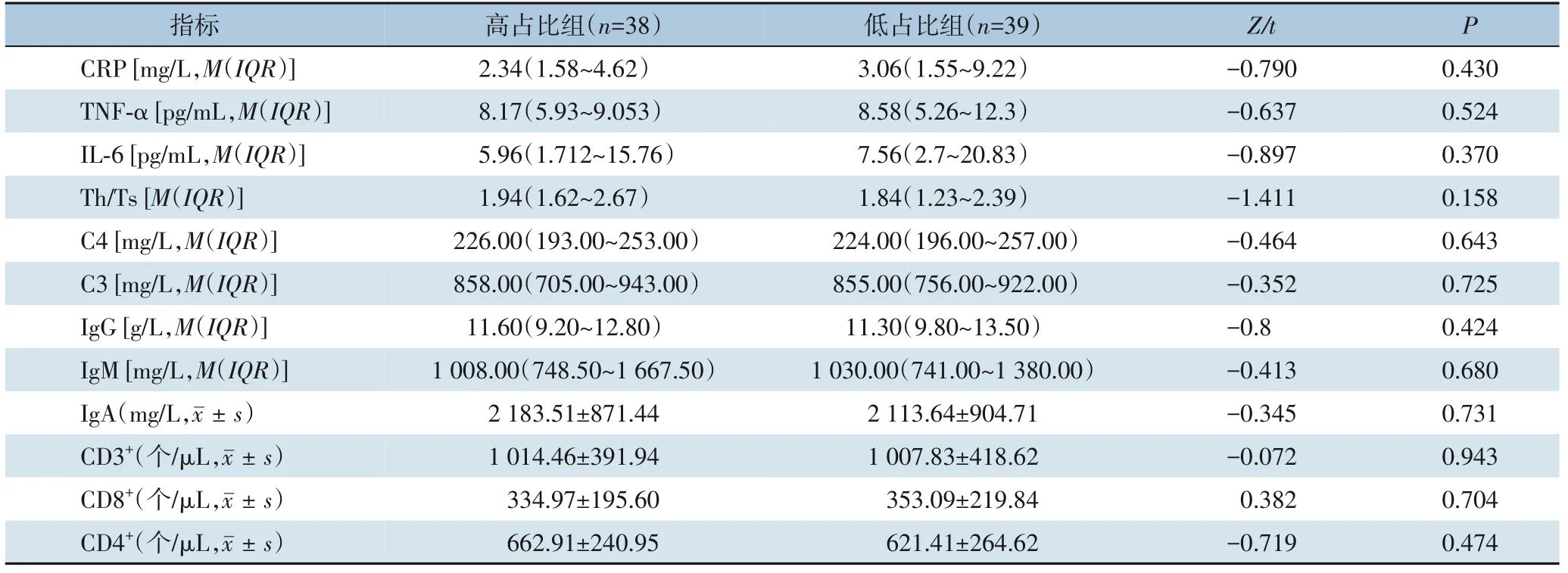
表4 两组患者术前炎症/免疫指标比较Table 4 Comparison of preoperative inflammation/immune indicators between the two groups of patients
2.3 两组患者肠外营养结束后营养及肝肾功能指标、免疫水平的变化
2.3.1 营养及肝肾功能指标采用重复测量方差分析比较两组患者肠外营养后的营养及肝肾功能指标。组内比较结果显示,所有患者的PAB、TP、ALB、Hb、TBA 术后水平均明显低于术前水平,TBIL、DBIL、ALT、AST、Ure 术后水平均明显高于术前水平(均P<0.05);组间比较结果显示,肠外营养结束后,主要监测指标PAB 及其他所有指标的差异均无统计学意义(均P>0.05);仅有TP(P=0.032)和ALB(P=0.008)存在分组与时间交互作用(均P<0.05)(表5)。
表5 两组患者肠外营养结束后的营养及肝肾功能指标变化比较(±s)Table 5 Comparison of changes in nutritional and liver/kidney function indexes after parenteral nutrition support between the two groups of patients(±s)
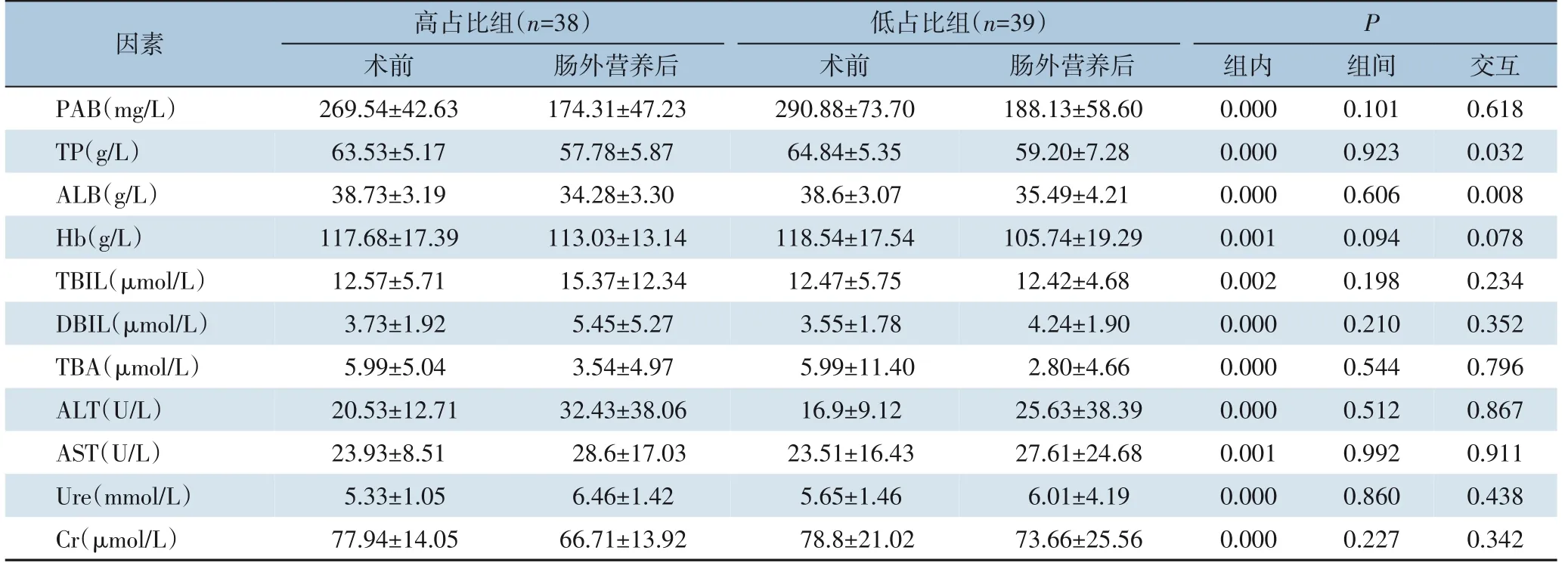
表5 两组患者肠外营养结束后的营养及肝肾功能指标变化比较(±s)Table 5 Comparison of changes in nutritional and liver/kidney function indexes after parenteral nutrition support between the two groups of patients(±s)
因素PAB(mg/L)TP(g/L)ALB(g/L)Hb(g/L)TBIL(μmol/L)DBIL(μmol/L)TBA(μmol/L)ALT(U/L)AST(U/L)Ure(mmol/L)Cr(μmol/L)高占比组(n=38)低占比组(n=39)P术前269.54±42.63 63.53±5.17 38.73±3.19 117.68±17.39 12.57±5.71 3.73±1.92 5.99±5.04 20.53±12.71 23.93±8.51 5.33±1.05 77.94±14.05肠外营养后174.31±47.23 57.78±5.87 34.28±3.30 113.03±13.14 15.37±12.34 5.45±5.27 3.54±4.97 32.43±38.06 28.6±17.03 6.46±1.42 66.71±13.92术前290.88±73.70 64.84±5.35 38.6±3.07 118.54±17.54 12.47±5.75 3.55±1.78 5.99±11.40 16.9±9.12 23.51±16.43 5.65±1.46 78.8±21.02肠外营养后188.13±58.60 59.20±7.28 35.49±4.21 105.74±19.29 12.42±4.68 4.24±1.90 2.80±4.66 25.63±38.39 27.61±24.68 6.01±4.19 73.66±25.56组内0.000 0.000 0.000 0.001 0.002 0.000 0.000 0.000 0.001 0.000 0.000组间0.101 0.923 0.606 0.094 0.198 0.210 0.544 0.512 0.992 0.860 0.227交互0.618 0.032 0.008 0.078 0.234 0.352 0.796 0.867 0.911 0.438 0.342
2.3.2 炎症/免疫指标采用重复测量方差分析比较两组患者术前和肠外营养后免疫指标。组内比较结果显示,所有患者的CRP、Th/Ts、补体C4 术后水平均明显高于术前水平,CD3+、CD4+、CD8+、IgG、IgA、IgM 术后水平均明显低于术前水平(均P<0.05);组间比较结果显示,肠外营养结束后,仅Th/Ts 的差异有统计学意义(P<0.05),其他指标差异均无统计学意义(均P>0.05);所有监测的炎症/免疫指标均无分组与时间交互作用(均P>0.05)(表6)。
表6 两组患者肠外营养后炎症/免疫指标变化比较(±s)Table 6 Comparison of changes in inflammation/immune indicators after parenteral nutrition support between the two groups of patients(±s)

表6 两组患者肠外营养后炎症/免疫指标变化比较(±s)Table 6 Comparison of changes in inflammation/immune indicators after parenteral nutrition support between the two groups of patients(±s)
因素CRP(mg/L)TNF-α(pg/mL)IL-6(pg/mL)CD3+(个/μL)CD4+(个/μL)CD8+(个/μL)Th/Ts IgG(g/L)IgA(mg/L)IgM(mg/L)C3(mg/L)C4(mg/L)P肠外营养后50.66±39.7 16.28±20.9 24.74±21.77 678.29±282.94 450.87±191.7 215.66±123.49 2.57±1.19 8.78±2.09 2 033.47±844.14 813.65±312.37 906.84±193.32 276.18±69.84高占比组(n=38)术前3.61±8.97 10.29±9.8 20.69±49.61 1 014.46±391.94 662.91±240.95 334.97±195.6 2.20±0.91 10.94±2.56 2 183.51±871.44 1 254.61±629.84 834.39±155.72 230.80±66.27低占比组(n=39)术前7.72±15.55 12.88±16.86 52.66±130.56 1 007.83±418.62 621.41±264.62 353.09±219.84 1.89±0.85 12.09±3.54 2 113.64±904.71 1 160.66±552.87 879.25±196.13 236.88±62.91肠外营养后57.21±49.21 19.39±79.05 21.01±16.94 707.89±296.46 431.86±206.14 260.25±132.98 2.01±1 9.38±2.99 1 635.66±735.64 946.03±484.32 886.97±158.09 273.91±85.69组内0.000 0.367 0.243 0.000 0.000 0.000 0.046 0.000 0.002 0.000 0.086 0.000组间0.334 0.674 0.217 0.867 0.492 0.364 0.026 0.108 0.163 0.836 0.707 0.874交互0.812 0.970 0.132 0.669 0.688 0.496 0.304 0.454 0.091 0.108 0.165 0.708
2.4 肠外营养期间其他药物使用情况
对两组患者在肠外营养期间可能影响营养、肝肾功能及免疫水平等指标,以及可能对患者术后产生影响的主要药品使用情况进行分析,结果显示,低占比组使用人血白蛋白针(20%)人数多于高占比组(P=0.025);使用鸦胆子油(P=0.620)和生长抑素(P=0.818)情况两组差异无统计学意义(表7)。

表7 两组患者肠外营养期间其他药物使用情况[n(%)]Table 7 Usage of other medications during parenteral nutrition in the two groups of patients[n(%)]
2.5 术后感染/并发症发生率、术后住院时间及住院费用
高占比组有2 例患者出现术后感染,低占比组有1 例出现术后并发症,两组在感染/并发症发生率方面差异无统计学意义(P=0.615)。高占比组术后平均住院时间为(7.32±1.58)d,中位数时间为7 (5~11) d;低占比组术后平均住院时间为(8.31±2.79)d,中位时间为8(5~22)d,低占比组术后住院时间长于高占比组,差异有统计学意义(P=0.045)。剔除异常值(术后住院22 d 患者)后,低占比组平均住院时间为(7.95±1.68)d,中位数为8(5~13)d,两组术后住院时间的差异无统计学意义(P=0.065)。两组住院费用的差异无统计学意义(P=0.876)(表8)。
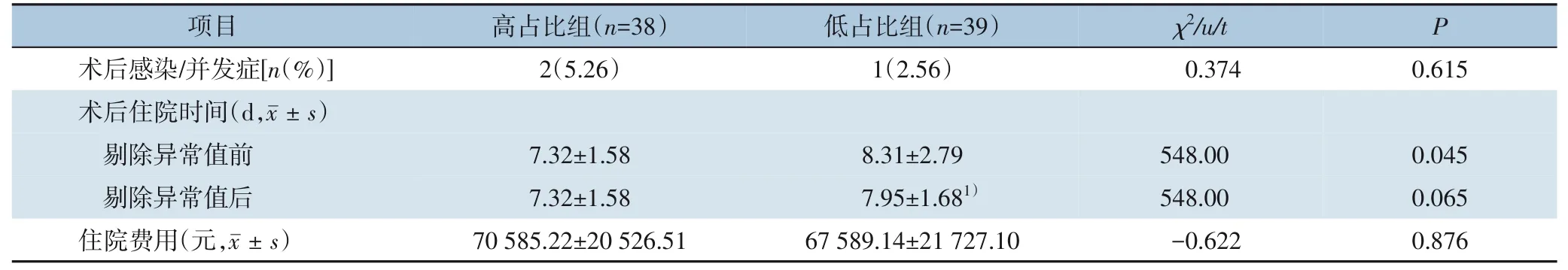
表8 两组患者术后感染/并发症发生率、术后住院时间和住院费用比较Table 8 Comparison of postoperative infection/complication rates,length of hospital stays,and in-hospital costs between the two groups of patients
2.6 多元线性回归分析
两组患者的TP 值和ALB 值间存在分组与时间的交互作用,故采用多元线性回归进一步分析,因变量为TP 和ALB,自变量为试验分组、患者疾病/手术亚组、BMI、性别、年龄、术后感染发生率、使用人血白蛋白针以及术前营养风险评分(NRS2002、PG-SGA)。TP 的多元线性回归结果显示,R2=0.167,德宾-沃森(dw) =1.859,年龄负向影响TP 水平(B=-0.239,P=0.013);ALB 结果显示,R2=0.180,dw=2.040,患者亚组正向影响ALB水平(B=0.632,P=0.039),年龄负向影响TP 水平(B=-0.143,P=0.009)(表9)。
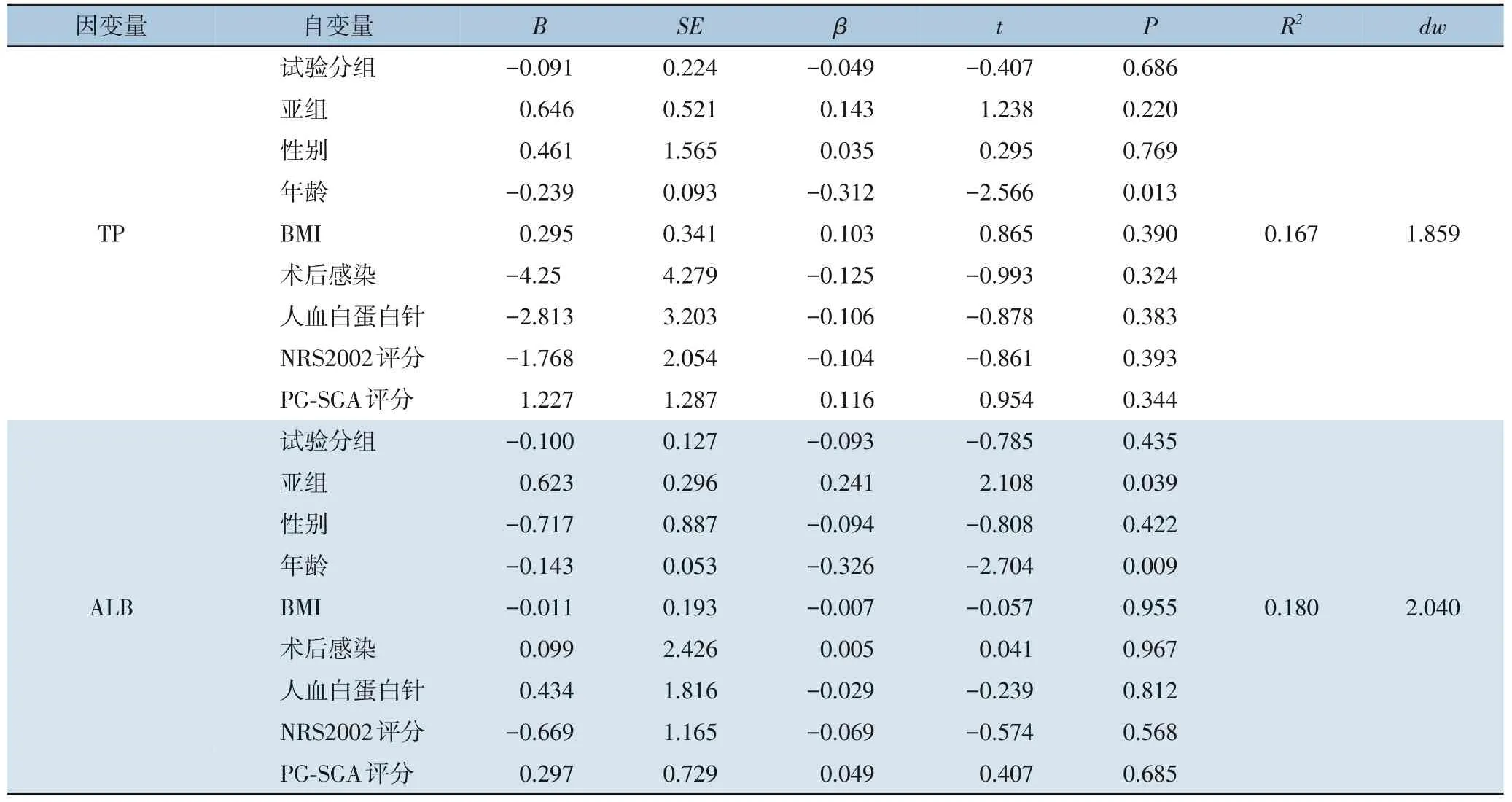
表9 两组肠外营养后TP、ALB的多元线性回归分析Table 9 Multivariate linear regression analysis of total protein and serum albumin after parenteral nutrition in two groups
3 讨论
本研究是在临床实际应用的基础上,依据国内、外药品说明书规定Ala-Gln 占全部氨基酸比例不同,比较Ala-Gln 占比全部氨基酸20%和30%的肠外营养对胃肠肿瘤患者术后营养指标及肝肾功能、免疫水平、术后感染及并发症、术后住院时间及住院费用等方面的影响。本研究纳入的患者为胃肠肿瘤手术患者,所有患者均为同一组主治医生,手术技能和用药习惯基本一致。
Ala-Gln 是常见的免疫营养药物,在体内分解为丙氨酸和Gln。Gln 是机体最丰富的游离氨基酸,具有促进蛋白质合成作用,是免疫细胞的燃料,补充Ala-Gln 旨在改善患者营养和免疫水平。本研究试验结果显示,不同浓度Ala-Gln 的肠外营养对主要监测指标PAB 无显著影响。本研究的主要监测指标PAB,半衰期仅有2 d,代谢迅速,对营养状况变化敏感,是评价患者营养状况、评判患者病情及预后的重要指标[23-25]。有研究[26]表明,PAB能够及时清除机体中感染的有毒物质,而在清除的过程中,导致其“被消耗”,当患者疾病处于急性发作期,PAB 水平与体内发生的炎性表现负相关。另有研究[27]表明,0.4 g/(kg·d)Gln 的肠外营养液(约占总氨基酸25%) 可改善创伤患者PAB水平。而本研究证实,Ala-Gln 占比全部氨基酸20%和30%对胃肠肿瘤患者PAB 水平无显著影响。
在手术等应激条件刺激下,机体易发生炎症反应导致ALB 渗漏至血管外组织间隙,同时术中失血也会造成ALB 的进一步降低[28]。Norberg 等[29]也证实大手术后ALB 水平会急剧下降33%,后缓慢上升。由于本研究时间限制,截至停止肠外营养时,本研究的受试者ALB 水平仍未恢复至术前水平。尤其是老年肿瘤患者,其肝脏质量、肝脏血流量以及酶活性以及代偿能力均比青年患者有所下降,手术创伤及营养摄入不足等情况都会导致肝脏合成ALB 能力下降。胃肠肿瘤患者营养补充需要长期进行,应避免术后营养不良[30],合理的营养干预十分重要。
Heyland 等[31]研究表明,重症患者入住ICU 后早期应用Gln 未改善患者临床结局,反而增加了病死率,该研究的一个实际情况是大量患者能量摄入不足,而Gln 超安全范围使用。部分重症患者肝肾功能受损、内环境紊乱,导致代谢Gln 能力下降[32]。Ala-Gln 占比全部氨基酸超过其说明书规定,是否会增加肝脏、肾脏负担也是本次研究是重要研究目的。本研究结果显示,与低占比组相比,高占比组并未增加胃肠肿瘤术后患者肝肾功能负担。
Gln 是快速代谢细胞的燃料,因其免疫调节作用被临床利用。T 淋巴细胞亚群分类较多,依据不同亚群功能差异可分为Th 和Ts 两类。CD4+为重要的Th 细胞,主要作用为辅助产生抗体和活化巨噬细胞;而CD8+属Ts 类细胞,具有抑制免疫反应作用。CD4+/CD8+比值能反映Th/Ts 二者之间的平衡,从而在一定程度上可反映机体免疫系统的稳定情况。当Th/Ts 升高时,体现机体免疫功能较强,反之则可能出现免疫抑制[33],Th/Ts 被认为是恶性肿瘤患者免疫抑制程度的重要指标[34]。有研究[35-37]表明,肠内或肠外营养中添加Gln 可提升患者Th/Ts水平,促进患者免疫调节。本研究发现,在肠外营养结束后,高占比组和低占比组的Th/Ts 水平较术前均有所升高,高占比组升高更明显,且显著高于低占比组,表明高剂量Ala-Gln 在T 细胞免疫调节作用优于低占比组。
一些研究[38-39]表明,Gln 在炎症反应过程可能通过减少促炎因子TNF-α、IL-6 的产生,起到保护肠黏膜作用。其他免疫指标如CRP 等也是反映术后感染的重要指标。TNF-α 是由单核细胞/巨噬细胞活化生成的一种细胞因子,在感染患者中水平显著升高,较高水平TNF-α 与手术后感染发生密切相关[40],研究表明GC 术后感染患者TNF-α 明显高于未感染患者[41]。IL-6 由巨噬细胞和辅助T 细胞分泌,是参与机体应激与免疫调节重要的因子,其水平可于2~3 h 内快速升高至峰值,参与和促进机体炎症反应[42]。手术创伤导致患者体内IL-6 升高,而且与手术创伤的程度具有明显的关联。本研究结果显示,高/低剂量Ala-Gln 对以上免疫指标无显著影响。
GC 根治术后并发症发生率为8.0%~35.7[43],主要并发症包括肠梗阻、腹腔出血、吻合口瘘、十二指肠残端瘘等[44];CRC 术后并发症主要有伤口感染、吻合口瘘、造口并发症等[45],并发症不仅导致住院时间延长,医疗费用增加,甚至直接影响患者生活质量及长期疗效。Ala-Gln 作为免疫药理营养素,可以降低患者术后并发症发生率[8,46-47]。但本研究发现Ala-Gln 占全部氨基酸比例不同对术后感染发生率、术后住院时间及住院费用无显著影响。
本研究立足于临床实践,从临床药师视角,以发现问题、解决问题的思路,从Ala-Gln 国内、外药品说明书规定剂量矛盾、药品使用说明书规定剂量与实际应用矛盾等方面入手,开展临床研究,旨在解决Ala-Gln 临床应用实际问题,为规范用药指导提供科学依据。并且在试验设计上,严格遵照临床诊疗规范,最大限度地保障了患者利益。
综上所述,本研究发现,Ala-Gln 占全部氨基酸比例不同对主要营养指标、肝肾功能以及对术后感染/并发症发生率、住院期间费的影响均无显著差异,高占比组Th/Ts 高于低占比组,提示30%占比Ala-Gln 的T 细胞免疫调节作用优于20%占比Ala-Gln。临床上应该多结合患者情况,选择合适的氨基酸制剂。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:梁宏岩、葛杰负责研究设计、实施、数据分析、文章撰写;刘婷、赵庭雨负责数据采集、文章撰写、文章审阅;谢凯强负责文章审阅、校正;刘合利、唐密密负责研究设计、实施、文章审阅、研究指导。

