慢性间歇性低氧大鼠肾组织差异蛋白的定量分析:基于TMTPRM技术
魏 敏,陈乃洁,李璟怡,刘丹,沈双宏,王丰,吴润华,陈沁
福建中医药大学1中西医结合学院,2临床技能教学中心,福建 福州350122
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种严重影响着公众健康的睡眠呼吸障碍性疾病,其特征是上呼吸道狭窄以及睡眠依赖性上呼吸道塌陷,导致通气周期性减少或停止,随之发生缺氧,高碳酸血症或觉醒[1]。随着中国人口的老龄化,OSAHS的患病率逐年增加[2],已成为严重的公共健康问题。目前OSAHS的研究热点主要集中在心脑血管疾病领域[3-6],而关于其引起的肾损伤相关研究较少[7,8],OSAHS病因复杂,会引起肾损伤医学界已达成共识,慢性间歇性低氧(CIH)是OSAHS引起肾损伤的独立危险因素[9],但具体机制尚不清楚。因此,明确CIH诱导肾损伤的分子机制,寻找有效的治疗靶点,具有重要的临床意义。
蛋白表达的变化在OSAHS肾损伤过程中起关键作用,然而参与蛋白及其相关的信号通路尚不清楚。基于质谱的蛋白质组学分析为探索OSAHS肾损伤发生机制提供了科学的方法,TMT具有检测通量高、定量准确度高、应用范围广、所有样品分离及鉴定条件完全一致的优势,平行反应监测技术(PRM)不依赖抗体,可以有效弥补非靶向蛋白质组学重复性和分析效率低的缺点,其灵敏度更高[10]。传统血液标本存在血浆高丰度蛋白混杂、不够准确等因素影响,应用肾组织是更为可靠的方法。因此,本研究中我们将大鼠肾组织分为CIH模型组和正常组,应用TMT 标记筛选出差异蛋白并用PRM技术进一步验证,探讨慢性间歇性低氧大鼠肾脏的差异表达蛋白研究,揭示其作用机制。
1 材料和方法
1.1 实验动物
选用SPF级SD雄性大鼠20只,体质量210~230 g,由杭州医学院提供(许可证号:SYXK(浙)2019-0002),实验大鼠由福建中医药大学实验室饲养。动物实验通过福建中医药大学伦理委员会审核(批准文号:2021162)。
1.2 主要试剂及仪器
低氧舱(中国上海塔望智能科技有限公司,型号Pro0x-100),电泳仪(型号1645050),4 ℃离心机,预冷Fresco17(Thermo Scientific),真空干 燥离心 机SPD111V(Thermo Scientific),HPLC 液相系 统:Ultimate 30 00(Thermo Scientific),EASY-nLC 1200(Thermo Scientific),质谱:Q Exactive HF-X 质谱仪(Thermo Scientific),质谱数据转化、搜库及分析软件:Proteome Discoverer2.4 及其内置Sequest HT(Thermo Scientific);Matrix Science(UK)。
1.3 实验方法
1.3.1 动物分组与模型制备 将20只大鼠按随机数字表法分为正常组、实验组,每组10只。实验组大鼠建立慢性间歇低氧模型,通过电脑程序设定向低氧舱中循环充入氮气和氧气,调控箱内氧浓度及低氧/复氧的频率。其中设定最低氧浓度5.0%,最高氧浓度21%,氧浓度下降期50 s,低氧持续期20 s,氧浓度上升期30 s及常氧维持期20 s构成一个循环周期,共计120 s,每天持续8 h(上午9:00~下午5:00),连续12周,建立慢性间歇低氧模型[11]。正常组普通饲养。实验结束后处死大鼠取肾组织部分冻存于液氮中,另一部分置于4%多聚甲醛溶液中固定。
1.3.2 HE染色观察大鼠肾组织 正常组、实验组大鼠按随机数字表法取3只剪下肾脏,放入生理盐水中清洗血迹,用滤纸吸干后置于4%多聚甲醛溶液中固定,然后将固定好的肾组织行石蜡切片,厚度为5 μm,经二甲苯脱蜡、脱水、HE染色、透明、封片之后在光学显微镜下观察大鼠肾组织的形态变化。
1.3.3 肾组织蛋白提取、酶解与TMT标记 BCA蛋白质法定量:正常组、实验组各取3例样品,每个样品用眼科剪剪碎组织,加入一定体积裂解液,采用BCA法测定浓度,每个样品取150 μg,用100 mmol/L三乙基碳酸氢铵(TEAB)定容至100 μL。酶解和肽段定量:蛋白定量后,进行还原烷基化,还原烷基化后的蛋白加入10 K超滤管中,12 000 r/min离心,弃掉收集管底部的溶液。三乙基碳酸氢铵加入超滤管,洗涤4次。加入用溶解液配制的胰蛋白酶,37 ℃酶解过夜。次日,离心收集酶解消化后的肽段,离心浓缩干燥后,加入溶解液复溶,体积为200 μL。
TMT标记:取等量的酶解产物,按照TMT试剂盒(TMT10plexTMIsobaric Label Reagent Set;Thermo Scientific,USA)的说明方法进行标记,取4 μg干燥样品质谱检测作为质控。干燥后的样品用25 μL缓冲液(10 mmol/L碳酸氢铵及2%ACN)重溶后,取20 μL上样,采用Thermo公司Ultimate3000 HPLC系统,高pH反相色谱法进行预分级,最终获得10个组分,离心浓缩干燥。
1.3.4 PRM靶向蛋白验证 每例样品取蛋白加入1 mol/L DTT混匀,57 ℃温育1 h,加入10 μL 1 mol/L Iodoacetimide/100 μL溶液混匀,室温避光放置40 min;还原烷基化后的蛋白加入10 K超滤管中,12 000 r/min离心,弃掉收集管底部的溶液;碳酸氢铵加入超滤管,洗涤4次,加入用溶解液配制的胰蛋白酶,37 ℃酶解过夜。次日,离心收集酶解消化后的肽段,将离心浓缩干燥后的多肽,Monospin脱盐柱脱盐,干燥后准备质谱上机分析。DDA模式建库,进行PRM模式检测目标肽段,所有样本的PRM原始数据导入Skyline软件进行定量统计。
1.4 结果分析及信息学处理
TMT质谱分析由质谱仪QE-HF-X(Thermo)完成,串联质谱检测采用的是数据依赖扫描(DDA)模式。搜库鉴定和定量分析用软件Proteome Discoverer(version2.4)和Sequest HT 进行原始数据分析,根据原始数据筛选,满足P<0.05 且组间Fold Change≥1.2或≤0.83(1/1.2)的蛋白,视为组间差异蛋白筛选标准。所得出的差异蛋白通过生物信息学分析工具DAVID进行Gene Ontology功能注释对蛋白质进行分类,并使用KEGG的通路数据库进行通路分析。采用Skyline软件对PRM原始文件进行数据分析。
2 结果
2.1 HE染色观察大鼠肾组织形态结果
HE染色结果显示:正常组大鼠的肾小球完整,肾小管上皮细胞形态规则,染色均匀,管腔清晰;模型组大鼠肾组织明显受损,肾小球形态不规则,球囊间隙变窄,肾小管上皮细胞肿胀,并且有炎细胞浸润,肾小管管腔狭窄(图1)。

图1 肾组织HE染色切片Fig.1 HE staining of the kidney tissue of the rats.A: Control group (Original magnification:×200).B:Control group(×400).C:Model group(×200).D:Model group(×400).
2.2 差异表达蛋白定量分析
本研究使用TMT结合LC-MS/MS技术对慢性间歇性低氧组及对照组大鼠的肾脏进行蛋白质组研究,以倍数变化大于1.2倍(上调>1.2倍或下调<0.83)且P<0.05的标准筛选差异表达蛋白质,实验组与对照组之间差异蛋白有31种,其中表达上调的蛋白质数量为22种(表1),表达下调的蛋白质数量为9种(表2)。蛋白质定量结果统计以火山图形式进行展示(图2)。
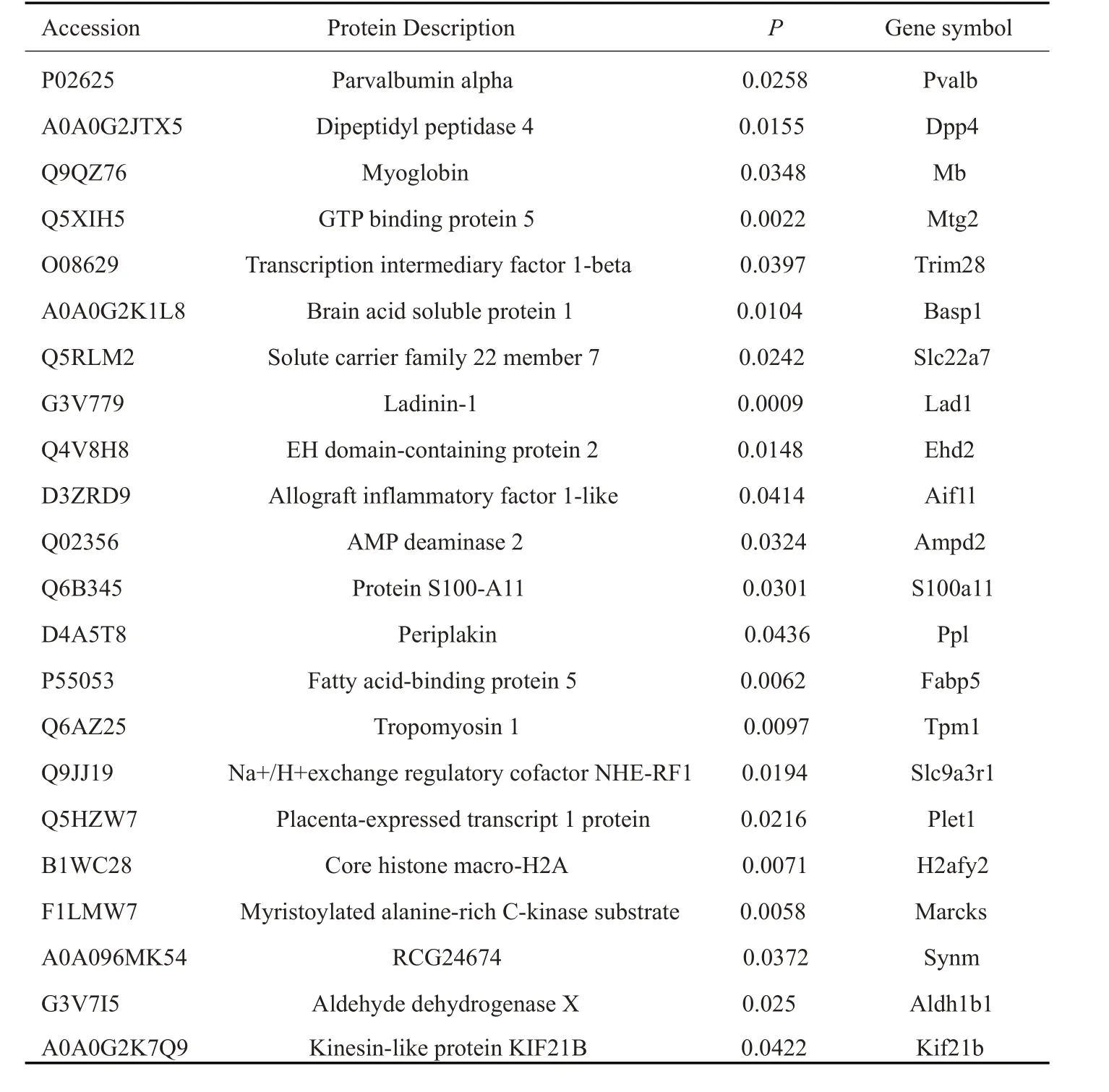
表1 显著差异表达的上调蛋白Tab.1 Significantly up-regulated proteins in the renal tissues of rats exposed to chronic intermittent hypoxia(CIH)
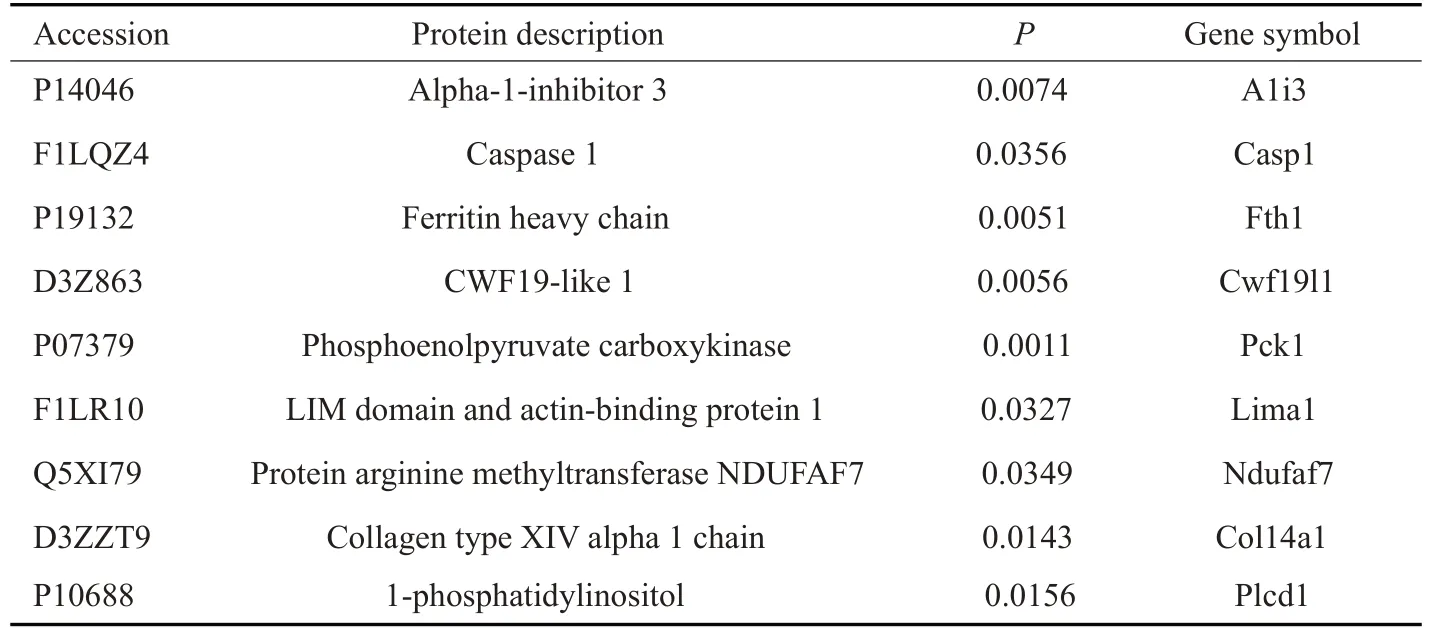
表2 显著差异表达的下调蛋白Tab.2 Significantly down-regulated proteins in the renal tissues of CIH rats
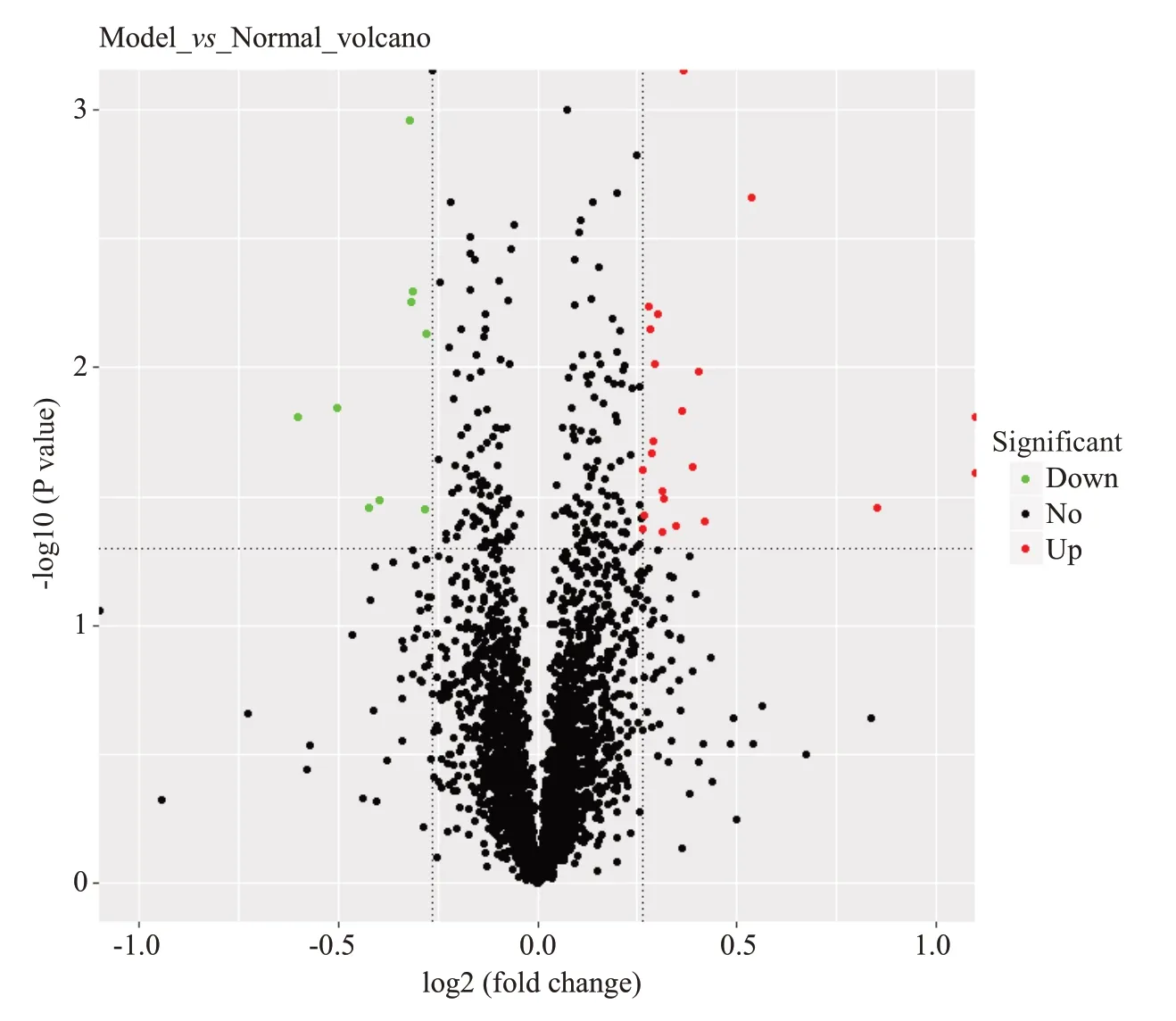
图2 差异蛋白火山图Fig.2 Volcano plot of the differential proteins in the renal tissues of CIH rats.The X-axis is the fold difference of the proteins (log2),and the Y-axis the corresponding-log10 (Q value).The red points are significantly up-regulated proteins,the green points are significantly down-regulated proteins,and the gray points are proteins that have no significant changes.
2.3 差异表达蛋白聚类分析
采用层次聚类分析法对实验组与对照组差异表达的蛋白进行聚类分析,并采用热图形式进行数据呈现(图3),以倍数变化大于1.2且P<0.05的标准筛选获取的差异表达蛋白,能够进一步表明差异表达蛋白筛选的合理性。
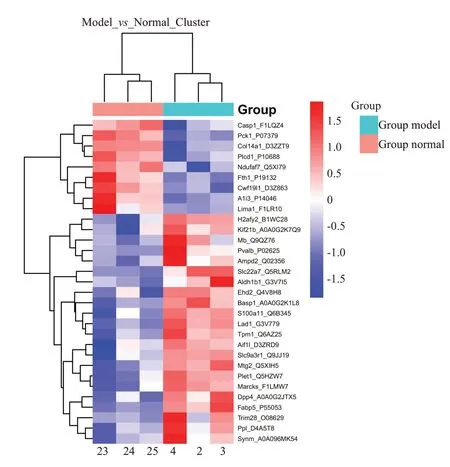
图3 差异表达蛋白聚类分析结果Fig.3 Cluster analysis of the differentially expressed proteins in the renal tissues of CIH rats.The red boxes are significantly up-regulated proteins,the blue ones are significantly down-regulated proteins,and the gray ones are proteins that have no significant changes.
2.4 差异表达蛋白的GO分析
提取31个差异蛋白序列的相关功能条目,模型组/对照组大鼠的生物学过程、细胞成分和分子功能的分析显示,在生物学过程方面主要富集在细胞间粘附、缺氧反应、钙离子等调节过程;在细胞成分分析方面,最常见的蛋白质主要与细胞外外泌体、细胞质、细胞核等相关;分子功能表明涉及钙离子结合、蛋白质活性、蛋白质结合等分子功能(图4)。
2.5 差异表达蛋白的KEGG通路分析
将差异蛋白输入KEGG 数据库中分析其富集程度。KEGG通路富集分析结果显示模型组/对照组大鼠差异蛋白涉及多条通路,发现PPAR信号通路、AMPK信号通路、代谢途径等(图5)。其中,P07379(基因编码PCK1)是参与上述通路的重要蛋白。

图5 差异表达蛋白的KEGG通路分析Fig.5 KEGG pathway analysis of the differentially expressed proteins.
2.6 PRM验证结果
根据生物信息学分析结果,以及查找文献及蛋白质数据库(UniProtKB),按照表达变化倍数由高到低依次查找差异蛋白具有的潜在生物学功能和意义,我们选择了20 个显著差异蛋白进行PRM 验证,结果筛选出P07379(PCK1)、P19132(Fth1)、Q5XI79(Ndufaf7)等蛋白质。用Skyline软件对目标蛋白的目标肽段进行分析,并与TMT结果相比较,PRM验证结果与TMT相对定量结果趋势一致(表3)。
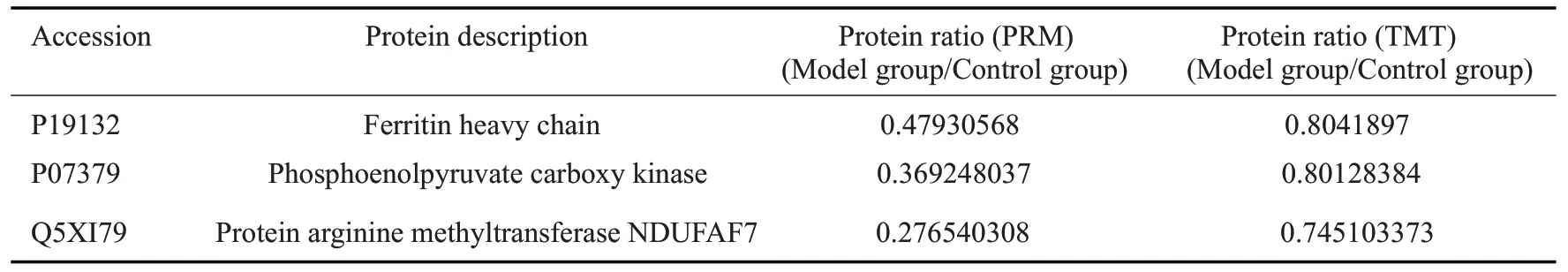
表3 PRM定量分析结果Tab.3 PRM quantitative analysis of the differentially expressed proteins
3 讨论
本研究应用TMT标记的蛋白质方法和生物信息学分析,以倍数变化大于1.2倍(上调>1.2倍或下调<0.83)且P<0.05的标准总共筛选出差异蛋白31种,其中上调的22种,而下调的9种。GO分析显示这些差异蛋白质主要参与细胞间粘附、缺氧反应、钙离子等生物学过程;涉及钙离子结合、蛋白质活性、蛋白质结合等分子功能;细胞外外泌体、细胞质、细胞核等细胞组分发生了显著变化。KEGG 通路富集分析发现PPAR 信号通路、AMPK信号通路、代谢途径等发生变化,在本研究鉴定到的差异蛋白中,P07379(基因编码PCK1)是参与上述通路的重要蛋白。根据生物信息学分析结果,以及查找文献和蛋白质数据库(UniProtKB),按照表达变化倍数由高到低依次查找差异蛋白具有的潜在生物学功能和意义,我们选择了20个显著差异蛋白进行PRM验证,结果筛选出P07379(基因编码PCK1)、P19132(基因编码Fth1)、Q5XI79(基因编码Ndufaf7)等蛋白质,发现与TMT相对定量结果趋势一致。
氧化应激在肾损伤中起重要作用,过量的活性氧(ROS)可以氧化或损伤DNA、蛋白质和脂质,诱发基因突变、蛋白质变性,引起肾功能损害[12]。肾脏中的氧化应激会激活重要的信号分子,例如单磷酸腺苷激活蛋白激酶(AMPK)[13],氧化应激导致肾小管上皮细胞线粒体功能及能量代谢异常,细胞凋亡增加[14]。CIH可诱发氧化应激和交感神经应激[15]。在正常情况下,ROS的产生和消除之间保持着稳定的平衡,而CIH可破坏这种平衡,从而诱发严重的氧化应激,进一步导致细胞中关键蛋白质的严重破坏[16]。肾小管上皮是对损伤最敏感的细胞,肾小管上皮细胞损伤也是肾纤维化的重要原因。有研究发现在CIH条件下观察到明显肾小管上皮细胞损伤,主要机制是CIH通过激活NLRP3炎性体触发了肾小管上皮细胞的焦亡[17]。我们发现一些差异表达蛋白如P07379蛋白(基因编码PCK1)在PPAR信号通路、AMPK信号通路中富集较多。PCK1(磷酸烯醇式丙酮酸羧激酶1)在氧化应激中被认为是必不可少的,PCK1通过PCK1-glucose-PPP-NADPH-GSH 轴抑制氧化应激反应的发生。研究表明[18],CD8+记忆T细胞通过上调PCK1,促进了葡萄糖-6-磷酸(G6P)的生成,大量的G6P通过磷酸戊糖途径被氧化生成NADPH,产生还原型谷胱甘肽,这对抑制氧化应激反应至关重要。因此,PKC1与氧化应激反应密切相关,可以通过增加抗氧化酶的表达,增强细胞的抗氧化能力,起到抗氧化应激的保护作用。我们发现CIH大鼠PCK1表达下调,减弱了抗氧化酶系统,诱发氧化应激,进一步损伤肾小管功能。这为PKC1在CIH肾损伤中的作用机制提供了重要线索。另外,PCK1在近端肾小管中高表达,PCK1缺失减少了ATP的产生[19]。PCK1对于保持肾小管细胞酸碱平衡、线粒体功能和葡萄糖稳态尤为关键。本实验发现,CIH大鼠PCK1表达下调,可能导致线粒体呼吸链复合体活性下降,影响ATP的生成,降低肾小管上皮细胞的代谢功能,影响肾小管对电解质和葡萄糖的重吸收。慢性间歇性低氧刺激导致ROS生成过多,超过抗氧化物质清除能力,线粒体功能受损,诱发氧化应激,能量代谢异常,对肾脏损伤可能是通过PCK1 介导激活PPAR/AMPK信号通路实现的。
PKC1可以通过磷酸化作用调控多个信号通路。过氧化物酶体增殖物激活受体(PPAR)在脂质代谢、葡萄糖稳态、细胞增殖和炎症中发挥核心作用[20]。PKC1可以磷酸化过氧化物酶体增殖物激活受体,从而抑制PPAR的转录活性,PKC1通过抑制PPAR的信号转导,间接影响胰岛素敏感性和葡萄糖利用。既往研究结果表明[21],PPARα在氧化应激诱导的肾小管损伤早期有反应。PPARα磷酸化可激活AMPK 等多种激酶信号通路,AMPK是一种在细胞内调节能量代谢的重要蛋白激酶[22]。AMPK可以在肾小管损伤的上皮细胞中表达,激活AMPK可增强脂肪分解产生ATP 而抵抗氧化应激。AMPK可通过直接磷酸化细胞内的一系列酶对代谢进行转录调控[23]。本研究中CIH条件下,PKC1可以磷酸化PPAR并激活AMPK,AMPK是细胞内的一个重要能量传感器,它可以检测细胞内ATP/AMP的比值。当细胞处于低营养或缺氧状态时,AMPK会被激活,进而刺激葡萄糖和脂肪酸的氧化,产生ATP,维持肾小管上皮细胞能量平衡。PKC1通过激活AMPK/PPAR的方式,参与了肾小管上皮细胞对营养和能量状态的监测。另有研究显示通过药物调节PPAR信号通路抑制炎症和氧化应激来缓解急性肾损伤[24]。PKC1通过调控AMPK/PPAR信号通路和抗氧化应激反应,协调肾小管上皮细胞的代谢和抗氧化状态,在细胞代谢、能量状态、炎症和氧化损伤方面发挥重要调节作用,其异常可能参与CIH肾损伤的发生。因此,我们的研究结果可能为PPAR/AMPK信号通路与CIH肾损伤之间的关系提供新的见解。
另外,Q5XI79蛋白(基因编码Ndufaf7)相关研究很少,其功能尚不清楚。而P19132 蛋白(基因编码Fth1)为铁蛋白重链,负责将亚铁氧化为反应性较低的三价铁,使铁安全地并入铁蛋白壳以减少游离铁。铁含量过载可引起线粒体氧化磷酸化途径异常,产生ATP的同时也产生大量ROS,形成脂质过氧化物,破坏细胞结构和功能。在AKI再灌注期间,ROS急剧增加诱导肾小管上皮细胞铁死亡[25]。研究表明铁蛋白重链是保护细胞免受氧化应激的主要参与者[26],在一些对铁死亡敏感的细胞中观察到了铁蛋白(包括Fth1和FTL)表达下调,这表明增加铁摄取或减少储存形式的铁均可诱发铁死亡[27]。有学者发现通过研究铁转运蛋白(FPN)对肾脏铁循环和全身铁稳态的影响,发现近端肾小管中FPN缺失导致的急性肾损伤可通过上调铁蛋白重链(Fth1)的表达来减轻[28]。根据以往研究显示,通过敲除Fth1来补充肾脏巨噬细胞中的不稳定铁池(LIP),可减少氧化应激及改善纤维化[29]。Fth1敲除小鼠比野生型小鼠肾损伤严重,表明铁蛋白重链对肾小管的保护作用[30]。多项研究表明铁死亡与肾细胞损伤之间存在密切关联,我们推测慢性间歇性低氧肾损伤与铁死亡有关,可能是导致肾小管上皮细胞损伤的重要机制,值得进一步深入研究。
综上所述,本研究使用TMT相对定量结合PRM靶向验证技术,对慢性间歇性低氧大鼠肾组织进行蛋白质组学研究,筛选出31个差异蛋白,主要富集在细胞间粘附、缺氧反应、钙离子等生物学过程;其中显著表达蛋白有P07379(基因编码PCK1)、Q5XI79(基因编码Ndufaf7)和P19132(基因编码Fth1),PCK1和Fth1与氧化应激、铁死亡等生物学过程密切相关,可作为潜在的生物标记物进行深入研究,从而为探索OSAHS肾损伤的发生机制提供新方向,为疾病的诊断、预后判断等提供新方法。
- 南方医科大学学报的其它文章
- 尿路上皮癌抗原1促进滋养细胞功能及对上皮-间质转化转化的调控作用
- Brain iron deposition increases in the bilateral substantia nigra of patients with medication-overuse headache: a quantitative susceptibility mapping analysis
- 益肺散结丸缓解小鼠癌因性骨骼肌萎缩的作用
- 环状RNA hsa_circ_0006834可作为肝细胞癌患者预后的潜在生物标志物
- 不同滴度MOG-IgG 抗体在MOG 抗体相关疾病中的诊断和临床意义:一项单中心回顾性研究
- 粪便蛋白Luminex液相芯片检测系统构建及其对结直肠肿瘤早期诊断的价值