腺相关病毒介导的shRNA敲低大鼠双侧臂旁外侧核EP3受体对发热反应的影响
何田慧,王楠萍,吴思濠,魏滟麟,胥建辉,张 洁
外周注射脂多糖(lipopolysaccharide, LPS)能够诱导体温调节中枢视前区合成释放发热介质前列腺素E2(prostaglandin E2, PGE2),PGE2与诱导发热的关键受体即EP3受体结合后,引起炎症性发热[1-4]。研究[5-7]表明,参与前馈体温调节的臂旁外侧核(lateral parabrachial nucleus, LPB)也介导了发热反应。在清醒和麻醉大鼠LPB局部应用PGE2均能引起明显的发热反应,其效应器机制与棕色脂肪代谢产热和骨骼肌战栗产热增强,尾部皮肤散热减少有关[6-7]。在LPS致热过程中,LPB局部能够合成PGE2,而且不管是减少LPB的PGE2生成,还是直接毁损LPB,均减弱了LPS性发热反应,提示LPB部分参与了LPS致热反应,但LPB的PGE2是否通过EP3受体参与LPS性发热尚不清楚。该实验采用RNA干扰、脑立体定位、无线遥测、能量代谢测定和实时荧光定量PCR等方法观察敲低LPB的EP3受体表达对LPB微量注射PGE2和腹腔注射LPS引起的发热反应的影响,以研究EP3受体是否介导LPB PGE2参与LPS致热反应的过程。
1 材料与方法
1.1 材料雄性SD大鼠20只,体质量140~160 g,购自成都达硕实验动物有限公司,在标准饲养条件下单笼饲养。腺相关病毒(adeno-associated virus, AAV)介导 的 AAV2-CMV-EGFP病毒(3.15×1012v.g./ml)及AAV2-shRNA-Ptger3(EP3)-EGFP病毒(3.42×1012v.g./ml)由上海吉凯基因化学技术有限公司提供, RNA Later购自美国Life公司,TRIzol购自美国Ivitrogen公司,PrimeScriptTMRT reagent Kit购自大连TaKaRa公司,FastStart Essential DNA Probes Master及实时荧光PCR探针购自美国Roche公司。脑立体定位仪(68018)购自深圳市瑞沃德生命科技有限公司,动物能量代谢分析系统(CLAMS-HC-8R)及温度传感器(G2 E-Mitter transponders)均购自美国Columbus Instruments公司,冰冻切片机(CM1950)购自德国Leica公司,自动荧光显微镜(BX63)购自日本奥林巴斯公司,实时荧光定量PCR仪(CFX96)购自美国BIO-RAD公司。
1.2 动物分组20只SPF级雄性SD大鼠随机分为shRNA-control组(对照组)和shRNA-EP3组(实验组)各 10只,每组动物中,5只用于实时荧光定量PCR实验,5只用于体温(Tcore)和能量代谢(EE)测定以及转染情况观察。分别向shRNA-control组和shRNA-EP3组大鼠LPB内注射AAV2-CMV-EGFP和AAV2- shRNA-Ptger3-EGFP病毒,2周后植入温度传感器,3周后植入留置导管,4周后进行相关指标检测,实验结束后处死大鼠制备含有LPB冰冻脑切片观察转染情况。
1.3 AAV2-shRNA-Ptger3-EGFP病毒合成shRNA干扰序列的筛选和病毒载体的构建由上海吉凯基因化学技术有限公司完成。根据Ptger3(EP3受体)基因设计并合成3条shRNA干扰序列(表1)。经过外源筛选有效RNAi载体实验检测得知shRNA b序列对目的基因的表达有敲减作用,因而该靶点为有效靶点。最终通过AAV将shRNA b序列包装为AAV2- shRNA-Ptger3-EGFP病毒。
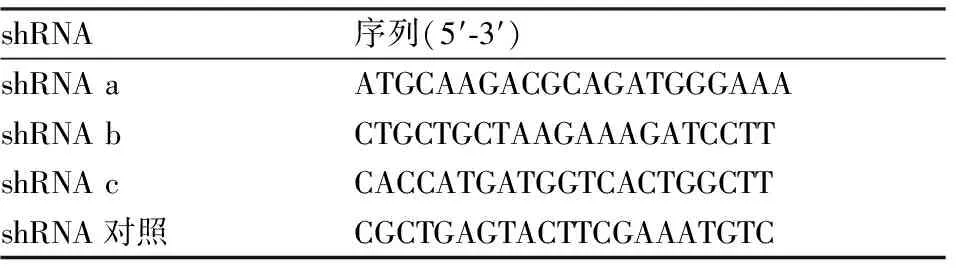
表1 大鼠Ptger3的3条shRNA及阴性对照shRNA
1.4 脑立体定位和病毒干扰140~160 g的大鼠经4%戊巴比妥钠 (1 ml/kg,腹腔注射)麻醉后,进行脑立体定位。LPB坐标为前囟后8.30~8.35 mm,中线左右旁开2.10 mm,深6.35~6.45 mm。每只大鼠LPB的2个位点分别注射250 nl病毒,注射速率为50 nl/min。3周后,于LPB上方植入留置导管。术后连续 3 d 肌肉注射头孢曲松钠(10 mg/100 g)以防止术后感染。
1.5 温度传感器植入和遥控测温大鼠麻醉后,参照文献[6-7]的方法,腹腔植入温度传感器。实验前连续7 d,每天上午10时对实验大鼠进行头颈部抚摸(handle),以减轻大鼠的应激反应。实验前1天下午,将大鼠移入清洁代谢笼,置于人工气候箱内的无线遥测接收板上进行适应性过夜,并开启动物代谢分析系统监测大鼠Tcore和EE。每日上午9:30—10:30利用大鼠头部留置导管向大鼠LPB注射生理盐水(0.1 μl)、PGE2(0.1 μg/0.1 μl)或腹腔注射脂多糖(100 μg/kg),随后连续同步监测记录10 h大鼠自由活动时的Tcore和EE。
1.6 AAV病毒转染位点形态学检测大鼠麻醉后,经升主动脉灌注生理盐水和多聚甲醛溶液进行前固定,剥离鼠脑后进行后固定。用30%蔗糖溶液脱水,在冰冻切片机中沿冠状面切片,制备30 μm厚含有LPB的脑切片,贴于黏附性玻片上,用抗荧光衰减封片剂封片后,用荧光显微镜检测病毒注射的位点及转染情况。
1.7 LPB EP3受体mRNA表达水平检测大鼠麻醉后,断头取脑,参照文献[6]用显微镊在冰上快速分离出LPB脑组织并转移至RNA later中,储存于-20 ℃备用。根据TRIzol试剂说明书提取样品总RNA,并测定总RNA的浓度和纯度。引物由成都擎科梓熙科技有限公司合成(表2)。根据PrimeScript 逆转录试剂盒说明书,将样品总RNA反转录为cDNA。根据FastStart Essential DNA Probes Master试剂盒说明书检测β-肌动蛋白(β-actin)和Ptger3(EP3受体)的mRNA水平。EP3受体mRNA通过β-actin(内参)mRNA 表达水平进行相对定量,计算方法为2-ΔΔCt。
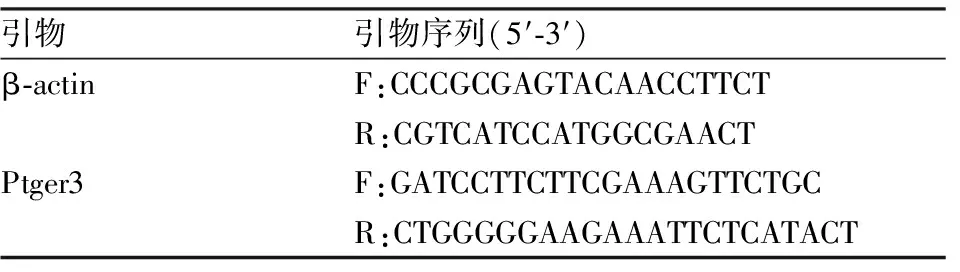
表2 实时荧光定量PCR 引物
2 结果
2.1 AAV成功转染大鼠LPB并敲低LPB EP3受体mRNA的表达由于对照病毒和干扰病毒均携带增强绿色荧光蛋白EGFP,故利用绿色荧光来观察病毒表达部位。在荧光显微镜下观察到shRNA-EP3组及shRNA-control组大鼠AAV病毒转染均主要集中于LPB脑区(图1A、B),提示AAV病毒成功转染至两组大鼠的LPB。接下来,通过实时荧光定量PCR验证2组大鼠LPB的EP3受体mRNA表达的变化。结果显示,与 shRNA-control 对照组相比,AAV病毒注射敲低了shRNA-EP3组大鼠LPB的EP3受体mRNA 的表达(P<0.05)(图 1C)。提示,AAV 介导的 shRNA有效敲低了大鼠LPB EP3受体mRNA的表达。

图1 病毒注射4周后大鼠 LPB转染效果以及LPB EP3受体mRNA表达的变化

图2 LPB应用生理盐水对shRNA-control组和shRNA-EP3组大鼠Tcore和EE的影响
2.2 敲低LPB的EP3受体表达对基础体温的影响shRNA-control组和shRNA-EP3组大鼠在24 ℃环境中的基础体温差异无统计学意义;向2组清醒大鼠LPB微量注射生理盐水均引起Tcore和EE出现短暂轻微的升高,但2组间差异无统计学意义(图 2)。
2.3 敲低LPB的EP3受体表达对LPB PGE2致热作用的影响向shRNA-control组清醒大鼠LPB注射PGE2引起Tcore和EE均明显升高,其峰值分别出现在给药后的30 min和25 min。而往shRNA-EP3组大鼠LPB注射PGE2引起清醒大鼠Tcore和EE均仅有轻微升高,与shRNA-control组相比,Tcore升高作用明显减弱,EE也有降低趋势(图3)。
2.4 敲低LPB的EP3受体表达对LPS性发热的影响shRNA-control组大鼠腹腔注射LPS引起典型的双相发热,体温分别在2.5 h和5.5 h左右达峰值,且均高于基础体温水平。shRNA-EP3组大鼠腹腔注射LPS后也引起体温升高,5.5 h体温与基础体温比较明显升高,但与shRNA-control组相比,发热反应减弱,腹腔注射LPS后5.5 h的体温明显低于shRNA-control组,2.5 h的体温也有降低趋势(图4)。
3 讨论
在LPS等致热源的刺激下,发热介质PGE2合成并释放到参与体温调节的脑区,与其受体结合后引起发热[1-4]。PGE2受体包括EP1-EP4 4个类型,其中EP3受体介导了PGE2的大部分中枢发热效应,是诱导发热的关键受体[2]。研究[6-7]表明,LPB也参与发热反应,是PGE2在视前区外的又一致热作用部位,但LPB PGE2的致热作用是否由EP3受体介导尚需证实。该研究通过AAV介导的shRNA敲低大鼠LPB EP3受体表达的模型,观察LPB EP3受体表达降低对发热反应的影响,以研究LPB EP3受体是否介导LPB PGE2的致热作用以及LPS引起的全身性发热反应。该研究采用脑立体定位注射的方式将AAV直接注入LPB,并参考文献[8],选择注射AAV病毒4周这个时间点观察病毒转染和敲低效率。在荧光显微镜下,shRNA-EP3组及shRNA-control组大鼠AAV病毒转染主要集中于LPB脑区,确保了干扰部位的局限性;与shRNA-control对照组相比,shRNA-EP3组大鼠LPB的EP3受体mRNA的表达明显减少,表明AAV2-shRNA-Ptger3-EGFP病毒有效敲低了LPB的EP3受体表达。shRNA-control 组和shRNA-EP3组大鼠的基础体温无明显差异,LPB微量注射生理盐水引起2组大鼠均出现核团注射操作引起的Tcore和EE的短暂轻微升高,但2组间无明显差异,提示,LPB EP3受体未参与基础体温的调节以及注射操作引起的应激性体温升高。往shRNA-control组清醒大鼠LPB注射PGE2引起EE和Tcore明显升高,其峰值分别出现在给药后的25 min和30 min,这与先前研究[6]LPB PGE2通过增加产热,诱导发热的结果一致。而向shRNA-EP3组大鼠LPB注射PGE2引起清醒大鼠Tcore和EE均仅有轻微升高,与shRNA-control组相比,Tcore升高作用明显减弱,EE增加也有减弱趋势,提示EP3受体介导了LPB PGE2的致热作用。
Oishi et al[9]研究表明,特异性敲除小鼠神经系统的EP3受体,消除了LPS诱导的发热反应,提示神经系统的EP3受体介导了LPS性发热。进一步的研究[4]表明,视前区的EP3受体在LPS性发热中起关键作用。另有报道[10]显示,选择性抑制环氧化酶-1,减少PGE2生成,可阻断LPS诱导的发热反应和LPB等脑区的Fos蛋白(神经元激活标志物)表达。敲除PGE2合成的终端酶mPGES-1也明显减少了LPS诱导的LPB等脑区Fos蛋白表达。先前实验[6-7]显示,腹腔注射LPS后,大鼠LPB的环氧化酶-2与mPGES-1的mRNA和蛋白的表达均明显上调;而且不管是向双侧LPB注射环氧化酶-2抑制剂减少PGE2的生成,还是应用鹅膏氨酸直接毁损LPB,均减弱了LPS性发热反应幅度,提示,LPB合成的PGE2可能参与了LPS性发热,但该过程是否由LPB EP3受体介导尚不清楚。在shRNA-control组中,大鼠腹腔注射LPS引起典型的双相发热,体温分别在2.5 h和5.5 h左右达峰值,这与先前研究[1,6-7]报道的LPS致热反应一致,说明AAV病毒注射对LPS性发热没有影响。在shRNA-EP3组,大鼠腹腔注射LPS后也引起体温升高,5.5 h体温明显高于基础体温,但与shRNA-control组相比,发热反应明显减弱,腹腔注射LPS后5.5 h的体温低于shRNA-control组,提示敲低LPB EP3受体表达削弱了LPS引起的发热,LPB EP3受体部分参与了LPS引起的全身性发热。
综上所述,敲低LPB的EP3受体表达不但削弱了LPB局部应用PGE2引起的发热反应,还减弱了腹腔注射LPS引起的全身性发热。提示LPB PGE2的致热作用由EP3受体介导,表明除了视前区EP3受体,LPB的EP3受体也在LPS性发热中起一定作用。

