不同真菌固态发酵对谷物多酚含量和抗氧化性的影响
徐莉娜,郭 尚,李艳婷,郭伟伟
(山西农业大学 山西功能食品研究院,山西 太原 030031)
谷物食品是全球膳食的主要来源。在许多发展中国家,儿童食用的大多数食品都属于谷物食品。谷物食品中含有大量的植酸,对绝大多数金属离子有极强的络合能力[1]。除此之外,谷类还能为人类提供膳食纤维、碳水化合物、维生素、蛋白质和多种矿物质[2]。但是,传统烹饪方式会降低谷物微量营养素如铁、锌、赖氨酸和蛋氨酸的生物可利用性[3]。其次,尽管全谷物食品富含营养,但许多成人和儿童基于谷物的口感不太好,并不会直接作为主食。这在很大程度上限制了谷物产品的发展。
我国传统发酵食品主要是由大麦、小麦和豌豆发酵而来,距今已有超过3 000 a的历史[4]。高等真菌在发酵食品中应用已久,研究它们的生物学特性对于筛选发酵剂、强化基质营养必不可少[5]。BEI等[6]研究发现,发酵可以激活基质的内源性酶,从而产生具有减少抗营养因子的产物,而这些酶的活化程度取决于所使用的原料[7]。赵丹等[8]和POSTEMSK等[9]研究发现,谷物固态发酵不仅在一定程度上改善了基质的营养成分,还促进了机体肠道微生物对营养的吸收。除此之外,谷物发酵过程中,还可能形成新的生物活性化合物,如益生菌低聚糖或其他代谢物[10-12]。
虽然目前对于真菌固态发酵产物的营养成分已有研究报道,但其主要从蛋白质、碳水化合物、脂肪和维生素等方面进行[8-9],对多酚含量与抗氧化性的相关性研究相对较少。因此,了解清楚不同发酵谷物之间多酚积累特性及其对抗氧化性的影响,对开发新型功能食品原料具有重要意义。
山西功能食品研究院食用菌资源研发团队常年进行真菌固态发酵的研究,发现在实验室现有条件下,采用双孢蘑菇AS2796 和嗜蓝孢孔菌G1 固态发酵谷物,其发酵产物的营养价值和抗氧化性有很大提升。因此,本研究以棱柄马鞍菌X1 菌株、双孢蘑菇AS2796 菌株和嗜蓝孢孔菌F.G1 为发酵菌株,以山西常见的10 种谷物(小麦、大米、燕麦、玉米、小米、藜麦、荞麦、大豆、豌豆和高粱)为发酵基质,对比研究3 株真菌菌株通过固态发酵对发酵基质总酚含量和抗氧化性能的影响,旨在为进一步开发口感佳、营养丰富的功能食品提供科学指导和理论依据。
1 材料和方法
1.1 材料
1.1.1 供试菌株 双孢蘑菇(Agaricus blazei)AS-2796 购自上海农业科学院食用菌研究所。棱柄马鞍菌(Helvella lacunosa)X1(GenBank 登录号KY 865326)和嗜蓝孢孔菌(Fomitiporia yanbeiensis)F.G1(GenBank 登录号为KT 861405)保存于山西农业大学山西功能食品研究院。供试谷物(小麦、大米、燕麦、玉米、小米、藜麦、荞麦、大豆、豌豆和高粱)由山西功能食品研究院提供。
1.1.2 培养基制备 在发酵前,选取完整谷物籽粒,去壳,洗净,用水浸泡6 h。固态发酵底物由谷物(200 g)、葡萄糖(1.6 g)、酵母膏(0.4 g)、KH2PO4(1.0 g)、MgSO4·7H2O(0.5 g)、FeCl3(0.05 g)和CaCl2·2H2O(0.1 g)组成,含水量65%,初始pH 值为6.5。
1.2 方法
1.2.1 固态发酵 发酵底物121 ℃高压灭菌30 min,挑取带PDA 培养基的菌块(直径8.0 mm)室温下接种,25 ℃避光培养。发酵过程中,每隔7 d 取一次样,共取6 次,即未发酵谷物(CK)、发酵7 d(7FM)、发酵14 d(14FM)、发酵21 d(21FM)、发酵128 d(28FM)、发酵35 d(35FM)。样品在60 °C 条件下过夜干燥,研磨并过0.4 mm 筛,备用。
1.2.2 谷物乙醇提取物 发酵完成以后,称取8.0 g样品置于三角瓶中,加入50 mL 乙醇(80%),25 ℃下浸提24 h,抽滤,去滤液,滤渣用200 mL 的乙醇(75%)复提,2 次滤液合并,45 ℃旋转蒸发得浓缩液,置于4 ℃保存,备用。
1.3 测定项目及方法
1.3.1 总酚含量的测定 发酵物的总酚含量采用Folin-Cioncalteu 比色法测定[13]。
1.3.2 抗氧化活性分析
1.3.2.1 DPPH 自由基清除活性测定 将1 mL 醇提物和4 mL DPPH(0.004%)溶液混合,剧烈摇动,摇匀后置于黑暗处反应30 min,以2,6-二叔丁基-4-甲基苯酚(BHT)作对照,然后采用紫外分光光度计在517 nm 处测定溶液的吸光度[14]。
式中,A1为样品吸光度;A0为空白对照组吸光度。
1.3.2.2 还原力的测定 不同浓度的乙醇提取物(1.0 mL)与2.5 mL 磷酸盐缓冲液(50 mmol/L,pH值7.0)和2.5 mL1%铁氰化钾混合,混合物在50 ℃下保温20 min。为了避免铁氰化钾对试验结果的干扰,在混合物中加入2.5 mL 的三氯乙酸(10%),3 000 r/min 离心10 min 后除去沉淀。最后,将1.25 mL 上清液与1.25 mL 蒸馏水和0.25 mL FeCl3溶液(0.1%,w/v)混合,静置10 min,700 nm 处测定吸光度值[14]。
1.3.2.3 超氧阴离子自由基清除活性测定 取0.2 mL 醇提物于试管中,加入3 mL Tris-HCl 缓冲液(pH 值8.2,0.05 mol/L),25 ℃条件下水浴10 min,加入预热的邻苯三酚12 μL,混匀后精确反应4 min,然后用0.5 mL 盐酸(10 mol/L)终止反应,以抗坏血酸为对照,于560 nm 处测定吸光度[14]。
式中,A1为样品吸光度;A0为空白对照组吸光度。
1.3.2.4 铁离子螯合能力测定 取0.4 mL 乙醇提物,分别加入200 μL FeCl2溶液(0.5 mmol/L)和1.8 mL 甲醇溶液,室温静置5 min 后,再加入0.8 mL邻菲咯琳亚铁离子铁试剂(5 mmol/L),室温反应10 min,以EDTA 为阳性对照,在550 nm 处测定吸光度[14]。较低的吸光度表明较高的螯合能力。
式中,A1为样品吸光度;A0为空白对照组吸光度。
1.4 数据分析
采用SPSS 16.0 进行数据差异显著性分析,采用Ducan's 进行多重检验(P<0.05)进行显著性分析;采用ORIGIN 7.5 绘制图表,每个样品混合重复测样3 次,测量结果取平均值。采用EC50计算软件计算EC50值(EC50为半最大效应浓度,指自由基清除率达到50%时所需要的样品含量)。EC50越小表示样品的抗氧化性越强。
2 结果与分析
2.1 发酵产物总酚含量
如图1~3 所示,10 种谷物经过3 株菌种(AS 2796、X1 菌株和F.G1)固态发酵后,发酵产物中总酚含量随发酵菌株和发酵时间的变化而变化。由图1 可知,经AS2796 固态发酵后,小麦、大米、小米、藜麦、燕麦和大豆的总酚含量与发酵时间呈显著正相关,相关系数(r)分别为0.938、0.655、0.940、0.935、0.766 和0.676。发酵35 d 后,6 种谷物的总酚含量达到最大值,小麦、大米、小米、藜麦、燕麦和大豆总酚含量分别为3.40、0.76、0.74、1.38、3.16、0.63 mg/g,分别是对照组的1.58 倍、1.21 倍、2.51 倍、1.97 倍、2.09 倍、1.24 倍。玉米、荞麦和豌豆的总酚含量与发酵时间呈正相关(r分别为0.183、0.447 和0.240),发酵28 d 后,玉米的总酚含量最大值为3.28 mg/g,是对照的0.98 倍。高粱的总酚含量与发酵时间呈负相关(r=-0.704),发酵7 d 后,高粱的总酚含量最大值为2.72 mg/g,比对照低10.82%。
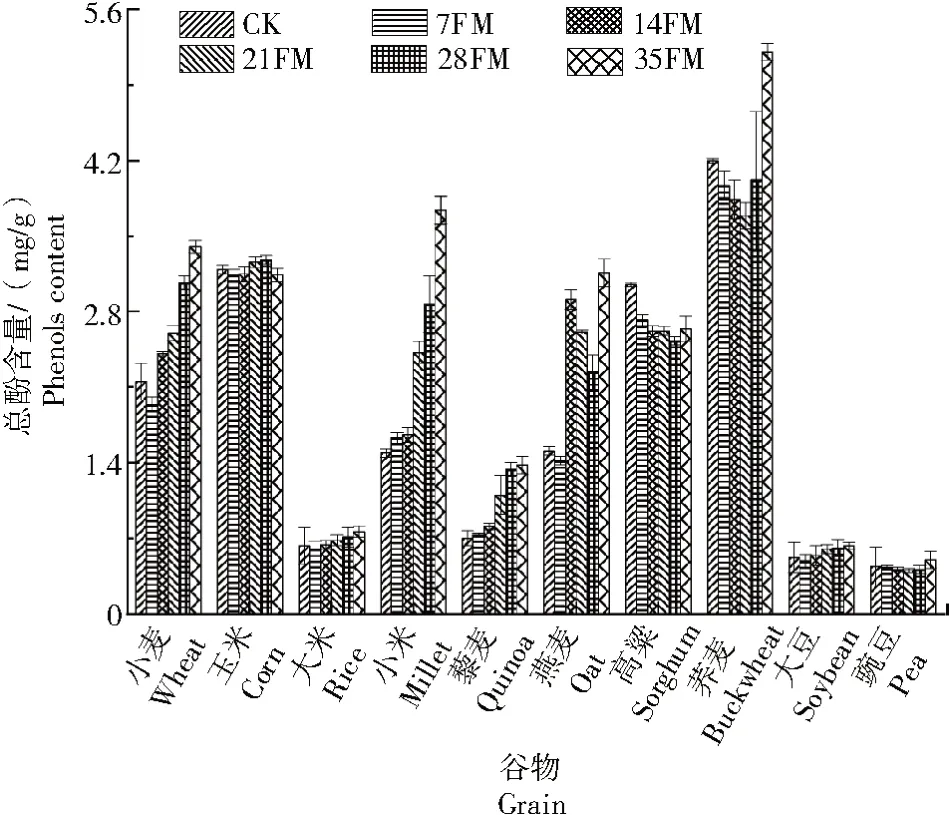
图1 AS2796 固态发酵对不同谷物总酚含量的影响Fig.1 Effects of solid-state fermentation by AS2796 on total phenol content of different grains
从图2 可以看出,经X1 菌株发酵后,小米、燕麦、藜麦、小麦和大豆的总酚含量与发酵时间呈显著正相关,相关系数(r)分别为0.930、0.898、0.911、0.764 和0.770。发酵35 d 后,小米、燕麦、藜麦、小麦和大豆5 种发酵谷类作物的总酚含量达到最大值,分别为3.38、3.30、1.30、3.06、0.57 mg/g,分别是对照组的1.57 倍、2.21 倍、1.86 倍、2.03 倍和1.10倍。大米、荞麦和豌豆的总酚含量与发酵时间呈正相关(r分别为0.435、0.398 和0.132);玉米和高粱的总酚含量与发酵时间呈负相关(r分别为-0.399和-0.723),发酵7 d 后,玉米的总酚含量最大值为3.18 mg/g,比对照低0.30%;高粱的总酚含量最高值为2.68 mg/g,比对照低12.00%。

图2 X1 菌株固态发酵对不同谷物总酚含量的影响Fig.2 Effects of solid-state fermentation by X1 on total phenol content of different grains
从图3 可以看出,F.G1 固态发酵后,小米、燕麦、藜麦、小麦、荞麦和大米的总酚含量与发酵时间呈显著正相关,相关系数(r)分别为0.918、0.520、0.927、0.927、0.763 和0.557。发酵35 d 后,小米、燕麦、藜麦、小麦、荞麦和大米6 种发酵谷类作物的总酚含量达到最大值,分别为3.43、0.68、3.69、1.33、3.00、5.80 mg/g,分别是对照组的1.60 倍、1.08 倍、2.48 倍、1.90 倍、1.99 倍和1.38 倍。大豆和豌豆的总酚含量与发酵时间呈正相关(r分别为0.215 和0.374)。大豆和豌豆的最大值分别为对照的0.96 倍和1.09 倍。玉米和高粱的发酵时间与总酚含量之间呈负相关(r分别为-0.194 和-0.680),其中,玉米总酚含量最大值为3.09 mg/g(发酵35 d),比对照低4.08%;高粱的总酚含量最大值为2.71 mg/g(发酵7 d 后),比对照低11.15%。

图3 F. G1 固态发酵对不同谷物总酚含量的影响Fig.3 Effects of solid-state fermentation by F. G1 on total phenol content of different grains.
试验结果表明,菌株AS2796 发酵的8 种谷物(玉米、大米、小米、燕麦、高粱、藜麦、大豆和豌豆)的最大多酚含量显著高于X1 菌株和F.G1 菌株发酵的谷物(P<0.05);F.G1 菌株对小麦和荞麦总酚含量的改善程度显著高于X1 菌株和AS2796 菌株(P<0.05)。
2.2 发酵产物的抗氧化性能分析
2.2.1 发酵产物对DPPH 自由基的清除能力 表1结果表明,AS2796 发酵的小麦、玉米、大米、小米、藜麦、燕麦、高粱、荞麦、大豆和豌豆对DPPH 自由基的清除能力与发酵时间的相关系数分别为-0.827、-0.710、-0.939、-0.857、-0.797、-0.626、-0.750、-0.762、-0.745 和-0.846;10 种发酵谷物的最小EC50值分别为0.07、1.29、9.35、0.16、0.17、1.94、0.01、0.46、0.07、0.08 mg/mL,比对照分别低0.12%、13.33%、33.32%、0.89%、0.38%、45.63%、0.32%、8.2%、0.24%和0.61%。发酵35 d 后,EC50值均为最低。
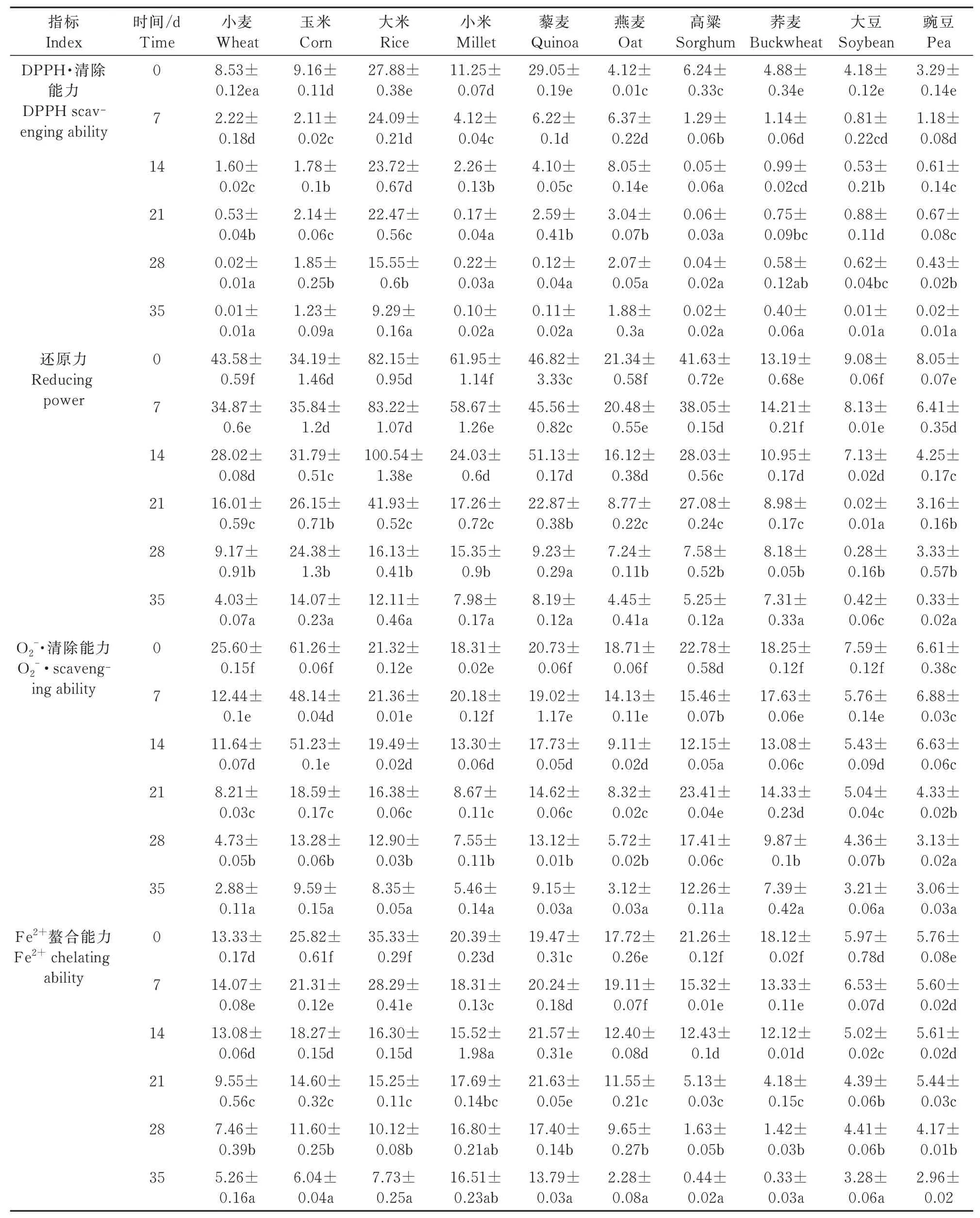
表1 AS2796 发酵产物的抗氧化性能的EC50值Tab.1 EC50 values of fermentation products by AS2796 in antioxidant propertiesmg/mL
表2 结果表明,X1 菌株发酵的10 种谷物(小麦、玉米、大米、小米、藜麦、燕麦、高粱、荞麦、大豆和豌豆)对DPPH 自由基的清除能力与发酵时间的相关系数分别为-0.830、-0.711、-0.938、-0.859、-0.797、-0.612、-0.752、-0.766、-0.748 和-0.854;其最低EC50值分别为0.16、1.38、9.44、0.23、0.24、2.01、0.17、0.55、0.16、0.17 mg/mL。发酵35 d 后,EC50值均为最低。
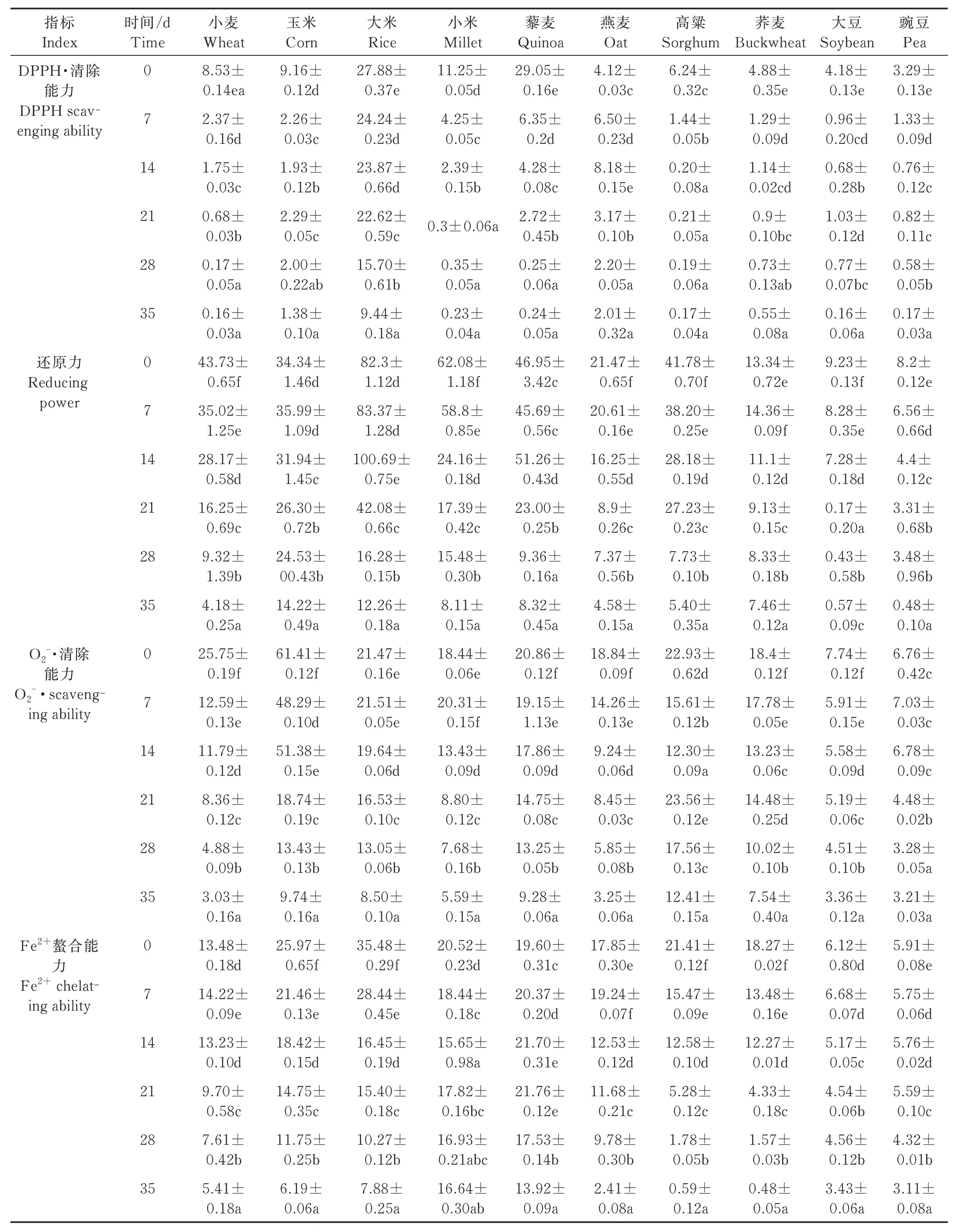
表2 X1 菌株发酵产物抗氧化性能的EC50值Tab.2 EC50 values of fermentation products by X1 in antioxidant propertiesmg/mL
表3 结果表明,F.G1 发酵的10 种谷物(小麦、玉米、大米、小米、藜麦、燕麦、高粱、荞麦、大豆和豌豆)对DPPH 自由基的清除能力与发酵时间的相关系数分别为-0.814、-0.690、-0.938、-0.849、-0.792、-0.626、-0.734、-0.731、-0.705 和-0.805;10 种发酵谷物的最小EC50值分别为0.07、1.29、9.35、0.16、0.17、1.94、0.08、0.46、0.07、0.08 mg/mL,比对照分别低0.82%、14.08%、33.54%、1.42%、0.59%、47.09%、1.28%、0.94%、1.67%和2.43%。发酵35 d后,EC50值均为最低。

表3 F.G1 发酵产物抗氧化性能的EC50值Tab.3 EC50 values of fermentation products by F. G1 in antioxidant propertiesmg/mL
上述结果表明,3 株真菌中,AS2796 菌株发酵的谷物对DPPH 自由基的清除能力更强。
2.2.2 发酵产物的还原力分析 表1 结果表明,AS2796 发酵后的10 种谷物其还原力与发酵时间的相关系数分别为-0.994、-0.927、-0.864、-0.929、-0.898、-0.975、-0.965、-0.940、-0.907 和-0.963;其EC50值最低分别为4.03、14.07、12.11、7.98、8.19、4.45、5.25、7.31、0.42、0.33 mg/mL。发酵35 d 后,除大豆(21 d)外,EC50值均为最低。
表2 结果表明,X1 菌株发酵后的10 种谷物的还原力与发酵时间的相关系数分别为-0.984、-0.925、-0.884、-0.921、-0.888、-0.915、-0.925、-0.932、-0.901 和-0.923;其最低EC50值分别为4.18、14.22、12.26、8.11、8.32、4.58、5.4、7.46、0.43、0.17 mg/mL,分别比对照低0.96%、41.59%、14.92%、13.09%、17.77%、21.46%、12.97%和56.56%。发酵35 d 后,除大豆(21 d)外,EC50值均为最低。
表3 结果表明,F.G1 发酵后的10 种谷物的还原力与发酵时间的相关系数分别为-0.991、-0.928、-0.832、-0.928、-0.894、-0.976、-0.935、-0.943、-0.909和-0.959;其最低EC50值分别为4.07、14.11、12.15、8.02、8.23、4.49、5.29、7.35、0.06、0.37 mg/mL。发酵35 d 后,除大豆(21 d)外,EC50值均为最低。
表1~3 结果表明,菌株AS 2796 发酵谷物的还原力要显著高于X1 菌株和F.G1 菌株(P<0.05)。
2.2.3 发酵产物的铁离子螯合能力 表1 结果表明,用AS2796 发酵的10 种谷物,其铁离子螯合能力与发酵时间的相关系数分别为-0.942、-0.995、-0.960、-0.629、-0.656、-0.939、-0.983、-0.975、-0.901 和-0.878;其最低EC50值分别为5.26、6.04、7.73、16.51、13.79、2.28、0.44、0.33、3.28 、2.96 mg/mL。发酵35 d 后,EC50值均为最低。
表2 结果表明,用X1 菌株发酵的10 种谷物,其铁离子螯合能力与发酵时间的相关系数分别为-0.941、-0.983、-0.964、-0.613、-0.679、-0.929、-0.976、-0.975、-0.897 和-0.848;其EC50最低值分别为5.41、6.19、7.88、16.64、13.92、2.41、0.59、0.48、3.43、3.11 mg/mL,分别比对照低40.59%、23.97%、22.3%、81.61%、71.49%、13.6%、2.78%、2.65%、57.45% 和53.99%。发酵35 d 后,EC50值均为最低。
表3 结果表明,用F.G1 发酵的10 种谷物,其铁离子螯合能力与发酵时间的相关系数分别为-0.935、-0.981、-0.953、-0.629、-0.701、-0.933、-0.965、-0.965、-0.908 和-0.880;其最低EC50值分别为5.17、6.08、7.47、16.4、13.56、2.22、1.00、0.27、3.21、3.01 mg/mL。发酵35 d 后,EC50值均为最低。
以上结果表明,菌株AS 2796 发酵的玉米、高粱和小麦的最低EC50值显著高于X1 菌株和F.G1 菌株的最低EC50值(P<0.05),F.G1 发酵后的小麦、大米、小米、藜麦、燕麦、荞麦和大豆的最低EC50值显著高于AS2796 和X1 菌株的最低EC50(P<0.05)。
2.2.4 发酵产物对超氧阴离子自由基的清除能力 表1 结果表明,AS 2796 发酵的10 种谷物的超氧阴离子自由基清除能力与发酵时间的相关系数分别为-0.924、-0.945、-0.960、-0.947、-0.980、-0.976、-0.383、-0.956、-0.963 和-0.920;10 种发酵谷物的EC50最低值分别是2.88、9.59、8.35、5.46、9.15、3.12、12.26、7.39、3.21、3.06 mg/mL,分别比对照低11.25%、15.65%、39.17%、29.82%、44.14%、16.68%、53.82%、40.49%、42.29%和46.29%。发酵35 d 后,EC50值均为最低。
表2 结果表明,X1 菌株发酵的10 种谷物的超氧阴离子自由基清除能力与发酵时间的相关系数分别为-0.913、-0.932、-0.956、-0.941、-0.976、-0.976、-0.329、-0.944、-0.954 和-0.918;10 种发酵谷物的EC50值分别为3.03、9.74、8.50、5.59、9.28、3.25、12.41、7.54、3.36、3.21 mg/mL。发酵35 d 后,EC50值均为最低。
表3 结果表明,F.G1 发酵的10 种谷类的超氧阴离子自由基清除能力与发酵时间的相关系数分别为-0.921、-0.946、-0.961、-0.948、-0.981、-0.974、-0.371、-0.954、-0.950 和-0.929;10 种发酵谷物的EC50最低值分别为2.91、9.62、8.38、5.49、9.18、3.15、12.29、7.42、3.24 3.09 mg/mL。发酵35 d 后,EC50值均为最低。
表1~3 结果表明,菌株F.G1 发酵的小麦、大米、小米、藜麦、燕麦、荞麦和大豆的EC50值均显著高于AS 2796和X1菌株发酵的谷物EC50(P<0.05)。
3 结论与讨论
本研究结果表明,采用不同的菌种在同一谷物上进行固态发酵,或者同一菌种在不同谷物上进行固态发酵,其发酵效果不相同。ZHAI 等[14]和KANG[15]等研究结果表明,发酵产物的营养成分变化与发酵菌株和发酵基质的生物特性及代谢机制有关,这与本研究结果一致。此外,X1 菌株与双孢蘑菇AS2796 都属于土生菌,但就本研究的结果来看,这2 株菌在同一种谷物上进行固态发酵时,发酵效果存在明显差异。
酚类化合物是大型真菌次生代谢产物之一,具有很好的抗氧化性,其抗氧化性与其酚羟基的氧化还原特性有关[14,16-17]。本研究结果表明,真菌固态发酵后的谷物,其多酚含量要高于未接种的谷物。可见,真菌固态发酵能够改善发酵基质的营养价值[18]。LEE 等[5]研究发现,总酚含量与抗氧化性有一定的相关性。从理论上讲,样品的抗氧化性应与其苯酚总含量一致。在本研究中,发酵后的高粱其多酚含量与抗氧化性并不存在正相关,这可能是因为在固态发酵的过程中,有新的抗氧化物产生[5,14-15,19-20]。
综上所述,发酵谷物的总多酚含量和抗氧化性能随着发酵时间和发酵菌株的变化而变化,在实际应用中要根据需要选择合适的发酵菌株,同时要根据所选基质的生物特性确定最佳发酵时间,以期得到营养价值更高的发酵产物。

