基于iap 基因的RT-LAMP 技术检测肉类食品中单核细胞增生李斯特菌的效果评价
陈 东, 杨 逍, 宋达峰*
(1.杭州安旭生物科技股份有限公司, 浙江 杭州 310000;2.浙江工商大学 食品与生物工程学院, 浙江 杭州 310000)
核细胞增生李斯特菌(L.monocytogenes)是一种人畜共患病原菌,也被称为高致病性兼容细胞有机体[1],被其污染的食物可导致人类感染[2]。 在美国每年有1 600 多人感染该病菌,200 多人死亡[1]。 20世纪90 年代,WHO 将单增李斯特菌列为食品四大病原菌之一。 单核细胞增生李斯特菌可突破血脑屏障或是胎盘屏障,有极大的可能性会感染宿主中枢神经,这也是高死亡率(20%~30%)的主要原因[3-5]。目前国标检测常用生化鉴定法, 该方法步骤烦琐、检测周期长、特异性低,无法做到快速灵敏检测[6],在市场检测中实用性差, 酶联荧光分析法(ELISA)则不够准确高效。 到目前为止,由于食品形态和成分的多样,单一配方的培养基无法适用于所有类型食物样品中单增李斯特菌的分离, 需分门别类培养,操作非常不方便。 而逆转录环介导等温扩增法(RT-LAMP)则可以很好地解决以上问题,既保留了逆转录检测技术的高效精确,又结合了环介导等温扩增法(LAMP)的简便操作,该方法可同时检测多批样本,成本较低,结果判定简单。 作者首次采用RT-LAMP 技术对8 株单增李斯特菌和33 株非单增李斯特菌进行特异性试验,研究不同条件下对单增李斯特菌的iap 基因的检测效果, 此外还探讨了死菌附着于样本对检测结果准确性的影响。 本实验以国家标准检测法为对照, 以确认RT-LAMP 的可行性。
1 材料与方法
1.1 菌种
分析了来自不同国家和来源的39 种细菌菌株,见表1。
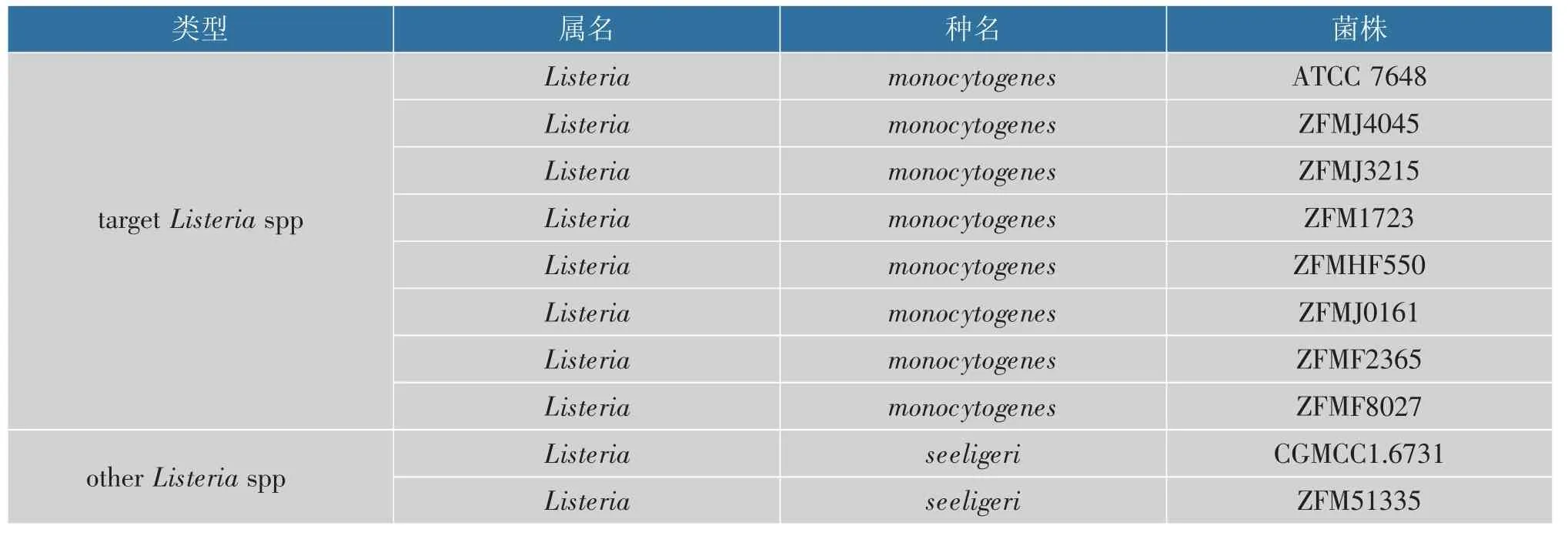
表1 RT-LAMP 实验菌株Table 1 RT-LAMP experimental strains
1.2 主要试剂
AMV 逆转录试剂、 细菌总RNA 快速抽提试剂盒、LAMP 引物及PCR 引物:上海生工生物工程科技有限公司;DNA 提取试剂盒:Axygen 公司。
1.3 方法
1.3.1 引物设计在GeneBank 中查找单核细胞增生李斯特菌的iap 基因的基因序列, 用Primer Explorer V4(Eiken Chemical,Japan)设计了4 个引物,包括2 个外引物(LM-F3 和LM-B3)和2 个内引物(LM-FIP 和LM-BIP),它们识别了iap 基因的6个区域,见图1。

图1 iap 基因引物在单核细胞增生李斯特菌中的位置和序列Fig.1 Location and sequence of iap gene primers in Listeria monocytogenes
1.3.2 DNA 和总RNA 的提取按照细菌总RNA快速抽提试剂盒(Sangon Biotech)和DNA 提取试剂盒(Axygen) 的操作说明分别提取DNA 和总RNA保存备用。
1.3.3 优化RT-LAMP 体系根据裴灵芝的RTLAMP 研究[7],进行微调后设定RT-LAMP 初始的基本反应体系(25 μL)为:缓冲液1×ThermoPol®,dNTPs 0.8 mmol/L,MgSO42.0 mmol/L,LM-FIP 0.8 μmol/L,LM-BIP 0.8 μmol/L,LM-F3 0.4 μmol/L,LM-B3 0.4 μmol/L,AMV 逆转录酶10 U/μL, 甜菜碱1.0 mol/L,Bst DNA 聚合酶320 U/mL,RNA 2 μL,63 ℃孵育1 h。 用控制单一变量的方法对甜菜碱(0、0.5、1.0、1.5 mol/L),MgSO4(1.0、2.0、3.0、4.0 mmol/L),dNTPs(1.2、1.6、2.0、2.4 mmol/L)和Bst DNA 聚合酶(40、80、160、320 U/mL)和引物的孵育温度(59、61、63、65 ℃)进行优化。
1.3.4 RT-LAMP 的特异性实验用8 株单核细胞增生李斯特菌和31 株非单核细胞增生李斯特菌菌株按照试剂盒说明提取RNA, 用最优的RT-LAMP体系进行实验, 观察凝胶电泳结果来判断RTLAMP 的特异性。
1.3.5 RT-LAMP 的灵敏度实验用纯单核细胞增生李斯特菌培养物(J0161)测定RT-LAMP 灵敏度。10 倍稀释法处理培养物,从中提取RNA,并在最佳反应条件下进行RT-LAMP。 用上述方法按照试剂盒说明提取DNA 并测试LAMP 的灵敏度, 将琼脂糖凝胶电泳结果与RT-LAMP 进行比较。
1.3.6 用RT-LAMP 和LAMP 检测活菌和死菌作者测试了当地市场购买的50 个肉类样品, 以确定RT-LAMP 是否能有效区分死细菌和活细菌。 将每个肉类样品匀浆后,用105CFU/dL 的单增李斯特菌感染40 个肉样品, 并将等浓度灭活菌液接种于剩余10 个肉类样品。 将每种培养物振荡培养后,离心取上清液提取DNA 和RNA, 分别用LAMP 和RT-LAMP 进行实验并分析结果。
1.3.7 检测肉样中的单核细胞增生李斯特菌将RT-LAMP 检测法和中国国家标准GB 4789.30—2016 法分别用于分析从中国当地市场获得的100个肉样品, 以确定RT-LAMP 鉴定肉中单核细胞增生李斯特菌的能力。 取每种肉类样品匀浆,离心并从上清液中提取RNA。采用国家标准GB 4789.30—2016 检测每种肉类样品,已证实了单核细胞增生李斯特菌菌落的存在。
2 结果与分析
2.1 引物设计
引物序列见表2。设计了4 个引物,包括2 个外引物(LM-F3 和LM-B3)和2 个内引物(LM-FIP 和LM-BIP),它们识别了iap 基因的6 个区域,见表2。
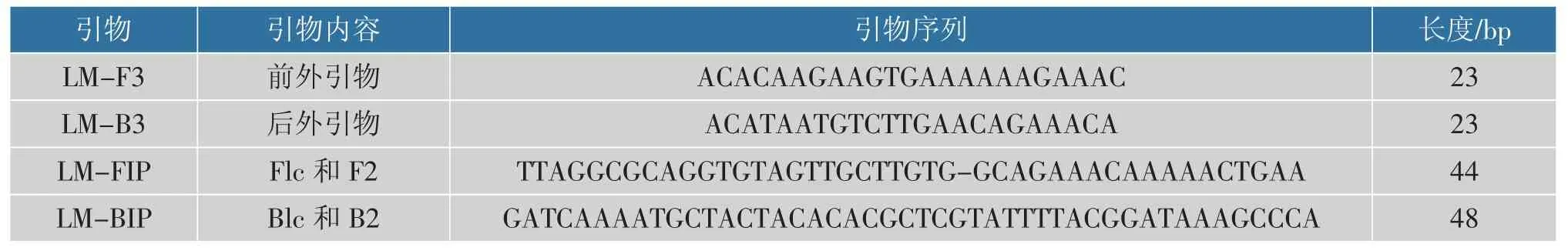
表2 iap 基因的特异性引物序列Table 2 Specific primer sequences of iap gene
2.2 优化RT-LAMP 体系
优化RT-LAMP 实验结果见图2。 在MgSO4浓度为2.0 mmol/L 时可以扩增iap, 而在其他浓度下不产生扩增产物。 随着dNTPs 浓度的增加,琼脂糖凝胶上的RT-LAMP 产物条带强度增加, 在dNTPs浓度为2.0 mmol/L 时观察到最佳条带。 添加1.0 mol/L 甜菜碱后,条带检测更清晰,但当甜菜碱浓度从1.0 mol/L 增加到1.5 mol/L 时没有观察到明显的差异; 随着反应体系中Bst DNA 聚合酶浓度的增加, 扩增产物在320 U/mL Bst DNA 聚合酶下观察到最佳扩增。 模板在59~65 ℃成功扩增,并且在63℃产生最明显的条带。 基于这些结果,RT-LAMP 测定条件为:MgSO42.0 mmol/L,dNTPs 2.0 mmol/L,甜菜碱1.0 mol/L,Bst DNA 聚合酶320 U/mL, 扩增温度63 ℃。 这些参数用作所有后续实验的标准条件。
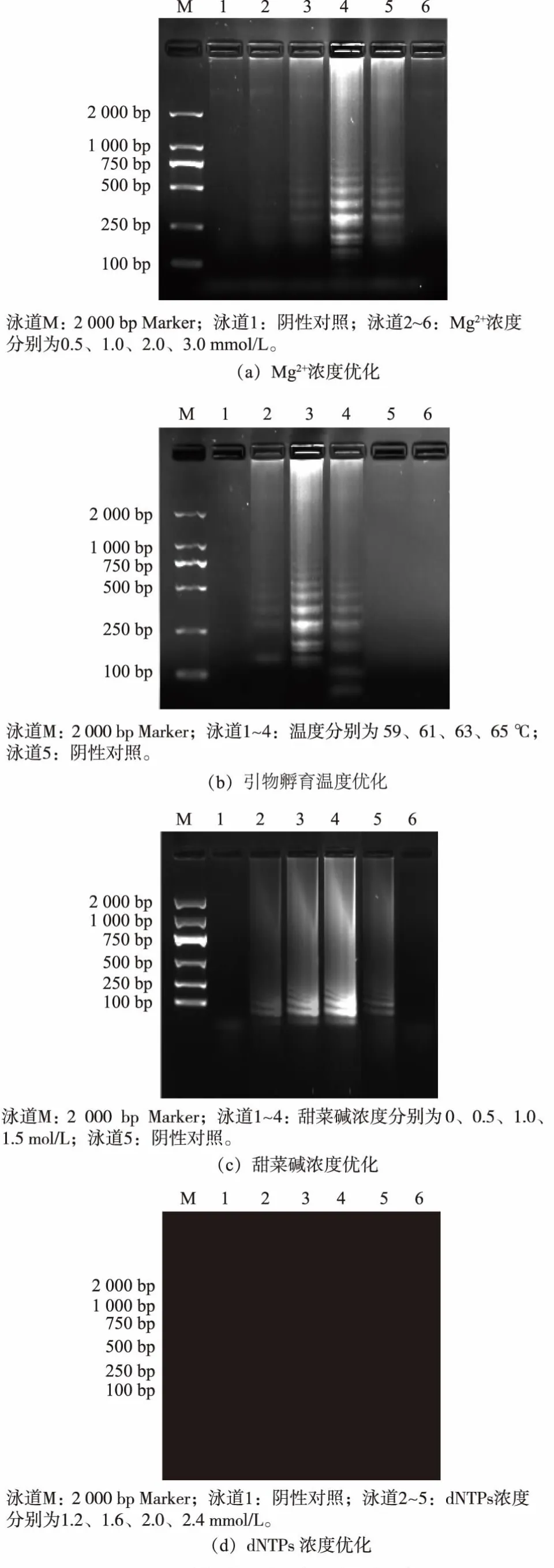
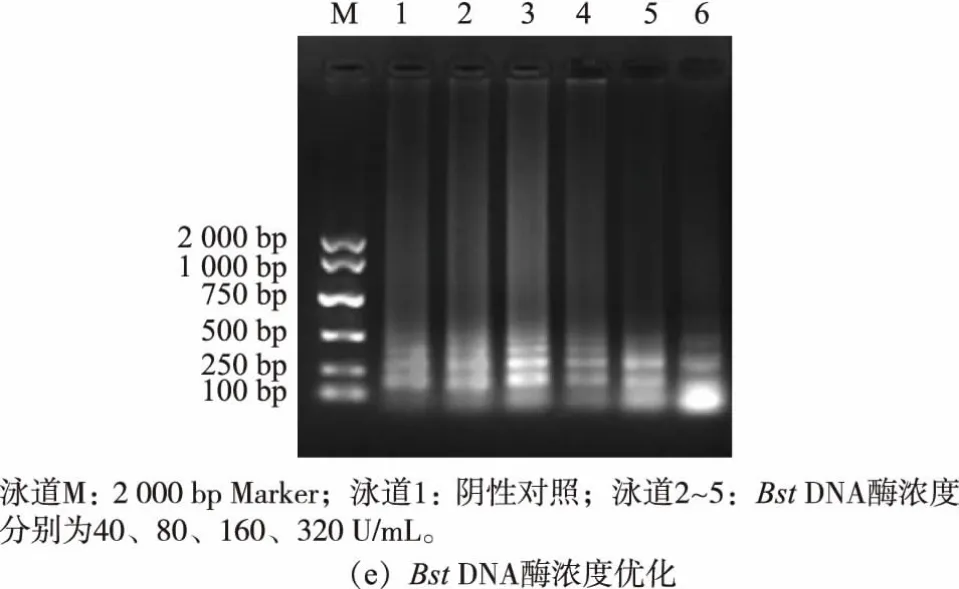
图2 RT-LAMP 体系优化结果Fig.2 Optimization results of RT-LAMP system
2.3 RT-LAMP 的特异性试验
设计的引物扩增了来自8 个单增李斯特菌菌株的iap 基因, 但没有扩增来自非单增李斯特菌的iap 序列。 因此,RT-LAMP 试验特异性地检测单增李斯特菌,没有假阳性结果,见图3。
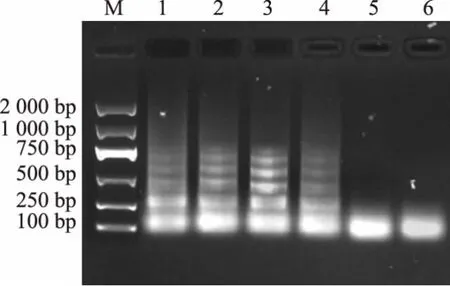
图3 RT-LAMP 特异性结果Fig.3 RT-LAMP specific results
2.4 RT-LAMP 的灵敏度试验
从单核细胞增生李斯特菌纯培养物的5 个连续稀释液中提取RNA(稀释10 倍),在最佳反应条件下进行RT-LAMP 检测。 在2 g/dL 琼脂糖凝胶上观察, 低于7.3×101CFU/mL 时没有明显的扩增产物,见图4(a)。 比较LAMP 和RT-LAMP 的灵敏度,LAMP 的 灵 敏 度 为1.4×102CFU/mL, 低 于RTLAMP,见图4(b)。
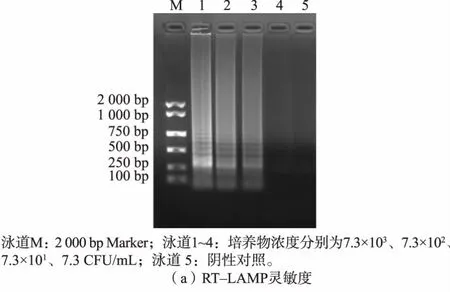
图4 RT-LAMP 和LAMP 灵敏度结果Fig.4 Sensitivity results of RT-LAMP and LAMP
2.5 活菌和死菌的RT-LAMP 和LAMP 检测
RT-LAMP 的测定结果见表3。在含有死单增李斯特菌的10 个样品中结果为阴性, 但在LAMP 测试的所有10 个样品中均为阳性, 而活菌污染样本则均被检出阳性。
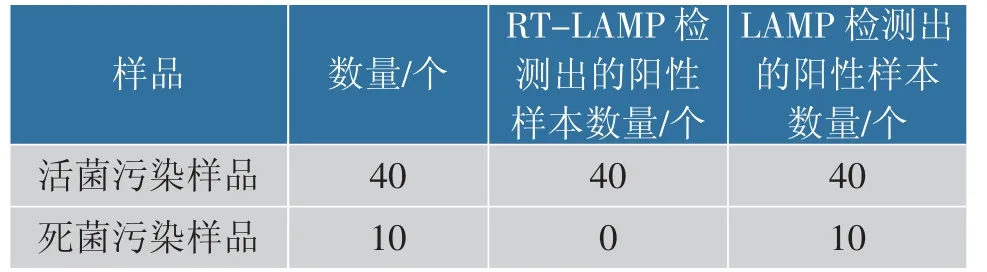
表3 RT-LAMP 和LAMP 检测死菌和活菌Table 3 Detection of dead and living bacteria using RTLAMP and LAMP
2.6 肉样中存活的单核细胞增生李斯特菌检测
100 个肉样品RT-LAMP 分析数据与国家标准GB4789.30—2016 的数据比较结果见表4。 RTLAMP 和GB 测定均鉴定出3 种单核细胞增生李斯特菌阳性样品,证实了RT-LAMP 测定的准确性。
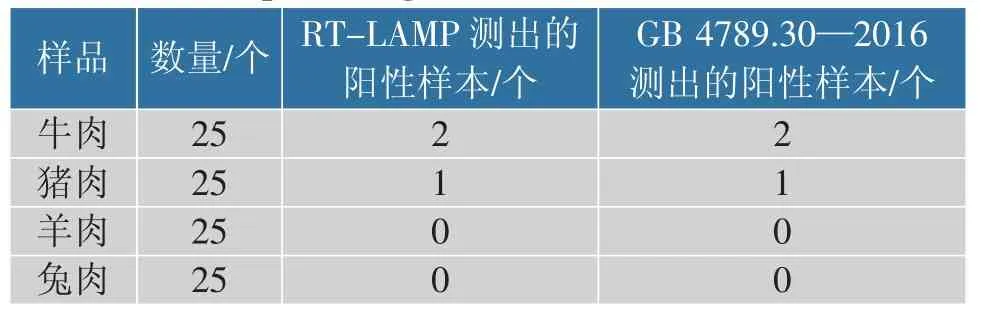
表4 RT-LAMP 和GB 法检测肉样中的单核细胞增生李斯特菌Table 4 Detection of Listeria monocytogenes in meat samples using RT-LAMP and GB methods
3 结 语
作者首次用RT-LAMP 以iap 基因为靶基因设计引物检测肉样中单增李斯特菌, 在传统的LAMP技术上作了延伸。此外,根据RT-LAMP 原理对反应体系进行优化,对该方法性能进行评估,并与国标进行对比。 实验结果表明,RT-LAMP 在7.3×101CFU/mL 培养物中即可检出单增李斯特菌, 具有高灵敏度。 且在特异性实验中没有出现假阳性结果,特异性强。 采用RT-LAMP 在7.3×101CFU/mL 的培养物中检测到单增李斯特菌, 灵敏度是LAMP 的2倍。 在活菌和死菌的检测实验中,与LAMP 技术相比,RT-LAMP 只对活菌进行扩增,可以区分活细菌和死细菌, 避免假阳性结果, 且鉴别能力较强,而GB 方法难以做到。 在随后的可行性实验中,RTLAMP 检测结果与国家标准GB 4789.30—2016 方法相同,但整体准确度更高,这表明它可以更快、更准确地检测单增李斯特菌,有望取代GB 4789.30—2016。实验结果还显示,MgSO4的浓度对引物结合和Bst 活性的影响最大, 镁离子的浓度不适合整个体系就不会得到扩增结果,这与之前的研究结果一致[8]。同时甜菜碱在体系中的作用值得探讨,虽然其他人报道在RT-LAMP 中加入甜菜碱只能适度提高反应性能[9],但在本实验中观察到扩增产物明显增加(1.0 mol/L 甜菜碱是最佳)。 这一现象可能与甜菜碱增强RNA 对Bst DNA 聚合酶的易接近能力有关[10]。
综上所述,RT-LAMP 技术检测肉样中单增李斯特菌具有特异性和良好的灵敏度, 相比GB 方法对死菌活菌的辨别准确,避免了消毒灭菌后死菌残留或因其他原因出现死菌情况下对食品卫生程度的误判[11-13]。 相比于传统生化方法,此技术节省了菌落培养分离所需的时间,减少了工作量,并能做到即取即测。 同时该技术延续了LAMP 技术的优点,仪器成本低且操作便捷,为食源性致病菌的快速高效检测提供了新途径。

