燕窝罐头原料及生产中嗜热微生物分析
范力艺, 范群艳, 林佳馨, 胡嘉淼, 张 怡*
(1.福建农林大学 食品科学学院, 福建 福州 350002; 2.厦门燕之屋丝浓食品有限公司, 福建 厦门 360000;3.中粮生物科技股份有限公司,北京 102200)
燕窝是由鸟类雨燕科(Apodidae)若干种金丝燕的唾液腺分泌物及绒羽等混合物筑就的巢窝,为我国传统名贵食材之一[1]。 燕窝以蛋白质、碳水化合物和氨基酸为主要成分,其中必需氨基酸含量约占总氨基酸的50%,具有极高的营养价值[2]。 燕窝具有止咳化痰、润肺生津、养胃补脾、抗氧化、延缓衰老等保健功效[2-4]。 此外,燕窝还可提高机体各项免疫机能,以对特异性及非特异性免疫功能的调节最为显著[5]。 现代社会崇尚营养健康且便捷安全的饮食模式,燕窝尤其是即食燕窝罐头制品的市场需求量随之增长。 由于燕窝罐头工序冗长,包括挑拣燕毛、汽蒸燕窝、蒸煮冰糖、灌装糖液等步骤,因此在复杂的加工过程中易被嗜热菌污染,且燕窝罐头pH 为6,水分活度Aw>0.85, 属于低酸性罐头 (LACF),而LACF 的杀菌一直是食品杀菌的重点与难点。
耐高温微生物俗称嗜热菌, 分布于高温区域,如温泉、火山口、日照充沛的土壤表层、工厂高温废水排放地带等, 大部分菌落的最适生长温度为50~60 ℃[6]。嗜热菌常见于青豆、蘑菇、芦笋、肉类等低酸性罐头,是引起低酸性食品罐头腐败变质的典型平酸菌之一。 在低酸性罐头原材料与加工链各个环节中,低浓度嗜热菌繁殖迅速,易造成微生物污染。 且多数嗜热杆菌能产生抗逆性极强的耐热芽孢,可抵御巴氏杀菌, 有的甚至能经受超高温瞬时灭菌(UHT)而存活[7-8]。 法国针对高温热处理罐头食品变质原因的调查结果表明,嗜热菌是绝大部分变质罐头产品的罪魁祸首。 有数据显示,所有污染菌种中热醋穆尔氏菌(Moorella thermoacetica)、地芽孢杆菌属(Geobacillus)、杆 菌 属(Thermoanaero bacterium)为主要污染菌,分别占36%、35%和10%,还有9%的罐头变质产品被芽孢杆菌属(Bacillus)污染[9]。
嗜热菌的存在会引起罐头内容物感官特性的变化,如汤汁变浑浊、出现酸臭味等[10],不仅影响产品品质及安全性,还将失去食用价值,削弱在高温环境下储存的可行性,给企业带来不可挽回的经济损失[11]。燕窝罐头成本高昂,难以进行大量的成品检测。虽然121 ℃灭菌处理30 min 以上可以使得燕窝罐头免于嗜热菌腐败,但燕窝品质往往无法得到保证。
因此,需要更好地了解嗜热菌及其在制罐工业加工生产线上的来源,以确保更好地控制制罐卫生条件。 微生物一般可通过内源性污染和外源性污染的渠道对食品造成污染。 诸多资料显示,嗜热菌污染可能源于原料或者生产线,嗜热杆菌可附着于乳品加工机械的不锈钢表面形成生物膜并在奶垢层中繁殖[12];经检验证实了午餐肉罐头酸败主要由于嗜热脂肪芽孢杆菌污染水源、设备等外环境介质所致[13];平酸和硫化物嗜热菌以及腐败厌氧嗜中温菌都能通过原料污染从而引起整个玉米罐头腐败变质[14]。
对燕窝的研究较多关注其生物活性及生理功能,缺乏对其微生物安全方面的探讨,更鲜见针对嗜热菌污染造成燕窝罐头产品腐败的相关报道,因此有必要对燕窝罐头中菌群结构开展研究,研究燕窝罐头中嗜热微生物的来源。 作者基于16S rRNA测序技术结合传统培养分离方法研究燕窝罐头生产线上的微生物分布情况,分析优势菌;对比分析原料、不同生产工序以及终产品的微生物群系构成的异同;揭示燕窝罐头中腐败微生物污染来源和关键工序,旨在为燕窝罐头的生产质量控制和卫生监管提供依据。
1 材料与方法
1.1 实验材料
燕窝样本:来自厦门一家燕窝有限公司,生产燕窝罐头的大致流程(含采样点标记)见图1。 对同一燕窝罐头生产线的3 个批次进行采样(每个批次都在同一组条件下进行),具体步骤为:在同一批次中的每处采样点(如干燕窝原料)重复采样5 次,再将3 个批次的样本均匀混合,代表本研究的一个样本 (如YW1)。 由此得到5 个样本, 依次编号为YW1、YW2、YW3、YW4、YW5,作为本试验的研究对象。 所有工序车间按照食品车间沉降菌标准(GB/T 16294—2010)执行,所有样品取样后放入无菌袋中密封保存,样本情况见表1。
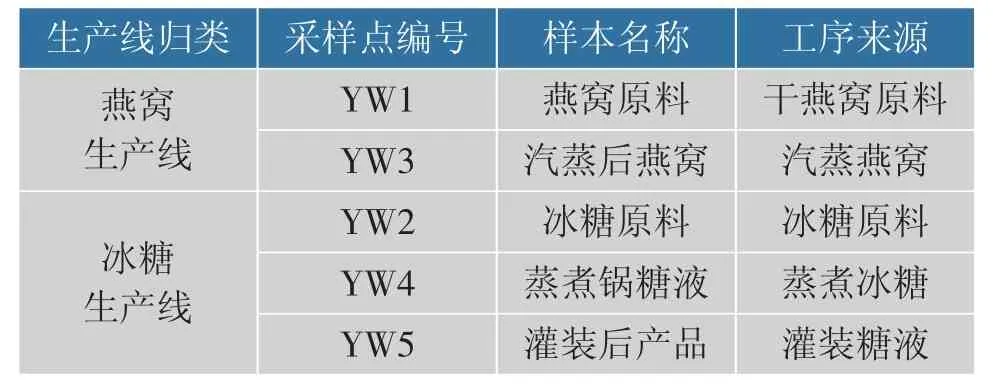
表1 样本情况说明Table 1 Description of samples
1.2 仪器与设备
E.Z.N.A.®soil 试剂盒:美国Omega Bio-Tek 公司;0.4 uL FastPfu 聚合酶: 中国TransGen 公司;引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′):上海生工生物工程公司;2 g/dL 琼脂糖:西班牙Biowest;PCR 仪:ABI GeneAmp®9700 型。
1.3 试验方法
1.3.1 样本采集在燕窝罐头生产线上的5 处地点分别采集样本, 编号为YW1、YW2、YW3、YW4、YW5,并注明来源。
1.3.2 细菌DNA 提取采用E.Z.N.A.®soil 试剂盒提取样本的微生物基因组DNA,具体步骤见试剂盒说明。
1.3.3 PCR 扩增以基因组DNA 为模板进行16S rRNA 基因序列扩增,扩增程序如下:预变性(95 ℃、3 min)、变性(95 ℃、30 s)、退火(55 ℃、30 s)、 延伸(72 ℃、30 s)、再延伸(72 ℃、10 min)。 扩增整个体系为20 μL,包括:10 ng DNA 模板,4 μL 5×FastPfu缓 冲 液,2 μL 2.5 mmol/L dNTPs,0.8 μL 引 物(5 μmol/L),0.4 μL FastPfu 聚合酶。
1.3.4 2 g/dL 琼脂糖凝胶电泳用2 g/dL 琼脂糖凝胶电泳检测扩增产物,具体操作如下:将琼脂糖粉、TAE 电泳缓冲液、 核酸染料于锥形瓶中加热融化;摆好梳子,待胶体冷却到约60 ℃时倒胶,待胶体凝固后拿掉梳子,形成胶孔,把胶板放进电泳槽,再缓慢倾注TAE 缓冲液直到液面在凝胶上方1~2 mm;混合样品和上样缓冲液后点样于胶孔;连接电源进行电泳,DNA 跑向正极, 观察到条带至下边缘1 cm 时停止通电; 取出凝胶在成像系统下观察拍摄。
1.3.5 Illumina Miseq 测序将检测达标准的PCR产物交由上海生工生物工程公司, 使用Illumina 公司的Miseq PE300 平台对其测序。
1.3.6 数据处理序列以97%的相似度进行OTU聚类,在此过程中去除单序列与嵌合体。 运用RDP classifier 对每条序列进行物种分类注释,与Silva 数据库进行比对, 并采用R 软件聚类PCA 分析不同组分的关联度。
1.3.7 传统方法分离培养嗜热菌使用AFNORCNERNA 标准[9]去重新激活样品中的芽孢,每10 g样品与100 mL 的锰盐牛肉汤培养基置于锥形瓶中,分别放置于37 ℃和55 ℃下,在无氧(石蜡封口)和有氧条件下培养7 d, 然后摇匀并吸取锥形瓶中液体0.1 mL 在锰盐琼脂培养基上,置于相同温度与相同氧气下培养。 然后用十倍稀释法,根据菌落形态、颜色、大小进行单菌落挑取,在锰盐培养基上划线分离,多次分离单菌落用于分子生物学鉴定。
1.3.8 鉴定分离出的单细菌DNA 提取及16S rDNA 测序分析。 采用细菌基因组DNA 提取试剂盒对SK8255 进行DNA 提取, 将提取的16S rDNA 进行PCR 扩增,PCR 引物7F1540R(CAGAGTTTGATC CTGGCTAGGAGGTGATCCAGCCGCA)和27F1492R(AGTTTGATCMTGGCTCAGGGTTACCTTGTTACGA CTT)。 反应过程为94 ℃预变性5 min,94 ℃45 s、55 ℃45 s、72 ℃1 min,共30 个循环,72 ℃延伸10 min,最终冷却至4℃,扩增结果再进行琼脂糖凝胶电泳,紫外灯下观察扩增效果,若出现1.5 kb 的条带,则证明扩增出了16S rDNA 序列。 将扩增产物送交上海生工生物工程技术服务有限公司进行测序。
2 结果与分析
2.1 Alpha 多样性分析
Alpha 多样分析中的Chao1 和ACE 指数表示群落的丰度,Shannon 和Simpson 指数表示群落的多样化[15]。 稀释曲线(丰富度曲线)用于初步评估微生物多样化分析中的测序数据量是否代表全部类群和物种的丰富性。 本研究中5 个采样点的稀释曲线见图2。
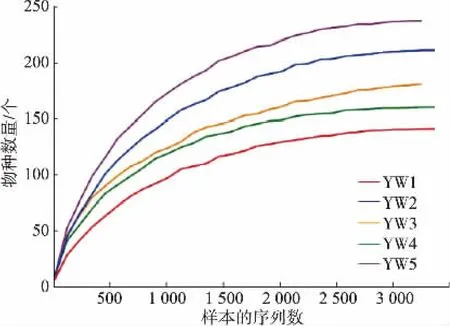
图2 稀释曲线Fig.2 Rarefaction curves
图2 中横坐标表示每个样本随机抽取的序列数, 纵坐标表示测序深度指数observed species,即在测序深度下的OTU 数量,也就是物种数量。 样本曲线的平缓程度反映了测序深度对于观测样本多样性的影响大小。 由图2 可知,在随机抽取的序列数约3 000 处,5 条样本曲线均趋于平坦,表明此时测序数据量已趋于饱和,测序深度可基本涉及样本中的所有物种,即使增加测序数据也不能检测到更多的OTU 单元。 故本研究的测序深度满足要求,反映了样本的完整菌群构成,可用于数据分析。
图3 (a) 表明在不同生产线不同工序中的Chao1 指数都存在显著性,其中YW1、YW2、YW3 的Chao1 指数显著增加, 表明其微生物丰富度显著增加,这说明燕窝在汽蒸过程存在人员代入其他微生物的隐患;YW2、YW3、YW4 的Chao1 指数显著下降,这可能由于冰糖蒸煮过程部分非耐热微生物死亡降解; 而YW5 样品是燕窝和冰糖最终混合的产品,因此有着最高的丰富度。 图3(b)中的Shannon指数只有燕窝相关工序的YW1、YW2、YW3 样品显著增加,这表明YW3 样品有着更好的均匀度,推测是汽蒸过程只降低了优势菌的含量,导致均匀度上升; 而燕窝原料在本身的环境中存在明显优势菌,导致YW1 样本的均一性较差, 因此Shannon 指数较低。
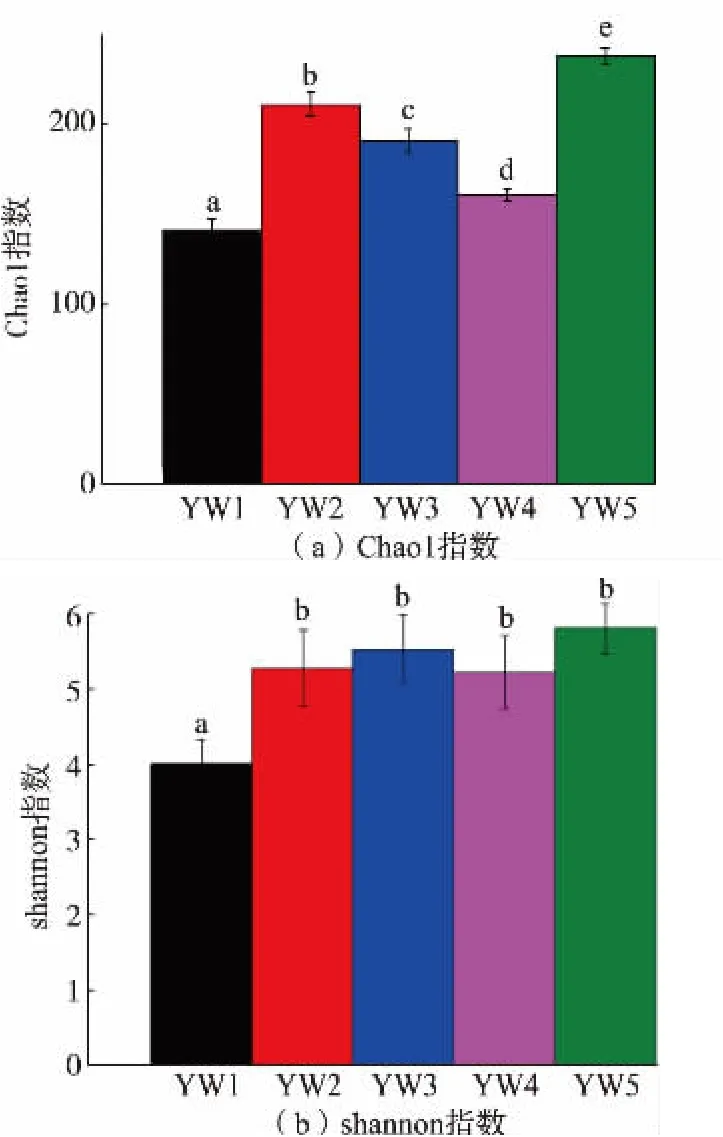
图3 Alpha 多样性分析Fig.3 Alpha diversity analysis
2.2 微生物群落结构分析
2.2.1 微生物群落丰度分布微生物环境是一个大型生态生物群落, 有着不同丰度的各类菌属,每个菌属的微生物种类和丰度因生境的不同而异。 这样一个优势菌属和低丰度菌属的组成便称为生境所具有群落结构。 因此,在对物种多样性分析的基础上,进一步对燕窝罐头原料与不同生产工序中的群落结构进行分析。 燕窝原料与不同生产工序中微生物群落(门水平、属水平)丰度分布情况见图4。
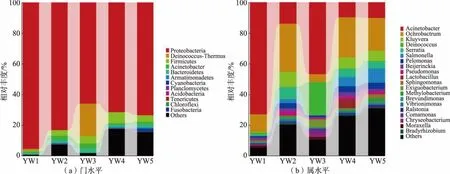
图4 微生物群落丰度分布图Fig.4 Abundance distribution of microbial community
优势菌是指在一个菌群中占主导地位的菌。 从图4(a)可知,在门分类水平中,Proteobacteria(变形菌门) 在5 份样本中占据绝对优势地位, 其次为Deinococcus-Thermus (异常球菌-栖热菌门)和Firmicutes (厚壁菌门)。 其中Deinococcus-Thermus的含量在燕窝汽蒸后(YW3 处)突增,代表这类微生物有较强的热抵抗能力, 因此在汽蒸后得以生存,从而在菌群中占据更大的比例。 异常球菌-栖热菌门中的水生栖热菌(Thermus aquaticus)最早在美国黄石公园被发现, 当时经检测为一种极端嗜热细菌,能在70 ℃下生长,该特性合理解释了图4 的突增现象[16]。 水生栖热菌中提取出的Taq DNA 聚合酶具有良好的热稳定性,被广泛应用于PCR。 图4(b)反映了属分类水平中Acinetobacter (不动杆菌属)、Ochrobactrum(苍白杆菌属)、Kluyvera(克吕沃尔氏菌属)在群落构成中占比较大,在全部样本中综合优势程度位列前三,均隶属于变形菌门。
2.2.2 物种相对丰度聚类热图图5 的物种丰度聚类热图直观地展示了各样本在属分类水平上微生物群落的变化情况。 各样本微生物群落在属水平热图聚类成功, 且各属细菌在5 个样本中存在差异。YW2、YW4、YW5(冰糖相关工序及灌装后产品)色块构成差异较小, 有相似的微生物群落构成,YW1、YW3(燕窝相关工序)有相似的微生物群落构成。 Acinetobacter 在YW1、YW3 中为优势菌属,在YW2、YW4、YW5 中为非优势菌属,这类菌属为变形菌门, 是所有样本属水平微生物中的第一优势菌属。 广泛分布于土壤、山洞、水池等地,容易在潮湿的环境中生活,是条件致病菌,可造成免疫功能低下的机体皮肤、伤口、呼吸系统、泌尿系统等的感染,特别是呼吸道感染,还可能伴有咳嗽、发烧、胸痛等不良反应[17]。 该菌属中的鲍曼不动杆菌是医院中感染重症患者的典型病原菌,其多重耐药为临床防治带来极大的难度[18-19],故有关Acinetobacter 的微生物污染问题应予以高度重视。 Ochrobactrum 和Kluyvera 在YW2、YW4、YW5 中 为 优 势 菌 属,在YW1、YW3 中为非优势菌属。 Ochrobactrum 属于革兰氏阴性菌,来源于动植物、水源、土壤等环境,是人类常见病原菌,有潜在的感染可能[20]。 有报道指出,人苍白杆菌与布鲁氏菌属有着类似的生物学特性,在免疫、遗传学方面具有高度关联性,二者可相互交叉凝集,且临床表现无差别,因此常引起鉴别和诊断上的失误[21]。 Kluyvera 多在肠道、呼吸道、泌尿道标本中检出,是一种与人类腹泻紧密联系的条件致病菌,有些会使生物模型发生病变,且这类微生物具有广泛的抗药范围,一经感染将给治疗造成困难[22-23]。
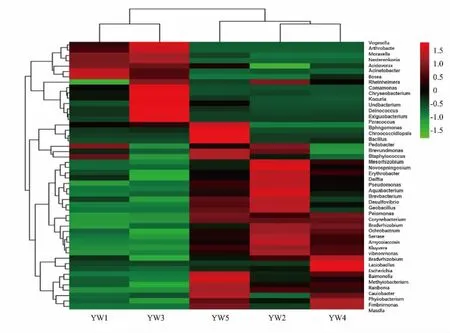
图5 微生物群落丰度聚类热图(属水平)Fig.5 Clustering heat map of microbial community abundance(genus level)
2.3 PCA 聚类分析
PCA 聚类分析(即主成分分析)是一种研究数据相似性或差异性的可视化方法,利用PCA 图可进一步得知YW1、YW2、YW3、YW4 和YW5 样本之间微生物群落结构的关联程度,见图6。在坐标图上距离越近的样本,物种组成相似性越大。
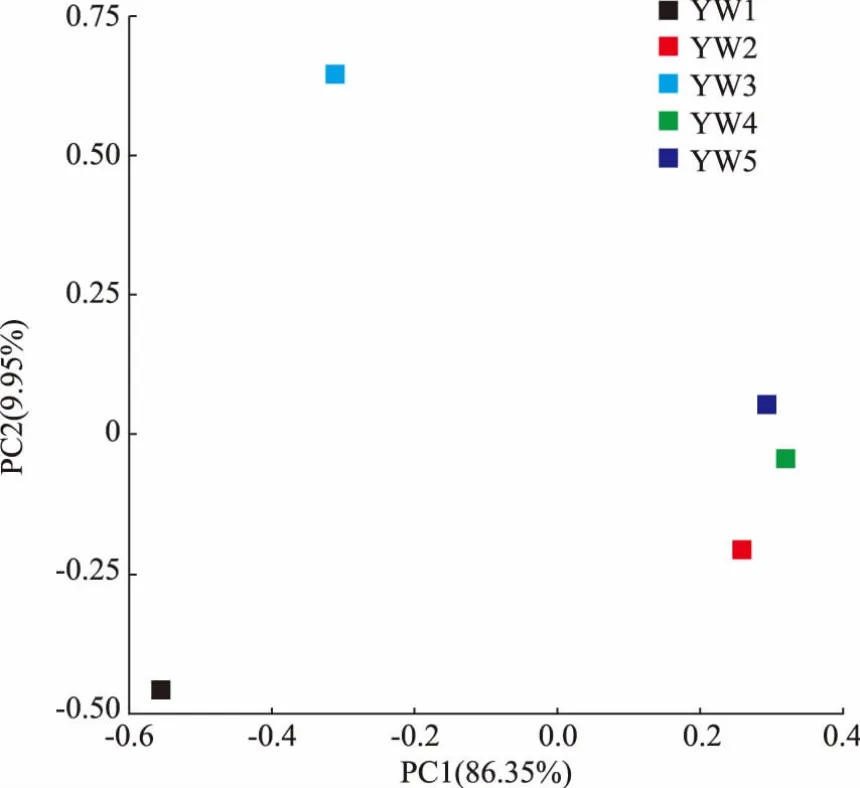
图6 微生物群落PCA 图Fig.6 PCA map of microbial community

图7 培养分离出的细菌绘制发育树Fig.7 A developmental tree drawn by culturing isolated bacteria
如图6 所示,2 个主成分可反映样本全部信息的96.3%(PC1 贡献率86.35%,PC2 贡献率9.95%),表明数据的提取较完全,且数据有很强的代表性。 5个样本组内,YW2、YW4、YW5 这3 个样本之间的距离较近,聚集性较好;而YW1 与YW3 之间的距离较远,较为分散,主要体现在PC2 成分上。 这说明冰糖原料、蒸煮锅糖液、灌装后成品这3 个环节高度相关,微生物群落结构相似;而燕窝原料、汽蒸后燕窝的微生物构成存在较大差异,这应该是由于燕窝在汽蒸过程,部分耐热微生物在原料中占据更大的比例。 总体来看,冰糖组样品(YW2、YW4、YW5)和燕窝组样品 (YW1、YW3) 明显分布于不一样的区域,表示2 组样品的物种组成差异较组内大。
2.4 典型嗜热菌分析
罐头加工中的排气工序会显著降低罐内氧含量,形成缺氧环境,这时厌氧菌和兼性厌氧菌成为主要腐败菌。 另外,经过热杀菌处理,罐内主要残留的是易形成芽孢且耐热极强的嗜热菌。 表2 为燕窝原料与不同生产工序中典型嗜热菌的检测结果。
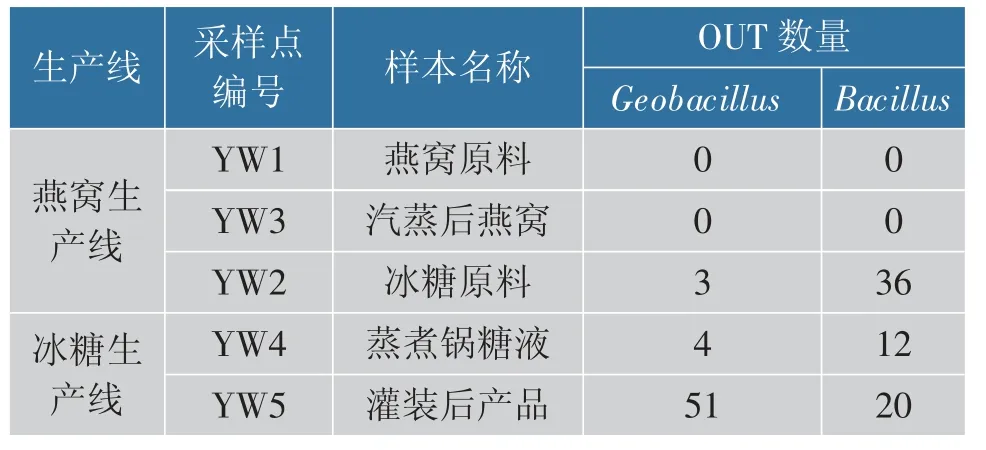
表2 典型嗜热菌检测情况Table 2 Detection of typical thermophilic bacteria
如表2 所示, 在YW2、YW4 和YW5 中检出了Geobacillus(地芽孢杆菌属)与Bacillus(芽孢杆菌属),这是2 种常见的污染菌属,具有高度耐热性、嗜热性,已被列为罐头食品的典型腐败菌属[14]。在冰糖原料中检出的2 类重要污染菌:Geobacillus 和Bacillus,并且蒸煮锅的糖液和最终产品中也检出相同的菌属,这说明冰糖原料是燕窝罐头的主要污染来源,并且与冰糖原料相关的YW4 工序也受到了冰糖的污染,因此需要对冰糖原料及相关工序进行重点监管。
地芽孢杆菌属中G.stearothermophilus (嗜热脂肪地芽孢杆菌) 是最常分离出的一种嗜热杆菌,为表面粗糙、 呈米黄色的革兰氏阳性菌。 它生长在pH≥5 的罐头食品中,通过分解糖类产酸,发生平盖酸败。 在国标中规定为湿热灭菌生物指示剂,它可以用来证实灭菌设备的性能,评价灭菌程序有效性,检验生产中的灭菌效果[24]。李雅丽等进一步验证了嗜热脂肪芽孢杆菌可作为低酸性饮料的杀菌指示剂[25]。芽孢杆菌属对不良环境具有较强抗逆性,在土壤中最为常见,其中B.smithii(斯密氏芽孢杆菌)在罐头食品、乳酪制品中分离获得。 黄卫强等在呼和浩特牛场地表土壤中分离鉴定出的优势菌有B.cereus(蜡状芽孢杆菌)、B.thuringiensis(苏云金芽孢杆菌)、B.licheniformis(地衣芽孢杆菌)[26]。B.cereus能够产生多种毒素,易引起食物变质和细菌性食物中毒,影响人体健康,所牵涉的食品种类极多。 有学者在天津某牧场奶样中分离出较高比例的地衣芽孢杆菌,有些菌株还携带耐药基因,可能增加生乳的安全隐患[27]。 B.subtilis(枯草芽孢杆菌)为一种靠鞭毛运动的好氧菌,其菌落形态多变,能分解色氨酸, 影响植物体内生长素吲哚乙酸的生物合成,可引起苹果、梨等果树的小叶病;能胨化牛奶,分解鲜乳中的蛋白质,产生腐败味。 有研究者在奶制品中分离出了B.subtilis,其菌株在孢子萌发后能在不锈钢表面生长,这意味着该菌在工厂环境中有附着在器械设备的能力[28]。 可见这2 种菌都有较强的抗逆性与耐热性能, 常从腐败的罐头中被分离出来,通常在121 ℃杀死1 个对数值的G.stearothermophilus需要3~6 min, 而杀死1 个对数值的B.smithii 需要1 min 左右, 因此这2 种耐热性极强的菌属可能会对燕窝罐头食品安全造成极大威胁,而其中地芽孢杆菌属可能产生的威胁更大[9]。 但是由于高通量测序通常只能精确到属水平,因此需要通过分离培养的方法进一步把嗜热微生物鉴定到种水平。
2.5 传统分离培养
通过传统分离培养后再进行一代测序可以确定冰糖中活的嗜热菌并且确定到种水平,其中一种为B.smithii(斯密氏芽孢杆菌),常从腐败罐头中将其分离出来;另外一种为Aeribacillus pallidus(苍白芽孢杆菌), 通常从奶粉中分离出来。 早期研究表明,Aeribacillus pallidus 可以在120~125 ℃存活30 min[29]。 从发育树看,与罐头常见腐败微生物嗜热脂肪地芽孢杆菌有很强的亲缘关系, 同属于Gebacillus;从序列亲缘关系来看,苍白芽孢杆菌这种微生物有着很强的热抵抗能力,对后期燕窝罐头杀菌造成了极大阻碍。
3 结 语
作者以燕窝罐头2 种原料与3 个主要生产工序为研究对象, 基于16S rRNA 高通量测序技术结合传统分离培养方法,对生产线样品中的微生物多样性展开了研究。 用稀释曲线验证了测序结果的可靠性,根据数据结果将样本大致分成2 组:燕窝相关生产工序(包括YW1 和YW3, 以下简称燕窝组样本)、冰糖相关生产工序与灌装后产品(包括YW2、YW4 和YW5,以下简称冰糖组样本)。
综合样本微生物群落丰度分布图和热图,发现2 组样本间具有显著差异, 冰糖组样本内差异较燕窝组更小,且冰糖组样本之间有相同的优势菌和相似的微生物群落构成,这说明污染的微生物也可能在冰糖相关工序中传播。 PCA 聚类分析结果再次验证了冰糖相关生产工序与终产品样本间密切的微生物联系。从OTU 检测结果可知,在冰糖原料、蒸煮锅糖液、 灌装后产品中均检测出Gebacillus 和Bacillus, 而燕窝原料中没发现这类嗜热微生物,因此可推断出,该生产线的污染微生物是由冰糖作为初始原料代入,而非燕窝原料或者其他生产工序中途代入,并且与冰糖相关的工序如熬制糖液也应该作为关键工序进行管控。 这源于冰糖特定的生产和销售模式,它从结晶到包装历时较长,且多为人工操作,污染风险远大于机械自动化生产,一些车间卫生条件较差,影响生产质量,加之漫长的销售周期,更促进了细菌滋生,加重了冰糖污染[30]。 为了进一步确认冰糖中的嗜热菌到种水平,将含有将冰糖嗜热菌分离培养后通过测序技术确定了冰糖中的2种嗜热菌, 分别为斯密氏芽孢杆菌与苍白芽孢杆菌, 这2 种是高耐热性的嗜热菌, 尤其后者在130℃下也不一定能被完全杀死。 此前在糖中发现嗜热脂肪地芽孢杆菌,并且发现受污染的砂糖是导致罐头变质的主要原因[31]。
嗜热菌的高抗逆性以及在工序间的持久传播性是个不容小觑的问题。 在实际生产过程中可以通过原料重点监控筛选出不含嗜热菌的供应商进行采购,或者可以通过预处理方式先降低原料中嗜热菌总体数量,从而降低最后杀菌工序的强度,在保证燕窝罐头品质的同时,杀灭燕窝罐头中的嗜热微生物。
作者用16s rRNA 技术研究了燕窝生产线上的微生物,并且证实了冰糖原料与包括最终产品在内的其他相关工序都携带嗜热腐败菌属Geobacillus,从而确定冰糖原料的品质是生产安全的关键控制点,而嗜热菌可作为评估生产过程整体卫生状况是否良好的候选指标。 采用该方法对不同批次的样品进行取样,研究结果相互印证,具有较强的科学性。之前有报道表明茶叶与饮料等生产线上的微生物污染也采用了类似的取样方法[32-33],下一步可以在更多企业更多的生产线上收集微生物数据,以大数据的方式研究不同生产线上被污染情况,从而更加明确食品工厂微生物污染与其他因素之间的关联性。 企业应积极采取措施改善生产过程,如通过对生产线的适当清洗、对原料质量标准的提高、对低酸性罐头高温稳定性的测定以及实时监测罐头中嗜热菌的变化等举措[34-35],以便更好地控制以嗜热孢子为代表的污染菌群,从而提高食品安全性。

