细菌素的抑菌机制及其在食品工业中应用进展
李冰瑶,郑茵,王涓,吴清平,张菊梅,丁郁
(1.广东省科学院微生物研究所,华南应用微生物国家重点实验室,农业农村部农业微生物组学与精准应用重点实验,广东省微生物安全与健康重点实验室,广东广州 510070)(2.暨南大学食品科学与工程系,广东广州 510632)(3.华南农业大学食品学院,广东广州 510642)
食品微生物污染一直是全球食品行业和消费者关注的重要问题。在新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)仍流行的情况下,微生物继发感染的机会仍然较高,并且在治疗过程中变得更为复杂[1]。食物中的腐败细菌对食品质量具有威胁性,如肉毒杆菌、单核细胞增生李斯特菌、肠球菌、链球菌、葡萄球菌、大肠杆菌等,进入人体组织会引起炎症性疾病、呼吸道感染、全身感染、肠道癌症等疾病,严重者可致命。因此,新型食品防腐技术及防腐剂开发尤为重要。已有研究表明,一些防腐剂对人体有不利影响,如易引起人体的过敏反应,亚硝酸盐会形成亚硝胺等致癌物质[2]。此外,某些传统防腐技术也会改变食物的感官特性和破坏食品中的可利用营养成分。近年来,人们越来越关注使用非病原微生物及其代谢产物抑制食品变质而延长食品保质期[3]。消费者们渴望营养安全且不含合成防腐剂的食品,因此研究人员试图通过寻找天然有效的替代品来保存食品以满足消费者需求[4]。
随着食品科学的不断发展,研究人员发现了一种安全和天然的防腐剂—天然生物防腐剂。在微生物中,乳酸菌(Lactic Acid Bacteria,LAB)具有生物保存能力,因为它能产生一系列天然活性抗菌物质,如有机酸、过氧化氢、细菌素等[5]。另外,乳酸链球菌素(Nisin)被认为是一种“天然防腐剂”,以耐受高热应力且在宽pH值范围内的活性而闻名[6],从而增加了其市场应用。第一个发现的细菌素是1925年从革兰氏阴性菌大肠杆菌中分离得到大肠杆菌素(Colicin),其通过抑制细胞壁合成与改变细胞膜通透性而抑制细菌,仅对与大肠杆菌密切相关的细菌或窄谱杀菌作用。后来发现来自乳酸菌的革兰氏阳性菌的细菌素,更具有广谱性,对一系列食物腐败微生物和食源性病原体有效[3]。目前,有几种经过鉴定和纯化的细菌素用作食品添加剂和防腐剂,主要包括:枯草杆菌素、Thuricin、Cerein和植物霉素。最常见的抗微生物肽(Antimicrobial Peptides,AMPs),也称为生物活性肽、细菌素或抗微生物活性肽,是乳酸链球菌生产的乳酸链球菌素,被认为在食品中使用是安全的[7]。
在过去的几十年里,细菌素在食品生物保鲜、果汁饮料加工、牛奶乳制品杀菌、食品防腐剂、新型食品包装材料等领域得到了持续的关注。因此,本文综述了细菌素的发展,重点介绍了细菌素的抑菌机制,以及细菌素在食品行业的应用及展望,为细菌素在食品工业中的应用提供一定的理论依据,同时对推动食品防腐保鲜技术的革新发展具有重要的意义。
1 细菌素的种类
Klaenhammer等[8]描述的经典分类方法将细菌素分为四类。I类细菌素是小的(分子量<5 ku)膜活性肽,称为羊毛硫抗生素,通常由19~50个氨基酸组成,经过广泛的翻译后修饰,产生了非标准氨基酸,如羊毛硫氨酸、β-甲基羊毛硫氨酸、脱氢丁碱、脱氢丙氨酸和Labyrinthine。I类又细分为Ia类(Lantibiotics)、Ib类(Labyrinthopeptins)和Ic类(Sanctibiotics)。Nisin是研究最深入的的I类细菌素。II类细菌素是小的(分子量<10 ku)耐热非羊毛硫抗生素,包含热稳定性小的、未修饰的多肽,并可进一步细分为IIa类(儿茶素样细菌素)[9],IIb类(双肽未修饰细菌素)、IIc类(环状细菌素)和IId类(未修饰的、线性的、非小儿茶素样细菌素)。IIa亚类包括单核细胞增多性李斯特菌含有N末端共有序列Tyr-Gly-Asn-Gly-Val-Xaa-Cys的活性肽;亚类IIb包含由两个活性肽组成的穿孔复合物;IIc亚类包括需要减少半胱氨酸残基的硫醇活化肽。III类包括大的(分子量>30 ku)耐热细菌素。IV类包括由一个或多个化学部分组成的复杂蛋白质,且数量较小。
1.1 革兰氏阳性细菌素
已有研究发现,革兰氏阳性细菌素包括I类、II类和III类。I类细菌素有Nisin A、Nisin U以及Nisin Z等;II类细菌素包括IIa类、IIb类和IIc类。IIa类细菌素包括儿茶素PA-1[10]和肉毒杆菌素X[11];IIb类细菌素包括lactacin F[12]和ABP-118[13];IIc类细菌素包括卡诺环素A[14,15]和肠霉素AS-48[16];III型革兰氏阳性细菌素包括表皮霉素NI01[17]和乳霉素A[18](表1)。I类革兰氏阳性细菌素如Nisin和lacticin 3147是具有正电荷的柔性螺旋形分子,可在目标生物的细胞膜上形成孔,从而导致目标物种细胞质膜去极化[19]。另外,由芽孢杆菌属分泌的Mersacidin,没有净电荷或净负电荷,这是一种可以干扰细胞酶促反应(如细胞壁合成)的球状分子[20]。

表1 革兰氏阳性细菌素分类Table 1 Summary of classification of Gram-positive bacteriocins

表2 革兰氏阴性细菌素分类Table 2 Summary of classification of Gram-negative bacteriocins
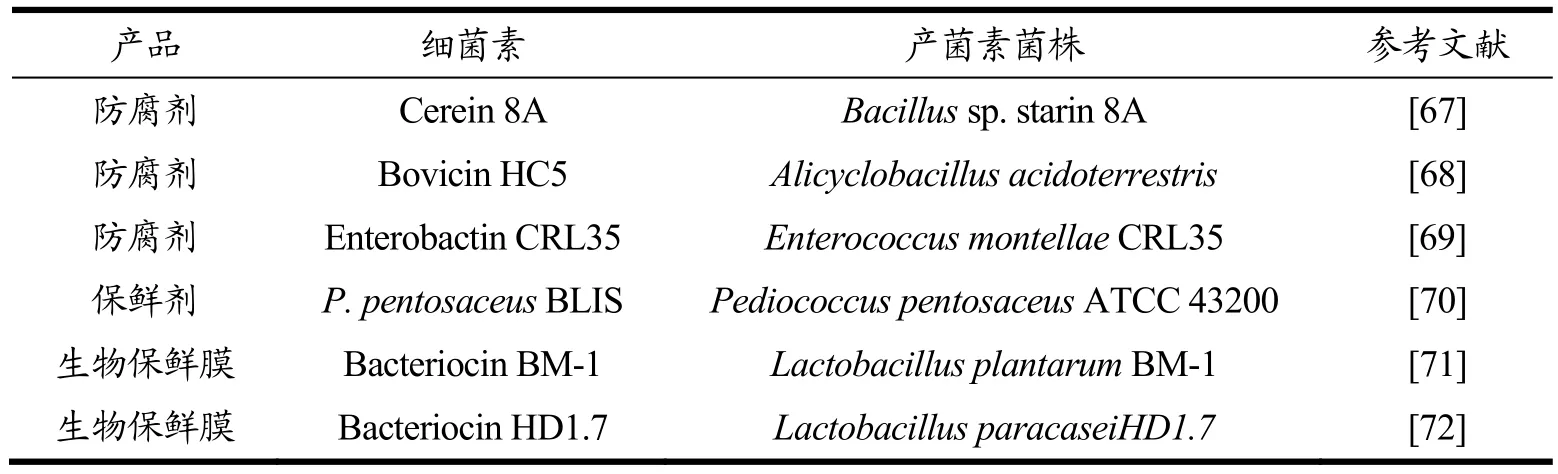
表3 细菌素在食品工业中的应用Table3 Application of bacteriocin in food industry
1.2 革兰氏阴性菌细菌素
低分子量肽(1~10 ku)的小菌素(Microcins)和高分子量蛋白质(30~80 ku)的大肠杆菌素(Colicins)是两种较常见的革兰氏阴性菌细菌素。大肠杆菌素由含有Colicins质粒的大肠杆菌菌株产生[6]。Microcins通常是高度稳定的分子,对蛋白酶、极端pH值和温度具有抗性。它们是由肠道细菌在压力条件下产生的,特别是在营养耗尽的情况下产生。如Microcin B17、C7-C51、D93和J25等也属于I类细菌素。II类细菌素又可进一步分为两个亚类,包括IIa类和IIb类。如Microcin L、V和N属于IIa类微肽,它们是需要三个不同的基因来合成和组装的功能肽。如Microcin E492、M和H47,它们属于IIb类微肽,是一种C末端有或没有翻译后修饰的线状多肽[32]。如Colicin A、B、K和N等都属于III类细菌素,都是成孔大肠杆菌素。
2 细菌素的抑菌机制
细菌素是细菌用来在同一环境中与微生物竞争手段之一。研究人员首次发现乳酸链球菌素以来,已经报道了大量具有独特结构和不同活性模式的细菌素[33]。大部分细菌素的作用机制取决于细菌素受体分子。细菌细胞表面和细胞膜对细菌素具有敏感性,因此细胞膜通透性改变和孔隙形成是细菌素攻击目标微生物细胞的重要因素之一[34]。然而,同一类别的所有细菌素不遵循相似的作用方式[35]。细菌素可能利用相同的受体,但它们与这些受体分子的相互作用方式以及对靶细胞的后效应可能完全不同。Lozo等[36]根据细菌素靶向受体分子之间的结构相似性,对细菌素抑菌方式进行分类。总的来说包括细胞膜损伤机制、阻碍细胞分裂和细胞壁损伤机制三个方面[37]。其中细胞膜损伤机制又包括5种模型[38]:(1)“桶板”型[39],指附着在细胞膜表面的细菌素会聚合在一起,形成一个离子通道;其中细菌素的疏水面朝向质膜疏水酰基链,亲水面朝向跨膜孔道;(2)“楔”型[40],与“桶板”型不同的是细菌素主要暴露于缺乏膜的疏水核心,“桶板”型中质子动力势使肽失活,而“楔”型中质子动力势能够减少肽结合到膜的能力;(3)“虫孔”型[41],抗菌肽与细胞膜表面结合后,其疏水区的移位可使细胞膜疏水中心形成裂口,并引发磷脂单分子层向内弯曲,直至形成孔道;(4)“毯式”型[38],细菌素平行于细胞膜排列,如同一张地毯覆盖于磷脂膜外表面。所以当细菌素浓度到达最大或者最小值时,裂缝会因为细胞膜的稳定性降低而形成。
2.1 靶向抑制革兰氏阳性菌的细菌素及其抑菌机制
许多抑制革兰氏阳性细菌的细菌素,通过攻击细胞膜起作用。某些I类细菌素抑制细胞膜上的脂质II(肽聚糖亚基从细胞质到细胞壁的主要转运蛋白),从而消除肽聚糖的合成。其他细菌素形成孔隙以抑制或杀死它们的目标细菌(图1)[6]。另外,某些革兰氏阳性细菌素可以在细菌的细胞膜上定位,使胞内无机盐离子、三磷酸腺苷(Adenosine Triphosphate,ATP)发生泄露,改变细胞膜Δψ而引起质子动力的消耗[43],增大细胞膜通透性抑制其生长。此外,细菌素能够使得蜡样芽胞杆菌细胞膜损伤,并且导致核酸降解从而导致细胞死亡[44]。革兰氏阳性细菌素中对Nisin的研究较为深入。据报道,Nisin对引起食品腐败的革兰氏阳性菌尤其是芽孢杆菌属比如梭状芽胞杆菌、嗜热芽孢杆菌、致死肉毒芽孢杆菌及芽孢等都具有很强的抑制作用,但是对革兰氏阴性菌、霉菌却没有较强的抑制效果[45]。已有研究表明Nisin在革兰氏阳性菌中通过对细胞壁前体类脂II的高亲和力而使细胞膜去极化从而达到抑菌效果。首先,Nisin在细胞膜上招募脂类II分子形成稳定的通道。这些通道的形成导致细胞内容物的泄漏,离子的外流驱散细胞的质子动力,并耗尽细胞内的ATP,从而进一步扰乱细胞膜和依赖于ATP的生化过程。Nisin与脂质II的结合也阻止了肽聚糖的合成,从而扰乱了细胞壁的生物功能[46]。细菌素导致目标细菌细胞的细胞膜通透性增加,可能是通过离子选择性孔的形成,影响质子细胞内ATP的动力和还原,细胞内底物泄漏,并最终导致细胞死亡[34]。

图1 革兰氏阳性细菌素Nisin和Lactococcin A的抑菌机理Fig.1 Bacteriostatic mechanism of bacteriocin Nisin and Lactococcin A
2.2 靶向抑制革兰氏阴性菌的细菌素及其抑菌机制
许多抑制革兰氏阴性菌的细菌素通过干扰DNA、RNA和蛋白质代谢来抑制其靶细菌。例如,小菌素MccJ25(Microcin J25,MccJ25)抑制RNA聚合酶,MccB17抑制DNA旋转酶,MccC7-C51抑制天冬氨酰tRNA合成酶,这些细菌素通过抑制酶的合成来达到抑菌效果。除此之外,一些细菌素如MccE492可通过形成孔隙来达到抑菌效果[6](图2)。Colicins是革兰氏阴性细菌产生的一种抗菌蛋白由三个特定的结构域组成[47],一个氨基末端易位(T)结构域,它参与通过转运子蛋白穿过外膜的转运;一个中央受体结合(R)结构域,它与细菌外膜受体结合;以及一个羧基末端细胞毒素结构域,它具有抗菌活性[48,49]。当细菌外膜表面有粘附素识别受体蛋白和转位蛋白系统时,粘附素被转运到细菌中,从而杀死细菌,这些细菌被称为敏感菌株。对于一种特殊的粘菌素,携带非受体蛋白的细菌被归类为耐药菌株。转运蛋白系统缺陷的细菌被归类为耐受菌株,产生免疫蛋白的细菌被归类为免疫菌株。耐药、耐受和免疫菌株不会被相应的粘菌素杀死。典型的粘菌素基因簇编码毒素蛋白、免疫蛋白和裂解基因[50]。根据外膜(转运体)系统的转运,粘菌素分为两组:A组和B组。一般来说,A组粘菌素由带有裂解基因的小质粒编码,可以从细菌中释放出来;而B组粘菌素由没有裂解基因的大质粒编码[48]。当粘菌素进入靶细胞后,根据杀菌机制可分为三类:(1)成孔型粘菌素:在细胞内膜形成孔或通道,导致胞质化合物渗漏、破坏电化学梯度、离子丢失和细胞死亡。它们包括粘菌素A、B、E1、Ia、Ib、K和N;(2)核酸酶型粘菌素:含有DNase、16S rRNase和tRNase的粘菌素,用于非特异性地消化细菌的DNA和RNA,这些蛋白包括粘附素E2到E9;(3)肽聚糖酶型粘附素:这些蛋白可以消化肽聚糖前体,导致细菌不能合成肽聚糖而死亡[48]。另一种由革兰氏阴性细菌产生的细菌素是微球菌素,主要由大肠杆菌产生,对高温、极端pH值和蛋白酶有很强的耐受性[51]。微球菌素的杀菌机制多种多样,包括成孔型、核酸酶型(如DNase和RNase功能)及蛋白质合成或DNA复制的抑制剂型。对革兰氏阴性菌产生作用的细菌素大多是几种已知细菌素的不同组合,其机制是靶向致死。由于蛋白区域片段的不同组合,这也丰富了细菌素的种类。Margaret等[52]对大肠杆菌被细菌素抑菌的过程进行了研究,电镜发现大肠杆菌的细胞膜不仅出现了大量的孔洞,ATP也因为孔洞而大量外泄,细胞内液紊乱也最终导致大肠杆菌无法正常生长[53]。

图2 典型细菌素对革兰氏阴性菌的作用机制Fig.2 The action of typical bacteriocins MccB17, MccJ25 and MccC7-C51 on Gram-negative bacteria
2.3 同时抑制革兰氏阳性菌和阴性菌细菌的细菌素及其抑菌机制
自然界中不仅存在可以分别抑制革兰氏阳性菌的细菌素,还存在可以同时抑制革兰氏阳性菌和革兰氏阴性菌的细菌素,主要有乳酸链球菌素、细菌素AS-48、细菌素Helvetin-M以及Latilactobacillus curvatusLAB-3H[54]等,具体的作用方式因细菌素的类型而不同。大部分这种类型的细菌素的主要受体是存在于细胞质膜中的阴离子脂质分子,细菌素分子的结合导致膜孔的形成,使离子和其他分子流出细胞外,造成细胞不可恢复的损伤和死亡[55]。其中细菌素AS-48是环形细菌素家族的原型,它们仅由革兰氏阳性细菌产生。迄今为止,已经报道了13种不同的球状环状细菌素,由58到70个氨基酸组成[56]。AS-48是一种有效的环状细菌素,它可以插入敏感细菌的膜中,以一种独立于任何受体的机制产生孔从而导致细菌死亡。细菌素AS-48对食物腐败和病原菌的活性以及对多种人类病原体具有很好的活性,其最小抑菌浓度(Minimum Inhibitory Concentration,MIC)在纳摩尔到微摩尔范围内[57]。它们对多种革兰氏阳性菌和革兰氏阴性菌都具有抗菌活性。比如对泌尿致病型肠球菌[56](Uropathogenic enterococci)、临床多药耐药金黄色葡萄球菌[58](Staphylococcus aureus)、结核分枝杆菌[59](Mycobacterium tuberculosis)、鱼类病原体[60](Lactococcus garvieae)等。由于这些原因,细菌素AS-48在天然食品防腐剂及医疗和兽医应用中潜力巨大[61]。另外,Helveticin-M是一种由卷曲乳杆菌(Lactobacillus crispatus)生产的新型III类细菌素,对金黄色葡萄球菌(Staphyloccocus aureus)、腐生链球菌(Staphylococcus saprophyticus)和阴沟肠杆菌(Enterobacter cloacae)具有抗菌活性。Helvetin-M破坏革兰氏阳性菌的细胞壁、革兰氏阴性菌的外膜,从而改变了细菌的表面结构。同时,Helveticin-M也被证明会破坏细胞的内膜,导致细胞内ATP的泄漏和靶细菌膜电位去极化。研究表明,Helveticin-M处理会引起细胞膜通透性增加,但胞质酶不受影响,表明为亚致死性损伤[9]。
3 细菌素在食品工业中的应用
食品安全已成为国际日益关注的问题,因此细菌素的应用受到了极大的关注,旨在控制食品腐败菌或病原体的生长,使其不会对食品本身产生不利影响[62,63]。同时,细菌素对人类生物体系影响最小,且可稳定的存在于食品基质中[55]。在过去的二十年里,人们已经研究出了它们作为食品防腐剂和保鲜剂的用途,常用于奶制品、水果、蔬菜、肉禽类、海鲜、果汁和饮料[64]。细菌素一般可通过三种方式添加到食品中:(1)作为纯细菌素制剂;(2)作为含有细菌素的发酵上清液;或(3)直接添加细菌素产生菌[65,66]。
3.1 细菌素作为食品中的防腐剂
由于细菌素的高抑菌活性以及稳定性,使其在不同的食品基质中具有潜在的防腐应用价值,例如在牛奶和奶酪等乳制品中[73]。如地衣芽孢杆菌产生的细菌素Bacillocin 490在需氧和厌氧条件下,在4 ℃储存期间保持杀菌活性、拥有宽pH值范围、以及在高温食品基质(即牛奶)中均能保持较好的杀菌活性[74]。这些特征使得Bacillocin 490可以在高温下进行的食品加工过程中使用。另外一种可以在牛奶和软奶酪中抑制单核细胞增生李斯特菌生长的cerein 8A,由蜡样芽胞杆菌8A产生[67]。另外,细菌素Bovicin HC5是一种羊毛硫抗生素,对芒果果肉中的Alicyclobacillus acidoterrestris具有杀芽孢作用。因此,细菌素Bovicin HC5可能可以用作经过热处理的酸性食品的生物防腐剂[68]。同时,从蜡样芽孢杆菌NS02中鉴定的热稳定性低分子量肽蜡质蛋白可作为一种潜在的生物抗菌剂,在食品饮料中具有有效的抗李斯特菌活性[75]。另外,已经有研究报道细菌素RC20975可以抑制苹果汁中的酸土脂环酸杆菌(Alicyclobacillus acidoterrestris),虽然不能杀死内生孢子,但添加细菌素RC20975有助于降低苹果汁中Alicyclobacillus acidoterrestris菌株中芽孢的耐热性,对苹果汁中的Alicyclobacillus acidoterrestris具有良好的杀灭作用[76]。由于细菌素的无毒性,抗菌性强等特点,近几年已经成为开发研究食品保鲜剂的热点。蒙氏肠球菌CRL35是一种无毒、非抗生素耐药的菌株,它能产生肠菌素CRL35,是一种IIa类细菌素,可减少肉类发酵过程中的单增李斯特菌增殖[69]。
3.2 细菌素作为食品生物保鲜剂
新鲜的食品果蔬制品在贮藏、运输和销售的过程中容易受微生物污染而导致食品的品质发生变化。为了防止食品发生腐烂变质、减少营养损失,各种细菌素型食品生物保鲜剂被开发。由于传统的腌制盐会对食物产生不利影响,而蒙氏肠球菌CRL35可以在发酵肉类中生长没有明显的负面影响,因此添加蒙氏肠球菌CRL35在肉制品中可以发挥较好的保护作用。L. plantarumsubsp.plantarum是一株从培根中分离到的植物乳杆菌,其产生的细菌素可抑制单核细胞增多性乳杆菌的生长[77]。该细菌素的应用可进一步扩大到牛奶和奶制品、水果、蔬菜和方便食品的保鲜。Pamela等[70]发现在加入细菌素Pediococcus pentosaceus后,火腿样品在亮度、红色和黄色方面的着色在整个冷藏过程中的稳定性较好,没有出现变色现象。这些结果表明Pediococcus pentosaceus作为肉类和其他食品加工行业的生物保鲜剂的潜在用途。徐畅等[78]将水果的天然产物以及Nisin复合添加,用来储藏肉制品,发现不仅保持了肉质的原来色泽,还有效的延迟了脂肪氧化以及蛋白质降解,同时大幅度的降低了肉制品中病原菌的总数。
3.3 细菌素作为食品的生物活性包装材料
生物活性包装是细菌素的另一种潜在的应用形式,细菌素或产生细菌素的菌株可以被添加到食品包装材料中。研究将细菌素的保藏功能与传统保鲜膜相结合,加强了细菌素与包装结合使用的吸引力,用来改善食品安全和延长保质期[71]。Contessa等[79]开发一种与细菌素结合的壳聚糖/琼脂生物塑料薄膜。该薄膜用作奶油干酪包装时,它有助于提高微生物稳定性,并且有助于在储存期间将活性化合物逐渐释放到食品中。Renpeng等[72]研发了一种负载细菌素的纳米纤维(Bacterial Cellulose-Bacteriocin,BC-B),大大提高了纳米纤维的机械强度、抗氧化活性、热稳定性和抗菌活性。该研究结果显示了BC-B纳米纤维作为抗菌生物材料的潜力,可用作活性食品包装的增强剂。
4 总结与展望
本文综述了细菌素的分类、抑菌机制以及在食品中的应用。细菌素具有较高抗菌性、无残留、杀菌快等特点;不仅对抗生素耐性病原菌有较好的效果外,还具备生产低成本的优势。市场对于以细菌素为代表的新型绿色防腐剂需求增加,未来细菌素将大量用于食品保鲜剂、生物活性包装材料以及食品防腐剂等领域。
虽然乳酸链球菌素和乳酸菌素等一些细菌素已经在商业上用于某些食品中,但细菌素的局限性和可变食物基质的一些影响因素限制了其广泛使用。所以,在积极发现新型细菌素的同时,还应该探索其他食品保鲜防腐的模式。大部分细菌素与抗生素一样也具有一定的耐药性,因此在探索细菌素在食品工业中的应用时应谨慎,可以考虑采用不同的方法来缓解这些耐药性问题。此外,为了降低细菌素生产纯化的成本,还可以通过细菌素的异源表达来实现,这将在很大程度上直接降低生产和纯化的成本。另外,随着细菌素与产生细菌素菌株与食品包装材料相结合的新技术的开发,细菌素作为食品的生物活性包装材料的未来市场被十分看好。
目前对细菌素的研究机制仍不够透彻,针对某些新型细菌素的安全性问题还需要进一步探索,比如细菌素在人体体内毒性问题、稳定性问题仍有待研究。因此,未来仍需要充分挖掘其抑菌分子机制,采取适当的方法消除或减少副作用影响,以保障其在食品中的安全使用。

