药用红树木榄胚轴抗HBV化学成分的研究
梁考云, 候师师, 高程海, 刘永宏, 易湘茜
( 广西中医药大学 海洋药物研究院/广西海洋药物重点实验室/药学院, 南宁 530200 )
乙型肝炎病毒(HBV)是一种流行性病毒,是引起乙型肝炎(简称乙肝)的病原体,属嗜肝DNA病毒科。全世界目前仍有2.4亿HBV感染者,9 300万为中国感染者,其中2 000万为乙型肝炎患者。HBV感染引起的乙型肝炎及并发症已成为中国面临的一个主要公共健康问题。目前,临床上应用于治疗乙肝药物拉米夫定(3TC)和干扰素都具有毒副作用且易产生耐药性等缺点(郑慧珂,2012)。因此,开发抑制HBV复制新型药物,成为乙型肝炎治疗领域急需解决的难题。
京族是世居广西的少数民族,也是中国唯一以海为生的海洋少数民族(何芳东,2013)。在民族长期发展过程中,京族成就了具有自己民族特色的用药体系,其主要偏重于使用海洋来源的中草药。木榄作为京族传统海洋药物,京族医书有用其主治乙型肝炎的记录(宁小清等,2013;张帅等,2016)。依据京族对红树木榄的传统药用,采用现代技术方法阐明其物质基础具有重要的科学意义和潜在的应用价值。课题组前期从木榄胚轴中获得能够抑制乙型肝炎细胞的HBV DNA复制的7个腈类化合物(Yi et al., 2015)。继续深入对木榄胚轴化学成分的研究,从中分离得到一个新生物碱gymnorrhizin A,其对乙肝病毒表面抗原(HBsAg)和乙型肝炎e抗原(HBeAg)有抑制作用(陈志勇等,2016)。然而,通过分析木榄胚轴提取物中高效液相色谱谱图发现还存在未被报道的化学成分,这不利于木榄胚轴在治疗乙型肝炎药物方面的开发利用。因此,为了全景式阐明木榄胚轴物质基础,继续以木榄胚轴为研究对象,挖掘出更多具有抗HBV活性的化合物,丰富海洋来源的具有抗HBV活性的化合物库,为今后开发木榄胚轴来源新型抗乙肝药物奠定基础。
1 材料与方法
1.1 仪器和材料
WatersE2695半制备高效液相色谱仪(美国Waters公司);半制备HPLC色谱柱为Welch Ultimate XB-C18 [10 mm × 250 mm,5 μm,月旭科技(上海)股份有限公司];分析型HPLC色谱柱为Welch Ultimate XB-C18[4.6 mm × 250 mm,5 μm,月旭科技(上海)股份有限公司];Sepacore中压制备色谱(瑞士步琦有限公司);EYELA N-1300V-WB小型旋转蒸发仪(上海爱朗仪器有限公司);WFH-203B暗箱式紫外分析仪(杭州奇威仪器有限公司);SW-CJ-2F超净工作台(苏州安泰空气技术有限公司);TAdvanced 96 PCR扩增仪(德国Biometra公司);ZWYP-2102恒温培养振荡器(上海智城分析仪器制造有限公司);Infinite M200PRO全波长多功能酶标仪(瑞士Tecan公司);Light Cycler480Ⅱ实时荧光定量PCR系统(瑞士Roche公司);HR1500-ⅡB2生物安全柜(青岛海尔生物医疗股份有限公司)。
柱层析正相硅胶(200~300 目,青岛海洋化工厂);薄层硅胶板(烟台化学工业研究所);Sephadex LH-20葡聚糖凝胶柱层析色谱(40~70 μm,美国GE Healthcare 公司);胎牛血清、DMEM培养液、PBS缓冲液、噻唑蓝MTT、胰蛋白酶(北京索莱宝科技有限公司);拉米夫定(3TC)(上海麦克林生化科技有限公司);HBV DNA定量测定试剂盒(湖南圣湘生物科技有限公司)。
实验用的木榄胚轴样品于2019年5月采自广西北仑河口红树林自然保护区(108°12′E、21°36′N),经广西中医药大学海洋药物研究院高程海研究员鉴别为红树科(Rhizophoraceae)木榄属(Bruguiera)木榄(B.gymnorhiza)的胚轴,标本保藏于广西中医药大学海洋药物研究院,标本编号为GXIMD M20190517。
1.2 提取分离
木榄胚轴新鲜样品(湿重约62.0 kg),使用95%工业酒精(料液比1∶3)浸泡提取3次,每次7 d,过滤取滤液,将滤液合并,减压浓缩得到浸膏状提取物。依次使用等体积石油醚、乙酸乙酯、正丁醇萃取,分别依次萃取3次,浓缩后得到石油醚部位(127.20 g)、乙酸乙酯部位(178.06 g)、正丁醇部位(626.00 g)和水部位(1 214.00 g)。
1.3 抗HBV 活性部位筛选
通过检测体外HepG2.2.15细胞上清液中分泌的HBV DNA的含量,以抑制HBV DNA分泌能力大小,来确定木榄胚轴不同提取部位的抗HBV活性。步骤如下。(1)各部位药液配制:精密称取各部位粗提物1 mg,使用适量DMSO溶解后,加入细胞完全培养基稀释成500、250、125 μg·mL-1浓度药液待用。(2)细胞毒性评价:采用MTT法检测木榄胚轴粗提物和各萃取部位对细胞的毒性作用,筛选出活性实验给药浓度。将处于对数生长期的HepG2.2.15细胞以每孔5 000个接种于96孔板待其贴壁,加入各萃取部位不同浓度药液,同时设阴性对照组(Control)和拉米夫定(3TC)阳性组。培养72 h后吸弃上清液,加入5 mg·mL-1MTT溶液50 μL继续培养4 h,吸弃旧液每孔加DMSO 100 μL,充分振匀。测490 nm 波长下OD值,计算细胞存活率。细胞存活率 (%)=(OD实验组A490值/OD阴性对照孔A490值)×100。(3)抗HBV活性评价:利用实时荧光定量PCR法(QPCR),取对数生长期HepG2.2.15细胞,以每毫升5×105个的细胞密度接种于24 孔板上,24 h贴壁后,实验组更换含药培养液,阴性组加入完全培养基,继续培养。第6天收集细胞上清液,按照病毒DNA制备试剂盒的操作步骤获得高纯度的HBV DNA,运用乙型肝炎核酸定量检测试剂盒检测细胞上清液HBV DNA水平。HBV DNA 抑制率(%)=(阴性对照孔HBV DNA拷贝数-实验孔HBV DNA拷贝数)/阴性对照孔HBV DNA拷贝数×100。
1.4 化学成分分离
取正丁醇萃取物(626.0 g)经硅胶拌样,采用硅胶柱色谱分离,以CHCl3-MeOH系统(10∶0、10∶1、5∶1、20∶7、0∶10,V∶V) 梯度洗脱,收集到13个组分[Z(1);Z2(2~3);Z3(4~8);Z4(9);Z5(10~20);Z6(21~28);Z7(29~33);Z8(34~37);Z9(38~43);Z10(44~57);Z11(58~63);Z12(64~82);Z13(83)]。组分Z3经硅胶柱色谱分离,以氯仿-甲醇系统(10∶0、10∶1、10∶2、10∶4、10∶10、0∶10,V∶V)系统洗脱,得6个组分(d1~d6),其中d3经半制备HPLC(MeOH∶H2O = 10∶90,V∶V)纯化后得化合物7(2.3 mg,tR= 13.56 min)、化合物8(1.6 mg,tR= 19.18 min)、化合物4(1.1 mg,tR= 21.89 min)。组分Z4经硅胶柱色谱分离,以氯仿-甲醇系统(10∶0、10∶1、10∶2、10∶4、10∶8、0∶10,V∶V)梯度洗脱,得7个组分(e1~e7),其中组分e4经半制备HPLC纯化后,在梯度MeOH∶H2O = 20∶80(V∶V)处得化合物10(3.2 mg,tR= 21.52 min),在MeOH∶H2O = 40∶60(V∶V)处得化合物11(2.4 mg,tR= 30.52 min)。组分Z6在放置过程中出现白色结晶,多次重结晶后,经半制备HPLC分析为较纯单体,得化合物5(10.2 mg)。组分Z10经Sephadex LH-20 葡聚糖凝胶柱层析色谱,以甲醇为洗脱溶剂,流经薄层板合并后得11个组分(a1~a11),其中组分a4经半制备HPLC(MeOH∶H2O = 95∶5,V∶V)纯化后,得化合物1(10.09 mg,tR= 7.08 min)、化合物2(9.14 mg,tR= 17.32)、化合物6(6.64 mg,tR= 9.79 min),组分a5经半制备HPLC(MeOH∶H2O = 95∶5,V∶V)纯化后,得化合物3(4.23 mg,tR= 13.05 min)。组分Z13(湿重15 g)经大孔树脂柱色谱(流动相分别为水、50%甲醇、100% 甲醇,依次冲5个柱体积),得3个组分(b1~b3),其中组分b3经半制备HPLC(MeOH∶H2O = 80∶20,V∶V)纯化后得化合物9(2.01 mg,tR= 23.45 min)。
1.5 单体化合物抗HBV 活性评价
使用MTT实验方法,以每孔5 000个HepG2.2.15细胞铺于96孔板,贴壁后,将分离得到的单体化合物稀释成100 μg·mL-1,同时使用100 μg·mL-1拉米夫定(3TC)作为阳性对照,另设阴性对照组。与给药72 h后,酶标仪下490 nm处测定OD值,并计算细胞存活率。细胞存活率(%)=(OD实验组A490值/OD阴性对照孔A490值)×100。
使用实时定量PCR实验方法,将每孔50万个HepG2.2.15细胞铺于24孔板,贴壁后,将分离得到的单体化合物稀释成100 μg·mL-1,同时使用100 μg·mL-1拉米夫定(3TC)作为阳性对照,另设阴性对照组。使用乙型肝炎核酸定量检测试剂盒检测第6天细胞上清液中HBV DNA的含量。
2 结果与分析
2.1 活性部位筛选结果
高浓度药物作用于细胞,会引起细胞变形、死亡,从而导致乙肝病毒标志物分泌量减少,对药物抗乙肝病毒作用的判定产生影响(刘建京和林秀玉,1995)。因此,需确定对HepG2.2.15细胞基本无毒性的药物剂量进行乙肝病毒实验。采用MTT方法测定木榄胚轴粗提物和不同萃取部位对HepG2.2.15细胞增殖的影响,确保后续抗HBV活性实验在基本无毒的条件下进行。由表1可知,与阴性对照组相比,粗提物和其他部位在500、250 μg·mL-1浓度下对细胞增殖均有显著抑制作用(P<0.05),水部位对细胞的增殖无抑制作用。粗提物和其他部位在125 μg·mL-1下对HepG2.2.15细胞无毒副作用,后续活性实验可使用125 μg·mL-1或者更低量为给药浓度。
HBV-DNA为乙肝病毒复制的基础,也是检测乙肝病毒复制的直接指标,研究表明慢性HBV感染的传染性强弱跟HBV DNA水平密切相关,同时HBV DNA复制水平会变化,乙肝疾病的病理现象也会变化。乙肝病毒DNA定量检测是最直接检测其是否发生复制的方法(王光彦等,2022)。现今可通过检测给药后HBV DNA复制水平来判断是否具有抗HBV活性。木榄胚轴粗提物及萃取部位对HepG2.2.15细胞上清HBV DNA影响。实验结果如图1所示,与阴性对照组相比,石油醚部位未表现出抑制细胞上清HBV DNA水平作用。木榄粗提物、水部位、正丁醇部位均使细胞上清HBV DNA的水平显著降低(P<0.05)。正丁醇部位抑制HepG2.2.15细胞分泌的HBV DNA具有极显著作用(P<0.01),抑制效果强于木榄胚轴粗提物,因此选择木榄胚轴正丁醇部位作为研究对象,进行物质基础研究。
2.2 化学成分结构鉴定(具体结构见图2)
化合物1白色结晶。ESI-MSm/z: 244.7 [M+H]+,分子式: C9H12N2O6。1H NMR (500 MHz, DMSO-d6)δH: 11.31 (1H, s, H-3), 7.89(1H, d,J= 8.07 Hz, H-6), 5.78 (1H, d,J= 5.46 Hz, H-1′), 5.65 (1H, d,J= 8.04 Hz, H-5), 4.02 (1H, t,J= 5.34 Hz, H-2′), 3.96 (1H, t,J= 4.53 Hz, H-3′), 3.84 (1H, q,J= 3.44 Hz, H-4′), 3.62 (1H, dt,J=3.06, 12.11 Hz, H-5′), 3.55 (1H, dt,J= 3.01, 12.20 Hz, H-6′);13C NMR (125 MHz, DMSO-d6)δC: 150.8(C-2), 163.2 (C-4), 101.8 (C-5), 140.8 (C-6), 87.7 (C-1′), 69.9 (C-2′), 73.6 (C-3′), 84.9 (C-4′), 60.9 (C-5′)。化合物波谱数据与文献(Wang et al., 2010)具体报道基本一致,故鉴定为尿嘧啶。
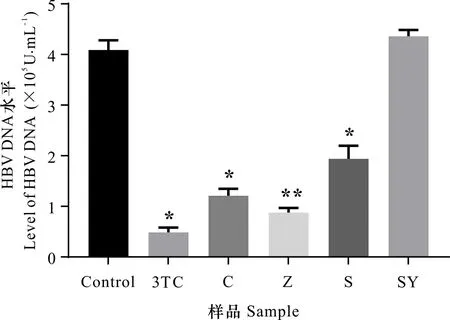
与阴性对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。C为粗提物; Z为正丁醇部位; S为水部位; SY为石油醚部位。下同。Compared with Control, * indicates significant differences(P<0.05), ** indicates extremely significant differences(P<0.01). C is crude extract; Z is n-butanol extract; S is water extract; SY is petroleum ether extract. The same below.图 1 木榄胚轴各提取物对HepG2.2.15细胞上清HBV DNA影响Fig. 1 Effects of each extract of Bruguiera gymnorhiza on HBV DNA of HepG2.2.15 cell supernatant
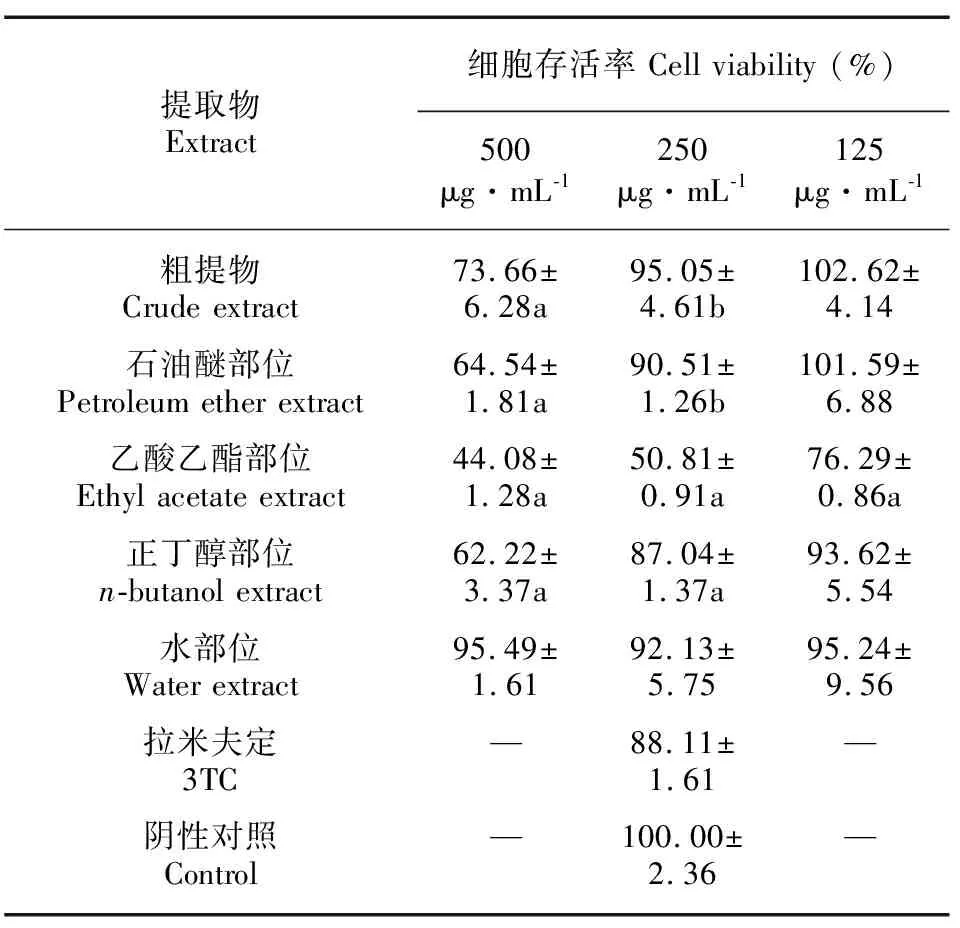
表 1 木榄胚轴粗提物及各萃取部位对HepG2.2.15细胞增殖的影响Table 1 Effects of crude extracts and extracted parts of hypocotyl of Bruguiera gymnorhiza on proliferation of HepG2.2.15 cells
化合物2白色粉末。ESI-MSm/z: 243.1 [M+H]+,分子式: C10H14N2O5。1H NMR (500 MHz, DMSO-d6)δH: 11.27 (1H, s, H-3), 7.70 (1H, d,J= 1.51 Hz, H-6 ), 6.17 (1H, dd,J= 6.13, 7.63 Hz, H-1′), 4.24 (1H, dt,J= 2.98, 2.98, 5.86 Hz, H-3′), 3.76 (1H, q,J= 3.72, 3.72, 3.73 Hz, H-4′), 3.56 (2H, m, H-5′), 2.07 (2H, m, H-2′), 1.77 (3H, d,J= 1.18 Hz, -CH3);13C NMR (125 MHz, DMSO-d6)δC: 150.5 (C-2), 163.8 (C-4), 109.4 (C-5), 136.2 (C-6), 83.7 (C-1′), 70.4 (C-3′), 87.3 (C-4′), 61.3 (C-5′), 12.3 (5-CH3)。化合物波谱数据与文献(姚成芬等,2018)具体报道基本一致,故鉴定为胸腺嘧啶。
化合物3白色粉末。ESI-MSm/z: 268.1 [M+H]+,分子式: C10H13N5O4。1H NMR (500 MHz, DMSO-d6)δH: 8.35 (1H, s, H-8), 8.13 (1H, s, H-2), 7.34 (2H, s, NH2), 5.87 (1H, d,J=6.24 Hz, H-1′), 4.61 (1H, m, H-2′), 4.14 (1H, dd,J=4.97, 2.95 Hz, H-3′), 3.96 (1H, m, H-4′), 3.67 (1H, dd,J=12.19, 3.66 Hz, H-5′), 3.55 (1H, dd,J=12.17, 3.66 Hz, H-5′);13C NMR (125 MHz, DMSO-d6)δC: 152.4 (C-2), 149.1 (C-4), 119.4 (C-5), 156.2 (C-6), 139.9 (C-8), 87.9 (C-1′), 73.4 (C-2′), 70.7 (C-3′), 85.9 (C-4′), 61.7 (C-5′)。化合物波谱数据与文献(Kun et al., 1991)具体报道基本一致,故鉴定为腺嘌呤核苷。
化合物4黄色粉末。ESI-MSm/z: 238.2 [M+H]+,分子式: C11H11NO5。1H NMR (500 MHz, DMSO-d6)δH: 6.76 (1H, t,J=1.55 Hz, 3-H), 6.58 (2H, d,J=1.49 Hz, 1, 4-H), 6.05 (1H, s, 6-H), 3.41 (3H, s, 12-CH3), 2.89 (2H, d,J=10.83 Hz, 8-CH2);13C NMR (125 MHz, DMSO-d6)δC: 114.9 (C-1), 152.3 (C-2), 112.0 (C-3), 109.8 (C-4), 72.9 (C-5), 177.6 (C-7), 41.3 (C-8), 134.0 (C-9), 131.8(C-10), 169.0 (C-11), 51.1(C-12)。化合物波谱数据与文献(Wang et al., 2014)具体报道基本一致,故鉴定为oryzalactam。
化合物5无色针状结晶。ESI-MSm/z: 235.2 [M-H]ˉ,分子式: C10H20O6。1H NMR (500 MHz, MeOH-d4)δH: 3.91 (1H, d,J=9.90 Hz, 3′-H), 3.87 (1H, dt,J=3.35, 1.65Hz, 5′-H), 3.76 (3H, m, 1′, 4′-H), 3.67 (2H, m, 6′-H), 3.51 (2H, m, 1-CH2), 1.56 (2H, dqd,J=8.60, 6.64, 2.50 Hz, 2-CH2), 1.40 (2H, m, 3-CH2), 0.94 (3H, t,J=7.38 Hz, 4-CH3);13C NMR (125 MHz, MeOH-d4)δC: 61.6 (C-1), 33.3 (C-2), 20.5 (C-3), 14.3 (C-4), 63.5 (C-1′), 101.6 (C-2′), 70.6 (C-3′), 71.6 (C-4′), 71.1 (C-5′), 65.2 (C-6′)。化合物波谱数据与文献(An et al., 2006)具体报道基本一致,故鉴定为正丁基-O-D-吡喃果糖苷。
化合物6白色粉末。ESI-MSm/z: 227.2 [M-H]ˉ,分子式: C10H12O6。1H NMR (500 MHz, DMSO-d6)δH: 7.85 (1H, d,J= 8.09 Hz, H-4), 6.15 (1H, m, H-7), 5.63 (1H, d,J= 8.08 Hz, H-3), 4.23(1H, dq,J= 3.10, 3.21, 6.34 Hz, H-9), 3.78 (1H, q,J= 3.58 Hz, H-11), 3.55 (2H, m, H-11), 2.08 (2H, m, H-8);13C NMR (125 MHz, DMSO-d6)δC: 163.2 (C-2), 101.8 (C-3), 140.6 (C-4), 150.5 (C-6), 84.1 (C-7), 39.7 (C-8), 70.4 (C-9), 87.4 (C-10), 61.3 (C-11)。化合物波谱数据与文献(Watanadilok et al., 2001)具体报道基本一致,故鉴定为nortetillapyrone。
化合物7无色粉末。ESI-MSm/z: 169.1 [M+H]+,分子式: C9H12O3。1H NMR (500 MHz, DMSO-d6)δH: 5.86 (1H, d,J=1.97 Hz, H-9), 4.92 (1H, ddd,J=11.67, 6.18, 1.58 Hz, H-6), 3.75 (1H, m, H-4), 3.58 (3H, s, CH3), 2.75 (1H, ddd,J=14.23, 4.73, 2.16 Hz, H-2 ), 2.33 (1H, tdd,J=14.00, 5.60, 1.98 Hz, H-2), 2.04 (1H, dtd,J=12.34, 3.87, 2.03 Hz, H-5), 1.19 (3H, m, H-5, H-3);13C NMR (125 MHz, DMSO-d6) δC: 172.4 (C-1), 34.7 (C-2), 23.7 (C-3), 79.4 (C-4), 42.3 (C-5), 65.1 (C-6), 173.0 (C-8), 111.9 (C-9), 51.3 (CH3)。化合物波谱数据与文献(Otsuka et al., 1993)具体报道基本一致,故鉴定为(4R,6S)-4-methoxy-2,3-dihydroaquilegiolide。
化合物8无色粉末。 ESI-MSm/z:155.1 [M+H]+,分子式: C8H10O3。1H NMR (500 MHz, DMSO-d6)δH: 5.86 (1H, d,J=1.92 Hz, H-9), 5.04 (1H, m, H-6), 4.12 (1H, p,J=2.87 Hz, H-4), 2.64 (2H, m, H-2), 2.48 (1H, dd,J=6.32, 3.17 Hz, H-5), 1.96 (1H, ddq,J=13.37, 5.30, 2.38 Hz, H-3), 1.46 (1H, tdd,J=13.34, 5.20, 2.34 Hz, H-3), 1.31 (1H, td,J=11.95, 2.39 Hz, H-5);13C NMR (125 MHz, DMSO-d6)δC: 173.1 (C-1), 32.7 (C-2), 40.3 (C-3), 63.9 (C-4),22.5 (C-5), 78.7 (C-6), 111.4 (C-7), 173.4 (C-8)。化合物波谱数据与文献(Otsuka et al., 1993)具体报道基本一致,故鉴定为(4R,6S)-2-dihydromenisdaurilide。
化合物9黄色油状物。ESI-MSm/z: 305.2 [M-H]-,分子式: C15H14O7。1H NMR (500 MHz, DMSO-d6)δH: 6.24 (2H, s, H-2′, 6′), 5.88 (1H, d,J=2.34 Hz, H-6), 5.69 (1H, d,J=2.26 Hz, H-8), 4.42 (1H, d,J=7.04 Hz, H-2), 3.78 (1H, ddd,J=12.44, 7.48, 5.04 Hz, H-3), 2.61 (1H, m, H-4), 2.34 (1H, m, H-4);13C NMR (125 MHz, DMSO-d6)δC: 81.0 (C-2), 66.3 (C-3), 27.4 (C-4), 156.4 (C-5), 95.0 (C-6), 156.2 (C-7), 93.8 (C-8), 155.3 (C-9), 98.9 (C-10), 129.8 (C-1′), 106.0 (C-2′, C-6′), 145.6 (C-3′, C-5′), 132.5 (C-4′)。化合物波谱数据与文献(肖云川等,2015)具体报道基本一致,故鉴定为没食子儿茶素。
化合物10无色粉末。ESI-MSm/z: 411.2 [M+H]+,分子式: C20H26O9。1H NMR(500 MHz, MeOH-d4)δH: 6.97 (1H, d,J=2.07 Hz, H-2′), 6.93 (1H, m, H-5′), 6.91 (1H, s, H-2),6.76 (2H, ddt,J=14.21, 7.87, 1.70 Hz, H-6, 6′), 6.65 (1H, dd,J=8.19, 1.23 Hz, H-5), 4.80 (1H, m, H-7), 4.47 (1H, d, 5.84 Hz, H-7′), 4.18 (1H, m, H-8), 3.78 (3H, s, OCH3), 3.72 (3H, s, OCH3′), 3.56 (1H, m, H-8′), 3.39 (1H, dd,J=11.94, 5.37 Hz, H-9), 3.27 (1H, m, H-9′), 1.80 (s, 1H), 1.25(d,J=6.75 Hz, 2H), 1.19(s, 2H);13C NMR (125 MHz, MeOH-d4)δC: 132.4 (C-1), 110.3 (C-2), 147.5 (C-3), 147.4 (C-4), 117.2 (C-5), 119.2 (C-6), 72.6 (C-7), 85.8 (C-8), 60.5 (C-9), 136.5 (C-1′), 110.8 (C-2′), 150.1 (C-3′), 145.8 (C-4′), 114.4 (C-5′), 119.3 (C-6′), 73.7 (C-7′), 76.0 (C-8′), 62.8 (C-9′), 55.1 (OCH3), 54.9 (OCH3′)。化合物波谱数据与文献(Greca et al., 1998)具体报道基本一致,故鉴定为1- (4-hydroxy-3-methoxy)-phenyl-2- [4-(1,2,3-trihydroxypropyl)2-methoxy]-phenoxy-1,3-propandiol。
化合物11黄色粉末。ESI-MSm/z: 551.5 [M-H]-,分子式: C27H36O12。1H NMR(500 MHz, MeOH-d4)δH: 6.57 (1H, s, H-2′), 6.43 (2H, s, H-2, 6), 4.38 (1H, d,J=6.63 Hz, H-7), 4.21 (1H, d,J=7.55 Hz, H-1″), 3.84 (6H, m, 3′, 5′-CH3), 3.74 (6H, s, 3, 5-CH3), 3.64-3.16 (9H, 3′, H-9, 9′, 2"~5"), 2.71 (1H, dd,J=15.20, 4.59 Hz, H-7′), 2.63 (1H, dd,J=15.16, 11.56 Hz, H-7′), 2.05 (1H, dddd,J=10.70, 6.80, 4.08, 2.64 Hz, H-8), 1.70 (1H, m, H-8′);13C NMR (125 MHz, MeOH-d4)δC: 138.9(C-1), 134.4 (C-4), 149.0 (C-3, 5), 106.9 (C-2, 6), 43.0 (C-7), 46.7 (C-8), 70.9 (C-9), 56.8 (3, 5-OCH3), 130.1 (C-1′), 107.8 (C-2′), 148.6 (C-3′), 139.4 (C-4′), 147.6 (C-5′), 126.4 (C-6′), 33.9 (C-7′), 40.5 (C-8′), 66.0 (C-9′), 56.6 (3′-OCH3), 105.5 (C-1″), 75.0 (C-2″), 78.0 (C-3″) , 71.3 (C-4″), 67.0 (C-5″), 60.0 (5″-OCH3)。化合物波谱数据与文献(吴兆圆和李蓉涛,2011)具体报道基本一致,故鉴定为 (-)-南烛木树脂酚-9-O-β-D-木吡喃糖苷。
2.3 单体化合物抗HBV活性结果
在给药浓度100 μg·mL-1条件下,与阴性对照组相比,化合物1和化合物10作用下HepG2.2.15细胞的存活率分别降低了14.05%、11.10%,差异具有统计学意义(P<0.05)。其余化合物对细胞增殖无明显抑制作用,即表明对细胞本身无毒副作用,结果如表2所示。后续可以选择化合物2-9和11在给药浓度100 μg·mL-1条件下,进行抗HBV活性实验。

图 2 木榄胚轴的正丁醇部位获得的单体化合物结构式Fig. 2 Structures formula of monomer compounds from the n-butanol extract of Bruguiera gymnorhiza hypocotyl
由图3可知,与阴性对照组相比,化合物4能降低HepG2.2.15细胞上清HBV DNA水平,但不显著(P>0.05),其抑制率为23.59%,其他化合物对HepG2.2.15细胞分泌HBV DNA水平无明显降低作用(P>0.05)。
3 讨论与结论
京族俗称红树为“海榄山”。由于解放前京族聚集区缺乏纯净饮用水,又长期以鱼虾蟹等为主要食物,因此,肝炎一直是京族的易发疾病。“海榄山”木榄具有清热解毒功效,京族用其主治乙型肝炎。木榄胚轴属可再生生物资源,采摘不会破坏生态环境和红树资源,本研究发现红树木榄胚轴的正丁醇萃取部位具有抗HBV活性,从而验证了京族传统用药的科学性。从活性部位正丁醇萃取相中获得了11个化合物,包括4个首次从药用红树木榄中获得,即oryzalactam (4)、正丁基-O-D-吡喃果糖苷 (5)、(4R,6S)-4-methoxyl-2,3-dihydroaquilegiolide (7)和(4R,6S)-2-dihydromenisdaurilide (8),丰富了木榄的化学成分。从木榄中获得的主要有二萜、三萜、酚类、含硫化合物、生物碱类等结构类型(高程海等,2022)。获得的化合物4为生物碱类化合物,化合物5为糖苷类化合物, 化合物7和化合物8为内酯类化合物,同时扩大了木榄的化合物结构类型。
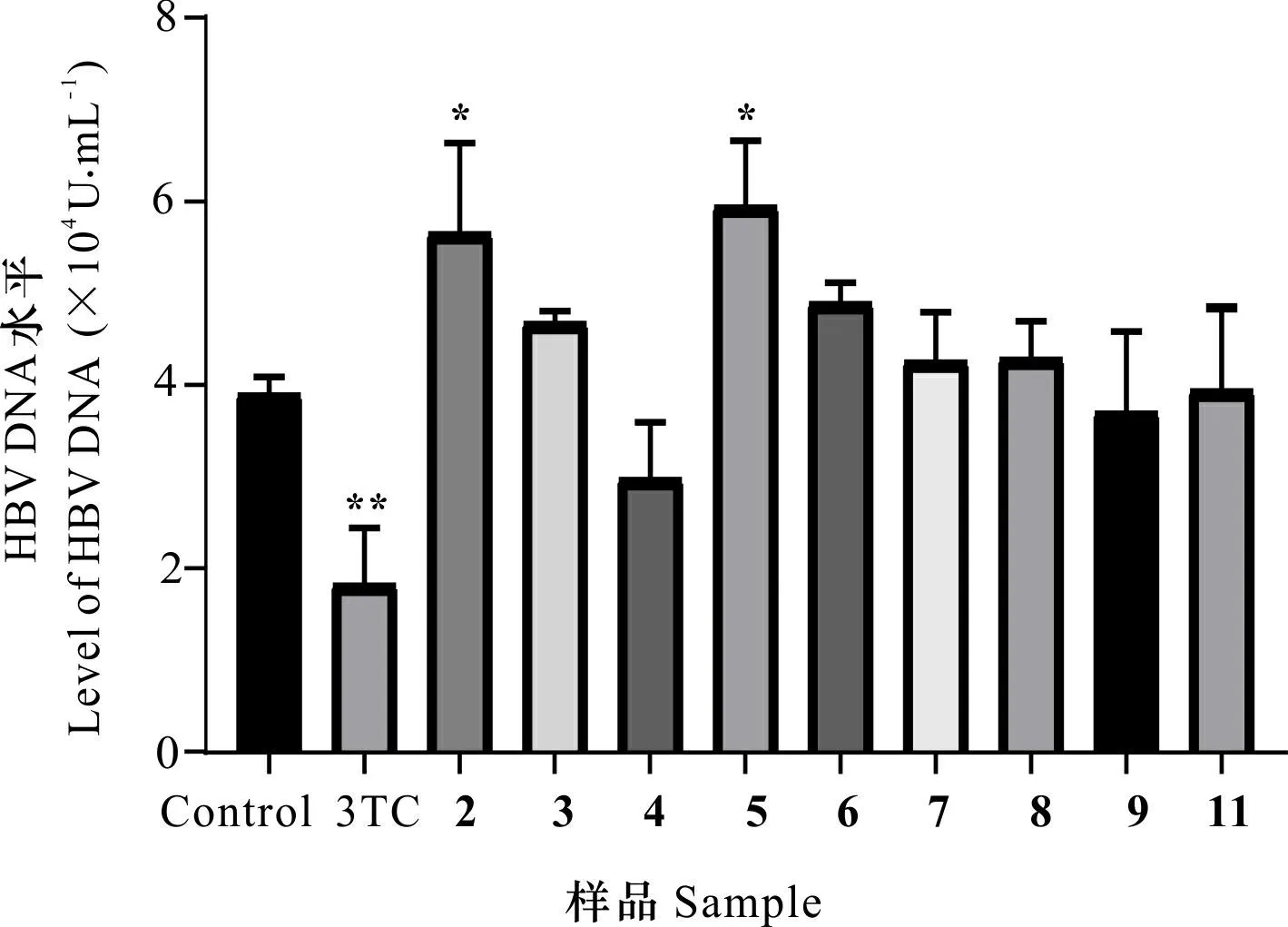
图 3 化合物2-9和11对HepG2.2.15细胞产生HBV DNA的抑制作用Fig. 3 Inhibitory effects of compounds 2-9, and 11 on production of HBV DNA in HepG2.2.15 cells
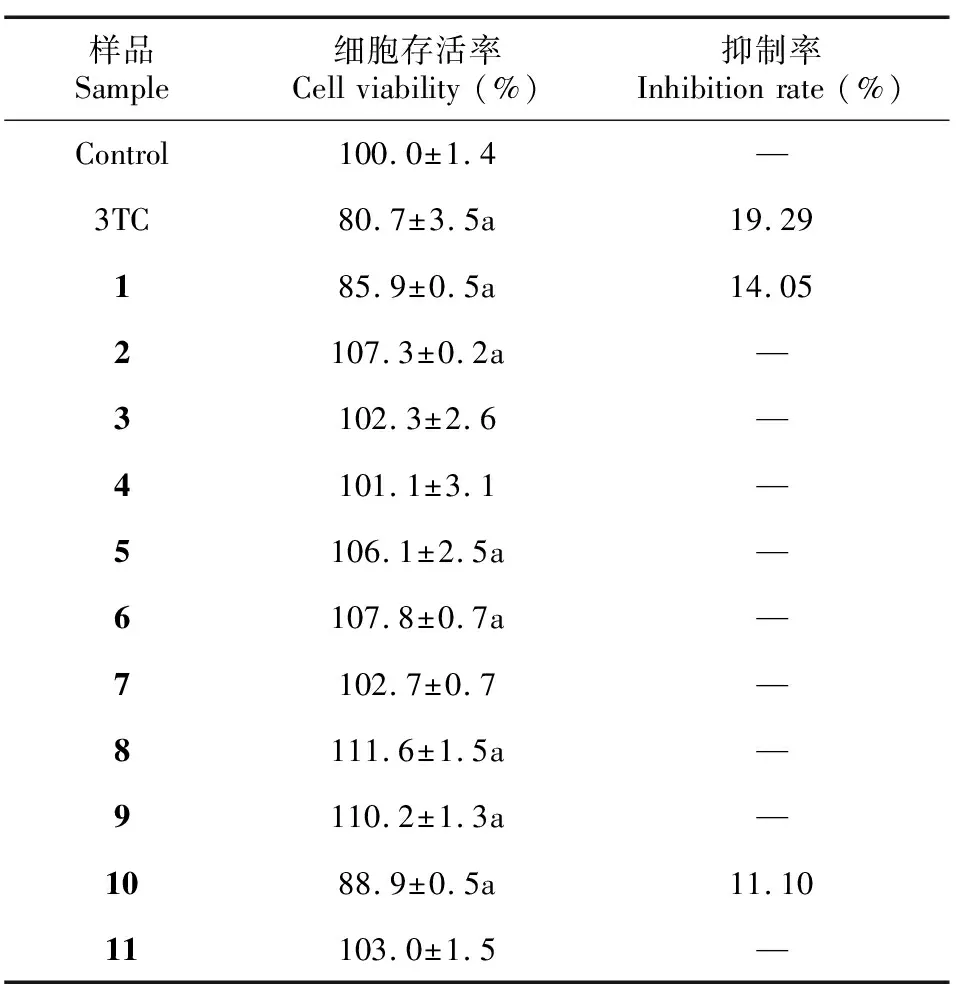
表 2 单体化合物对HepG2.2.15细胞增殖的作用Table 2 Effects of monomer compounds on proliferation of HepG2.2.15 cells
研究同时还获得4个生物碱类化合物尿嘧啶(1)、胸腺嘧啶(2)、腺嘌呤核苷(3)和oryzalactam (4)。生物碱是天然产物的重要组成部分,对多种病毒表现出抑制活性,如甲型流感病毒、HBV、HCV、HSV、HIV、寨卡病毒、柯萨奇病毒和烟草花叶病毒(王宏等,2022)。研究首次报道了生物碱oryzalactam (4)具有抗乙型肝炎病毒活性,也具有强 ABTS+和 DPPH自由基清除能力(Wang et al., 2014)。因此,猜测oryzalactam抗HBV活性与其强抗氧化活性有着一定联系,可能是发挥抗氧化活性的基团协同或拮抗了一些生理因子,有利因子的表达水平增强,从而在非细胞毒性浓度下表征出抑制HBV的活性。梁晓莲等(2021)研究表明,生物碱发挥抗HBV活性机制为直接抑制HBV DNA和HBV cccDNA产生,而其他生物碱如槐定碱等是通过介导的蛋白激酶(p38 MAPK)水平降低,间接发挥抗HBV活性,本研究中生物碱化合物4的强抗氧化活性拮抗HBV DNA因子的表达水平,进而体现出较为显著的抗HBV活性,符合以上猜测。本研究目前关于木榄胚轴化学成分中抗HBV活性方面研究较少,后续将根据化合物4的紫外吸收波长等关键信息,借助高效液相色谱方法,定向获得更多化合物4的同系物科研工作奠定基础,为研制海洋来源的新型抑制HBV复制的药物提供先导化合物,来提升红树木榄胚轴的药用价值。

