呼吸道迟缓爱德华菌不同组分对肺部炎症作用的对比分析
李 琴 胡 悦 秦啸峰 冯志红 王 炜 孙 英*
(1. 首都医科大学燕京医学院检验学学系,北京 101300;2. 首都医科大学基础医学院免疫学系,北京 100069;3. 首都医科大学宣武医院呼吸内科,北京 100053)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种异质性肺部疾病,以持续、进行性气流受限为特征[1]。COPD已成为全球第三大死因,预计到2040年死亡人数将达到每年440万[2],其发病机制仍旧不明,但越来越多的证据[3-4]表明COPD的发生发展与肺部微生态相关。“恶性循环假说”认为细菌定植到呼吸道,诱导肺部细胞产生炎性细胞因子,破坏肺组织和损伤免疫防御机制,进一步有利于细菌的定植,从而形成一个不断放大的正反馈循环,促进COPD的发生和发展[5]。有研究[6-7]显示,80% COPD患者急性加重期与感染因素有关,其中大约50%是细菌来源的。急性加重不仅大大降低患者生活质量、增加医疗卫生负担和患者死亡风险,而且频繁的急性发作可引起肺功能快速下降[8-9]。
笔者课题组前期应用16S核糖体核糖核酸(16S ribosomal ribonucleic acid,16S rRNA)基因测序技术检测发现变形菌门肠杆菌科迟缓爱德华菌(Edwardsiellatarda)仅在COPD急性加重期患者诱导痰中检出。该菌极少感染人类,感染者患有慢性疾病是重要的易感因素,最常见的是肠胃炎,肠外感染罕见,如菌血症、败血症、脓肿、软组织感染等,但肠外感染患者症状表现严重,病死率接近50%[10]。目前,迟缓爱德华菌感染仅局限于临床病例的发现,机制研究少有文献报道。本文研究以迟缓爱德华菌为研究对象,分别采用迟缓爱德华菌体组分及代谢物构建急性肺损伤小鼠模型和体外细胞刺激实验,探讨呼吸道迟缓爱德华菌诱导的肺部炎症反应,为进一步深入研究COPD的发展机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
野生型C57BL/6J小鼠,SPF级、雌性、6~8周龄、体质量为18~20 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXY(京)2021-0006。动物实验通过首都医科大学动物实验及实验动物管理委员会审查批准(AEEI-2021-117)。
1.1.2 细胞系
A549细胞(ATCC CCL-185,人肺泡基底上皮细胞),MLE12细胞(ATCC CRL-2110,小鼠肺上皮细胞系),THP-1细胞(ATCC TIB-202,人单核细胞系),及RAW264.7细胞(ATCC SC-6003,小鼠巨噬细胞系)均为本实验室保存。
1.2 实验方法
1.2.1 实验动物分组及处理
应用SPF级野生型C57BL/6小鼠构建迟缓爱德华菌滴鼻急性肺损伤模型,设立磷酸缓冲盐液(phosphate buffer saline,PBS)对照组(Control组)、灭活菌体组(Body组)、细菌裂解物组(Lysate组)和细菌培养上清或代谢物组(Supernatant组)。每只小鼠于第1至3天连续滴鼻3 d,每次滴鼻50 μL细菌作用物,细菌作用物剂量是以相同细菌数下的产生量进行计算。第4天杀鼠取材分析。
1.2.2 细菌培养及其成分制备
迟缓爱德华菌(CICC 10630)购自中国工业微生物菌种保藏管理中心,用脑心浸液肉汤培养基常规培养,待细菌生长至对数生长期,离心过滤收集细菌培养上清;细菌沉淀经0.2%(质量分数)的甲醛溶液处理后制备灭活菌体;细菌沉淀超声裂解至菌液透明清澈,离心收集上清,测定细菌裂解物的蛋白浓度。
1.2.3 支气管肺泡灌洗液炎症细胞分类计数
小鼠经过量麻醉致死后行气管插管,用无菌PBS进行肺泡灌洗,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)经离心后,细胞悬液制备涂片,瑞氏染色进行细胞分类计数。共计数300个细胞,分别计算巨噬细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞细胞的数量。
1.2.4 肺组织中嗜酸性粒细胞和白细胞介素(interleukin,IL)33阳性细胞的检测
肺组织切片经刚果红染色后,进行嗜酸性粒细胞的计数;经免疫组织化学染色检测肺组织中IL-33的表达。
1.2.5 迟缓爱德华菌及其成分作用于细胞实验
A549细胞、MLE12细胞和RAW264.7细胞为贴壁生长的细胞,用含10%(体积分数)胎牛血清(fetal bovine serum, FBS) 的DMEM培养基;THP-1细胞为悬浮生长的细胞,用含10%(体积分数)FBS的PRMI 1640培养基,用于细胞刺激实验前需加入100 ng/mL的佛波酯(phorbol-12-myristate-13-acetate, PMA)诱导分化,成为贴壁细胞;以上细胞均在37℃、5%(体积分数)CO2条件下培养。将计数后的细胞悬液接种于24孔细胞培养板内培养24 h后,更换无血清培养基饥饿处理12 h,分别加入迟缓爱德华菌灭活菌体、细菌裂解物和细菌培养上清进行刺激,作用12 h和24 h后收集细胞培养上清,进行细胞因子检测。
1.2.6 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测BALF和细胞培养上清中炎性细胞因子的含量
BALF和细胞培养上清按适宜比例稀释后,应用商品化ELISA试剂盒检测炎性细胞因子IL-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的含量,按照试剂说明书操作,全波长酶标仪(Perkin Elmer,美国)检测450 nm波长下的吸光度值。
1.3 统计学方法
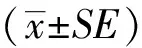
2 结果
2.1 迟缓爱德华菌引起气道内炎症反应
迟缓爱德华菌菌体、裂解物和培养上清分别作用于呼吸道,检测BALF中炎性细胞数量和促炎细胞因子的浓度,结果显示四组间各炎性细胞数量和促炎细胞因子水平差异均有统计学意义(P<0.05)。两两比较结果显示,与对照组相比,裂解物和培养上清刺激组中性粒细胞、巨噬细胞和淋巴细胞数均显著增加(P<0.05),而灭活菌体组未见明显改变(P>0.05)(图1A、B、D);只有裂解物组嗜酸性粒细胞显著增加(P<0.05)(图1C);同时,裂解物组和培养上清组促炎细胞因子IL-1β、IL-6和TNF-α水平显著升高(P<0.05),灭活菌体组未见显著升高(P>0.05)(图1E、F、G)。
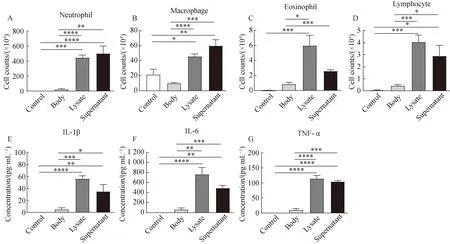
图1 BALF炎性细胞和细胞因子检测Fig.1 Differential counting of cells and detecting proinflammatory cytokines in BALF
2.1 迟缓爱德华菌刺激小鼠肺部表达IL-33细胞变化
在BALF细胞因子的检测中,各组均未检出IL-33。为进一步探讨肺组织中表达IL-33的细胞是否会增加,应用免疫组织化学法检测肺部IL-33的表达情况。结果显示,四组间肺组织中IL-33+细胞数量和百分比差异均有统计学意义(P<0.05)。两两比较显示,与对照组相比,灭活菌体可刺激肺组织中IL-33+细胞数量和百分比明显增加(P<0.05);裂解物组IL-33+细胞数量和百分比均有下降(P>0.05),培养上清组IL-33+细胞数量有增加的趋势(P>0.05),但百分比略有下降趋势(P>0.05)(图2B、C),可能与肺组织大量炎症细胞浸润有关。
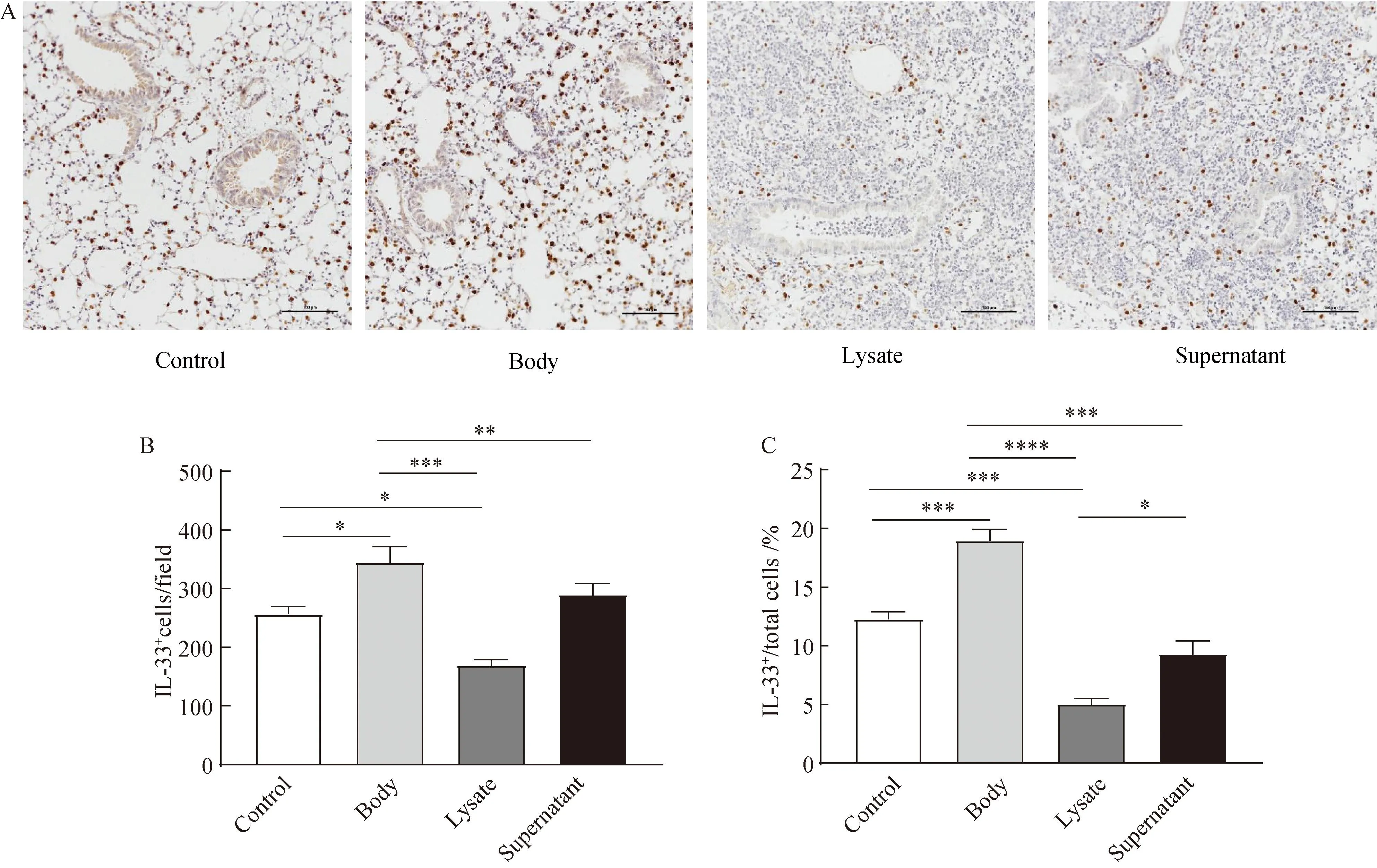
图2 迟缓爱德华菌诱导肺组织IL-33+细胞变化Fig.2 Variation of IL-33+ cells in the lung tissue induced by Edwardsiella tarda
2.3 迟缓爱德华菌刺激肺部嗜酸性粒细胞浸润
肺组织中IL-33的表达增加,是否会引起肺组织中嗜酸性粒细胞的浸润。结果显示,四组间肺组织中嗜酸性粒细胞浸润情况差别有统计学意义(P<0.05)。两两比较显示,与对照组相比,灭活菌体组和培养上清组嗜酸性粒细胞浸润显著增加(P<0.05),裂解物刺激组则未见明显改变(P>0.05)(图3A、B、C)。

图3 迟缓爱德华菌诱导肺组织嗜酸性粒细胞浸润Fig.3 Infiltration of eosinophil in the lung tissue induced by Edwardsiella tarda
2.4 迟缓爱德华菌刺激小鼠气道细胞炎性细胞因子产生增多
为进一步明确BALF中炎性细胞因子的产生来源,应用迟缓爱德华菌作用于呼吸道上皮细胞和巨噬细胞。结果显示,作用于小鼠呼吸道上皮细胞(图4A、B、C),细菌裂解物刺激组细胞培养上清中促炎细胞因子IL-1β、IL-6和TNF-α表达均明显增加,且显著高于其他刺激组(P<0.05);灭活菌体不能刺激MLE12细胞产生促炎细胞因子(P>0.05);细菌培养上清仅能上调小鼠上皮细胞IL-6的表达(P<0.05)(图4B)。作用于小鼠巨噬细胞,细菌裂解物刺激组促炎细胞因子IL-1β、IL-6和TNF-α的表达均增加且IL-1β显著高于其他各组(P<0.05);细菌培养上清刺激组IL-6和TNF-α表达显著增加(P<0.05);灭活菌体刺激组细胞上清中未检测到IL-1β和IL-6,但TNF-α的表达异常显著(P<0.05)(图4D、E、F)。

图4 迟缓爱德华菌对小鼠气道细胞炎性细胞因子表达的影响Fig.4 Effects of Edwardsiella tarda on expression of proinflammatory cytokines by murine airways epithelial cells and macrophages
2.5 迟缓爱德华菌刺激人气道细胞炎性细胞因子产生增多
为明确迟缓爱德华菌对小鼠模型及细胞的炎症作用在人源细胞也存在,应用迟缓爱德华菌灭活菌体、裂解物和培养上清作用于人肺泡上皮细胞和人单核-巨噬细胞。结果显示,在上皮细胞受到作用后,各刺激组细胞培养上清中细胞因子IL-6表达均显著增加(P<0.05),细菌裂解物刺激组细胞上清中IL-6表达增加明显高于其他各组(P<0.05)(图5A);各组均未能检测到IL-1β的表达。作用于人巨噬细胞,各刺激组细胞培养上清中细胞因子IL-1β和IL-6表达均增加(P<0.05)(图5B、C)。
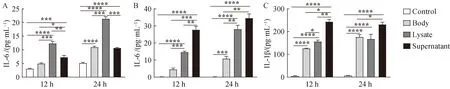
图5 迟缓爱德华菌对人气道细胞炎性细胞因子表达的影响Fig.5 Effects of Edwardsiella tarda on expression of proinflammatory cytokines by human airways epithelial cells and macrophages
3 讨论
COPD是我国第三大死亡原因,是近年国家重点关注的重大慢病之一。该疾病具有高度的异质性,不同临床类型的患者具有不同的病理生理改变、治疗反应及疾病进展,慢性阻塞性肺疾病全球倡议2023年版(Global Initiative for Chronic Obstructive Lung Disease,GOLD2023)[11]提出了基于危险因素的COPD分型,将感染相关COPD单列一类。COPD急性加重主要与感染因素有关。目前已报道[12],从COPD患者呼吸道标本最常检出的细菌是变形菌门流感嗜血杆菌、铜绿假单胞菌、肺炎克雷伯菌等和厚壁菌门肺炎链球菌等。笔者课题组前期研究发现变形菌门迟缓爱德华菌仅在COPD急性加重期患者中检出。迟缓爱德华菌是一种革兰阴性兼性厌氧菌,属肠杆菌科爱德华菌属,宿主广泛,多感染水生鱼类、爬行动物、两栖动物等[13],且是其菌属中唯一能够感染人类的细菌[14],但有关人类疾病的研究多局限于病例报道,少有深入的机制研究。为此,本研究初步探讨了迟缓爱德华菌不同组分对肺部炎症的作用。
COPD以肺部持续性炎症反应为主要特征。气道中中性粒细胞和巨噬细胞数量以及促炎细胞因子水平的增加与COPD的急性加重和严重程度直接相关[12, 15]。已有研究[16]报道肺炎链球菌经鼻感染香烟烟雾暴露小鼠,可进一步诱导肺损伤和导致肺气肿发展。研究[17]表明流感病毒和流感嗜血杆菌合并感染诱导COPD小鼠急性加重,促进巨噬细胞、中性粒细胞、单核细胞、自然杀伤细胞和CD4+T细胞在肺部募集。金黄色葡萄球菌慢性定植的肺气肿小鼠的肺功能下降、组织损伤及中性粒细胞浸润程度比其他呼吸道条件致病菌更显著且其代谢产物同型半胱氨酸加速COPD肺功能下降[18]。本文研究结果可见迟缓爱德华菌不同组分作用有所差异,其中裂解物和代谢物滴鼻组可明显诱导小鼠气道中性粒细胞和巨噬细胞增加。值得注意的是迟缓爱德华菌菌体和代谢物可引起肺部嗜酸性粒细胞的增加,而细菌裂解物刺激可诱导BALF中嗜酸性粒细胞的数量增加。有研究[19]表明COPD患者急性加重期气道嗜酸性粒细胞水平升高尤为明显,嗜酸性粒细胞计数升高是与哮喘和COPD患者预后较差相关的炎症标志物[20],与频繁急性加重和疾病严重程度显著相关[21]。研究[22-23]表明炎症介质驱动的嗜酸性粒细胞炎症在COPD中发挥作用,且嗜酸性粒细胞可通过组织蛋白酶L促进肺基质破坏和肺气肿。因此,迟缓爱德华菌引起肺部及气道嗜酸性粒细胞增加可能参与COPD进展。IL-33可诱导嗜酸性粒细胞增加[24],笔者课题组已发表数据[25]显示,IL-33可促进抗自身肺组织抗体的产生。本文研究显示迟缓爱德华菌仅灭活菌体滴鼻可引起肺部IL-33+细胞的增加,但嗜酸性粒细胞的增加是否与肺部IL-33表达增加相关,以及IL-33产生是否可诱导此条件下的自身抗体产生,继而参与COPD的发生发展,尚待进一步深入研究。
已知IL-1β、IL-6和TNF-α在COPD患者肺部持续性炎症反应和疾病的恶化中发挥着重要的作用[26-27]。IL-1β和IL-6可以通过促进抗原呈递、炎症细胞活化和参与基质降解酶的表达来激活免疫系统并促进急性炎症反应[28]。本文研究显示滴注迟缓爱德华菌不同组分可刺激小鼠气道促炎细胞因子IL-1β、IL-6和TNF-α表达增加。体外实验也证明迟缓爱德华菌菌体、裂解物和代谢物可刺激人和小鼠呼吸道上皮细胞和/或巨噬细胞不同程度表达IL-1β、IL-6和TNF-α。因此,迟缓爱德华菌可诱导气道细胞产生促炎细胞因子参与肺部炎症反应。
已有研究[16]报道肺炎链球菌经鼻感染香烟烟雾暴露小鼠,可进一步诱导肺损伤和导致肺气肿发展。本文研究通过体内外实验证明迟缓爱德华菌能够造成肺部急性损伤,可能通过中性粒细胞、嗜酸性粒细胞等炎性细胞以及多种促炎细胞因子介导,在COPD的发生发展中发挥作用。结果也显示,不同成分诱导的炎症反应存在差异。因此,进一步深入研究迟缓爱德华菌何种自身菌体成分或代谢产物主要诱导肺部炎症损伤及其损伤机制,有助于揭示呼吸道迟缓爱德华菌在COPD加重中的作用,可能为COPD的诊断提供一个新的检测指标,同时也为COPD急性加重的治疗提供新的证据和思路。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明李琴:设计实验,实验研究,数据分析,撰写文章;胡悦:实验研究,分析数据,文章撰写;秦啸峰、冯志红:技术支持;孙英、王炜:设计实验,审订论文。

