双峰驼TLR1原核表达体系构建、抗体制备及组织表达分析
谢东旭 张睿 索南吉 刘柯江 王亭玮 王雯慧
(甘肃农业大学动物医学院,兰州 730070)
Toll 样受体 (Toll-like receptors, TLRs) 是天然免疫系统受体家族的代表,也是最早研究的一个模式识别受体 (Vijay, 2018)。1997 年,人类TLRs家族的发现是免疫学领域的重大突破 (孔伟梁等,2021),迄今已在哺乳动物中发现了13 种不同类型的TLRs (TLR1 ~ TLR13) (尹淑园,2020)。目前已知,TLR1 是一种非催化性Ⅰ型跨膜糖蛋白,其受体间有着相似的结构。同时TLR1 可以和TLR2 通过螺线管结合形成异质二聚体,此异质二聚体能识别多种微生物配体和具有不同脂质部分的脂蛋白,以此增加了对病原相关分子模式 (Pathogen-Associated Molecular Patterns, PAMPs) 的识别谱(Barre-Sinoussiet al., 1983; Qiuet al., 2021)。
TLR1 进化十分保守,从蛋白质的C 端至N 端依次由胞内区、跨膜区和膜外区构成 (Markset al., 2021)。胞内区含有保守的TIR 结构域,用于与下游接头分子的TIR 功能域特异性相互作用,起始下游信号级联反应;跨膜区中跨膜结构域决定了TLR1 的亚细胞定位;膜外区中病原结合结构域与病原相关分子模式 (PAMPs) 的识别有关。TLR1 能够识别三酰基脂肽 (Guanet al., 2010),识别后可激活MyD88 依赖的NF-кB 信号级联反应,导致树突状细胞的成熟和迁移以及T 细胞的激活,从而促进炎症因子的生成,参与病原体的杀伤(Masonet al., 2016)。因此,TLR1 在抗细菌、病毒、寄生虫感染方面发挥着至关重要的作用。研究表明,TLR1 参与结核病、结肠炎、类风湿性关节炎、前列腺癌等多种疾病的调控 (Melițet al.,2019)。
随着对TLR1 研究的不断深入,针对TLR1及其配体在预防和治疗与天然免疫相关疾病方面的研究成为热点 (Luchneret al., 2021),对于TLR1 在天然免疫中作用机制的研究必不可少。此外双峰驼对各种复杂气候条件和病原体的耐受力极为独特,其天然免疫力的作用不容忽视。一方面国内外关于双峰驼TLR1 在天然免疫中的研究匮乏,市场上也缺乏驼源性的TLR1 商品化抗体来支持研究;另一方面TLR1 在不同器官组织中的表达分布具有物种特异性 (唐娜等,2020)。因此,本研究试通过原核表达系统诱导蛋白表达,并制备兔抗双峰驼TLR1 多克隆抗体,通过HE 染色和SABC 免疫组化法检测其在双峰驼心脏、肝脏、脾脏、肺脏和肾脏中的表达,以期为双峰驼天然免疫机理研究提供抗体支撑的同时,为今后双峰驼黏膜免疫系统和天然免疫机理研究积累材料。
1 研究方法
1.1 双峰驼TLR1重组质粒的构建
首先参照NCBI 数据库,选择双峰驼TLR1基因序列 (XM_010962675.1),选取编码区 (CDs),通过DNAstar软件将编码区核苷酸序列翻译为对应的氨基酸片段。随后通过Protean 分析双峰驼TLR1基因的抗原表位和亲水性,选择膜外区不含信号肽的氨基酸区域作为主要抗原位。通过SignaiP 4.1 Server 和TMHMM Server 2.0 分别进行信号肽和跨膜区分析,将高亲水性信号肽和蛋白跨膜区截除,并截取蛋白膜外区抗原指数较高的序列 (预测分子质量62 kDa)。通过Primer 5.0 进行酶切位点预测,添加酶切位点BamHI 和XhoI;最后将序列经碱基优化后送至金开瑞生物科技有限公司产品合成,后将基因序列连接到pET-B2M 载体上,随后进行双酶切验证,并将酶切验证后的重组质粒冻干粉转化进BL21 (DE3) 感受态细胞,提取质粒测序分析,将测序正确的阳性重组质粒命名为pET-B2M-TLR1。
1.2 重组蛋白TLR1的诱导表达及表达形式鉴定
将pET-B2M-TLR1 重组质粒利用热应激法转化至感受态细胞BL21 (DE3) 中,将重组菌命为pET-B2M-TLR1-BL21 (DE3),挑选形态正常的单个菌落接种于LB固体培养基 (Kan+) 培养,放于恒温摇床中37 ℃、220 r/min培养7 h;取该新鲜培养菌液50 μL 加入到5 mL LB 液体培养基 (Kan+) 中,恒温摇床37 ℃、220 r/min 培养约2 h 至OD600值为0.6 ~ 0.8;在无菌条件下取出1 mL 菌液制样,作为诱导前对照,剩余部分加入0.2 mmol/L 的IPTG 4 μL,恒温摇床37 ℃、220 r/min培养6 h后收集菌体,进行SDS-PAGE检测。为确定目的蛋白的表达形式,将菌体用超声破碎并离心,分别取其上清液和沉淀制样,进行SDS-PAGE检测。
1.3 重组蛋白TLR1的纯化
以最佳表达条件诱导重组蛋白TLR1 大量表达,使用PBS 磷酸盐缓冲液将收集的菌体沉淀,经离心混匀洗涤3次后,加入蛋白裂解抑制剂,并使用超声破碎 (180 W破碎3 s,暂停4 s,直至菌液清亮),用PBS 溶液将破碎的菌体洗涤2 次。用含盐酸胍的Binding buffer 溶解液重悬沉淀,加入β-巯基乙醇使沉淀溶解、蛋白变性,经过离心收集上清。将上清 (变性后的蛋白) 与Ni-NTA 镍柱填料冰浴结合4 h,静置后洗脱,参考康为世纪生物科技有限公司生产的His 标签蛋白纯化试剂盒中的操作说明,使用Washing Buffer 洗去杂蛋白,使用Elution Buffer 洗脱目的蛋白。之后用20 mmol/L 咪唑的洗脱液,洗去吸附力低的杂蛋白,500 mmol/L咪唑的洗脱液洗脱目的蛋白;之后测定洗脱后目的蛋白含量,进行SDS-PAGE分析检测,分析纯化效果。
1.4 动物免疫及多抗制备
健康的成年雄性日本大耳兔 (购自兰州兽医研究所实验动物中心) 适应性饲喂1 周,观察饮食及精神状态,若无不良反应,则开始每隔1 周进行1 次免疫,共免疫4 次。将纯化蛋白与弗氏完全佐剂1∶1混合乳化,通过腘淋巴结注射及背部皮下多点注射的方式免疫。首次免疫剂量为800 μg/mL 纯化蛋白。1 周后进行第2 次免疫,将纯化蛋白与等体积的弗氏不完全佐剂1∶1 混合乳化,使免疫剂量减半,第3 次免疫同第2 次,第4 次免疫取200 μL 的500 μg/mL 纯化蛋白连续3 d 耳缘静脉注射。待第4 次免疫结束1 周后,进行心脏采血,4 ℃、3 000 r/min 离心8 min 待血液分层后,分离血清,分装放入超低温冰箱保存。
1.5 TLR1多克隆抗体效价的检测
将纯化后的重组蛋白TLR1 作为抗原,置于96 孔酶标板每孔5 μg 于 4 ℃包被12 ~ 16 h,经TBST 洗涤,脱脂奶粉封闭、TBST 洗涤后,加入按1∶2 000、1∶4 000、1∶8 000、1∶16 000、 1∶32 000、1∶64 000、1∶128 000 比例稀释的兔血清,37 ℃孵育1 h,TBST 洗涤后加Abmart 生物医药有限公司生产的HRP 标记的山羊抗兔IgG 二抗(1∶8 000 稀释),37 ℃孵育1 h,TBST 洗涤后加TMB 显色液 (现用现配),置于暗室显色10 min,显出蓝色时,加入2 mol/L 的H2SO4(每孔50 μL) 终止显色,用酶标仪测波长450 nm下的OD450值。
1.6 TLR1多克隆抗体特异性的检测
将纯化的重组蛋白TLR1 经常规电泳后,通过湿转转印至PVDF 膜上,取出PVDF 膜放到封闭液中,37 ℃封闭1.5 h,倒出封闭液,加TBST 溶液37 ℃震荡5 min,重复4 次。将一抗 (兔抗血清) 用封闭液按比例稀释 (1∶1 000 稀释),37 ℃孵育1 h后,4 ℃孵育过夜;弃去一抗液体,经TBST 溶液 ,37 ℃震荡洗膜15 min,洗5 次,加HRP 标记的山羊抗兔IgG 二抗 (1∶8 000 稀释) 37 ℃震荡孵育2 h,后用TBST 溶液洗膜5 次,滴加ECL 化学发光液显色,用蛋白发光印记仪曝光并拍照。
1.7 HE 染色和SABC 免疫组化法检测TLR1 在双峰驼组织中的表达
将本实验室制好的双峰驼心脏、肝脏、脾脏、肺脏和肾脏石蜡切片,进行HE 和SABC 免疫组化染色。使用BOSTER 生物工程有限公司生产的SABC-免疫组化试剂盒,将切片依次使用3% H2O2溶液、0.1%胰蛋白酶、BSA 封闭液分别作用15 min、30 min、40 min;兔抗血清一抗 (1∶1 000稀释) 4 ℃孵育18 ~ 22 h;山羊抗兔IgG 二抗37 ℃孵育30 min;显色、复染、脱水、透明、封片;使用光学显微镜观察并拍照。
2 结果
2.1 TLR1重组质粒的构建
预测分析双峰驼TLR1 蛋白亲水性和抗原表位(图1A),发现该蛋白为抗原指数较高的亲水蛋白,预测信号肽发现该蛋白无信号肽 (图1B),预测其跨膜结构发现该蛋白共有796个氨基酸,其中氨基酸1 ~ 585 组成其膜外区 (图1C),用Editseq (DNASTAR 7.0) 截取膜外区抗原指数较高的一段序列(区段:29 ~ 441aa,预测分子质量62 kDa),在序列两端添加起始密码子ATG 和终止密码子TAG,最后将获得的重组质粒进行双酶切验证,最终预测该重组蛋白TLR1大小为62 kDa。

图1 双峰驼TLR1 蛋白生物学信息预测.A:双峰驼TLR1 蛋白亲水性与抗原指数的预测;B:双峰驼TLR1 蛋白信号肽预测;C:双峰驼TLR1蛋白跨膜区预测Fig.1 Prediction of biological information on the bactrian camel TLR1 protein. A: Prediction of the hydrophilicity and epitope of TLR1 protein in bactrian camel; B: Prediction of TLR1 protein signal peptide in bactrian camel; C: Prediction of TLR1 protein transmembrane in bactrian camel
2.2 重组质粒pET-B2M-TLR1的表达及表达形式
将pET-B2M-TLR1- BL21 (DE3) 37 ℃培养至OD600为0.6 ~ 0.8 时,用0.2 mmol/L 的 IPTG 诱导7 h,收集菌体,SDS-PAGE 检测,重组菌诱导后产物中有清晰的目的条带;超声破碎离心后的沉淀中蛋白的表达量更多一些,表明重组蛋白TLR1 在BL21 中成功表达,且主要以包涵体形式表达,大小约为62 kDa (图2A),与预测结果相符。
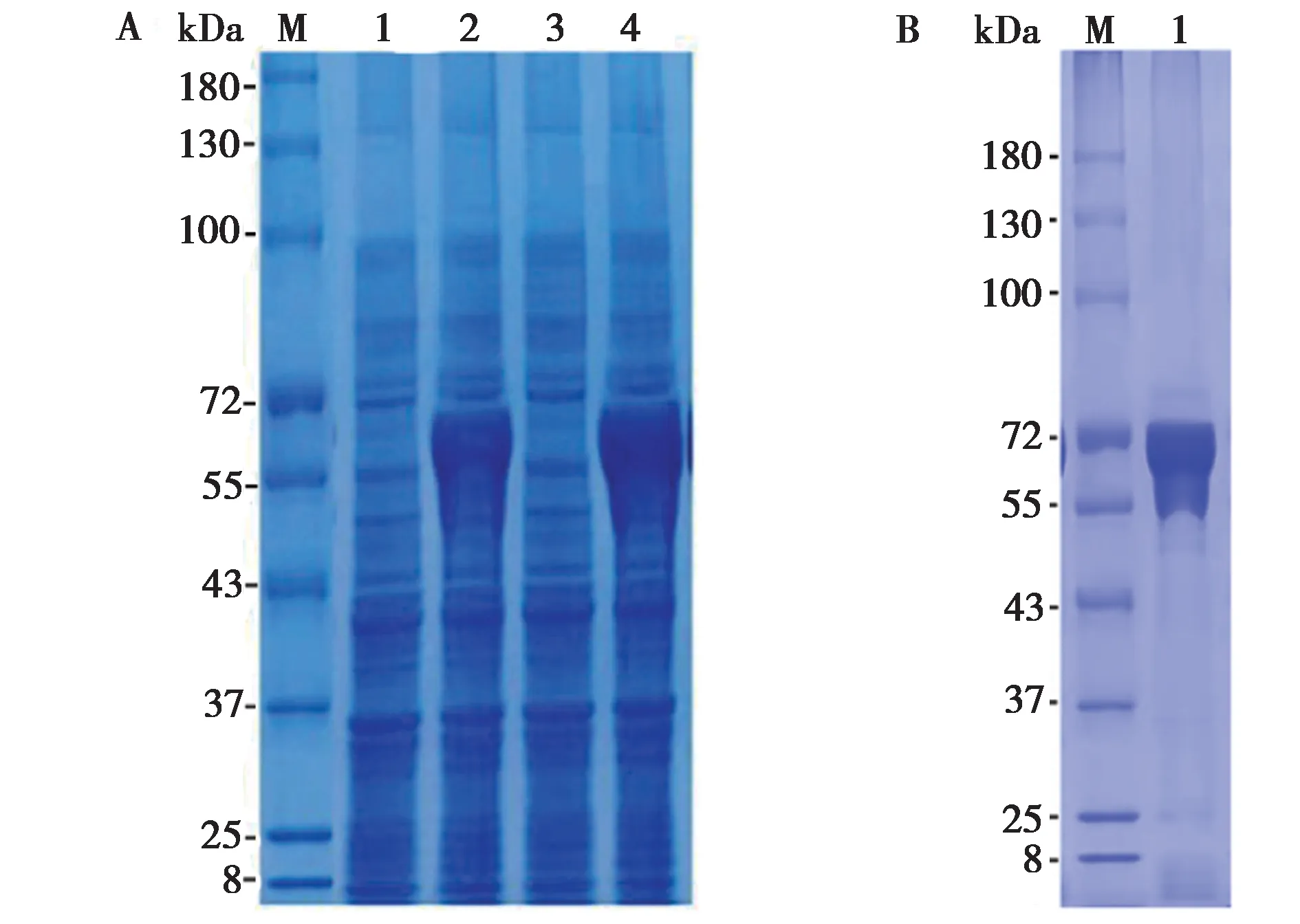
图2 双峰驼重组蛋白TLR1 的表达与纯化. A:双峰驼重组蛋白TLR1 表达的SDS-PAGE 检测,M,蛋白分子质量标准;1,未诱导重组蛋白;2,诱导后重组蛋白;3,上清;4,沉淀. B:双峰驼重组蛋白TLR1 纯化,M,蛋白分子质量标准;1,纯化后的蛋白Fig.2 Expression and purification of the recombinant protein TLR1 from the bactrian camel. A: SDS-PAGE detection of bactrian camel TLR1 recombinant protein expression, M, Protein marker; 1, Uninduced recombinant protein; 2, Induced recombinant protein; 3, Supernatant; 4, Precipitation. B: Purification of bactrian camel TLR1 recombinant protein, M, Protein marker; 1, Purified protein
2.3 TLR1蛋白的纯化结果
将表达的重组蛋白TLR1 进行纯化,从镍柱上洗脱下来的纯化蛋白,经测定其最高蛋白含量大于2.5 mg/mL,SDS-PAGE 验证,纯化的蛋白纯度良好,无杂蛋白,大小为62 kDa (图2B)。
2.4 TLR1抗体血清效价的检测结果
ELISA 结果显示,兔抗TLR1 蛋白血清能与重组蛋白特异性结合,即具有免疫原性。抗血清P/N值OD450(平均值-空白) / OD450(阴性-空白) ≥ 2.1,视为血清呈阳性的有效稀释 (表1)。血清抗体效价为对应的阳性最高稀释度,即该血清抗体效价为1∶64 000。

表1 ELISA测定抗体血清效价Table1 Serum potency of antibodies determined by ELISA
2.5 TLR1抗体血清的Western blot鉴定结果
Western blot 测试结果显示,在PVDF 膜上约62 kDa处有清晰的蛋白印迹条带存在 (图3),表明该抗体能与重组蛋白TLR1 特异性结合,即双峰驼重组蛋白TLR1具有良好的反应原性。

图3 双峰驼重组蛋白TLR1的Western blot 鉴定结果. M:蛋白分子质量标准;1:阴性对照;2:多克隆抗体血清Fig.3 Western blotting identification results of recombinant protein of bactrian camel. M: Protein marker; 1: Negative control; 2: Purified serums
2.6 TLR1 抗体血清在双峰驼组织器官中的表达分析
免疫组化结果显示,TLR1 在双峰驼心脏、肝脏、脾脏、肺脏和肾脏中均有表达,但在不同组织器官中的表达有所差异。
2.6.1 TLR1在双峰驼心脏的表达
根据TLR1 在双峰驼心脏组织中HE 和SABC免疫组化的染色结果观察可见,心肌纤维在心肌膜中呈螺旋状排列,心肌细胞的细胞核位于心肌纤维中央,较大并呈圆形或椭圆形,且着色明显(图4A);在双峰驼心肌纤维的心肌细胞中,TLR1阳性反应广泛发生 (图4C);未加一抗的阴性对照组细胞核着色明显,未见阳性反应物 (图4B)。

图4 TLR1在双峰驼不同组织器官中的表达. A: 心脏苏木精-伊红染色 1 000 ×;B: 心脏阴性对照 1 000 ×;C:心脏免疫组化染色1 000 ×;D:肝脏苏木精-伊红染色 1 000 ×;E:肝脏阴性对照 1 000 ×;F:肝脏免疫组化染色 1 000 × (“➡”指示的为枯否细胞,“➤”指示的为肝细胞);G:脾脏苏木精-伊红染色 1 000 ×;H:脾脏阴性对照 1 000 ×;I:脾脏免疫组化染色 1 000 × (“➡”指示的为单核/巨噬细胞);J:肺脏苏木精-伊红染色 1 000 ×;K:肺脏阴性对照 1 000 ×;L:肺脏免疫组化染色 1 000 × (“→”指示的为呼吸性细支气管上皮细胞);M:肺脏苏木精-伊红染色 1 000 ×;N:肺脏阴性对照 1 000 ×;O:肺脏免疫组化染色 1 000 × (“➡”指示的为Ⅰ型肺泡细胞,“➤”指示的为Ⅱ型肺泡细胞);P:肾脏苏木精-伊红染色 1 000 ×;Q:肾脏阴性对照 1 000 ×;R:肾脏免疫组化染色 1 000 ×;S:肾小管苏木精-伊红染色 1 000 ×;T:肾小管阴性对照 1 000 ×;U:肾小管免疫组化染色 1 000 × (“➡”指示为远曲小管上皮细胞)Fig.4 TLR1 expression in different tissues and organs of bactrian camels. A: Heart hematoxylin-eosin staining 1 000 ×; B: Heart negative control 1 000 ×; C: Immunohistochemical staining of heart 1 000 ×; D: Liver hematoxylin-eosin staining 1 000 ×; E: Liver negative control 1 000 ×; F: Immunohistochemical staining of liver 1 000 × (‘➡’indicates kwashiorkor cells and ‘➤’indicates hepatocytes); G: Spleen hematoxylin-eosin staining 1 000 ×; H: Spleen negative control 1 000 ×; I: Immunohistochemical staining of spleen 1 000 × (‘➡’indicate monocytes/macrophages);J: Lung hematoxylin-eosin staining 1 000 ×; K: Lung negative control 1 000 ×; L: Immunohistochemical staining of lung 1 000 × (‘→’indicates bronchial epithelial cells); M: Lung hematoxylin-eosin staining 1 000 ×; N: Lung negative control 1 000 ×; O: Immunohistochemical staining of lung 1 000× (‘➡’ indicates typeⅠalveolar cells and‘➤’indicates type Ⅱ alveolar cells); P: Kidney hematoxylin-eosin staining 1 000 ×; Q: Kidney negative control 1 000 ×; R: Immunohistochemical staining of kidney 1 000 ×; S: Kidney tubules hematoxylin-eosin staining 1 000 ×; T: Kidney tubules negative control 1 000 ×; U: Immunohistochemical staining of kidney tubules 1 000 × (‘➡’indicate proximal tubule epithelial cells)
2.6.2 TLR1在双峰驼肝脏的表达
根据染色结果观察可见,在肝小叶中观察到呈板状排列,且细胞体积较大,呈多边形排列,核仁明显的细胞,初步判断为肝细胞。在肝窦中,观察到呈星形的细胞,附着在内皮细胞表面,初步判断为枯否细胞 (图4D);TLR1在肝窦的枯否细胞中阳性反应强烈,呈深棕色 (图4F);阴性对照组中细胞核着色明显,未见阳性反应物 (图4E)。
2.6.3 TLR1在双峰驼脾脏的表达
根据染色结果观察可见,在脾脏组织的白髓区,呈现大量深蓝色轮廓清晰的细胞,初步判断为T 细胞或者单核/巨噬细胞 (图4G);经免疫组化染色后观察到,在白髓区呈现圆形或不规则形、胞浆丰富、胞体巨大、卵圆形核的阳性细胞,判断其为单核/巨噬细胞,表现强阳性反应 (图4I);阴性对照组中细胞核着色明显,未见阳性反应物(图4H)。
2.6.4 TLR1在双峰驼肺脏的表达
根据染色结果观察可见,在呼吸性细支气管中,腔面起伏不平,被覆一层上皮细胞,初步判断为单层纤毛柱状上皮细胞,上皮下方散在分布少量的平滑肌细胞 (图4J);TLR1 在呼吸性细支气管管壁的上皮细胞中阳性反应强烈,呈深棕色 (图4L);阴性对照组中上皮细胞与平滑肌细胞细胞核着色明显,且未见阳性反应物 (图4K)。
在肺泡的肺泡上皮中,可见胞核扁圆、胞体扁平的细胞与胞核较大、圆形、胞体略呈立方形的细胞连接紧密,初步判断其分别为Ⅰ型肺泡细胞和Ⅱ型肺泡细胞 (图4M);TLR1 在肺泡上皮的Ⅰ型肺泡细胞和Ⅱ型肺泡细胞中呈阳性反应(图4O);阴性对照组中细胞核着色明显,未见阳性反应物 (图4N)。
2.6.5 TLR1在双峰驼肾脏的表达
根据染色结果观察可见,在双峰驼肾脏的皮质迷路的肾小体中分布有形态特殊、胞体大、形似足靴且紧贴于毛细血管基膜的细胞,初步判断为足细胞 (图4P),在皮质迷路的肾小体周围分布有管腔大而规则的远曲小管,且其上皮细胞细胞核呈圆形位于细胞中央,初步判断为单层立方细胞 (图4S);经免疫组化染色后观察到,TLR1 在肾小体中无明显的阳性反应,但在远曲小管上皮细胞中出现强阳性反应 (图4R、U);阴性对照组中细胞核着色明显,未见阳性反应物 (图4Q、T)。
3 讨论
双峰驼作为我国荒漠地区特有畜种,在生物学特性上具有诸多优势,如耐盐碱、耐高温差、耐渴等,对复杂的气候条件和病原体也具有独特的耐受力,因此对其天然免疫作用的研究不容忽视。TLR1 是表达于天然免疫细胞、上皮细胞和内皮细胞等细胞表面的重要模式识别受体,通过自身的富含亮氨酸的重复单位 (leucine-rich repeats,LRRs) 结构域识别PAMPs,刺激炎症因子的生成,参与病原体的杀伤 (Rameshet al., 2015)。TLR1 的分子结构在不同物种间存在较大的差异,而且对于配体的识别具有种属特异性 (Zhouet al., 2021),因此对于不同物种间TLRs 的基因蛋白结构以及识别配体的种属特异性研究,可进一步为疾病病原的识别,安全高效疫苗和药物的研究提供理论依据。此外对TLR1基因多态性的研究结果显示,TLR1基因的多态性与机体疾病的遗传易感性密切相关。例如TLR1 的多态性位点248S 和S602I 能增加对结核病的易感性 (Noreen and Arshad, 2015),rs5743611 与结肠炎的发生呈正相关。因此,可在相关疾病研究中将TLR1 作为研究的候选分子。基于双峰驼TLR1 对配体识别的种属特异性以及其基因多态性与疾病的相关性,为深入研究双峰驼TLR1 在天然免疫抗病机制中发挥的作用及功能,以及进一步为病原识别、疫苗和药物的研究提供物质基础,对TLR1 进行相应抗体的研究是必要的。
原核表达系统因其具有目的基因培养周期短、表达水平高、操作简单、遗传背景明确、经济、快速等特点,而成为制备抗体的最佳选择。因此,本研究采用原核表达系统对双峰驼TLR1 进行表达。另外,有研究表明,在原核表达系统中,密码子优化是增加目的蛋白表达量的一种途径,且该方法已被广泛应用于相关研究中 (陈徵婷等,2022)。因此,本研究对截取的基因序列进行了密码子优化,并成功构建了pET-B2M-TLR1 重组质粒。有研究发现,在同等条件下,未去除信号肽的重组蛋白始终无法表达,去除信号肽的重组蛋白却能成功表达 (Liuet al., 2019),因此本研究对高亲水性信号肽进行了截除,且通过原核表达系统高效地表达了双峰驼重组蛋白TLR1。该重组蛋白通过经典免疫法免疫日本大耳兔,制备了兔抗双峰驼TLR1 多克隆抗体,通过间接ELISA 检测抗体效价为1∶64 000,通过Western blot 检测原核表达的重组蛋白TLR1 能与对应抗体特异性识别。本研究利用制备的兔抗双峰驼TLR1 多克隆抗体,通过HE 染色和SABC 免疫组化技术,证明了双峰驼TLR1 在其心脏的心肌细胞上呈阳性表达,推测TLR1 可能在维持心肌细胞正常电生理活动中发挥作用。TLR1 在肝脏的枯否细胞上呈阳性表达,枯否细胞是位于肝脏中的特殊巨噬细胞,是单核巨噬细胞系统的一部分,TLR1 可能参与枯否细胞清除血液中的外来抗原过程中相关抗原的识别过程。TLR1 在脾脏的单核巨噬细胞中呈阳性表达,脾脏作为机体重要的免疫器官,具有免疫防御性,TLR1 可能参与脾脏单核巨噬细胞吞噬含铁血黄素、酸性磷酸酶等物质的过程。TLR1 在肺脏的呼吸性细支气管上皮细胞、Ⅰ型肺泡细胞和Ⅱ型肺泡细胞均呈阳性表达。肺脏作为机体与外界气体交换的主要场所和病原体侵入机体的主要途径,TLR1 作为重要的模式识别受体,可能参与肺脏天然免疫防御的过程。TLR1 在肾小管上皮细胞呈阳性表达,而肾小管上皮细胞作为非专职的抗原呈递细胞,推测TLR1 可能在其中参与调节固有免疫和获得性免疫,以及局部免疫微环境的形成过程。综上所述,本研究利用原核表达系统成功制备出效价高、特异性良好的兔抗双峰驼TLR1 多克隆抗体,且操作简便、经济,为其商品化抗体的研发提供了物质基础。此外,利用HE 染色和SABC 免疫组化技术分析研究了TLR1 在双峰驼心脏、肝脏、脾脏、肺脏和肾脏中的表达,表明抗体有良好的特异性,能够用于实践中对于TLR1 的识别与检测,为进一步探究TLR1 在双峰驼心脏、肝脏、脾脏、肺脏和肾脏中所扮演的角色奠定了基础,为今后双峰驼天然免疫机理的研究积累了材料。
——野双峰驼

