川陕花椒根皮提取物对人角质形成细胞辐射损伤的防护作用
王成芳,齐雪松,邵 帅,杜树山,苟 巧
(1.中国疾病预防控制中心辐射防护与核安全医学所,辐射防护与核应急中国疾病预防控制中心重点实验室,北京 100088; 2.北京师范大学地理科学学部,北京 100875)
放射性皮肤损伤是放射治疗(简称放疗)中常见的并发症之一。据统计,临床上约有90%的肿瘤患者在放疗中或放疗后出现不同程度的皮肤损伤[1],轻症表现为脱屑、红肿、瘙痒,引发皮肤炎症,重症时发生溃疡,导致皮肤组织坏死,甚至癌变[2-3]。放疗所致皮肤损伤可能面积并不大,但其损伤严重时可到达软组织、肌肉组织甚至是骨组织,易迁延不愈反复发作,不仅降低患者的生存质量,也影响患者的治疗进程和效果[4]。尽管临床上已经对放射性皮肤损伤的发病机制做了大量的探索与研究,研发了多种用于防治皮肤不良反应的药物,但是由于放射损伤机制复杂、患者个体化差异大等因素,疗效并不稳定,现行的临床治疗方案还没有统一的标准[5]。因此,仍需积极开发疗效显著且稳定的放射性皮肤损伤防治药物。
花椒属植物富含萜类、生物碱、香豆素、木脂素、酰胺、黄酮和脂肪酸类化合物[6],除果实外,其根、茎、叶均可入药,无论是中医临床还是基础研究,花椒属植物被应用于皮肤疾病由来已久[7-8]。然而,川陕花椒(ZanthoxylumpiasezkiiMaxim.)根皮提取物(ZPE)在放射性皮肤损伤中的作用研究目前未见相关报道。因此,本研究以人皮肤角质形成细胞HaCaT为受试对象,探讨川陕花椒根皮提取物(ZPE)对其辐射损伤的影响及其机制,旨在为ZPE作为放射性皮肤损伤防治药物的研发提供理论依据,也为扩大川陕花椒的药用价值提供新的方向。
1 材料与方法
1.1 仪器、材料与主要试剂
CCK-8 试剂盒(日本同仁化学研究所);Annexin V-PE/7AAD细胞凋亡检测试剂盒(南京凯基生物有限公司);DCFDA Cellular ROS检测试剂盒(美国Abcam公司);人IL-1β、人IL-6 ELISA试剂盒(武汉华美生物工程有限公司);磷酸化p38、SAPK/JNK抗体套装,GAPDH抗体(arigo上海帛龙生物科技有限公司);β-actin抗体(武汉三鹰生物技术有限公司);辣根过氧化物酶(HRP)标记山羊抗兔抗体(北京中杉金桥公司);总蛋白提取、蛋白定量及ECL 发光检测试剂盒、标准蛋白Marker(美国Thermo公司)。Multiskan GO型连续波长酶标仪(美国Thermo公司);FACS Cabular流式细胞仪(美国BD公司);Axiocam ERC5S型倒置显微镜(德国ZEISS公司);电泳仪、化学发光检测系统(美国Bio-Rad 公司)。
1.2 药物配制
ZPE为川陕花椒根皮提取物,由北京师范大学地理科学学部杜树山教授实验室提供,植物样本采集于甘肃文县,经北京师范大学生命科学学院刘全儒教授鉴定,自然阴干粉碎。提取方法如下:药材粉碎后取粗粉样品100 g,按照料液比1∶10加入甲醇,超声提取3次,每次超声30 min,减压抽滤,合并滤液并减压浓缩至浸膏,称其浸膏重量,并计算出膏率为13%。用高糖DMEM细胞培养液为溶剂,配制成10 mg/mL的ZPE溶液,-20 ℃冻存备用。细胞实验时用细胞培养液稀释成不同浓度作用于细胞。
1.3 照射条件
北京师范大学化学学院钴源60Co γ射线照射,源强5 000 Ci,照射距离为79 cm,剂量率为1.0 Gy/min。
1.4 细胞培养
人皮肤角质形成细胞HaCaT(购自广州吉妮欧生物科技有限公司),用含10%胎牛血清、1%青链霉素的高糖DMEM培养液于37 ℃、5%CO2条件下培养。每2~3 d换1次培养基,每周传代1~2次。
1.5 CCK-8检测细胞存活率
取对数生长期的HaCaT细胞(6×103个/孔)接种于96孔板,每组设6个复孔,分别给予0、2、4、6、8、10、15 Gyγ射线照射,于照后24、48、72、96 h进行检测,或在照射前用含不同浓度(0、62.5 μg/mL、125 μg/mL、250 μg/mL、500 μg/mL、1 mg/mL、2 mg/mL、4 mg/mL)ZPE的培养基预处理细胞1 h,经0、8.0 Gy γ射线照射(设立空白对照组和照射对照组),照后72 h进行检测,按照CCK-8试剂盒说明书操作,全波长酶标仪测定各孔450 nm波长下吸光度值(OD),计算细胞存活率,细胞存活率(%)=100×(OD处理组-OD培养液对照组)/(OD空白对照组-OD培养液对照组)。
1.6 克隆形成实验
取对数生长期的细胞分别接种于培养瓶内,实验分为4组:(1) 空白对照组;(2) ZPE组,药物浓度为2 mg/mL;(3) 照射对照组;(4) 照射对照组+ZPE组。待细胞贴壁后继续培养,照射前1 h加药处理,(3)、 (4)组细胞分别给予4.0 Gy 的照射剂量。照射后各组细胞悬液按比例稀释分别接种于6孔板中,并轻轻转动,使细胞分散均匀,静置培养12天。弃去培养液,PBS清洗两遍,加1∶3醋酸/甲醇固定10 min,去固定液,加适量Giemsa应用染色液染色30 min,用流水缓慢洗去染色液,空气干燥。低倍光学显微镜下计数≥50个细胞的克隆数,以0 Gy组集落形成率为对照,计算不同照射剂量下的细胞存活分数(surviving fraction,SF),每组6个复孔。
细胞存活分数按公式计算:细胞贴瓶率(plating efficiency,PE)=100%×克隆数/细胞接种数;细胞存活分数(SF)= 100% ×受照射细胞的贴瓶率(PE)/对照细胞的贴瓶率(PE)。
1.7 细胞凋亡和细胞内ROS检测
取对数生长期的HaCaT细胞(1.8×105个/孔)接种于6 孔板中,每组设3个复孔,用含2 mg/mL ZPE的培养基预处理细胞1 h后,经8.0 Gy γ射线照射(设立空白对照组和照射对照组),照后继续培养24 h和48 h,按照Annexin V-PE/7AAD细胞凋亡和DCFDA Cellular ROS检测试剂盒说明书操作。经流式细胞仪检测,计算细胞凋亡率和坏死率;ROS以流式细胞仪检测荧光强度的几何均值(Geo Mean)计算结果,进行各组比较分析。
1.8 细胞分泌IL-1β和IL-6检测
细胞接种、实验分组、照射剂量以及ZPE浓度同1.7细胞凋亡检测,分别于照射后24 h和48 h收集细胞培养上清液。按ELISA检测试剂盒说明书步骤操作。IL-1β和IL-6以浓度(pg/mL)计算结果,进行各组比较分析。
1.9 Western blot检测蛋白表达
细胞接种、实验分组、照射剂量以及ZPE浓度同1.7细胞凋亡检测,照射后24 h收获细胞。提取细胞总蛋白40 μg进行聚丙烯酰胺凝胶电泳及转膜。5%BSA封闭液封闭1 h,一抗(兔抗人p38、磷酸化p38、JNK、磷酸化JNK)1∶1 000稀释,4 ℃孵育过夜;二抗(辣根酶标记山羊抗兔)1∶5 000 稀释,常温孵育1 h。分别用β-actin(1∶3 000 稀释)和GAPDH(1∶40 000稀释)抗体作为内参照。经化学发光液孵育,Bio-Rad ChemiDoc XRS+化学发光成像系统显影拍照,图片采用Image J图像处理软件进行灰度分析。
1.10 统计学方法
所有计量资料均采用平均数±标准差表示,采用SPSS 19.0统计软件对数据进行统计分析。所有数据均进行方差齐性检验:方差齐,多组数据比较采用单因素方差分析,两组数据比较采用q检验;方差不齐,采用秩和检验。p<0.05时认为差异有统计学意义。
2 结果
2.1 60Co γ射线照射对HaCaT细胞存活率的影响
检测不同剂量(0、2、4、6、8、10、15 Gy)γ射线照射后24~96 h,HaCaT细胞的存活情况示于图1。图1结果显示,随着受照剂量的增加以及受照后时间的延长,细胞的存活率显著降低(p=2.3×10-6~5.2×10-3),在受照后72 h和96 h,细胞的剂量效应梯度明显。细胞经8.0 Gy照射后72 h的存活率为50%,为HaCaT细胞的半数致死剂量。因此,选择8.0 Gy和72 h作为后续ZPE抗辐射作用浓度筛选实验的照射剂量点和照射后检测时间点。
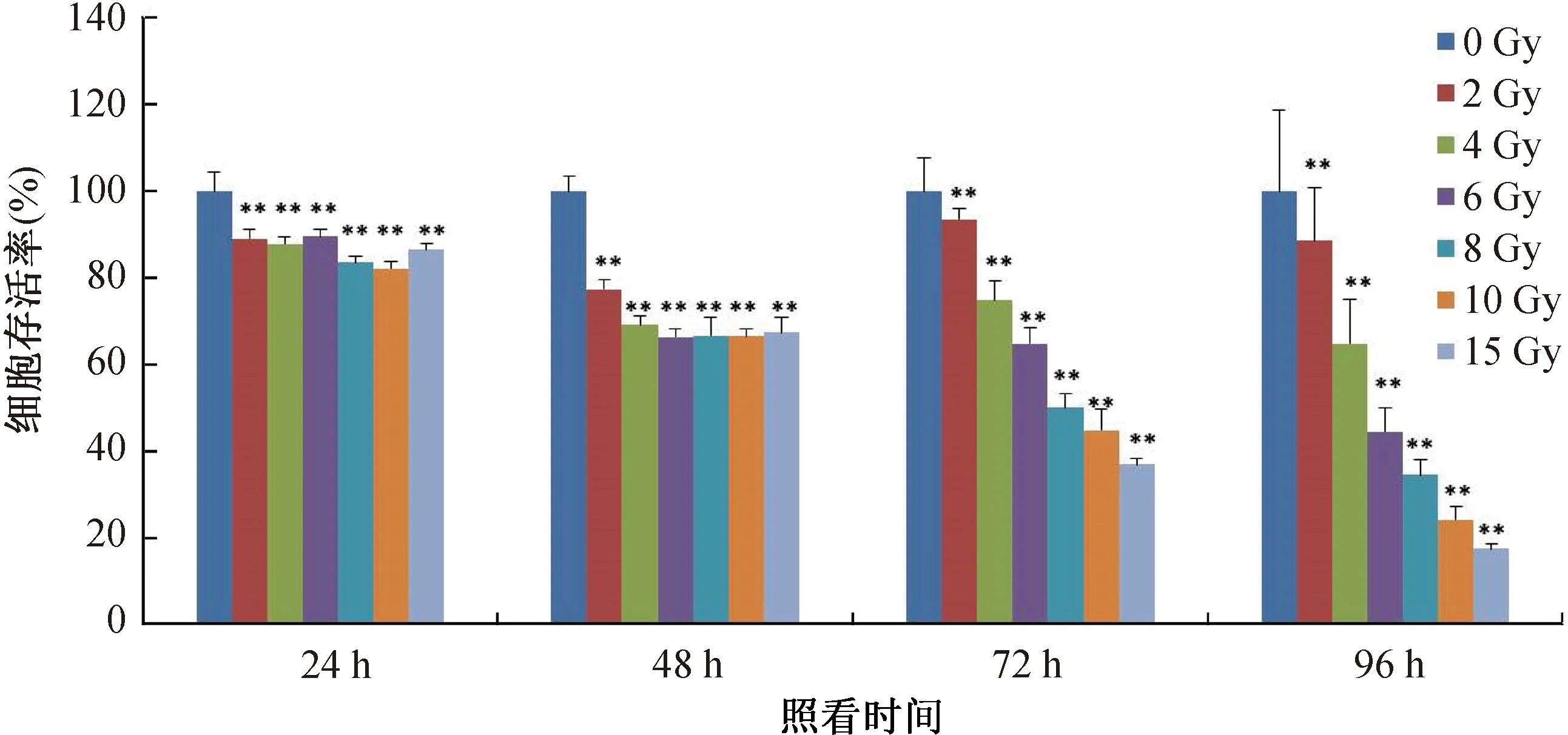
**与空白对照组比较,p<0.01。
2.2 ZPE对60Co γ射线照射后HaCaT细胞存活的影响
不同浓度的ZPE对4 mg/mL 细胞的细胞毒性结果如图2所示。由图2可见,1 mg/mL 和2 mg/mL ZPE作用后72 h,细胞的存活率略有增高(104%和105%,p=0.035和p=0.007),当药物浓度达到4 mg/mL时,与空白组比较,细胞的存活率为53%,细胞存活显著降低(p=5.4×10-5),说明4 mg/mL ZPE对HaCaT具有细胞毒性。
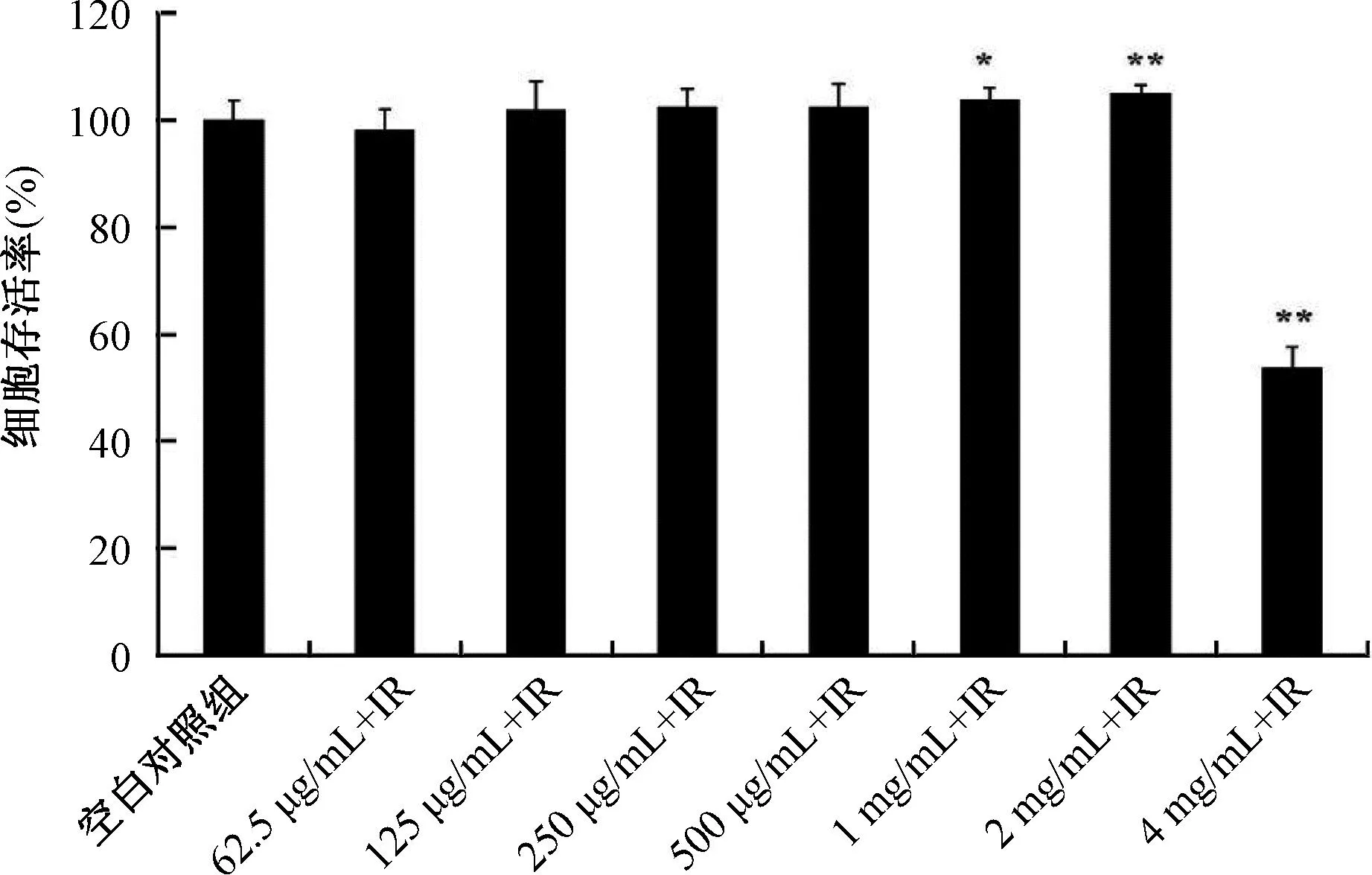
*与空白对照组比较,p<0.05; **与空白对照组比较,p<0.01。
HaCaT细胞照射前经不同浓度ZPE(0、62.5 μg/mL、125 μg/mL、250 μg/mL、500 μg/mL、1 mg/mL、2 mg/mL、4 mg/mL)处理后,再进行8.0 Gy γ射线照射。结果显示,ZPE对HaCaT细胞具有明显的辐射防护作用,且药物在0~2 mg/mL浓度范围内,与细胞的存活率具有良好的浓度-效应关系,即随着浓度升高,细胞存活率逐渐增加(见图3,p=1.2×10-4~9.2×10-3)。在药物浓度为2 mg/mL时,受照细胞的存活率达到79%,显著降低了细胞的辐射损伤。
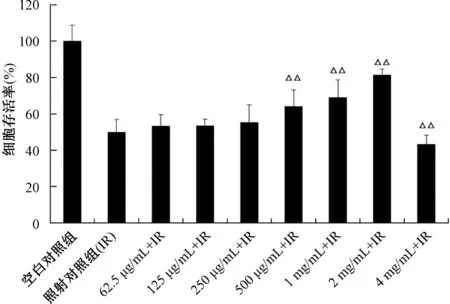
△△与照射对照组比较,p<0.01。
HaCaT细胞经8.0 Gy γ射线照射72 h后,细胞存活率降低50%。与相应浓度ZPE预处理组未受照细胞相比,62.5 μg/mL ~ 1 mg/mL预处理组受照细胞存活率降低幅度仍达40%~49%,而2 mg/mL ZPE预处理组受照细胞的存活率仅降低26%,4 mg/mL ZPE预处理组受照细胞的存活率仅降低11%,但该浓度ZPE对HaCaT具有细胞毒性。因此,选择2 mg/mL的ZPE作为后续的实验药物浓度。
2.3 ZPE对60Co γ射线照射后HaCaT细胞克隆形成的影响
图4为ZPE对60Co γ射线照射后HaCaT细胞克隆形成的影响结果。由图4可见,细胞经4.0 Gy的γ射线照射后,细胞克隆数显著降低,照射(IR)组细胞存活分数仅为9.58%;经ZPE作用后,细胞存活分数为26.50%,与IR组比较显著升高(p=0.006)。
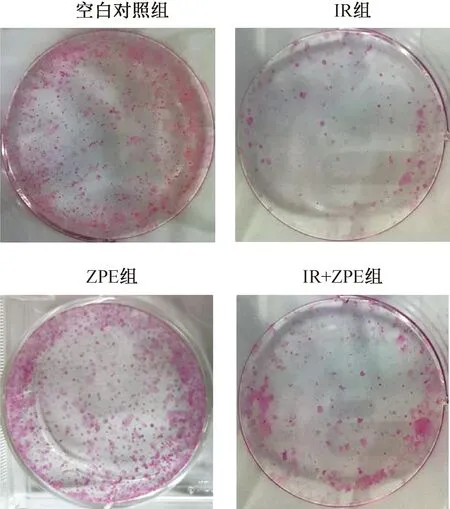
图4 ZPE对γ射线照射后HaCaT细胞克隆形成的影响
2.4 ZPE对60Co γ射线照射后HaCaT细胞凋亡和坏死的影响
图5和表1分别给出了ZPE对60Co γ射线照射后HaCaT细胞凋亡和坏死的影响结果。如图5和表1所示,HaCaT细胞经8.0 Gy γ射线照射后24 h和48 h,细胞凋亡率分别为14.98%和19.99%,显著高于空白对照组(p=0.001,p=3.2×10-4);照射前1 h给予2 mg/mL ZPE后,细胞凋亡率和坏死率均显著降低(p=7.5×10-4~2.1×10-3)。以上结果表明,ZPE预处理减少了受照细胞的凋亡和坏死。
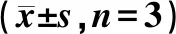
表1 ZPE对受照HaCaT细胞的凋亡率和坏死率的影响
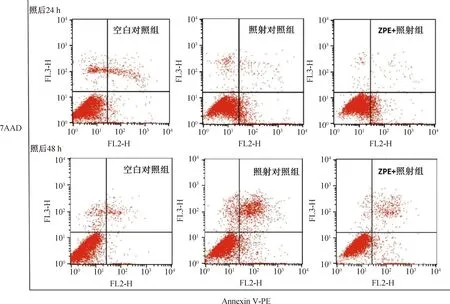
图5 ZPE对受照HaCaT细胞凋亡和坏死的影响(流式细胞仪散点图)
2.5 ZPE对60Co γ射线照射后HaCaT细胞内ROS水平的影响
流式细胞术检测受照后24 h和48 h HaCaT细胞内ROS水平,结果如图6所示。由图6可见,受照HaCaT细胞内ROS荧光强度显著增加(与空白组比较,p=6.3×10-4,p=2.3×10-4);在2 mg/mL ZPE的作用下,细胞内ROS荧光强度显著降低(与照射组比较,p=0.001),且与空白对照组水平相近,其差异无统计学意义(p=0.133,p=0.125)。

**与空白对照组比较,p<0.01;△△与照射对照组比较,p<0.01。
2.6 ZPE对60Co γ射线照射后HaCaT细胞分泌IL-1β和IL-6的影响
表2为ZPE对γ射线照射后HaCaT细胞分泌IL-1β和IL-6的影响结果。由表2可见,照射后24 h和48 h细胞培养液中IL-1β和IL-6的浓度均显著升高(p=5.2×10-6~2.3 ×10-4)。照后48 h,2 mg/mL ZPE预处理组的细胞培养液中IL-1β和IL-6的浓度均显著降低(p=0.001);其中,ZPE组与空白对照组的相比,细胞培养液中IL-6的浓度水平无统计学差异(p=0.241)。表明ZPE干预可显著抑制受照细胞内炎症因子IL-1β和IL-6的分泌。
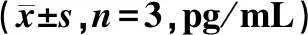
表2 ZPE对γ射线照射后HaCaT细胞分泌IL-1β和IL-6的影响
2.7 ZPE对60Co γ射线照射后HaCaT细胞内p38和JNK蛋白表达水平的影响
p38和JNK蛋白同属应激激活的蛋白激酶,其磷酸化会影响细胞生长、周期和凋亡等细胞过程,并参与炎症、应激反应的调控,图7给出了 ZPE对60Co γ射线照射后HaCaT细胞内p38和JNK蛋白表达水平的影响结果。如图7所示,HaCaT细胞经8.0 Gy γ射线照射后,p38和JNK蛋白磷酸化水平显著上升(p=2.6×10-4,p=5.5×10-4);细胞受照前经2 mg/mL ZPE作用后,二者蛋白磷酸化水平明显降低(p=4.2×10-4,p=0.021)。表明ZPE可能通过调节p38和JNK蛋白磷酸化水平,减轻γ射线照射引起的HaCaT细胞凋亡。

**与空白对照组比较,p<0.01;△与照射对照组比较,p<0.05;△△与照射对照组比较,p<0.01。
3 讨论
中医认为放射性皮炎的发生机制为热毒侵肤、脉络阻滞,从发病机制入手采用凉血解毒、清热燥湿、祛腐生肌类的中药制剂进行整体辨证治疗[9]。川陕花椒不仅具有温中止痛、散寒除湿、止痒杀虫的功效,在化妆品中作为植物原料,可促进皮肤新陈代谢,具有抗皱、抗氧化等作用。有文献报道,花椒树皮提取物及其活性成分可以抑制紫外线UVB诱导的炎症因子和MMP的表达,进而抵抗皮肤老化,可用作防晒霜的活性成分[10]。本文研究显示,8.0 Gy γ射线照射可对人角质形成细胞产生较严重的辐射损伤,照后24 h和48 h大量细胞发生凋亡和坏死,照后72 h细胞的存活率降低至50%。细胞在照射前经川陕花椒根皮提取物(ZPE)作用后,不仅减少了细胞凋亡和坏死,也大幅提升了HaCaT细胞的存活率,表明川陕花椒根皮对辐射引起的人角质形成细胞损伤具有预防作用,这可能与花椒中富含酰胺、生物碱、黄酮等抗辐射活性成分有关[7,10]。同时,细胞平板克隆实验表明,在照射剂量为4.0 Gy的条件下,ZPE组细胞的增殖情况显著高于照射组,也佐证了ZPE对HaCaT细胞的辐射防护作用。
抑制ROS的产生是中药作用于机体抗辐射的主要途径之一[11]。人体受到射线照射后会产生大量的活性氧自由基(ROS),ROS会诱导细胞发生脂质过氧化连锁反应,损伤核酸、蛋白质等生物大分子和糖脂类等生物小分子[12],进而导致细胞凋亡,抑制细胞增殖等而产生皮肤损伤,从而引发一系列炎症[13]。本文的研究结果显示,γ射线照射会显著升高HaCaT细胞内的ROS水平;在照射前经川陕花椒提取物ZPE预处理后,可清除辐射产生的ROS,减少辐射诱导的HaCaT细胞氧化损伤。
放射性皮肤损伤以炎性反应为主。早期炎性反应主要是由促炎细胞因子如IL-1、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α、趋化因子如IL-8、酪氨酸激酶受体和粘附分子ICAM-1、VCAM、E-选择蛋白等引起[14]。表皮是皮肤组织的最外层,其中角质形成细胞(keratinocytes,KC)含量最为丰富,占表皮细胞90%以上,KC可通过释放细胞因子间接地影响机体免疫功能。IL-1β和IL-6是KC分泌的重要细胞因子,皮肤组织液中的IL-1β和IL-6主要来自KC。因此,本研究对HaCaT细胞培养液中IL-1β和IL-6的分泌水平进行研究,结果发现,HaCaT细胞经8.0 Gy γ射线照射后24 h和48 h,细胞培养液中IL-1β和IL-6浓度显著升高;受照前经ZPE作用的HaCaT细胞分泌IL-1β和IL-6的水平均显著降低,提示ZPE可能通过抑制受照人角质形成细胞内炎症因子IL-1β和IL-6的分泌减轻放射性皮肤损伤。
MAPK级联是细胞内重要的信号转导系统之一,MAPK信号通路中的JNK和p38主要对炎性因子和多种类型的细胞应激信号进行传导,与细胞的炎症反应密切相关[15]。根据文献报道花椒属植物及其活性物质在一些炎症疾病中,药物作用与下调MAPK(JNK、ERK 和 p38)信号通路磷酸化密切相关[16-17]。本研究发现,HaCaT细胞在受照后24 h,照射组p38与JNK蛋白磷酸化水平明显升高,经过预防给予ZPE后,受照细胞的p38和JNK磷酸化水平则显著降低。有文献报道[18],皮肤炎症性疾病的炎症反应可通过MAPK信号通路进行调控,促进细胞炎症因子如IL-1β、IL-6和IL-8的释放。这与本研究中受照细胞的培养液内IL-1β、IL-6的浓度检测结果相一致,即电离辐射激活MAPK信号通路,促进炎症反应发生;ZPE可通过降低JNK和p38蛋白磷酸化水平,减少IL-1β、IL-6等炎性因子的分泌,从而减轻皮肤炎症反应。
综上所述,本文初步探索了ZPE对HaCaT细胞辐射损伤的防护作用,其机制与减少细胞炎症因子IL-1β和IL-6分泌、降低细胞内ROS水平、降低p38和JNK蛋白磷酸化有关。但川陕花椒的化学成分研究报道很少,关于其活性物质基础还需要进一步的探索挖掘,为研究预防和治疗放射性皮炎的药物提供依据。

