旱作果园土壤促生菌的筛选与鉴定
王琦 王媛媛 李阳 李夏媛 田鑫 武艳霞 史高川


收稿日期:2023-07-20中文收稿日期
基金项目:国家重点研发计划(2021YFD1901105);山西省科技重大专项计划“揭榜挂帅”(202101140601026);山西省基础研究计划项目(202203021212445);山西农业大学博士人才引进科研启动项目(2022BQ15);山西省博士毕业生、博士后研究人员来晋工作奖励经费科研项目(SKBYKY2022085)。
第一作者简介:王 琦(1990-),女,助理研究员,主要从事果园地力提升及微生物群落结构研究工作。电话:13070126381;E-mail:wq210509@sxau.edu.cn
*通信作者:史高川(1976-),男,副研究员,主要从事梨果栽培及有害生物防控的研究。
摘 要:【目的】为促进旱作果园有机培肥过程中土壤养分高效利用。【方法】通过实验室平板培养和高通量测序等方法,对有机果园根际土壤微生物进行筛选。【结果】结果表明,果园土壤微生物的最适筛选浓度为10-2和10-3,在所得菌株中经鉴定,热羧基链霉菌和枯草芽孢杆菌这两株同时具有纤维素分解、固氮、解磷和解钾等功能。【结论】热羧基链霉菌和枯草芽孢杆菌能激发旱作果园的培肥效果。
关键词:菌剂;培肥;果园;有机旱作;土壤养分
文章编号:2096-8108(2023)06-0034-04 中图分类号:S606+.1中图分类号 文献标识码:A文献标志码
Screening and Identification the Growth-promoting Bacteria in Upland Orchard Soil
WANG Qi1,WANG Yuanyuan2,LI Yang1,LI Xiayuan1,TIAN Xin1,WU Yanxia1,SHI Gaochuan1*
(1.Pomology Institute, Shanxi Agricultural University, Taiyuan Shanxi 030031,China;
2.Shennong Seed Industry(Shanxi)Co., Ltd,Taiyuan Shanxi 030012,China)
Abstract:【Objective】 To promote the efficient utilization of soil nutrients in the process of organic fertilization in dry orchards. 【Methods】 The soil microorganisms in the rhizosphere of organic orchards were screened by laboratory plate culture and high-throughput sequencing. 【Results】 The results showed that the optimal screening concentrations of soil microorganisms in orchards were 10-2 and 10-3, and the two strains of Streptomyces thermocarboxydusand Bacillus subtilis were identified as having the functions of cellulose decomposition, nitrogen fixation, phosphorus and potassium removal. 【Conclusion】Streptomyces thermocarboxydus and Bacillus subtilis can stimulate the fertilization effect of dry orchards.
Keywords:fungicide; fertilizer; orchard; organic dry farming; soil nutrient
在干旱条件下,长期施用化肥造成果园土壤质量变差、肥力降低,有益微生物多样性低、群落结构差,直接导致果树产量低、果品品质差,制约着果园的可持续发展。隨着人们环保意识和对绿色农业发展的重视,有益微生物特别是植物促生菌(plant growth-promoting bacteria,PGPB)的应用被认为是提高农业生产率、改善土壤及环境健康的有效措施[1]。然而,在山西干旱的背景下,通过添加植物促生菌改善有机农业生产过程中土壤养分循环利用、果树养分高效利用的研究缺乏系统性。基于此,本文对果园促生菌种的筛选与鉴定展开研究。
植物促生菌可通过固氮、解磷解钾等直接或间接促进植物生长及发育,从而抵御植物受到干旱胁迫而引发的生长限制[2-3]。此外,促生菌还可改善土壤微生物群落结构,进而促进植物的生长发育[4-5]。有研究表明,荧光假单胞菌(Pseudomonas fluorescens)可通过固氮作用,促进小麦[6](Triticum aestivum)等作物的生长发育。此外,接种嗜根链霉菌(Streptomyces rhizophilus)、球形芽孢杆菌(Bacillus sphaericus)和解淀粉芽孢杆菌后,通过氨化作用促进土壤中有机氮转化为无机氮,从而提高油菜(Brassica napus)中总氮含量[7]。同样的,胶质芽孢杆菌和巨大芽孢杆菌则能促进蔬菜等对钾的吸收利用,在提高作物产量和品质的同时,缓解了植物所受盐渍化的胁迫[8]。因此,筛选土壤中的植物促生菌能够有效增加植物对养分的利用效率,改善有机培肥果园中土壤养分供需不匹配的状况。
鉴于此,本研究从果树根际促生菌入手,通过筛选山西旱区有机培肥果园中具有促生功能的微生物,然后对其不同促生功能进行测定与验证,同时对不同菌株的形态和分子学水平进行鉴定,为进一步研制旱作果园田间促生菌剂提供微生物材料。
1 材料与方法
1.1 试验材料
试验用土壤样品采集于山西农业大学果树研究所核桃园、梨园和樱桃园中,共计5个土壤样品,其中有机培肥果园3个,分别为核桃园(SM1)、梨园(SM2)和樱桃园(SM3);常规施肥果园2个,分别为核桃园(EM1)、梨园(EM2)。供试土壤于2022年5月20日采集于不同果园,土壤采集后立即装入自封袋,液氮保存并迅速转移至实验室,保存于-30℃冰箱用于后续微生物分离。
1.2 试验方法
分别采用牛肉膏蛋白胨琼脂培养基、马丁培养基和高氏Ⅰ号培养基对土壤中细菌、真菌和放线菌进行微生物最佳浓度确定及筛选。然后利用纤维素分解培养基对纤维素分解菌进行分离、纯化,并通过阿须贝无氮培养基、亚历山大硅酸盐培养基、NBRIP(溶解无机磷)和NBRIPY(溶解有机磷)培养基对分离所得菌株的养分活化能力进行进一步验证[9]。并通过高通量测序对目标菌株进行菌种鉴定(委托上海派森诺生物科技有限公司测定),并利用显微镜对菌落结构进行镜检。
1.3 数据处理
数据整理及统计分离使用Excel 2019和Minitab 18.0进行分析处理。纤维素分解能力(R)等于菌落透明圈直径(D,cm)除以菌落直径(d,cm),
即R=Dd。
2 结果与分析
2.1 土壤微生物最佳筛选浓度
通过对不同果园土壤中细菌、真菌和放线菌的培养最佳土壤浸提液稀释浓度筛选发现(见表1),施用有机肥之后,土壤微生物丰富度提高,显著提高了土壤中可培养细菌和真菌的数量。其中,对土壤中可培养微生物筛选的土壤浸提液浓度可低至10-7。有机培肥果园土壤中细菌的最佳筛选浓度为10-6和10-7,真菌的最佳筛选浓度为10-4和10-5。有机培肥对土壤中可培养放线菌的数量影响不显著。
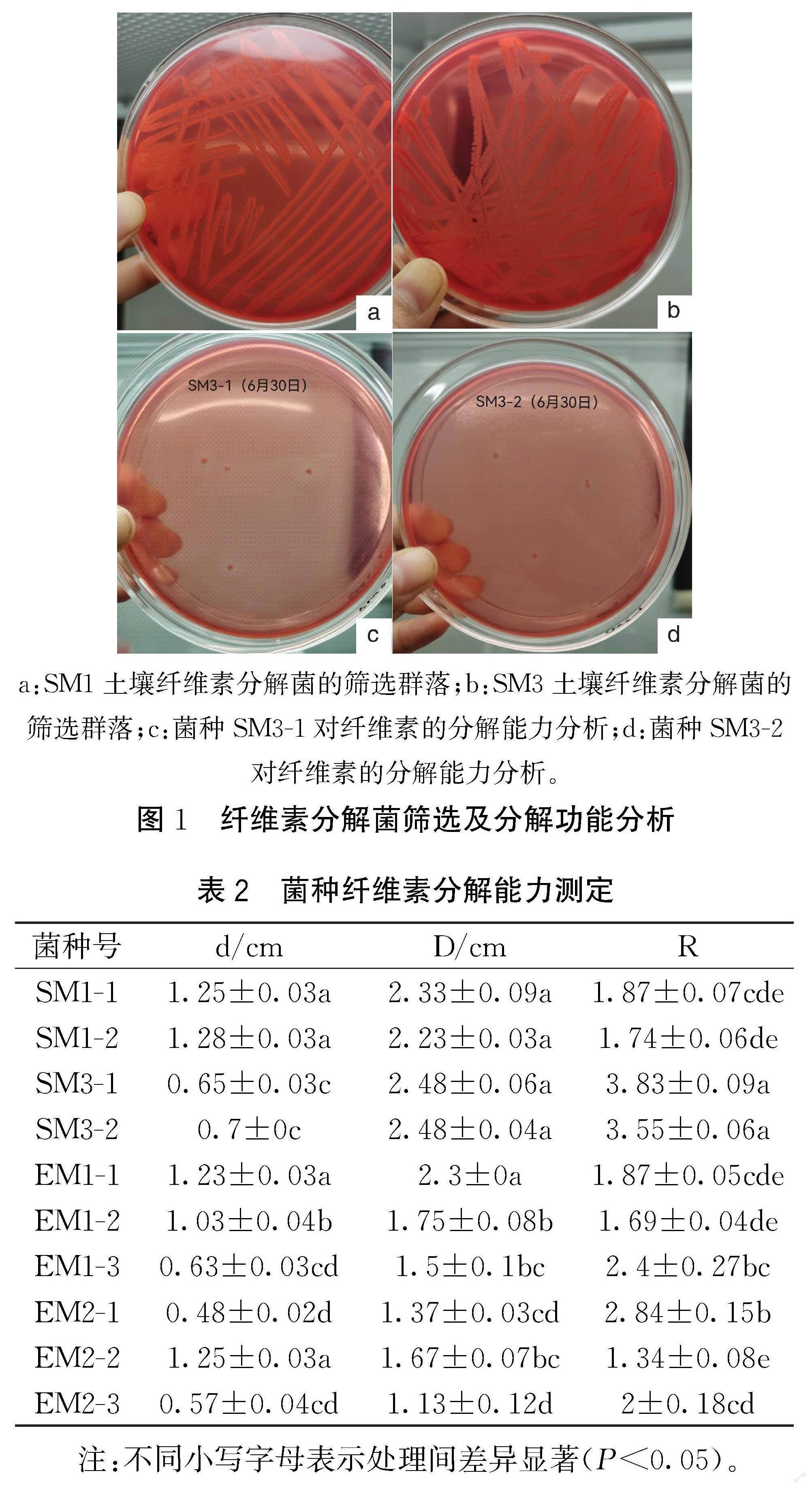
2.2 果园土壤纤维素分解菌的筛选
以土壤悬浊液10-3浓度浸提液对纤维素分解菌进行筛选(见图1),通过筛选初步获得10余株具有纤维素分解能力的菌株。通过对各菌株纤维素分解能力进行测定(见表2),结果表明SM3-1和SM3-2两菌株的纤维素分解能力最强,显著高于其他菌株的分解能力,分别为3.83和3.55;其次为EM2-1、EM1-1和SM1-2,对纤维素的分解能力分别为2.43、2.33和2.06。
a:SM1土壤纤维素分解菌的筛选群落;b:SM3土壤纤维素分解菌的筛选群落;c:菌种SM3-1对纤维素的分解能力分析;d:菌种SM3-2对纤维素的分解能力分析。
2.3 菌种的土壤养分活化能力鉴定
为进一步验证各菌株的其他养分分解功能,通过固氮、无机磷溶解、有机磷溶解和解钾培养基对已筛得菌株的进行平板培养。结果表明(见表3),菌株SM1-1、SM1-2和EM2-2在无氮培养基上的生长势显著强于其他菌株,其具有较强的固氮能力。对于菌株对无机磷的溶解能力,则表现为除EM1-2、EM2-1和EM2-3之外,其他菌株的溶解无机磷能力均较强。而筛选出的菌株对有机磷的溶解能力均较强,其中EM2-3的溶解能力最弱。对于解钾能力,菌株SM1-1、SM1-2、EM1-1、EM1-3和EM2-2的溶解能力较强,其他菌株的溶解能力均较为微弱。综上可知,菌株SM1-1和SM1-2能够有效溶解土壤中难溶性的养分,同时具有较强的固氮能力,是果园中优质的促生菌株。
2.4 优势菌种的生物鉴定及形态观察
通过革兰氏染色法对SM1-1和SM1-2进行显微镜观察(见图2),结果表明,SM1-1和SM1-2均为革兰氏阳性菌,且均呈现杆状。为了进一步判定菌种的种属,通过高通量测序后对菌种的DNA序列进行比对,结果表明SM1-1属于热羧基链霉菌属(Streptomyces thermocarboxydus),SM1-2属于枯草芽孢杆菌属(Bacillus subtilis)。
3 讨论及结论
自由生活在植物根部或植物体内的一系列能够促进植物生长发育的有益微生物为植物促生菌[10]。因此,选择果园根际土壤进行植物促生菌的提取是可取的。通过对不同果园根际土壤微生物进行室内培养,结果发现,不同处理条件对果园根际土壤可培养微生物的数量及培养的稀释浓度不尽相同。有机培肥能够增加土壤中微生物的丰富度,但是减少了可培养微生物的数量,因此,有机培肥果园根际土壤的可培养微生物最佳筛选浓度为10-2、10-3。
在旱作条件下,增施有机肥、果园生草覆盖或秸秆还田等措施能有效提高土壤有机质含量,增加土壤中养分的储蓄[11],改善土壤蓄水能力[12]。但是,生草覆盖或秸秆还田后,在旱作条件下纤维素、半纤维素和木质素等的降解缓慢,是造成有机培肥后旱作土壤养分提高减慢的主要原因[13-14],而纤维素分解菌则能有效促进纤维素的分解与养分的释放。因此,本研究从纤维素分解菌的分离纯化入手,分别从5个处理的土壤中筛选出10株具有纤维素分解能力的菌体。而纤维素分解菌在纤维素培养基上产生水解圈的大小可以代表纤维素分解菌的分解能力,进一步通过分解圈的测定发现,SM3-1和SM3-2菌株的纤维素分解能力最佳,分别为3.83和3.55。
在旱作条件的果园中,土壤养分的匮乏同样是制约果树产量与果实品质的重要因素[15]。因而,具有固氮、解磷解鉀能力的菌株在有机培肥果园中则能发挥出更大的养分提升作用。通过进一步对筛得菌株固氮、解磷和解钾功能的分析,发现菌株SM1-2和SM1-1不仅具有纤维素分解能力,且同时具有良好的固氮、解磷和解钾功能。因而,SM1-1和SM1-2是旱作果园有机培肥过程中友好的菌株。通过显微镜观察发现,SM1-1和SM1-2均为革兰氏阳性菌,进而通过高通量测序鉴定两菌分别为热羧基链霉菌和枯草芽孢杆菌。
通过本试验得到两株适合山西旱区果园有机培肥过程中,既能高效分解还田的纤维素物质,同时能够起到固氮、溶解土壤及有机肥中固定态无机磷、有机磷和钾元素的菌株。本研究结果为山西有机旱作果园发展提供了微生物菌剂研发的原材料,能够促进旱作条件下有机果园的高效利用。
中文致谢
参考文献
[1] 马莹,曹梦圆,石孝均,等.植物促生菌的功能及在可持续农业中的应用[J/OL].土壤学报:1-15.[2023-03-07].http://kns.cnki.net/kcms/detail/32.1119.P.20221111.1234.004.html.
[2] MA Y, DIAS M C, FREITAS H. Drought and Salinity Stress Responses and Microbe-Induced Tolerance in Plants[J]. Frontiers in Plant Science, 2020, 11.
[3] ORTZ-CASTRO R, CONTRERAS-CORNEJO H A, MACAS-RODRGUEZ L,et al. The role of microbial signals in plant growth and development[J]. Plant Signaling and Behavior, 2009, 4(8): 701-712.
[4] ZAHIR Z A, ARSHAD M, FRANKENBERGER W T. Plant Growth Promoting Rhizobacteria: Applications and Perspectives In Agriculture[J]. Advances in Agronomy, 2003, 81(3): 97-168.
[5] VERHAGEN B W M, TROTEL-AZIZ P, COUDERCHET M,et al. Pseudomonas spp.-induced systemic resistance to Botrytis cinerea is associated with induction and priming of defence responses in grapevine[J]. Journal of Experimental Botany, 2010, 61(1): 249-260.
[6] NAWAZ A, SHAHBAZ M, ASADULLAH M,et al. Potential of Salt Tolerant PGPR in Growth and Yield Augmentation of Wheat (Triticum aestivum L.) Under Saline Conditions[J]. Frontiers in Microbiology, 2020, 11: 1-12.
[7] LIU Y, GAO J, BAI Z,et al. Unraveling mechanisms and impact of microbial recruitment on oilseed rape (Brassica napus l.) and the rhizosphere mediated by plant growth-promoting rhizobacteria[J]. Microorganisms, 2021, 9(1): 1-21.
[8] 耿麗平, 范俊, 王婧瑶,等. 解磷、钾功能性微生物耐盐效应研究[J]. 水土保持学报, 2020, 34(4): 370-375.
[9] 胡秀娜. 苹果根际促生菌的筛选鉴定及苹果砧木平邑甜茶的促生效果[D]. 山东,泰安, 中国: 山东农业大学, 2016.
[10] HASHEM A, TABASSUM B, FATHI ABD_ALLAH E. Bacillus subtilis: A plant-growth promoting rhizobacterium that also impacts biotic stress[J]. Saudi Journal of Biological Sciences, King Saud University, 2019, 26(6): 1291-1297.
[11] XIONG Y, ZHENG L, SHEN R,et al. Effects of Nitrogen Deficiency on Microbial Community Structure in Rhizosphere Soil of Wheat[J]. Acta Pedologica Sinica, 2022, 59(1): 218-230.
[12] 杨东, 魁永红, 张东勇. 甘肃省临夏太子山林区土壤化学性质与生化活性的相关性研究[J]. 西北师范大学学报, 2003, 39(3): 68-72.
[13] 陈阿娜, 汤斌. 一种改进的纤维素分解菌鉴别培养基[J]. 生物学杂志, 2006, 23(6): 48-49.
[14] 李昊. 固氮菌和纤维素分解菌的分离及混合添加对瘤胃发酵的影响[D]. 东北农业大学, 2013.
[15] 冯敬涛, 于天武, 吴晓娴,等. 微生物菌肥对苹果土壤理化特性及养分吸收的影响[J]. 北方园艺, 2021(2): 97-102.

