牛支原体的分离培养与分子生物学鉴定
胡 茜, 赵 超, 王永璇, 罗小芬, 冉芳菲, 成虹松, 朱二鹏,2, 牟真权, 程振涛,2*
(1. 贵州大学动物科学学院,贵州 贵阳 550025;2. 贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025;3. 德江县平原镇农业服务中心畜牧站,贵州 德江 565200)
牛支原体属于原核生物,兼性厌氧,无细胞壁,体外培养周期较长,且对营养条件的要求较高,条件适宜时可观察到“煎蛋”样菌落[1,2]。牛支原体感染可引起以肺炎为主的临床症状,导致关节、结膜、乳腺、耳道等多处发生炎症,并能诱发妊娠母牛流产[3]。此外,牛支原体攻击机体的免疫系统,增加继发感染其他病原的概率[4]。2008年,我国首次从病牛肺脏中分离出牛支原体,此后牛支原体病在我国多个地区陆续有报道,并严重损害养牛业的发展[5]。牛感染呼吸道疾病的病原复杂多样,牛支原体是其中常见且危害较大的1种,快速鉴定诊断此病并采取相应防治措施对于控制其流行和发展具有重要意义。在鉴别牛支原体的方法中,普通PCR和实时荧光定量PCR作为检测效率较高的技术而常用于实验室诊断[6]。2022年10月,贵州省平坝区某牛场出现发热、气喘病例,剖检病死牛见肺脏有干酪样病灶,疑似支原体感染。为确诊其发病原因,本研究采集病死牛的肺脏组织进行实验室诊断,现将相关情况报道如下。
1 材料与方法
1.1 病料采集
无菌条件下采集病死牛的肺脏组织,4 ℃冷藏送至贵州大学预防兽医学实验室,-20 ℃保存备用。
1.2 主要试剂
改良Hayflick液体培养基:PPLO肉汤、马血清(均购自青岛海博生物技术有限公司),酵母粉(购自英国OXOID公司),氨苄西林钠(购自北京索莱宝科技有限公司),葡萄糖、乙酸钠(购自成都金山化学试剂有限公司);改良Frey氏固体培养基(购自北京中海生物有限公司),柱提法病毒DNA/RNA提取试剂盒(购自哈尔滨元亨生物药业有限公司),支原体通用型(MYCO-U)核酸检测试剂盒(荧光PCR法)(购自武汉科前生物股份有限公司),2×TaqPCR Master Mix、DL 2 000 DNA Marker(均购自大连宝生物工程有限公司);其他试剂均为国产分析纯。
1.3 主要仪器
二氧化碳培养箱(型号:BPN-150CW,上海一恒科学仪器有限公司)、生物显微镜(型号:C33,上海普赫光电科技有限公司)、高速冷冻离心机[型号:Sorvall Legend Micro 17R,赛默飞世尔科技(中国)有限公司]、荧光定量聚合酶链式反应检测系统(型号:FQD-96A,杭州博日科技股份有限公司)、基因扩增仪(型号:T20,杭州朗基科学仪器有限公司)。
1.4 病原分离培养
无菌条件下取病死牛肺脏组织加入改良Hayflick液体培养基[7],置于37 ℃摇床中培养3 d,观察到培养基颜色由红色转为黄色时,无菌条件下以相同条件传代2次。传代完成后取菌液200 μL接种于改良Frey氏固体培养基,倒置于37 ℃、5%CO2培养箱中培养3~5 d,用接种环挑取单个典型菌落接种于改良Hayflick液体培养基。重复上述操作培养纯化3次,分别于 -80 ℃甘油及冻干保存菌种。
1.5 病原实时荧光定量PCR鉴定
取培养菌液1 mL,12 000 r/min离心15 min,按照柱提法病毒DNA/RNA提取试剂盒说明书提取DNA作为模板。根据支原体通用型核酸检测试剂盒说明书,设置实时荧光定量PCR反应体系25 μL:MYCO-U反应液19 μL,混合酶液1 μL,模板5 μL。反应程序:95 ℃预变性2 min;扩增95 ℃ 15 s,60 ℃ 30 s(此阶段结束时采集荧光信号),共45个循环。判定条件:各样品达到阈值线的循环数即为Ct值,阳性对照Ct值≤32并出现特征性扩增曲线,阴性对照无特征性扩增曲线(无Ct值),以上条件同时满足则试验有效,否则视为无效。当被检样品出现特征性扩增曲线且Ct值≤40判为阳性,被检样品Ct值>40或无Ct值判为阴性。
1.6 基因测序分析
参考GenBank收录的牛支原体PG45(登录号:CP002188.1)基因序列设计牛支原体特异引物(F:5’-ATAAAAAAATCTAACAAT-3’,Tm值35.4 ℃;R:5’-TTAGTGAACAATTAACTTGGAAT-3’,Tm值46.4 ℃;预扩增片段345 bp)进行PCR扩增。PCR反应体系20 μL:上、下游引物各1 μL,模板4 μL,Mix 10 μL,ddH2O 4 μL。反应程序:95 ℃预变性3 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,共循环35次;72 ℃终延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,取阳性产物送往生工生物工程(上海)股份有限公司测序。将测序结果与GenBank中收录的10株不同支原体参考株(见表1)进行同源性比较,绘制系统进化树。
2 结果与分析
2.1 培养菌落形态
在改良Frey氏固体培养基上可见针尖大小的单个菌落,显微镜下观察呈现“煎蛋”样菌落(见图1),符合支原体培养特征。

图1 改良Frey氏固体培养基上生长的菌落形态(10×10)
2.2 实时荧光定量PCR鉴定结果
由图2可见:分离菌株Ct值为28.91,且有特征性扩增曲线,判为阳性,提示为支原体。
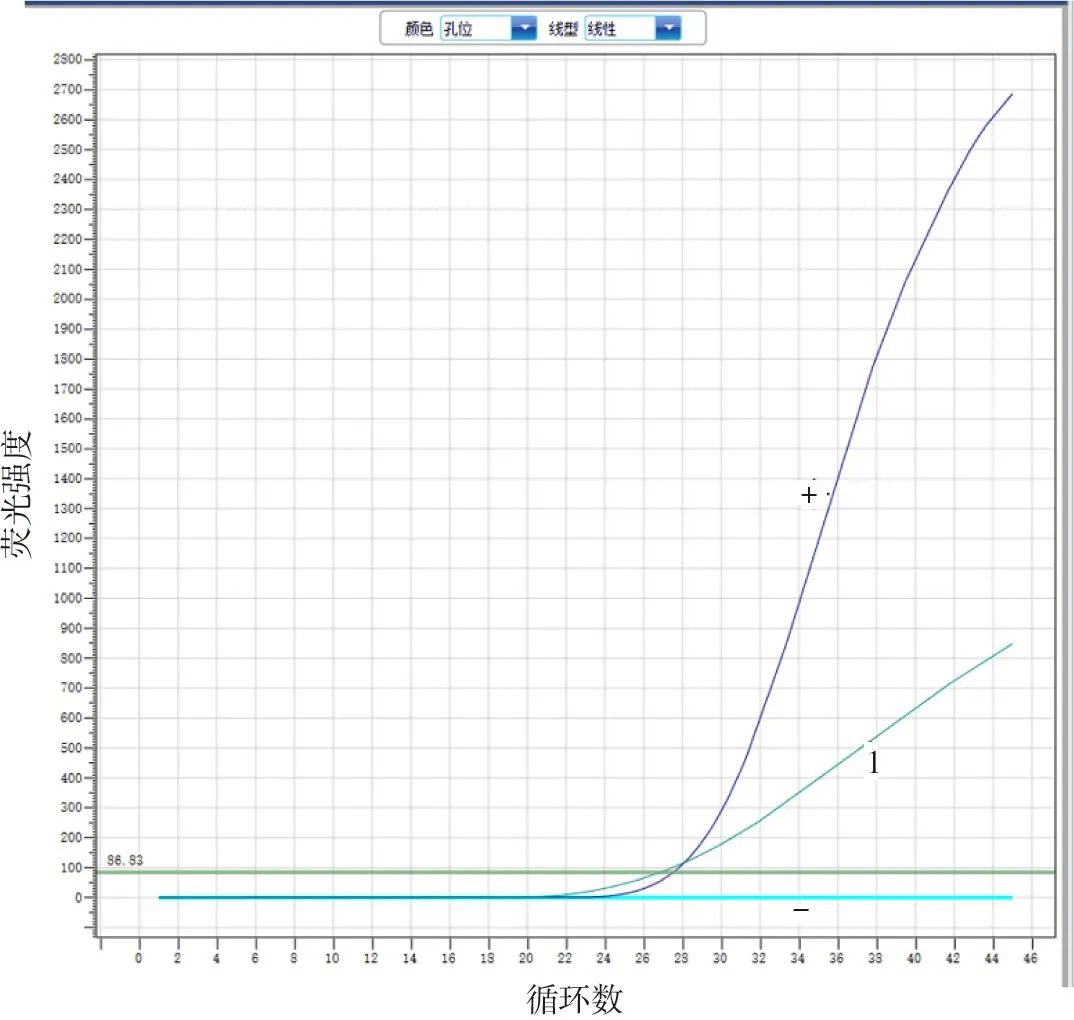
1:分离菌株;+:阳性对照;-:阴性对照图2 分离菌株实时荧光定量PCR鉴定结果
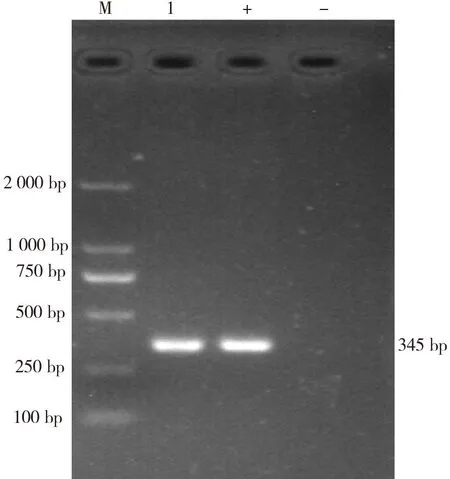
M:DL 2 000 DNA Marker;1:分离菌株;+:阳性对照;-:阴性对照图3 PCR扩增结果
2.3 基因测序结果
由图3可见:PCR扩增出与预期片段相符的345 bp目的条带,将分离菌株命名为GZ-PB1。基因序列分析结果显示,分离菌株与各牛支原体参考株的同源性均高达95.6%(见图4),且处于同一进化分支(见图5);与猪、羊、鸡支原体参考株的同源性均小于30%,并处于不同进化分支。分离菌鉴定为牛支原体。

图4 分离菌株与10株支原体的同源性比较

图5 分离菌株与10株支原体的系统进化树
3 结论
通过病原分离培养、分子生物学鉴定,诊断发病牛为牛支原体感染。
4 讨论
牛支原体病的传染源及传播方式多种多样,难以防范[8]。牛感染支原体病后生产性能下降,且易继发感染其他病原造成严重损害,因此需及时诊断并制定隔离、治疗和淘汰等措施。牛支原体的分离鉴定是常用诊断方法之一,可用于DNA提取、菌种保存、流调及分析与其他菌株的亲缘关系等,但由于牛支原体在体外培养较困难、生长周期长,因此存在一定的局限性[9,10]。普通PCR方法的检测效率、灵敏度和特异性都较高,可用于临床样本的快速检测,但其耗时较长,且可能出现假阳性[11,12]。实时荧光定量PCR的灵敏度是普通PCR的4~10倍,具有检测速度快、定量准确、灵敏度高等优点[6]。本研究通过病原分离培养初步判断病牛为支原体感染,再结合分子生物学鉴定和遗传进化分析,相互弥补各检测方法的不足,快速、准确地诊断出本次感染病原为牛支原体。

