山柰酚对溴氰菊酯诱导卤虫氧化应激的保护作用
马丹丹,隋丽英,周庆礼,郭庆彬,潘娜敏,李贞景
(1.天津科技大学食品科学与工程学院,天津 300457;2.天津科技大学海洋与环境学院,天津 300457)
我国是世界上从事水产养殖历史最悠久的国家之一。近年来,随着越来越多的消费者对海鲜等水产制品的喜爱,水产养殖业发展迅速,已经成为我国经济发展的主要产业之一。然而,目前水产养殖动物发病率和死亡率不断升高,导致水产品质量下降,影响水产养殖业的健康发展。2020 年安徽省水产养殖动物因疫病死亡而带来的经济损失约为4.18 亿元人民币,动物平均发病率为 7.59% ,平均死亡率为4.85%[1]。随着农药施用量的增加,生态环境监测机构多次从水生动物养殖水体中检测到农药残留,样品中农药检出率高达 55.36% ,其中溴氰菊酯(deltamethrin,DEL)的检出率为14.41%[2]。溴氰菊酯的化学式为C22H19Br2NO3,是一种Ⅱ型拟除虫菊酯杀虫剂,被广泛用于农作物等生物靶向防虫除害和水产养殖动物寄生虫防治[3-4]。然而,随着溴氰菊酯的广泛使用,该物质很可能通过地表径流和生活废水流入河流和湖泊。在珠江河口、福建近海和渤海湾近海沉积物中检测到DEL 的残留浓度为10~100 μg/L,已超过欧盟推荐标准[5]。溴氰菊酯疏水性较强,且在水生生物体内的代谢和排泄能力较弱,极易导致水生动物中毒死亡[6]。目前,溴氰菊酯的生态毒性已经在鱼、虾、蟹等不同种类的水生动物身上得到了研究,溴氰菊酯暴露能显著引起中华绒螯蟹(Eriocheir sinensis) 、斑 马 鱼(Danio rerio) 、尼 罗 罗 非 鱼(Oreochromis niloticus)等水生生物产生组织损伤、代谢紊乱、免疫毒性和细胞凋亡[7],导致生物体内丙二醛(MDA)和活性氧(ROS)水平显著升高,以及超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)的活性降低[8-10]。抗氧化剂如姜黄素、槲皮素和苋籽提取物在小鼠[11]、翠澧(Channa punctata)[12]和乌澧(Channa argus)[13]等动物中对溴氰菊酯诱导的氧化应激和神经毒性具有明显的改善作用。这说明抗氧化剂是用于缓解溴氰菊酯诱导的氧化应激和不良影响的潜在治疗剂。
山柰酚(kaempferol,Ka)是一种天然多酚类黄酮,主要以山柰酚苷的形式广泛存在于西兰花、茶叶、豆类和草莓中[14],具有抗氧化、抗癌、抗炎和神经保护的作用[15-16]。山柰酚能够降低油酸诱导的HepG2 细胞的脂质堆积和氧化应激[17]。山柰酚通过调控Nrf2/HO-1 信号通路改善由H2O2和百草枯暴露血管损伤小鼠的氧化应激和炎症反应[18]。但是,关于山柰酚对水生生物氧化应激改善作用的研究较少。
水生甲壳类动物对溴氰菊酯的毒性也非常敏感[8]。卤虫是一种小型、低等的甲壳动物,广泛分布于盐田和咸水湖泊,是水产经济动物苗种的重要开口饵料[19]。卤虫因其生命周期短、后代产量大、对污染物高度敏感等特点,成为水生生态毒理学研究中常用的实验动物[20]。本研究以卤虫为研究对象,评估山柰酚对溴氰菊酯诱导卤虫抗氧化能力的影响,旨在进一步为黄酮类化合物减轻水生动物氧化损伤提供直接的实验依据及有效的干预措施。同时,将Ka 作为饵料添加剂投喂水生动物也会降低养殖成本,提高水产行业的经济效益,具有广泛的应用前景。
1 材料与方法
1.1 卤虫孵化与养殖条件
本实验所用的孤雌生殖卤虫由天津科技大学海洋与环境学院亚洲区域卤虫参考中心提供。
卤虫的孵化条件:温度28 ℃,盐度30 g/L,光照强度 2 000 lx,连续充气[21]。孵化24 h 后收集卤虫无节幼体,转移至水族箱中进行培养,盐度30 g/L,保持密度为1 个/mL。养殖管放入水箱中,28 ℃恒温养殖,光/暗周期为 14 h/10 h,每天分别在 9:00 和21:00 投喂Chlorella,每天的总投喂量为105个/mL,每2 天换1 次水,每隔12 h 及时补充蒸发掉的水。
1.2 试剂与仪器
人造海水(ASW),盐度 30 g/L,美国 Instant Ocean 公司;MDA、SOD、CAT、GSH-Px 试剂盒,南京建成生物工程研究所;总 RNA 提取试剂盒、PrimeScriptTMRT 试剂盒,日本Takara 公司。
SZ61型立体显微镜,Olympus 公司;SZX12 型体视显微镜,宁波舜宇仪器有限公司;FLX800TBI 型荧光酶标仪,美国BioTek 仪器公司;NanoDrop 2000 型微量紫外分光光度计,美国Thermo Scientific 公司;
1.3 指标分析
1.3.1 溴氰菊酯对卤虫的急性毒性实验
设定 7 个梯度组(0、0.001、0.01、0.1、1、5、10 μg/L)进行溴氰菊酯暴露实验,实验过程中停止投喂饵料。每组设计3 个平行,每个平行为100 只卤虫无节幼体,36 h 后对各组卤虫进行观察并记录卤虫的存活率,采用Probit 回归模型计算溴氰菊酯对卤虫的半致死浓度(LC50)。以36 h-LC50为1 个毒性单位(toxic unit),记为1 TU。
1.3.2 卤虫孵化率、体长和存活率的测定
实验设置空白对照(Control)组、二甲基亚砜(DMSO)组、DEL 组、Ka 组和DEL+Ka 组,其中选择0.105 μg/L(0.5 TU)溴氰菊酯和山柰酚(0.01、0.1、0.5、1 mg/mL)进行实验。Control 组卤虫进行常规培养,各处理组卤虫分别加入DEL 或Ka 配制培养液,其他培养条件均与Control 组一致。
卤虫孵化率的测定:1.60 g 孤雌生殖卤虫卵置于含有1 L 孵化液(人造海水)的锥形孵化管中孵化。孵育24 h 后,用50 μL 移液枪分6 次随机取样,置于24孔板内,通过SZ61 型立体显微镜在计数室中记录不同处理组中样品的无节幼体、伞状幼体和未孵化卵的数量,每个处理组设置3 个平行。孵化率(H)按式(1)计算。
式中:n1、n2、n3分别为无节幼体、伞状幼体和未孵化卵的数量。
卤虫生长实验:将同一时间孵化的、大小均匀的Ⅰ期无节幼体转移到1 L 孵化管中培养,养殖密度为1 个/mL。在16 d 的培养过程中,每2 d 从孵化管中分3 次随机取出150 mL 培养液,统计各组取样液中卤虫的存活率。同时,每2 d 从各处理组中取出15 只卤虫,用SZX12 型体视显微镜及其软件进行图像采集并测定其体长。
1.3.3 卤虫抗氧化酶活性和脂质过氧化物含量的测定
实验设置Control 组、DEL 组、Ka 组和DEL+Ka 组,其中DEL 质量浓度为0.105 μg/L,根据不同处理组卤虫个体水平相关指标测定结果,本实验选择0.1 mg/mL Ka 进行实验。将大小均匀、生长良好的无节幼体卤虫转移至200 mL 锥形培养管中,培养液中分别溶解不同浓度的DEL 或Ka,每组约200 只卤虫,培养至成熟期(约16 d),每组设置3 个平行。从各给药组中随机取出50 只卤虫,用相同温度的清水清洗3 次,除去卤虫表面的盐渍;收集各处理组的卤虫置于5 mL 离心管中,用生理盐水(质量体积比1∶9)均质。组织匀浆在4 ℃、12 000 g 条件下离心15 min,取上清液。上清液用试剂盒测定抗氧化酶(SOD、CAT、GSH-Px)及丙二醛(MDA)的含量。
采用荧光染料2′,7′-二氯乙酸荧光素(DCFHDA)测定不同处理组卤虫的ROS 水平。将上清液转移至96 孔板,用10 μmol/L DCFH-DA 在37 ℃黑暗环境下孵育30 min,利用FLX800TBI 型荧光酶标仪测定不同处理组卤虫的荧光强度(激发波长488 nm,发射波长525 nm)。
1.3.4 实时荧光定量PCR
实验按照1.3.3 节的方法处理卤虫。处理结束后,随机取出10 只卤虫成体,除去表面的盐渍,收集在1.5 mL 离心管中,在冰上进行RNA 提取。卤虫总RNA 采用Trizol 法提取,采用NanoDrop 2000 型微量紫外分光光度计对提取的RNA 进行定量和定性测定。仅采用高质量RNA(A260/A280范围为1.8~2.2,RIN 8.0)进行实时荧光定量 PCR 分析。使用PrimeScriptTMRT 试剂盒进行cDNA 合成。以β-actin基因为管家基因[22],利用实时荧光定量引物设计软件Primer Premier 5.0 设计引物(表1)。采用SYBR Green 法进行实时荧光定量 PCR。将20 μL(0.8 μL正向引物、0.8 μL 反向引物、10 μL 2×TB Green Premic Ex TaqⅡ、2.4 μL cDNA 和6.0 μL RNase-free water)反应物混合,95 ℃扩增30 s,95 ℃ 5 s,退火30 s,循环40 次,72 ℃扩增30 s,每组样品进行3 次技术重复。靶基因的相对表达量采用2-ΔΔCt法计算。

表1 引物Tab.1 Primers
1.3 数据统计学分析
使用Excel 和GraphPad Prism 软件对数据进行记录、统计分析并作图。对统计结果进行单因素方差分析,用Duncan’s 多重比较分析检测显著性差异,不同字母表示组间具有显著性差异(P<0.05)。
2 结果与分析
2.1 溴氰菊酯对卤虫的急性毒性
不同质量浓度溴氰菊酯胁迫卤虫的存活率如图1 所示。溴氰菊酯和卤虫存活率之间具有良好的剂量-效应关系。溴氰菊酯对卤虫的 LC50为0.210 μg/mL,95%可信区间为0.097~0.401,回归方程为 y =-0.634-0.909 x,R2=0.983。按照 GB/T 15670—2017《农药登记毒理学试验方法》农药毒性分级标准,溴氰菊酯的安全质量浓度为0.001 2 μg/L,因此溴氰菊酯对于卤虫属于剧毒性污染物。
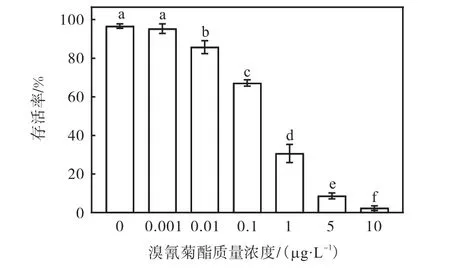
图1 不同质量浓度溴氰菊酯胁迫卤虫的存活率Fig.1 Survival rates of Artemia when exposed to different concentrations of deltamethrin for 36 h
2.2 山柰酚对卤虫孵化率、存活率和体长的影响
溴氰菊酯和不同浓度的山柰酚对卤虫孵化率的影响如图2 所示。DMSO 组卤虫孵化率与Control 组没有显著差异(P>0.05)。DEL 组卤虫的孵化率和Control 组相比显著下降(P<0.05)。在溴氰菊酯暴露卤虫培养液中加入不同质量浓度Ka 后,和DEL 组相比,DEL+0.01 Ka 组、DEL+0.1 Ka 组和DEL+0.5 Ka 组卤虫的孵化率显著提高(P<0.05),DEL+1 Ka 组卤虫孵化率显著下降(P<0.05)。当不同质量浓度Ka 单独培养时,和Control 组相比,0.01 Ka 组卤虫孵化率显著下降(P<0.05),0.1 Ka 组和0.5 Ka组卤虫的孵化率没有显著差异(P>0.05),1 Ka 组卤虫的孵化率显著下降(P<0.05)。

图2 溴氰菊酯和不同质量浓度的山柰酚对卤虫孵化率的影响Fig.2 Hatching percentage of Artemia when exposed to DEL and different concentrations of Ka
溴氰菊酯和不同质量浓度的山柰酚对卤虫存活率和体长的影响如图3 所示。由图3(a)可知:DMSO组卤虫存活率与Control 组没有显著差异(P>0.05)。在溴氰菊酯诱导卤虫的1~5 d,各处理组卤虫的存活率和Control 组没有显著差异(P>0.05)。随着培养时间的增加,DEL 组卤虫的存活率显著低于Control 组(P<0.05)。在DEL 处理卤虫的培养液中同时加入不同浓度Ka,与DEL 组相比,DEL+0.01 Ka 组存活率没有显著差异(P>0.05),DEL+0.1 Ka 组和DEL+0.5 Ka 组存活率显著提高(P<0.05),DEL+1 Ka 组存活率显著降低(P<0.05),但以上处理组和Control组相比,存活率显著降低(P<0.05)。在卤虫的培养液中单独加入Ka 时,Ka 对卤虫的存活率也有显著的影响。与Control 组相比,0.01 Ka 组存活率没有显著差异(P>0.05),0.1 Ka 组和0.5 Ka 组存活率显著提高(P<0.05),1 Ka 组存活率显著降低(P<0.05)。通过整个实验周期的存活率测定,溴氰菊酯和山柰酚对卤虫存活率的影响主要体现在卤虫的成体期。
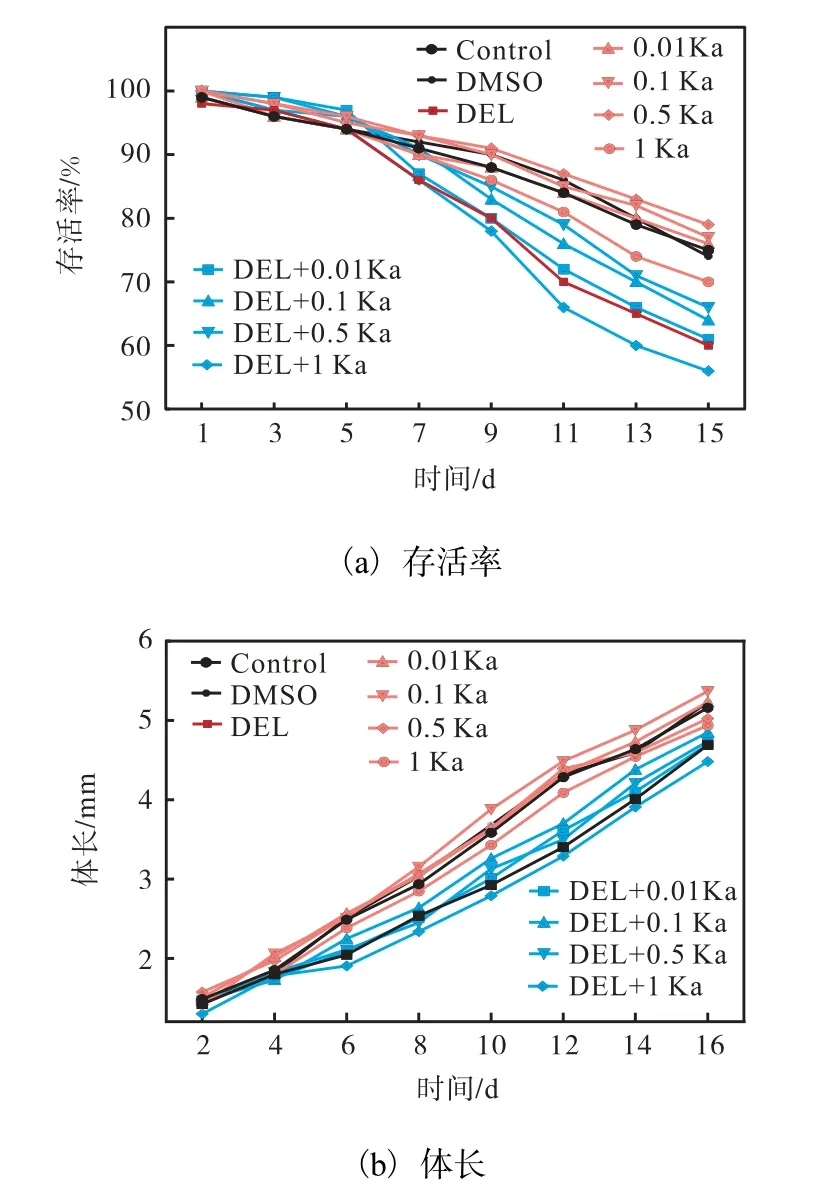
图3 溴氰菊酯和不同质量浓度的山柰酚对卤虫存活率和体长的影响Fig.3 Effects of DEL and different concentrations of Ka on the survival rate and body length of Artemia
由图3(b)可知:DMSO 组卤虫体长与Control 组没有显著差异(P>0.05)。溴氰菊酯在给药第4 天开始对卤虫生长具有抑制作用。同时给药DEL 和不同质量浓度Ka 后,DEL+0.01 Ka 组、DEL+0.5 Ka 组、DEL+1 Ka 组与DEL 组没有显著差异(P>0.05),DEL+0.1 Ka 组卤虫体长在第10 天开始显著提高(P<0.05),但仍低于Control 组。卤虫单独给药Ka时,与Control 组相比,0.01 Ka 组和0.5 Ka 组无显著差异(P>0.05),1 Ka 组显著降低(P<0.05),0.1 Ka组显著提高(P<0.05)。山柰酚的改善作用主要从第10 天开始体现。
2.3 山柰酚对卤虫抗氧化酶及脂质过氧化物含量的影响
溴氰菊酯和山柰酚对卤虫SOD、CAT、GSH-Px活性和MDA 含量的影响如图4 所示。
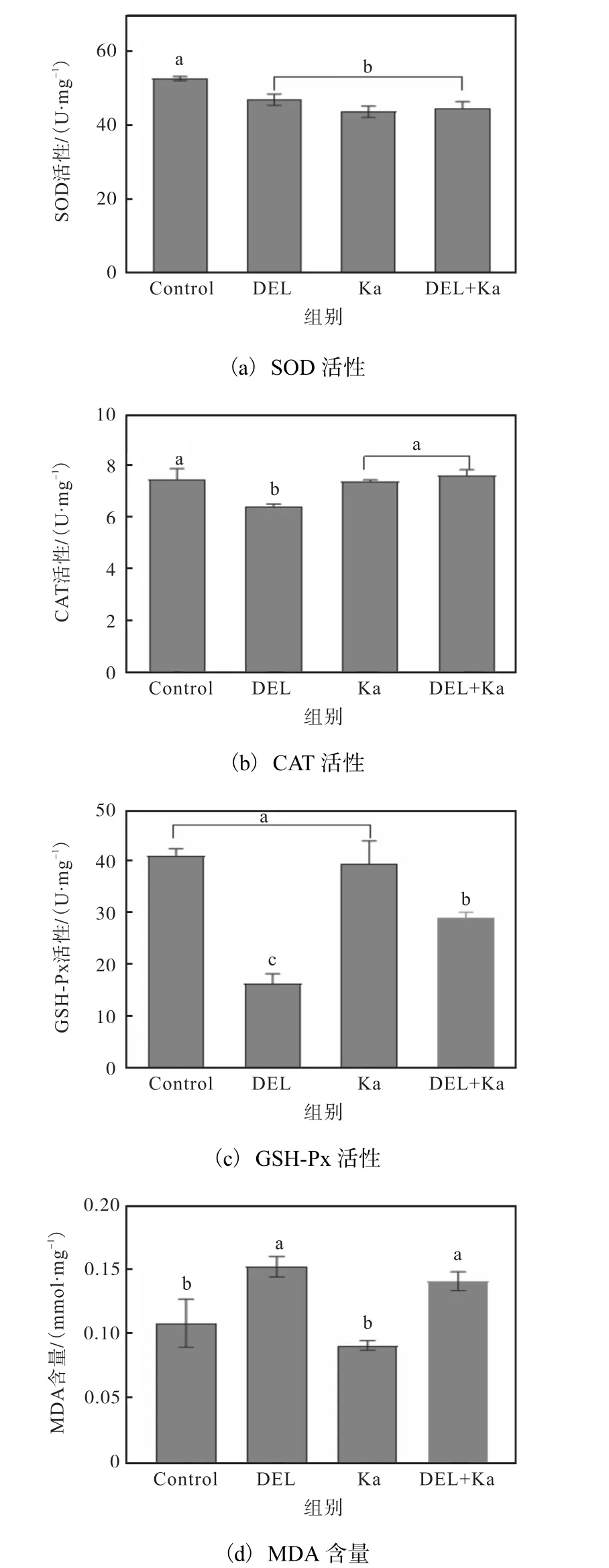
图4 溴氰菊酯和山柰酚对卤虫SOD、CAT、GSH-Px 活性和MDA含量的影响Fig.4 Effects of DEL and Ka on the SOD,CAT,GSH-Px enzyme activities and MDA contents in Artemia
与Control 组相比,溴氰菊酯能够显著降低卤虫体内SOD、CAT、GSH-Px 活性,MDA 含量显著上升(P<0.05)。当单独加入0.1 mg/mL 山柰酚时,卤虫的SOD、CAT、GSH-Px 活性和MDA 含量与Control 组没有显著差异(P>0.05)。在溴氰菊酯暴露卤虫的培养液中加入0.1 mg/mL 山柰酚后,卤虫的CAT 和GSH-Px 活性和DEL 组相比显著提高(P<0.05),但仍低于Control 组;MDA 含量下降,但没有显著差异(P>0.05);卤虫的SOD 活性和Control 组相比没有显著差异(P>0.05)。
2.4 山柰酚对卤虫ROS含量的影响
溴氰菊酯暴露和山柰酚对卤虫ROS 水平的影响如图5 所示。与Control 组相比,DEL 组ROS 水平显著增加(P<0.05)。与DEL 组相比,Ka 组和DEL+Ka 组卤虫的ROS 水平显著下降(P<0.05),但与Control 组没有显著差异(P>0.05)。

图5 溴氰菊酯和山柰酚对卤虫ROS水平的影响Fig.5 Effect of DEL and Ka on ROS production in Artemia
2.5 山柰酚对卤虫Nrf2 信号通路相关基因表达量的影响
溴氰菊酯和山柰酚对卤虫Nrf2 信号通路中相关基因的影响如图6 所示。
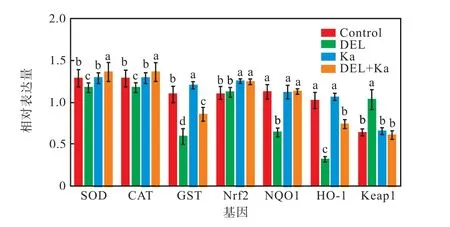
图6 溴氰菊酯和山柰酚对卤虫Nrf2 信号通路关键基因表达的影响Fig.6 Effects of DEL and Ka on the expression of key genes in the Nrf2 signaling pathway of Artemia
与Control 组相比,DEL 组中基因SOD、GST、NOQ1 和HO-1 的表达量显著下降(P<0.05),基因CAT 和Nrf2 表达量下降,但没有显著性差异(P>0.05),基因Keap1 的表达量显著上升(P<0.05)。Ka组卤虫中基因SOD、CAT、GST、Keap1、NOQ1 和HO-1 的表达量和Control 组均没有显著差异(P>0.05),Nrf2 的表达量高于Control 组(P<0.05)。与DEL 组相比,DEL+Ka 组卤虫中基因CAT、GST、Nrf2、NOQ1 和HO-1 显著上升(P<0.05),但基因SOD 表达量没有显著差异(P>0.05),基因Keap1 表达量显著下降(P<0.05)。
3 讨 论
甲壳类动物是对拟除虫菊酯化合物最敏感的物种群[23]。将甲壳类动物草虾(Palaemonetes pugio)作为毒性测试物种进行急性毒性实验,结果表明,5 种拟除虫菊酯均具有不同程度的毒性作用。其中,溴氰菊酯是毒性最大的化合物,在4 ng/L 时造成约20%的草虾死亡,在11 ng/L 时导致约100%的草虾死亡[23]。卤虫是海水鱼、虾、蟹育苗的重要生物饵料,同时也是毒理学优良的实验动物。在本研究中,首先采用急性毒性实验观察卤虫暴露溴氰菊酯36 h 后的毒性反应,计算LC50并进行毒性分级。研究结果显示溴氰菊酯对卤虫36 h 的LC50为0.210 μg/L,按照GB/T 15670—2017《农药登记毒理学试验方法》农药毒性分级标准,判定溴氰菊酯为剧毒性农药。卵的孵化和生长是评估卤虫发育状况最直接的指标。与Control 组相比,溴氰菊酯暴露的卤虫的孵化率、存活率和体长均显著降低(P<0.05),而0.1、0.5 mg/mL山柰酚能够显著提高溴氰菊酯暴露卤虫的孵化率和存活率,0.1 mg/mL 山柰酚能够显著提高卤虫的体长(P<0.05),这可能是山柰酚发挥了其抗氧化活性,有效缓解了由溴氰菊酯暴露引起的氧化损伤,从而提高了卤虫的孵化率和存活率。此外,1 mg/mL 山柰酚会抑制卤虫的生长发育,表明山柰酚对卤虫的作用效果呈现高浓度抑制,需要控制山柰酚对卤虫的给药浓度。在溴氰菊酯暴露下给药一定浓度的山柰酚,卤虫的生长发育指标和单独暴露溴氰菊酯时相比有一定的缓解作用,但仍然低于Control 组,这表明山柰酚仅能对卤虫的生长起到一定的改善作用,但无法完全治疗氧化损伤的卤虫。此外,通过对卤虫整个发育周期的暴露实验发现,成熟时期卤虫对溴氰菊酯最敏感,并且山柰酚的改善作用最为显著。
在水生动物中,ROS 对正常细胞功能不可或缺,并在细胞防御过程中发挥重要作用。然而,过量的ROS 会导致组织或细胞的氧化损伤[24]。为防止过多ROS 对机体造成的氧化损伤,机体的抗氧化系统发挥了作用。SOD 将超氧阴离子(·O2-)和H+代谢为O2和H2O2,随后通过CAT 和GSH-Px 转化为H2O[25]。因此,这些抗氧化酶常被用作生态毒理学研究中的生物标志物,评估一些污染物对甲壳类动物的亚致死影响[13,26]。MDA 是脂质过氧化的主要产物,其含量反映了脂质过氧化程度[27]。在本研究中,溴氰菊酯暴露于成体卤虫之后,卤虫的SOD、CAT 和GSH-Px 活性受到抑制,MDA 含量和ROS 水平显著上升,这些抗氧化酶活性的降低可能是过量ROS 产生造成相应蛋白的损伤所致,这说明溴氰菊酯能够引起卤虫严重的氧化应激反应。单独加入山柰酚之后,卤虫的酶活性与Control 组相比没有显著差异(P>0.05)。然而,在溴氰菊酯暴露卤虫的培养液中加入0.1 mg/mL 山柰酚,和DEL 组相比,加入山柰酚0.1 mg/mL 组卤虫的SOD、CAT 和GSH-Px 活性显著上升,MDA 含量和ROS 水平下降,山柰酚可能增强了应激状态下卤虫的抗氧化能力,并消除卤虫氧化应激期间产生的过量ROS 。研究[28]发现,DEL 暴露导致虹鳟鱼(Oncorhynchus mykiss)体内SOD、CAT 和GST 活性持续降低。相反,山柰酚能够显著提高链脲佐菌素诱导糖尿病大鼠的抗氧化酶活性,降低脂质过氧化物含量[29],这与本研究结果一致。
Keap1/Nrf2/ARE 信号通路是水生动物抗氧化应激最重要的机制[30]。研究[31]表明,溴氰菊酯暴露使乌澧(Channa argus)的肝脏和肠道中基因SOD、Nrf2、NOQ1 和HO-1 表达水平降低。本研究利用实时荧光定量PCR 检测该通路中的关键基因发现,溴氰菊酯暴露导致卤虫体内SOD、Nrf2、GST、NQO1、HO-1和CAT 的mRNA 表达减少,Keap1 的mRNA 表达增加。在卤虫的培养液中单独加入山柰酚之后,卤虫的Nrf2 信号通路中相关基因的表达量与Control 组相比没有显著差异(P>0.05)。然而,与DEL 组相比,DEL+Ka 组中SOD、Nrf2、GST、NQO1、HO-1 和CAT 的mRNA 表达水平上调,而Keap1 基因的mRNA 表达水平下调。当溴氰菊酯暴露时,卤虫过量的ROS 暴露导致氧化系统和抗氧化系统之间失去平衡。山柰酚能够激活Keap1/Nrf2/ARE 信号通路,促使Nrf2 从Keap1 中解离,转入细胞核,并与转录因子结合。然后,复合物与Maf 蛋白结合形成二聚体后与抗氧化反应元件(ARE)结合,促进抗氧化基因的转录。Keap1 是一种负调节Nrf2 活性的胞浆蛋白[32]。研究显示溴氰菊酯暴露提高了卤虫基因Keap1 的表达,山柰酚显著抑制了溴氰菊酯诱导的Keap1 的高表达,表明山柰酚缓解溴氰菊酯诱导卤虫氧化应激可能是通过抑制Keap1 的表达和激活Nrf2/ARE 信号通路实现的。
4 结 论
溴氰菊酯暴露卤虫的孵化率、存活率和体长显著降低,并诱导卤虫产生氧化应激损伤。山柰酚能够促进溴氰菊酯诱导卤虫的生长发育,同时能够提高卤虫的抗氧化能力和Nrf2 通路中关键基因的表达,对溴氰菊酯诱导卤虫的氧化应激具有缓解作用。本研究以卤虫为实验动物,进一步拓宽了山柰酚的应用领域,同时也为农药残留物对水生甲壳类动物的氧化应激损伤提供了一种有效的解决方法,有助于水生动物的健康发展。

