基于网络药理学及动物实验探究雷公藤-白芍治疗类风湿关节炎的作用机制
李方泽,万磊,赵磊,朱子衡,马熙檬,李舒,胡赛赛,程静,陈莹莹
1.安徽中医药大学第一临床医学院,安徽合肥 230031;2.安徽中医药大学第一附属医院风湿免疫科,安徽合肥 230031
类风湿关节炎(rheumatoid arthritis,RA)是一种可导致全身多系统损害的自身免疫性疾病[1-2]。目前治疗RA的方法较为多样,其中以托法替布为代表靶向合成改善病情抗风湿药(targeted synthesis of disease-modifying anti-rheumatic drugs,tsDMARDs)为当今新一类治疗RA的药物,临床疗效显著[3-4]。通过药物精准调控RA某些通路或关键靶点,进而影响免疫炎症反应,缓解症状,是治疗RA新的有效方法。网络药理学可从分子网络角度分析药物、疾病与相关靶点及通路之间的联系,为新的靶向药物研发提供理论基础和依据[5]。
雷公藤(TripterygiumwilfordiiHook.f.)和白芍(PaeonialactifloraPall)被广泛应用于治疗RA[6]。雷公藤治疗RA具有独特的临床疗效,但其较大的毒副作用限制其临床应用[7]。白芍治疗RA效果较雷公藤弱,经常与有毒中药配伍,发挥减毒功效[8-9]。雷公藤与白芍配伍既可增加疗效,又可有效减少雷公藤对肝细胞的损伤[10-12]。本研究通过网络药理学分析雷公藤配伍白芍治疗RA可能的分子作用机制,并验证分析结果,为临床应用提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级雄性Wistar大鼠40只(购于安徽省实验动物中心,许可证号SYXK 2005-02),平均体质量(216.0±28.3)g,实验前适应性饲养7d。本研究经安徽中医药大学实验动物伦理委员会审批通过(伦理审批号:AHUCM-rats-2021022)。
1.1.2 药品与试剂 雷公藤、白芍购自安徽中医药大学第一附属医院中药房(生产单位:亳州市金方千草药业有限公司,货号:5656851、564822411,规格:500g/袋),雷公藤甲素购自Merck公司(货号:T3652-1MG,纯度≥98%);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-4、IL-6、IL-17、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自武汉基因美生物科技有限公司(货号:JYM0635Ra、JYM0647Ra、JYM0646Ra、JYM0480Ra);弗氏完全佐剂(Freund’s complete adjuvant,FCA)购自美国Sigma公司(货号:MB9887);Western一抗二抗去除液购自Beyotime公司(货号:P0025);β-肌动蛋白购自Zsbio公司(货号:TA-09);磷酸化磷脂酰肌醇-3-激酶(phosphorylated phosphatidylinositol 3-hydroxy kinase,p-PI3K)购自Abcam公司(货号:ab86714),磷酸化蛋白激酶B蛋白(phosphorylated AKT protein,p-AKT)购自CST公司(货号:4691S)。
1.1.3 仪器与数据库 多功能酶标仪(Molecular Decices公司,型号:spectra Max MZe)、转膜仪(上海天能科技有限公司,型号:VE-186)、自动曝光仪(上海培清科技有限公司,型号:JS-1070P)。使用中药系统药理学分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)及DisGeNET、GeneCards、String、Metascape、PubChem、PDBe在线数据库。
1.2 方法
1.2.1 网络药理学 ①雷公藤-白芍有效成分及作用靶点检索:利用TCMSP,设置关键词为“雷公藤”“白芍”,筛选条件为“口服生物利用度≥30%,类药性指数≥0.18”,检索雷公藤-白芍活性成分并预测作用靶点。②RA靶点检索:以“rheumatoid arthritis”为关键词,在DisGeNET和GeneCards收集RA靶点。③“雷公藤-白芍-活性成分-RA”网络构建:通过R获得共同作用靶点,利用Cytoscape 3.9.1构建“雷公藤-白芍-活性成分-RA”网络,并通过计算度中心性(degree),获取核心活性成分。④构建共同靶点蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络及核心靶点筛选:利用String数据库构建共同靶点PPI网络,设置物种为“H.sapiens”,最低要求互动分数为0.4,隐藏单独节点。使用Cytoscape 3.9.1 CytoNCA插件,计算网络中各靶点中介中心性(betweenness,BC)、接近中心性(closeness,CC)、degree、特征向量中心性(eigenvector,EC),以大于各靶点BC、CC、EC、degree中位数为条件,连续筛选两次,获得核心靶点。⑤富集分析:利用Metascape数据库对共同靶点进行富集分析,设置物种为“H.sapiens”,P<0.01。⑥分子对接:利用PubChem及PDBe数据库,分别下载核心有效成分与核心靶点的分子结构,采用AutoDock Tools及Pymol软件对其进行分子对接。
1.2.2 动物实验验证 ①药物制备:雷公藤及白芍各10g加入10倍水量浸泡2h,煎煮2次,第一次30min,第二次40min,将两次煎煮液混合均匀,室温静置30min,过滤并浓缩至生药浓度为1g/ml,置于4℃冰箱保存备用。②造模及分组干预:将大鼠随机分为正常对照(normal control,NC)组10只,关节炎模型组30只;NC组大鼠不做处理;关节炎模型组大鼠使用0.1ml FCA于右后足跖皮内进行注射,复制为佐剂关节炎(adjuvant arthritis,AA)大鼠模型,并于第12天在AA大鼠尾部注射0.05ml FCA加强免疫[13]。第15天将30只AA大鼠按随机数字表法分为模型(model control,MC)组、雷公藤-白芍(tripterygium wilfordii-white peony,TP)组及雷公藤甲素(triptolide,TPL)组,每组10只。第16天开始给药,每天1次,连续30d。TP组大鼠给予雷公藤-白芍汤剂浓缩液2.08g/kg灌胃,TPL组大鼠给予雷公藤甲素混悬液0.2mg/kg灌胃,NC组及MC组大鼠给予同体积生理盐水灌胃。③ELISA检测细胞因子:采集用药后第31天大鼠腹主动脉血,离心取上层血清,根据说明书利用ELISA试剂盒测定TNF-α、IL-6、IL-17及IL-4含量。④蛋白质印迹法(Western blot,WB)检测p-PI3K、p-AKT:用蛋白提取试剂盒提取用药后第31天大鼠滑膜总蛋白,进行电泳分离,采用半干法使蛋白质从胶转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)。在室温下将p-PI3K、p-AKT抗体(1∶1000稀释)和PVDF膜孵育2h。采用一抗、二抗孵育,利用增强化学发光法显色并拍照,计算灰度值,以p-PI3K、p-AKT与β-肌动蛋白的比值为蛋白相对表达量。
1.3 统计学方法
利用SPSS 23.0统计学软件对数据进行处理分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,不符合正态分布的计量资料采用Wilcoxon秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 网络药理学及分子对接
2.1.1 雷公藤-白芍有效成分及作用靶点 获得有效成分雷公藤51个,白芍13个,共同有效成分61个。预测作用靶点雷公藤94个、白芍154个,共同作用靶点160个。
2.1.2 RA靶点检索 利用DisGeNET与GeneCards数据库分别收集RA靶点2723个和4465个,去除重复项后获得靶点5469个。
2.1.3 构建“雷公藤-白芍-活性成分-RA”网络及分析将160个共同作用靶点与5469个RA靶点利用R取交集,获得113个共同靶点,通过Cytoscape 3.9.1构建包括148个节点、353条边的“雷公藤-白芍-活性成分-RA”网络。利用degree值筛选排名前5位的核心活性成分,分别为山柰酚、雷公藤甲素、川陈皮素、β-谷甾醇和豆甾醇,可能为雷公藤-白芍治疗RA的核心活性成分,见图1、表1。

表1 雷公藤-白芍治疗RA核心有效成分
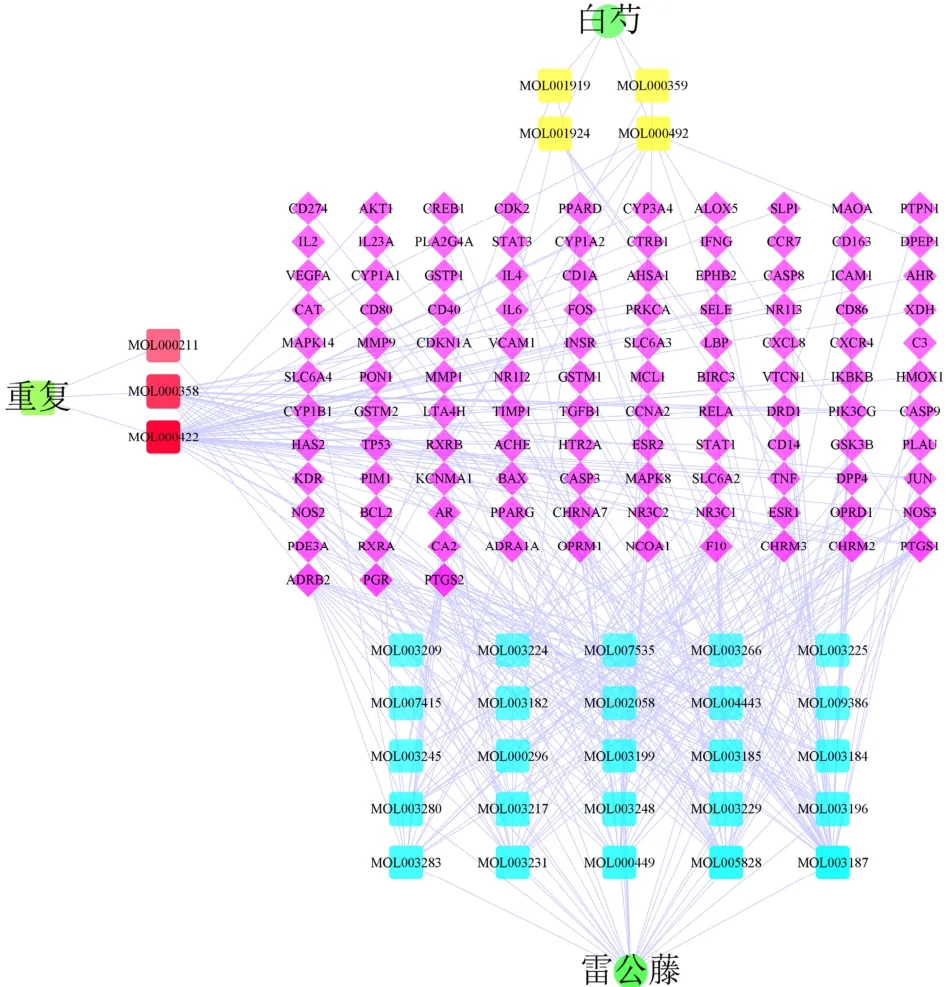
图1 中药-有效成分-作用靶点网络
2.1.4 PPI网络及核心靶点 String数据库获得拥有148个节点,353条相互作用连线的PPI网络,Cytoscape 3.9.1、CytoNCA插件获得12个核心靶点,分别为TNF、IL-6、IL-4、IL-2、丝氨酸/苏氨酸蛋白激酶1(RAC-alpha serine/threonine-protein kinase,AKT1)、前列腺素内过氧化物合成酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、过氧化物酶体增生激活受体(peroxisome proliferative activated receptor,PPARG)、CXC趋化因子配体8(C-X-C motif chemokine ligand 8,CXCL8)、血管内皮细胞生长因子A(vascular endothelial growth factor A,VEGFA)、细胞肿瘤蛋白P53(cellular tumor antigen p53,TP53)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP9),以上可能是雷公藤-白芍治疗RA的核心靶点,见图2。

图2 PPI网络及核心靶点
2.1.5 富集分析 获得1678条基因本体(gene ontology,GO)富集结果,其中GO生物过程(biological process,BP)1461条,包括炎症应答、细胞激活等;GO分子功能(molecular function,MF)151条,包括脂肽结合、蛋白酶结合等;GO细胞组分(cellular component,CC)66条,包括核膜、微绒毛等;富集分析获得信号通路191条,包括PI3K/AKT信号通路,TNF信号通路(TNF signaling-pathway)等,可能为雷公藤-白芍治疗RA的关键信号通路,见图3。
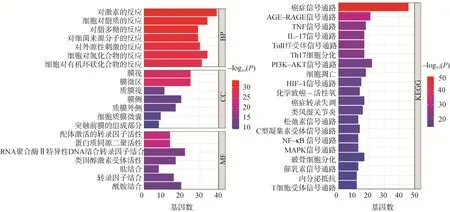
图3 GO和KEGG富集分析
2.1.6 分子对接 除川陈皮素及IL-2外,其余关键有效成分与核心靶点均可稳定结合,最低结合能均<-5kcal/mol,关键有效成分与核心靶点之间可形成多条化学键,空间结构稳定,见表2、图4。

表2 分子对接结合能(kcal/mol)

图4 分子对接模式图
2.2 动物实验验证
2.2.1 雷公藤-白芍对AA大鼠血清细胞因子的影响 与NC组大鼠相比,MC组大鼠的TNF-α、IL-6、IL-17显著升高,IL-4显著降低(P<0.05);与MC组大鼠相比,TP组与TPL组大鼠的TNF-α、IL-6、IL-17均显著降低,IL-4显著升高(P<0.05);与TPL组大鼠相比,TP组大鼠的TNF-α、IL-6、IL-17显著降低,IL-4显著升高(P<0.05),见表3。
表3 各组大鼠的细胞因子比较(±s,pg/ml,n=10)

表3 各组大鼠的细胞因子比较(±s,pg/ml,n=10)
注:与NC组比较,*P<0.05,与MC组比较,#P<0.05;与TPL组比较,ΔP<0.05
组别 TNF-α IL-4 IL-6 IL-17 NC组 36.30±2.85 9.39±0.87 26.59±2.93 30.94±2.954 MC组 188.33±23.67* 3.11±0.31* 83.64±5.71 93.43±5.89 TP组 78.71±6.39*#Δ 6.01±0.52*#Δ 40.87±6.37*#Δ 40.08±4.31*#Δ TPL组 103.42±8.38*# 4.62±0.42*# 61.41±6.88 52.91±3.12
2.2.2 雷公藤-白芍对AA大鼠滑膜组织p-PI3K、p-AKT蛋白表达的影响 与NC组大鼠比较,MC组大鼠的p-PI3K和p-AKT蛋白表达显著升高(P<0.05);与MC组大鼠比较,TP组和TPL组大鼠的p-PI3K和p-AKT蛋白表达显著降低(P<0.05);与TPL组大鼠比较,TP组大鼠的p-PI3K和p-AKT蛋白表达显著降低(P<0.05),见表4和图5。
表4 各组大鼠滑膜组织p-PI3K、p-AKT蛋白相对表达的比较(±s,n=10)

表4 各组大鼠滑膜组织p-PI3K、p-AKT蛋白相对表达的比较(±s,n=10)
注:与NC组比较,*P<0.05;与MC组比较,#P<0.05;与TPL组比较,ΔP<0.05
组别 p-PI3K p-AKT NC组 0.22±0.01 0.47±0.02 MC组 0.73±0.02* 0.91±0.01*TP组 0.37±0.01*#Δ 0.61±0.04*#Δ TPL组 0.62±0.01*# 0.82±0.01*#
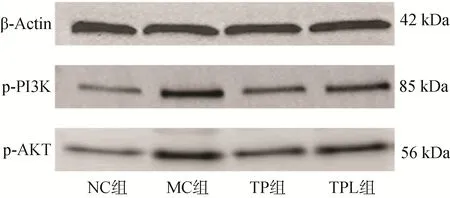
图5 各组大鼠滑膜组织p-PI3K、p-AKT蛋白相对表达
3 讨论
RA的特点是免疫细胞和细胞因子作用于机体,激活破骨细胞、成纤维细胞及免疫复合物介导的补体等,导致细胞因子网络失调,引起炎症级联反应,产生慢性炎症[14]。因此,调节机体免疫、减少促炎因子分泌、减轻关节滑膜炎症是治疗RA的关键。
网络药理学表明,雷公藤-白芍所含成分复杂,可通过多靶点、多途径治疗RA。核心有效成分有抗炎和调节免疫等作用,对细胞因子及骨代谢平衡有调控作用[15-18]。TNF-α可作用于多条信号通路,调控IL-6和IL-4的分泌[19];IL-4可通过抑制Th1介导的促炎作用,调节巨噬细胞的极化和活性,预防关节损伤和骨侵蚀,改善关节炎,促进组织修复[20];IL-6可降低机体区分自我和非我的能力,刺激Th17途径,导致纤维化和炎症反应[21]。异常活化的PI3K/AKT信号通路可影响巨噬细胞极化,增加抗凋亡基因在滑膜细胞的表达,导致细胞因子分泌紊乱,滑膜纤维细胞过度增生[22-24]。动物实验显示,通过雷公藤-白芍治疗后可明显降低TNF-α、IL-6、IL-17及p-PI3K、p-AKT的表达,显著增加IL-4的分泌,表明雷公藤-白芍可有效抑制RA中的PI3K/AKT信号通路的过表达,恢复免疫平衡。
综上,本研究利用网络药理学发现雷公藤-白芍可通过多种有效成分影响多条信号通路和作用靶点,对RA产生治疗作用。动物实验表明,雷公藤联合白芍可通过调控PI3K/AKT信号通路干预下游相关细胞因子,对AA大鼠产生治疗作用,为雷公藤联合白芍治疗RA提供理论与实验依据。

