肢端肥大症药物治疗进展
郑思畅, 周薇薇, 王卫庆
(上海交通大学医学院附属瑞金医院内分泌代谢科 上海市内分泌代谢病研究所国家代谢性疾病临床医学研究中心(上海) 国家卫健委内分泌代谢病重点实验室上海市内分泌肿瘤重点实验室,上海 200025)
肢端肥大症(acromegaly)是一类起病缓慢的内分泌代谢性疾病,通常是由于过多的生长激素(growth hormone, GH)促使肝脏产生超量的胰岛素样生长因子1(insulin-like growth factor 1, IGF-1)为主要临床特征。 超过95%的GH 异常分泌是由分泌GH 的垂体腺瘤所致,剩下少数的是由于异位GH、促GH 释放激素(GH releasing hormone,GHRH)瘤所致。 肢端肥大症可导致多种内分泌代谢、心血管、呼吸、肌肉骨骼、肿瘤等合并症。 根据不同地区的文献报道,2000 年之前的患病率(3~7)例/10 万人年,近年的患病率报道较前升高,为(4~13)例/10 万人年[1]。根据国内外最新的指南,肢端肥大症的治疗方式主要有手术治疗、 药物治疗和放射治疗3 种[2-3]。本文将就GH 的病理生理特点及对应肢端肥大症的药物治疗进行总结。
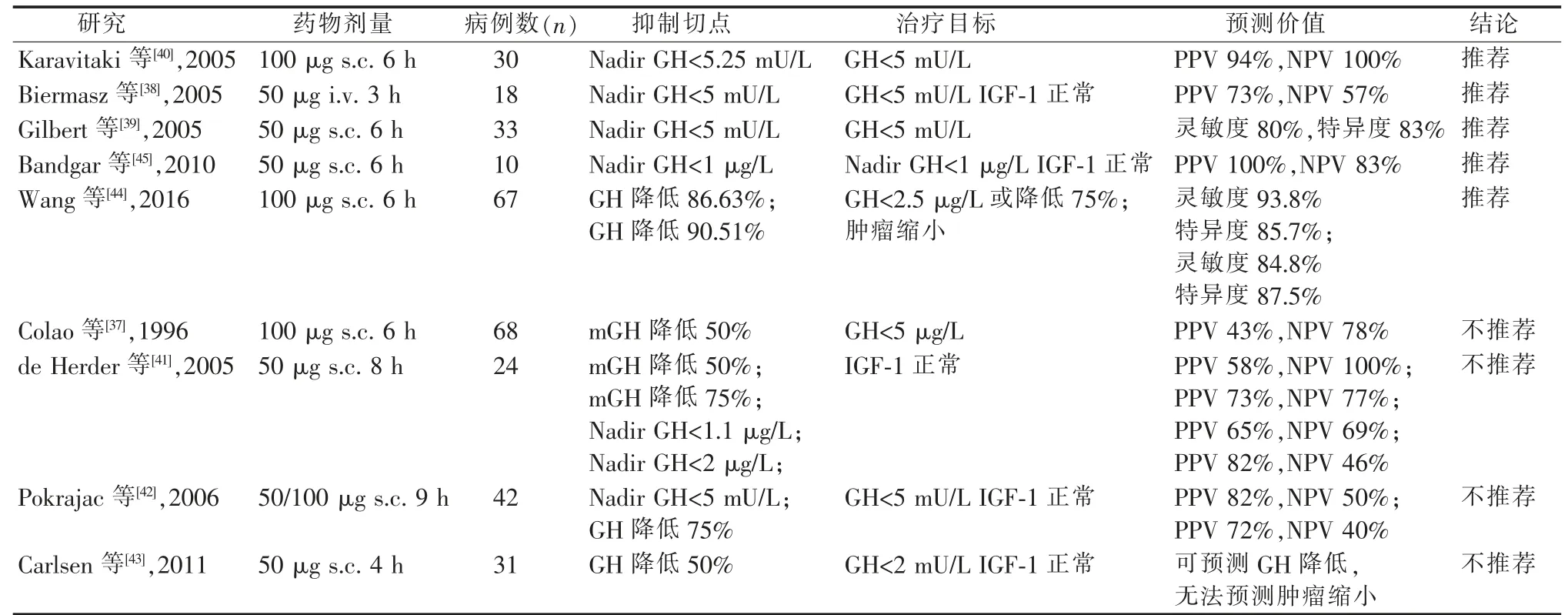
表1 奥曲肽抑制试验预测价值[37-45]
GH 是垂体GH 细胞产生的多肽激素, 与催乳素有较高的同源性,在人体中均来源于嗜酸干细胞。 GH 主要位于垂体侧翼,占垂体细胞的35%~45%。 编码人类GH 的基因位于第17 号染色体长臂22~24 区,由2 个基因组成,包括5 个外显子和4 个内含子。 循环中的GH 主要包括分子量为22 000 和20 000 的GH,前者占垂体GH 的90%~95%,后者占5%左右。 GH 的分泌受到下丘脑的GHRH 和生长抑素(somatostatin,SST), 又称GH 释放抑制因子(somatotropin release inhibiting factor,SRIF)的调节。 垂体GH 细胞通过表达GHRH 受体、SRIF 受体亚型2 和5 (SSTR2 和SSTR5)进而调节GH 的分泌, 其中SSTR2 是GH 分泌细胞的主要受体。尽管SRIF 抑制GH 的分泌,但不抑制GH 的合成。GH 受体(GH receptor, GHR)在体内广泛分布,其中以肝脏中分布最多。 GH 通过GHR 启动Janus 激酶(Janus kinase,JAK)-信号转导及转录激活蛋白 (signal transducer and activator of transcription, STAT)途径的磷酸化级联反应,促进下游信号分子(如STAT5)的启动和募集,诱导肝脏和其他组织产生和分泌IGF-1。 同时GH 也是一种可以不通过靶腺器官而直接产生生物学效应的激素。 GH 可直接促进脂肪代谢、改善胰岛素抵抗、促进胰岛素合成、改善肝脏代谢、骨骼及牙齿的发育,也可通过IGF-1 促进骨骼肌发育、心血管内皮的增长、胃肠道的增生、软骨细胞发育等[4]。
肢端肥大症的药物治疗主要包括SST 受体配体(SST receptor ligands,SRL)、多巴胺受体拮抗剂(dopamine receptor antagonists,DRA)和GHR 拮抗剂(GHR antagonist,GHRa),可有效减轻GH 过量分泌或生物学作用[5]。 针对难治性/侵袭性垂体瘤,目前有替莫唑胺以及免疫治疗尚在研究[6]。
SRL
垂体GH 瘤主要(约95%)表达SSTR2 或者SSTR5,第一代的奥曲肽(octreotide)(包括皮下及口服制剂)、奥曲肽长效缓释剂、兰瑞肽(landreotie),第二代的帕瑞肽(pasireotide)主要通过SSTR2 和SSTR5 的结合,使得GH 分泌减少[7-10]。针对不同的文献报道,SRL 的有效率控制率在22%~55%之间,由于第二代的SRL 对SSTR5 也有疗效, 帕瑞肽长效缓释剂对肢端肥大症患者生化缓解率高于奥曲肽长效缓解率。SRL的不良反应主要表现为2 种,一种为注射部位出现疼痛、肿胀、瘙痒等;另一种则和SSTR 分布相关,SSTR 不仅在垂体中有表达,在胰腺、胃肠道(包括胆囊)、肾上腺等组织中也有广泛表达[11],可表现为腹部痉挛、腹泻、腹胀、恶心呕吐等,常在注射前2 周较为明显,后可逐步缓解。 长期使用SRL 可出现胆囊结石及胆泥淤积的发病率升高, 大部分患者仅表现为腹胀,无明显腹痛症状,通常不需要进行外科干预,仅随访即可。 区别于第一代SRL 不良反应,帕瑞肽对胰岛素分泌抑制性更高,会出现高血糖。 因此,糖尿病患者或者基线血糖和糖化血红蛋白偏高患者, 在帕瑞肽初始治疗或者增加剂量后的3 个月内需要注意每周监测血糖水平[12]。
多巴胺受体激动剂
GH 与泌乳素具有较高的同源性,GH 腺瘤的表现有多巴胺受体D2(dopamine D2 receptor, D2R)的表达,多巴胺受体激动剂(dopamine receptor agonist, DA)通过结合D2R 可抑制GH 的释放。目前临床较为常用的是第一代溴隐亭和第二代卡麦角林, 可作为SRL 的补充, 也可单独用于GH 和IGF-1 水平轻度升高的患者。 溴隐亭单药IGF-1 控制率为10%~20%,而卡麦角林的单药控制率可达35%左右,推荐对IGF-1 低于参考范围上限1.5 倍的肢端肥大症患者单药治疗[13-14]。 常见的不良反应包括恶心、头痛、便秘、直立性低血压、 鼻塞以及雷诺现象。 此类不良反应在溴隐亭上更为常见。 鉴于这些不良反应主要发生在首次给药及每次加量后,可以通过逐步阶梯式增加药物剂量、睡前服用以及与食物同服等方式减轻药物的不良反应。随着剂量的增加会出现购物冲动、赌博冲动、性冲动等精神类不良反应[15]。 长期大剂量使用卡麦角林会造成心包、肺组织、后腹膜的纤维化改变[14]。
GHRa
在GH 的三维结构被阐明后,发现GH 有2 个结合位点(结合位点1 是高亲和力位点、 结合位点2 是低亲和力位点)参与细胞膜上的GHR 结合,产生二聚化发挥临床作用。GHRa[派格索曼(pegvisomant)]则可以与人GH 竞争性结合GHR,直接阻断GH 作用,从而有效降低外周IGF-1 的浓度[16]。 派格索曼的特点是起效快,单次注射即可抑制约30%的IGF-1 水平,单药治疗的有效率可达90%及以上,在真实世界则是60%左右,并且不良反应可控[17-20]。 常见不良反应是注射部位反应、恶心、腹泻、血脂升高、一过性转氨酶异常等。 鉴于派格索曼无直接降低GH 作用,个别报道会导致肿瘤体积增大, 治疗期间建议定期复查垂体磁共振(magnetic resonance,MR)评估肿瘤体积的变化。
替莫唑胺及其他
替莫唑胺(temozolomide)是一种口服烷化剂,已获准用于治疗胶质母细胞瘤。 虽然目前没有临床试验数据公布,但已有足够的证据证明其在难治性垂体瘤治疗中的效果,可延长中位无进展生存期和总生存期[21-22],并在国内外指南中推荐使用[2,23-24]。目前也有针对难治性垂体瘤的免疫靶向治疗研究,但患者数量较少,无法形成有效指导意见[25-26]。
关于SRL 疗效预测问题
SRL 治疗效果与诸多因素相关:年龄、性别、基线GH 和IGF-1 水平、肿瘤影像特点(大小、T2 加权像信号)、肿瘤病理特点(稀疏/致密颗粒型、SSTR2/SSTR5 的表达水平)相关,也可通过奥曲肽抑制试验(octreotide suppression test,OST)预测疗效。 在基线数据上,目前认为老年患者、女性、较低的GH 和IGF-1 水平、T2 加权像肿瘤为低信号、 病理为致密颗粒型,对于SRL 治疗较为敏感[8]。 绝大多数的研究证明SSTR2 是第一代SRL 疗效的独立预测因素,在肿瘤中的低表达,对SRL 治疗有很强的阴性预测价值[27-28]。 SSTR5 的表达在第二代SRL(帕瑞肽)中是一重要的阳性预测因素[29-30],其争议点在于SSTR5 是独立的预测因素还是通过SSTR2 间接起效[31],需要更多的临床研究来验证。 E-钙黏连蛋白的表达缺失是第一代SRL 耐药的独立危险因素, 也有认为是作为稀疏颗粒型腺瘤的一种表达形式[32-33]。Ki-67 是一种核抗原,与肿瘤的增殖和侵袭相关,目前的研究报道提示,Ki-67 高表达预示第一代SRL 反应较差, 是否可以将第二代SRL作为一线治疗目前仍有争议[34-35]。对于未手术的患者,二十世纪八九十年代开始就有通过短效OST 预测长期SST 以及SRL 的疗效[36],对于OST 预测SRL 疗效的临床价值,以及通过GH 最低抑制值还是GH 抑制率来作为独立指标判断OST 有效性,在不同的研究中有争议(见表1)[37-45]。
关于术前药物治疗
目前的指南不推荐对所有肢端肥大症患者进行术前药物治疗。 对不适合接受手术的患者,如全身情况较差,有严重肢端肥大症全身表现如心功能不全、 重度鼻咽部软组织肿胀、睡眠呼吸暂停综合征,严重高血压和未控制的糖尿病不适合手术的患者,优先推荐SRL 治疗,在一般情况改善后可择期手术治疗[46]。针对预期手术无法切除的大腺瘤且无肿瘤压迫症状的患者,可以考虑优先使用药物治疗。 药物治疗可以不同程度缩小肿瘤的体积, 可能提高术后的生化缓解率[47],尤其是侵袭性肿瘤患者,对预后有改善效果。也有文献报道术前的SRL 仅可短期内提高术后生化缓解率, 术后长期的生化缓解率无明显差异[48]。
关于联合用药
在第一代SRL 单药治疗最大剂量/最大耐受剂量后仍未达到生化控制者,除去再次手术及放射治疗,可以根据患者的肿瘤残留情况、糖耐量异常情况、生化指标、临床表现可酌情换用第二代SRL、派格索曼等,或者联合药物治疗。 联合使用作用机制不同的药物可以提高患者的生化缓解率[49-50]。较为常见的方案是SRL 治疗的基础上增加DA 联合[51-52]以及与GHRa(PEG)联合治疗[53-54],联合治疗可以在原有基础上进一步降低激素水平,提升缓解率。 也有部分文献报道了DA+PEG 联合治疗的方案[55-56],可以进一步降低基线的IGF-1 水平。 女性、体重、基线IGF-1 水平、PRL 水平与联合治疗效果相关。

