广西普通油茶果及林地土壤持久性有机污染物分布特征
黄小芮,刘晓玲,栾 洁,周静宣,曾永明,陈松武
(广西壮族自治区林业科学研究院,广西南宁 530002)
普通油茶(Camelliaoleifera)为山茶科(Theaceae)常绿小乔木,是我国南方丘陵地区特有的油料资源树种[1]。普通油茶果富含油脂且含有大量易吸收的类黄酮物质,具有预防高血压、心血管疾病、抗衰老和提高机体免疫力等功效,还可作为润滑油、防锈油[2-3]。作为广西近年主要栽培的经济树种之一,普通油茶种植面积位列全国第3[4]。截至2021年,广西普通油茶林面积达55万公顷,普通油茶籽年产量达30万吨[5]。土壤可为普通油茶的生长发育提供养分,化肥在农业生产中被大量使用,导致部分区域土壤存在污染风险[6]。为降低普通油茶产地土壤污染风险,保障普通油茶果的产量与品质,开展普通油茶果及林地土壤污染物的污染水平研究,有助于更好地了解广西普通油茶产地污染现状。
持久性有机污染物(Persistent Organic Pollutants,POPs)是一类能通过空气、水流和土壤等途径在环境中实现迁移和生物积累的有机污染物,易积累且难降解[7]。POPs 包括多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)、多氯联苯(Polychlorinated Biphenyls,PCBs)、有机氯(Organochlorine Pesticides,OCPs)和邻苯二甲酸酯(Phthalic Acid Esters,PAEs)等。食品中的POPs 含量易在植物生长和加工过程中因污染而积累,对人体健康构成潜在风险。POPs易在油脂丰富的植物中积累,随普通油茶种植面积的快速增长,普通油茶产地环境风险逐渐上升,普通油茶的POPs含量也引起了研究人员的关注。目前,相关研究表明普通油茶籽和成品油茶籽油中均有POPs 检出;湖南省、江西省和浙江省的普通油茶果、林地土壤中均可检测出PAHs、PCBs 和OCPs[8-9],普通油茶籽油和成品茶油中均检测出PAHs[10-12]、PAEs[13-16]。
鉴于普通油茶存在潜在的POPs污染风险,本研究选取广西普通油茶果及林地土壤为研究对象,在广西普通油茶产地内选择48个采样点,采用气相色谱-三重四极杆串联质谱(GC-MS/MS)建立74 种POPs 同时检测的SOP 方法。将POPs 分为PAHs、PCBs、OCPs 和PAEs 4 大类,分析POPs 在普通油茶果及林地土壤的分布特征,以期更好地了解广西普通油茶产地的污染状况,并为普通油茶的质量研究提供数据支持。
1 材料与方法
1.1 样品采集和制备
在广西普通油茶主产区柳州市、来宾市和百色市,分别选择1 个距离工业污染区较近的普通油茶种植区域,以污染最严重区域设为污染源(圆心),采用同心圆布点法[17],距离污染源半径10 km区域为预计重度污染区域(A);距离污染源半径10~30 km区域为预计中度污染区域(B);距离污染源半径30~50 km 区域为预计轻度污染区域(C);距离污染源半径50~100 km 区域为预计安全区域(D),在每个区域主导风的下风向分散设置4 个采样点(表1)。采样点的土壤采集深度为0~15 cm;将土壤带回实验室风干,粉碎后过100 目筛,常温保存。采集新鲜普通油茶果,带回实验室,将其分离成种皮、壳和籽仁,打碎,冷冻保存。3 个城市共计采集48 个采样点的48批普通油茶果及其对应的土壤,普通油茶果分离后分别得到48份种皮、壳和籽仁。
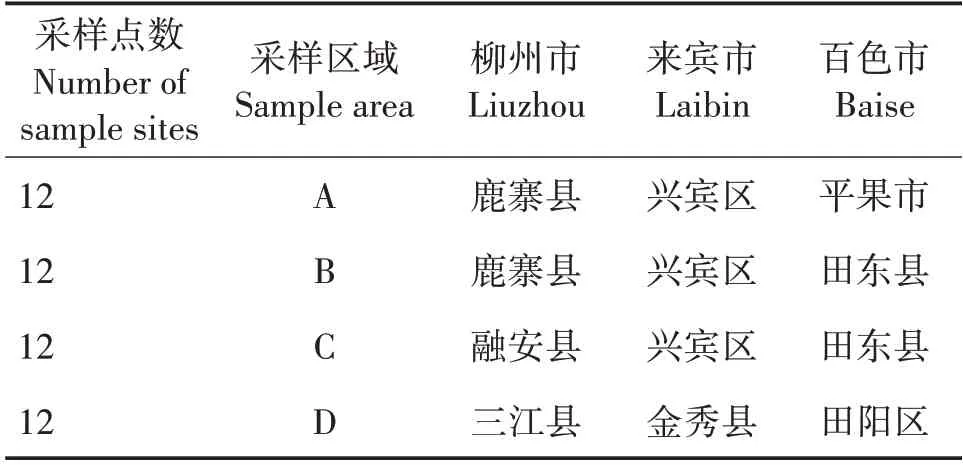
表1 采样点分布Tab.1 Distributions of sample sites
1.2 试验试剂和仪器
1.2.1 试验试剂
本试验使用74 种POPs 及其内标,包含了16 种PAHs、17 种PCBs、23 种OCPs 和18 种PAEs 及5种PAHs 氘代内标、PCB 198(内标)、外环氧七氯B(内标)和16种PAEs 内标,均购于北京曼哈格生物技术公司。
16种PAHs和其内标为萘(Nap)、苊烯(Acy)、苊(Ace)、芴(Flu)、菲(Phe)、蒽(An)、荧蒽(Fl)、芘(Pyr)、苯并(a)蒽(BaA)、屈(Chr)、苯并(b)荧蒽(BbF)、苯并(k)荧蒽(BkF)、苯并(a)芘(BaP)、茚并(1,2,3-cd)芘(InP)、二苯并(a,h)蒽(DahA)和苯并(g,h,i)苝(BghiP)及萘-D8、苊-D10、菲-D10、屈-D12和芘-D12。17种PCBs和其内标为PCB 3、PCB 8、PCB 18、PCB 29、PCB 50、PCB 28+PCB 31、PCB 52、PCB 44、PCB 101、PCB 149、PCB 118、PCB 153、PCB 138、PCB 180、PCB 194、PCB 206 和PCB 209 及PCB 198。23 种OCPs 和其内标为六氯苯、α-六六六、δ-六六六、γ-六六六(林丹)、β-六六六、七氯、艾氏剂、反-氯丹、顺-氯丹、α-硫丹、β-硫丹、狄氏剂、异狄氏剂、异狄氏醛、硫丹硫酸盐、异狄氏剂酮、甲氧滴滴涕、o,p′-DDE、p,p′-DDE、p,p′-DDD、o,p′-DDT、p,p′-DDT 和灭蚁灵及外环氧七氯B。18 种PAEs 为DMP、DEP、DIBP、DBP、DMEP、BMPP、DEEP、DPP、DHXP、BBP、DBEP、DCHP、DEHP、DNOP、DNP、DINP、DPHP 和DAP。16 种PAES 内标为D4-DMP、D4-DEP、D4-DIBP、D4-DBP、D4-DMEP、D4-BMPP、D4-DEEP、D4-DPP、D4-DHXP、D4-BBP、D4-DBEP、D4-DCHP、D4-DEHP、D4-DPHP、D4-DNOP和D4-DNP。
用于提取、纯化POPs的乙腈(色谱纯)、丙酮(色谱纯)和正己烷(色谱纯)购于安徽天地高纯溶剂有限公司;异辛烷(色谱纯)购于美国天地有限公司;NaCl、无水MgSO4、PSA(N-丙基乙二胺)、纳米碳粉和无水Na2SO4购于上海麦克林生化科技股份有限公司;C18色谱柱、Florisil购于StanQuik公司。
1.2.2 试验仪器
CE622-1CCN 电子天平购于赛多利斯科学仪器(北京)有限公司,用于样品和药品的称量;TDZ5 高速离心机购于湖南赫西仪器装备有限公司,用于离心样品;M32 全自动高通量平行浓缩仪购于北京莱伯泰科仪器股份有限公司,用于提取样品POPs时的快速浓缩;GCMS-TQ8050NX 气质联用仪(GC-MS/MS)购于岛津(香港)有限公司,用于样品POPs 含量的测定。
1.3 检测方法
依据《植物性食品中有机氯和拟除虫菊酯类农药多种残留量的测定》(GB/T 5009.146—2008)[18]、《食品安全国家标准食品中指示性多氯联苯含量的测定》(GB 5009.190—2014)[19]、《食品安全国家标准食品中多环芳烃的测定》(GB 5009.265—2021)[20]和《食品安全国家标准食品中邻苯二甲酸酯的测定》(GB 5009.271—2016)[21],建立普通油茶果和林地土壤POPs检测的SOP方法。
1.3.1 样品前处理
分别称取研磨好的种皮、壳和籽仁10 g 放于50 mL离心管中,依次加入20 mL 乙腈溶液、约2 g NaCl用于盐析;涡旋萃取,10 000 r/min 离心3 min,取上清液转移至含有MgSO4、C18、PSA 和纳米碳粉的离心管中,涡旋混合;将混合液10 000 r/min 离心3 min,取2 mL 上清液于40 ℃氮气吹干;加入内标溶液,再次于40 ℃氮气吹干,用1 mL 丙酮-异辛烷溶液(V丙酮∶V异辛烷=1∶1)复溶,获得待测种皮、壳和籽仁样品。
称取5 g 已过筛的土壤样品放于50 mL 离心管中,用20 mL丙酮-正己烷溶液(V丙酮∶V正己烷=1∶1)超声、涡旋混合萃取,10 000 r/min 离心3 min,取上清液转移至复合固相萃取小柱(从下至上为Florisil、C18、PSA 和无水Na2SO4),收集淋洗液于40 ℃氮气吹干;加入内标溶液,再次于40 ℃氮气吹干,用1 mL丙酮-异辛烷溶液(V丙酮∶V异辛烷=1∶1)复溶,得待测林地土壤样品。
1.3.2 样品检测
将待测样品过0.22 μm有机滤膜,采用GC-MS/MS测定。
GC 条件:Rtx-5MS 毛细管色谱柱(30 m×0.25 mm×0.25 μm);升温程序为初始温度60 ℃,以40 ℃/min 升温至150 ℃,保持1 min,再以10 ℃/min升温至170 ℃,保持1 min,再以10 ℃/min 升温至220 ℃,保持1 min,最后以5 ℃/min升温至310 ℃,保持3 min;进样口温度为290 ℃;载气为高纯氦气(99.999%),载气流速1.0 mL/min;不分流进样,进样量1.0 μL。
MS 条件:电子轰击(EI)离子源,电离能量70 eV,离子源温度280 ℃,传输线温度290 ℃,溶剂延迟4 min。
48 个采样点采集回来的土壤、种皮、壳和籽仁样品各为1批次,每批次样品均设置一组平行双样;林地土壤样品设置1 组方法空白,普通油茶果样品设置1组方法空白,采用内标法定量样品中的POPs,各POPs 单体的检出限为0.27~60.00 μg/kg,在0~250 μg/kg范围内线性良好,R2均大于0.999。
1.4 数据处理
采用Excel 2016 和Origin 2018 软件进行数据处理与分析;采用Excel 2016软件绘图。
2 结果与分析
2.1 普通油茶林地土壤与种皮、壳和籽仁POPs 污染水平
2.1.1 PAHs污染水平
林地土壤及种皮、壳和籽仁主要PAHs为苊、菲、荧蒽、苯并(a)蒽、苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、茚并(1,2,3-cd)芘、二苯并(a,h)蒽和苯并(g,h,i)苝(图1)。10种PAHs在普通油茶果内的平均含量均较低,表明PAHs 在普通油茶果内污染水平均较低。菲、荧蒽、苯并(b)荧蒽和苯并(g,h,i)苝主要分布在土壤中,说明普通油茶果中这些PAHs可能是从土壤中吸收而来。

图1 普通油茶林地土壤及种皮、壳和籽仁中多环芳烃分布情况Fig.1 Distributions of PAHs in C.oleifera forest soils,seed coats,shells and kernels
2.1.2 PCBs污染水平
普通油茶果和林地土壤的PCBs污染程度较轻,含量均在4 μg/kg 以下(图2)。林地土壤的PCB 52和PCB 8 平均含量分别为1.55 和0.71 μg/kg,高于种皮、壳和籽仁(0.56~0.61、0.01~0.02 μg/kg),说明PCB 52和PCB 8在土壤中富集能力较大。林地土壤的PCB 28+PCB 31、PCB 3、PCB 18、PCB 44、PCB 101、PCB 194、PCB 209、PCB 153、PCB 138、PCB 180 和PCB 29 平均含量与种皮、壳和籽仁接近,表明普通油茶果可以富集这些物质,林地土壤和普通油茶果中富集程度差不多。种皮、壳和籽仁的PCB 118 平均含量高于林地土壤,说明普通油茶果中的这种PCB可能不仅来源于土壤,也来源于大气,在普通油茶果中容易富集。籽仁的PCB 149 和PCB 206 平均含量高于林地土壤、种皮和壳,表明PCB 149 和PCB 206可能具有亲脂性,易在籽仁中富集。
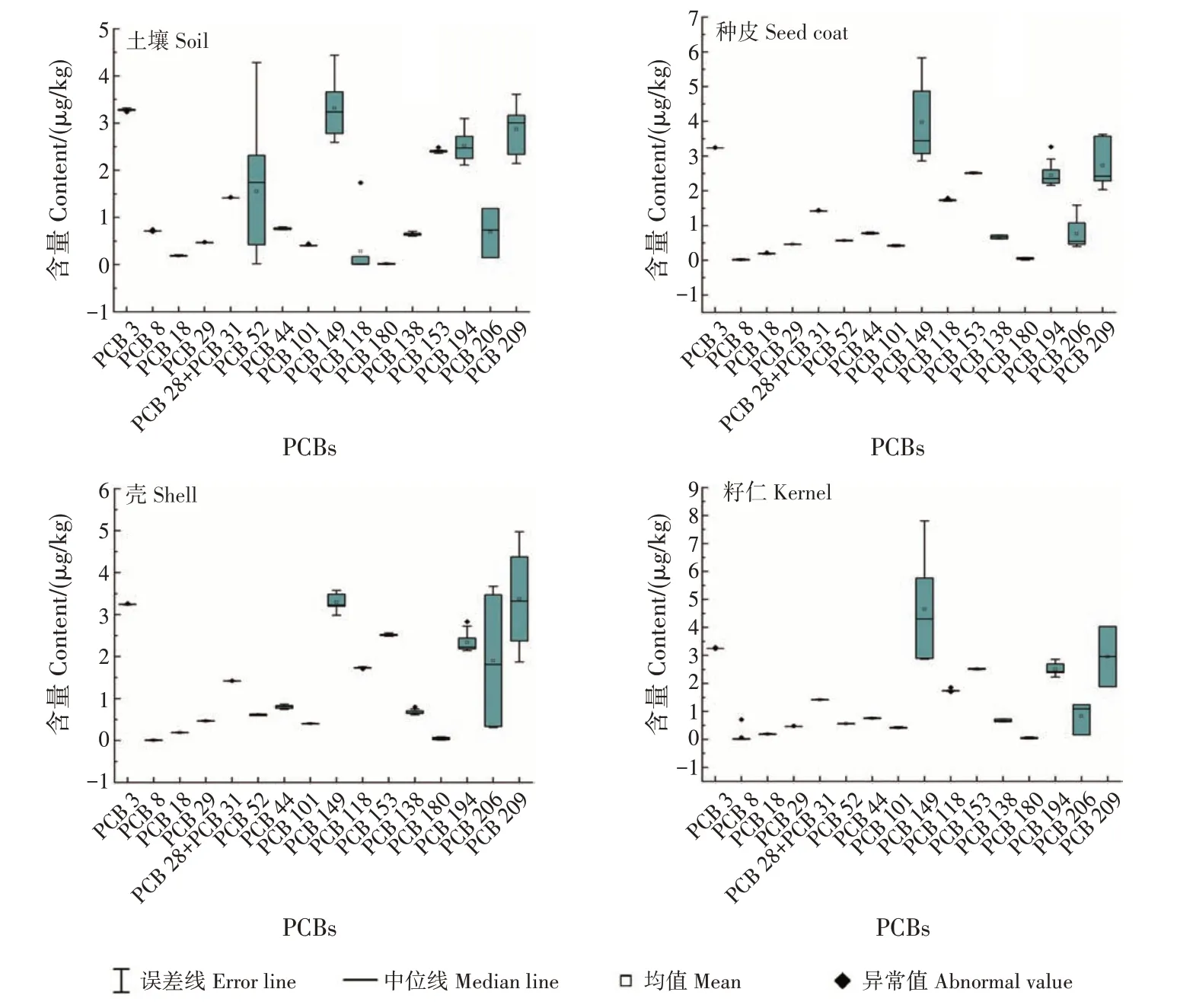
图2 普通油茶林地土壤及种皮、壳和籽仁中多氯联苯分布情况Fig.2 Distributions of PCBs in C.oleifera forest soils,seed coats,shells and kernels
2.1.3 OCPs污染水平
除了α-六六六,林地土壤及种皮、壳和籽仁中共检测到22种OCPs(图3)。在林地土壤及种皮、壳和籽仁中,六氯苯和狄氏剂的平均含量相近,说明这些OCPs富集程度相差不大。林地土壤主要OCPs为γ-六六六(林丹)、七氯、异狄氏醛和硫丹硫酸盐,种皮、壳和籽仁主要OCPs均为γ-六六六(林丹)、七氯、p,p′-DDT和异狄氏酮。
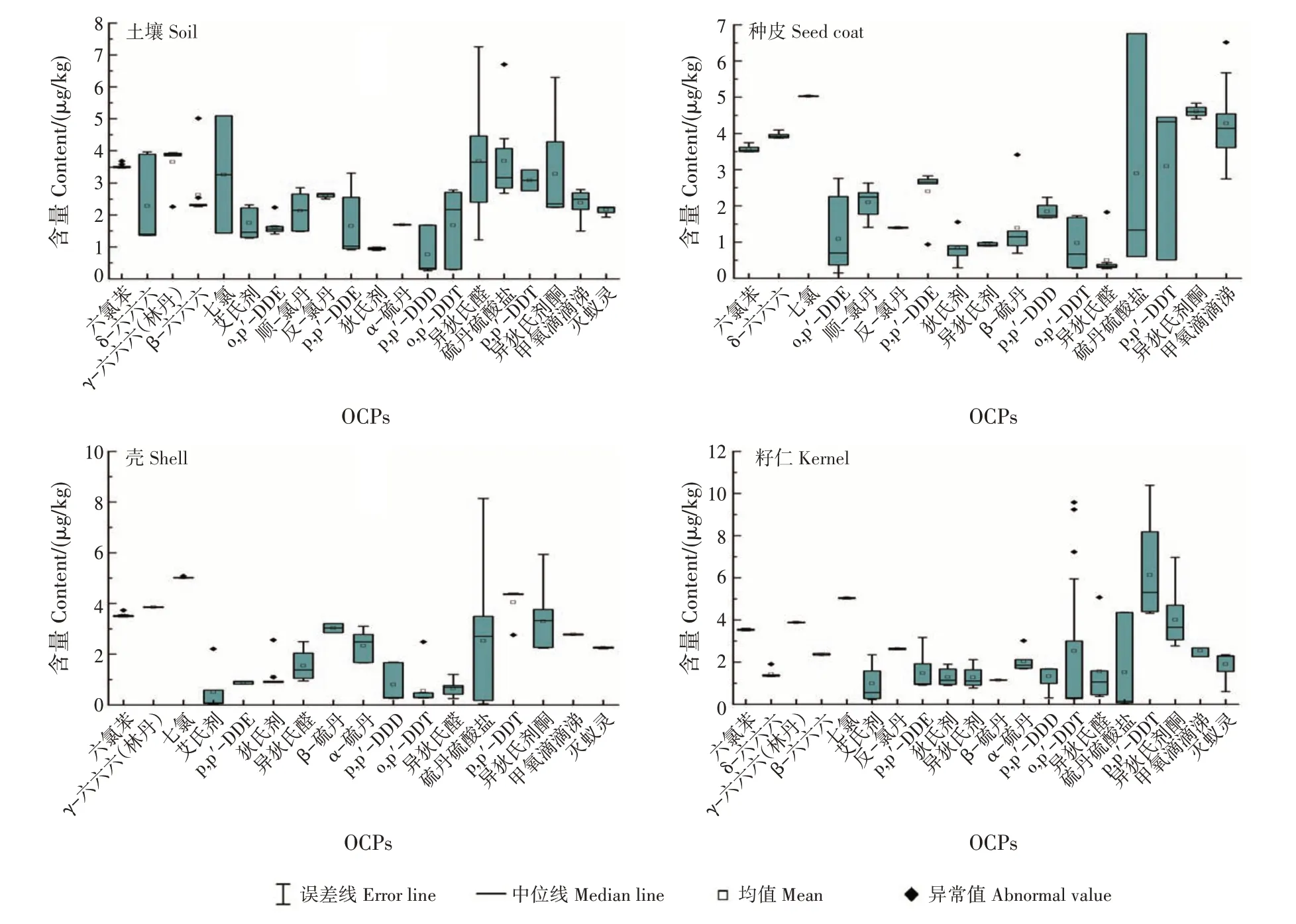
图3 普通油茶林地土壤及种皮、壳和籽仁中有机氯分布情况Fig.3 Distributions of OCPs in C.oleifera forest soils,seed coats,shells and kernels
2.1.4 PAEs污染水平
林地土壤及种皮、壳和籽仁中均能检测到DMP、DIBP、DBP 和DCHP,其中DBP、DCHP 和DIBP 平均含量均较高,需要持续关注其是否具有食用安全风险(图4)。其他10 种PAEs 在林地土壤和普通油茶果中没有检出或者平均含量极低。壳、种皮和籽仁的PAEs 平均含量均低于林地土壤。
图4 普通油茶林地土壤及种皮、壳和籽仁中邻苯二甲酸酯分布情况Fig.4 Distributions of PAEs in C.oleifera forest soils,seed coats,shells and kernels
2.2 普通油茶林地土壤与种皮、壳和籽仁不同POPs总含量
PAHs 总含量在林地土壤及种皮、壳和籽仁中的总含量分别为615.45、284.83、268.56 和235.65 μg/kg;PCBs 总含量分别为286.73、200.46、192.83 和172.39 μg/kg(图5)。PAHs、PCBs 物质在土壤中的总含量均高于种皮、壳和籽仁,说明这些污染物不容易在普通油茶果内富集,不会对普通油茶果的食用安全造成影响。
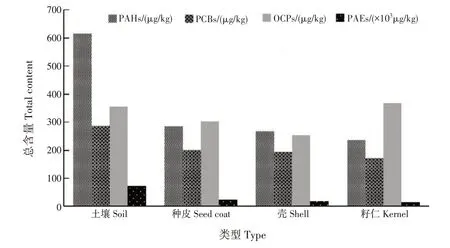
图5 普通油茶林地土壤及壳、种皮和籽仁中POPs总含量Fig.5 Total contents of POPs in C.oleifera forest soils,shells,seed coats and kernels
OCPs在林地土壤及种皮、壳和籽仁中的总含量分别为355.80、302.66、252.95 和367.69 μg/kg;林地土壤和籽仁的OCPs总含量较高。
PAEs在林地土壤及种皮、壳和籽仁的总含量分别为73.25×103、24.15×103、17.22×103和14.77×103μg/kg,PAEs 在4 种POPs 中含量最高,远远高于其他3种POPs。
3 结 论
本研究对广西柳州市、百色市和来宾市3 个普通油茶主产区的林地土壤及种皮、壳和籽仁POPs污染水平进行分析。结果发现,PAHs、PCBs 物质不易在种皮、壳和籽仁富集,但对于土壤中的含量应加以控制。环境中的PAHs 来源于不充分燃烧的有机物[22],林地附近应减少有机物燃烧,降低多环芳烃污染程度。PCBs常被用作润滑剂和增塑剂等,与生物质炭易结合[23];可增加炭基肥的施用量增强土壤的净化能力。OCPs普遍存在于林地土壤及种皮、壳和籽仁,可能是使用含有机氯的农药、化肥及工业污染[24];OCPs 的亲脂性较强,最终积累在籽仁中。PAEs 在林地土壤及种皮、壳和籽仁中的含量均较高,这是由于主产区有塑料污染;在高温多雨地区,塑料中的PAEs更容易向环境迁移[25],在以后的研究中可进一步监控PAEs的污染情况。
利益冲突:所有作者声明无利益冲突。
作者贡献声明:黄小芮负责数据收集与分析、论文撰写与修改和文献检索;刘晓玲负责研究计划制定、试验调查;栾洁负责文献检索;周静宣负责样品处理;曾永明负责研究计划制定、数据收集与分析;陈松武负责研究计划制定、统筹实施。

