山羊PGRMC1基因序列分析及表达特性分析
李 安,李瑞文,王 永,王友利,李艳艳,刘 伟,林亚秋
(1.西南民族大学畜牧兽医学院,四川 成都 610041; 2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;3.青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041; 4.电子科技大学医学院附属妇女儿童医院,四川 成都 610041; 5.成都市妇女儿童中心医院,四川 成都 610041)
随着生活水平的不断提高,人们对肉质要求也越来越高;山羊肉因其具有低胆固醇、肉质好、口感风味优美等特点,作为一种良好的食品资源深受消费者的青睐.皮下脂肪细胞具有较高的饱和脂肪酸会导致冠心病和动脉硬化等疾病的发生[1],并且会引起肉质风味的改变[2],皮下脂肪细胞分化,受众多基因复杂而密切的调控.
孕酮素受体膜成分1(Progesterone receptor membrane component 1,PCRMC1)是一种血红素结合蛋白,可结合并调节细胞色素P450酶的活性,进而影响多种生化途径和药物代谢[3].PGRMC1涉及类固醇生成,孕酮(P4)信号传导,膜运输,以及有丝分裂纺锤体和细胞周期调节等多种功能[4];PGRMC1还参与激素和胆固醇合成以及介导化学抗性[5].PGRMC1不仅抑制卵巢颗粒细胞的增殖与凋亡,进而影响卵泡细胞发育[6].此外,PGRMC1具有多种调控功能,包括神经元导向孕酮反应、类固醇生成和甲羟戊酸途径的调节等[7].PGRMC1对人、小鼠、绵羊等多种物种胆固醇合成与代谢至关重要[8],如PGRMC1通过促进小鼠脂肪细胞中的脂质积累进而导致肥胖小鼠的生成,并且在小鼠脂肪组织特异性敲除PGRMC1显著抑制高脂肪饮食诱导的脂肪细胞肥大[9].PGRMC1在人的多种组织中表达如肺、结肠、甲状腺、乳腺、卵巢和子宫颈[10].
以上研究结果表明PGRMC1对多种生命活动具有重要作用,并且对脂质的积累以及脂肪细胞的肥大具有一定的调控作用,然而PGRMC1在山羊上研究少有报道.因此本研究采用RT-PCR技术克隆山羊PGRMC1基因序列,并运用生物信息学软件及在线工具对山羊PGRMC1基因进行生物信息学分析.利用荧光定量PCR技术(Real-time fluorescence quantitative PCR, RT-qPCR)技术检测PGRMC1在山羊不同组织及脂肪细胞分化不同阶段的表达水平.研究结果将为阐明PGRMC1的生物学功能及经济畜种的肉质改良提供基础数据及参考.
1 实验材料与方法
1.1 实验材料
采集了标准条件下饲养的简州大耳羊(n=8)的组织,心、肝、脾、肺、肾、背最长肌,分别放入冷冻管后放入液氮罐中保存,并送至实验室,用于总RNA的提取.
1.2 实验方法
根据Genbank中的山羊预测序列(登录号:XM_018044217.1)通过软件Primer Premier 5.0设计引物见表1.PCR总反应体系为(25 μL),1 μL山羊小肠组织,1 μL PCR正向引物,1 μL反向引物,12.5 μLTaq酶,9.5 μL ddH2O.PCR反应条件为:95 ℃预变性3 min,94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸2 min,38个循环;最后在72 ℃条件下延伸10 min.通过2%琼脂糖凝胶电泳检测PCR产物,使用胶回收试剂盒纯化和回收产物.将纯化回收的产物链接至PMD-19T载体,转化至DH5α感受态细胞.接种于含Amp+的LB固体培养基中,培养箱孵育过夜.对阳性菌落PCR验证,并送上海生工生物工程有限公司测序.

表1 引物信息Table 1 primer information
1.3 序列分析
克隆获得的山羊PGRMC1序列利用表2的分析方法进行序列分析.
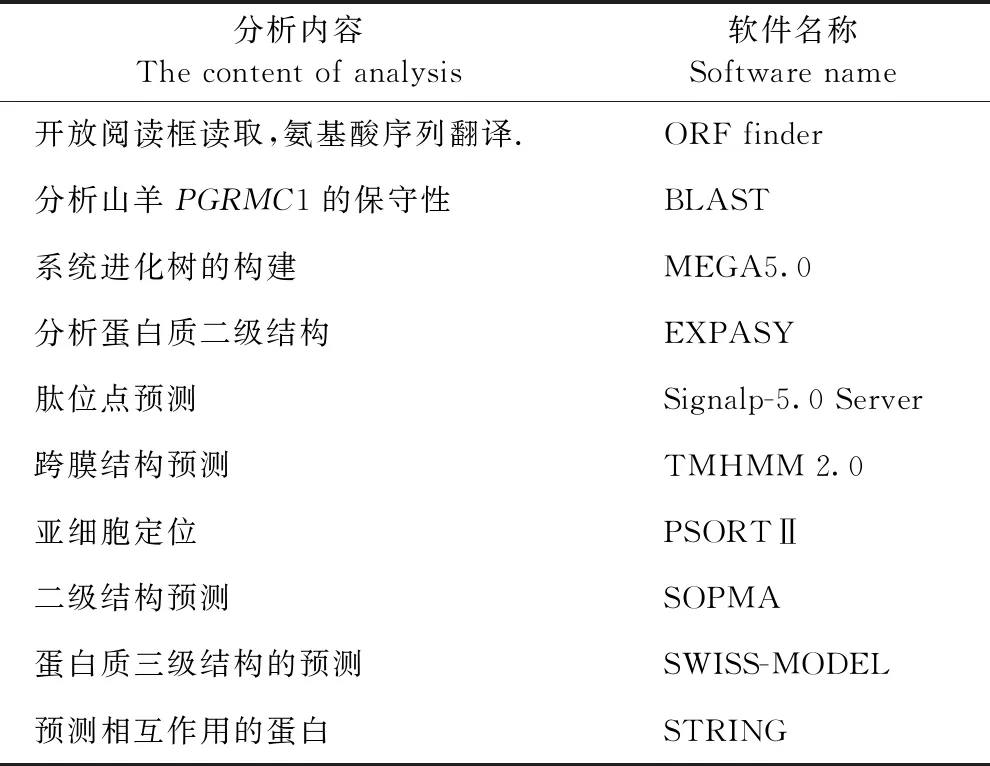
表2 生物信息学分析软件及其分析内容Table 2 Bioinformatic analysis software and its analysis content
1.4 山羊PGRMC1的组织差异表达分析
以山羊各组织作为cDNA进行RT-qPCR,进而检测PGRMC1的组织表达水平,以UXT作为内参基因,矫正基因的表达水平.在克隆获得山羊PGRMC1基因序列的基础上,设计定量引物见表1.RT-qPCR反应程序为:预变性95 ℃,3 min),变性(95 ℃,10 s),退火(60 ℃,10 s)和延伸(72 ℃,15 s),其中变性、退火和延伸,共40个循环.采用2-ΔΔCt法对RT-qPCR数据进行分析.
1.5 山羊PGRMC1在皮下前体脂肪细胞分化过程中的差异表达分析
复苏实验室前期保存的皮下前体脂肪细胞,待长至F2时进行诱导分化,分别收取培养不同时期(0、12、24、36、48、60、72、84、96、108、120 h)细胞总RNA,反转录后作为cDNA,利用RT-qPCR检测PGRMC1在皮下脂肪细胞不同分化时期的表达水平.方法同上.
2 结果
2.1 山羊PGRMC1基因的克隆
本研究通过RT-PCR成功克隆获得山羊PGRMC1基因序列1024 bp,其中5′UTR 区域111 bp,3′UTR区域为342 bp,CDS区585 bp,编码194个氨基酸(图1).
2.2 山羊PGRMC1基因序列分析
山羊PGRMC1的核苷酸序列与其他物种如绵羊、牛、猪、羊驼、猩猩、人、马、猫、骆驼、和狐狸的相似程度为88.79%~99.69%不等(表3).表明PGRMC1基因在不同物种间具有高度保守性.
蛋白质理化性质分析发现,山羊PGRMC1分子式为C958H1484N254O309S4;分子量为21 632.08,亮氨酸在氨基酸中含量最高为11.9%,其次为天冬氨酸(11.3%)、谷氨酸(8.8%)、甘氨酸(8.2%),酪氨酸含量最低(0.5%)(图2a).带正电荷(Arg+Lys)的氨基酸总数为39大于带负电荷(Asp+Lys)的氨基酸数目为23,表明PGRMC1蛋白带正电荷;理论等电点PI(Protein isoelectric point)为 4.54,亲水性总平均值为-0.614,不稳定指数为 46.65,因此,预测PGRMC1蛋白为酸性亲水不稳定蛋白.磷酸化位点预测显示山羊PGRMC1有28个磷酸化位点,其中包括丝氨酸(Ser)磷酸化位点11个,苏氨酸(Thr)磷酸化位点11个,酪氨酸(Tyr)磷酸化位点6个.山羊 PGRMC1没有跨膜结构域,且无信号肽;亚细胞定位表明其主要存在于细胞质(39.1% )中其次为细胞核(34.8%),线粒体(17.4%),过氧化物酶体(4.3%)和高尔基体(4.3%)(图2b).

图1 山羊PGRMC1基因核苷酸序列Fig.1 Goat PGRMC gene nucleotide sequence

表3 山羊与其他物种核苷酸相似度比对Table 3 Nucleotide similarity comparison between goats and other species
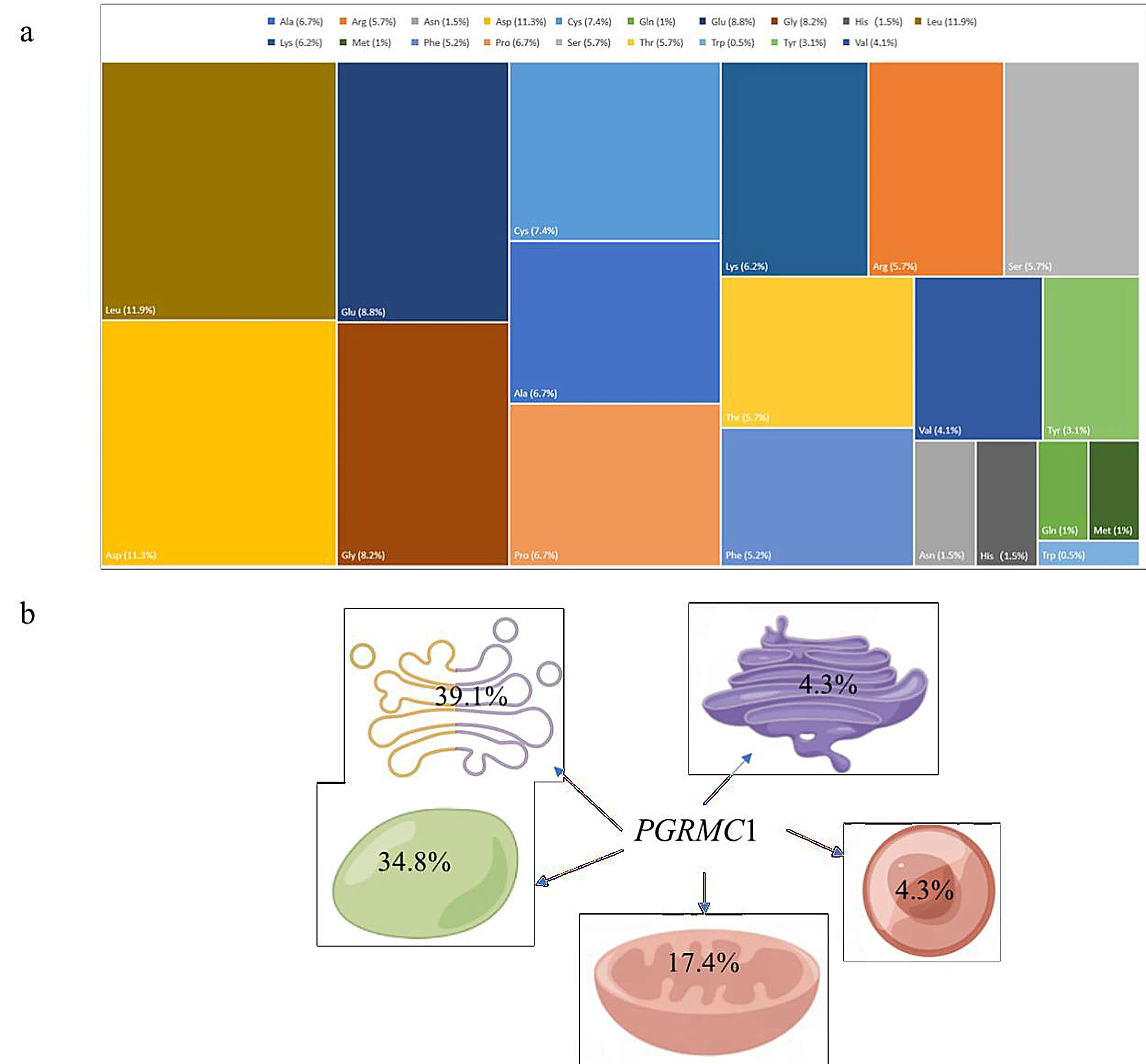
图2 山羊PGRMC1序列分析Fig.2 Goat PGRMC1 sequence analysisa.氨基酸含量分析;b.亚细胞定位分析a.Amino acid content analysis;b.Subcellular localization analysis
2.3 蛋白质二级结构预测分析
蛋白分析表明山羊PGRMC1具有135个氨基酸,有35个氨基酸可能形成α螺旋,15个氨基酸可能形成延伸链,4个氨基酸可能形成β螺旋,81个氨基酸可能形成无规则圈曲(图3a).蛋白质三级结构预测结果与二级结构一致(图3b).蛋白质相互作用分析表明山羊PGRMC1可能与EGFR,PAQR9, CYP20A1,CYB5A,CYP1A2,POGK, MRPL30和MTD1等蛋白具有相互作用(图3c).
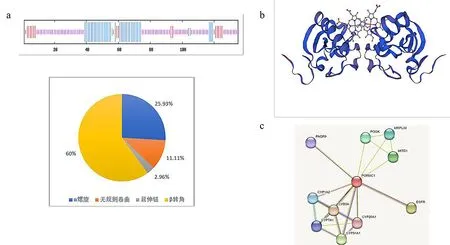
图3 山羊PGRMC1蛋白的结构分析Fig.3 Structural analysis of PGRMC1 protein in goatsa.PGRMC1二级结构;b.PGRMC1三级结构;c.PGRMC1与其他基因相互作用的网络a.PGRMC1 secondary structure;b.PGRMC1 tertiary structure;c.Networks in which PGRMC1 interacts with other genes
2.4 山羊PGRMC1系统进化树分析
通过MEGA5.0软件,对山羊PGRMC1的进化过程进行了分析(图4),通过构建进化树表明山羊与绵羊亲缘关系最近,与马的亲缘关系最远,符合物种的进化规律.
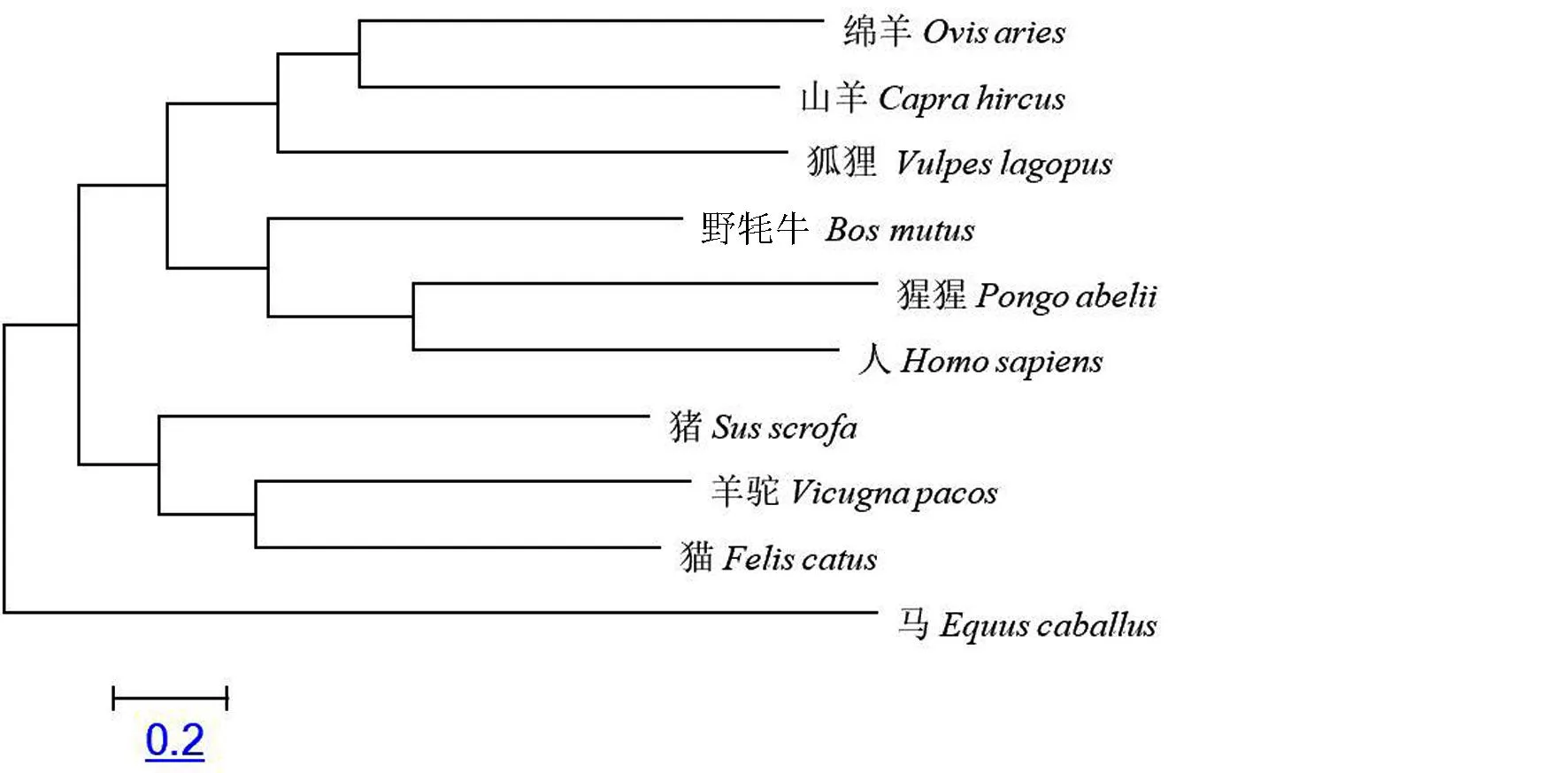
图4 PGRMC1基因系统进化树Fig.4 PGRMC1 gene phylogenetic tree
2.5 山羊PGRMC1的组织表达分析
通过RT-qPCR方法检测山羊PGRMC1在各组织中的表达水平,如图5所示山羊PGRMC1在山羊心、肝、脾、肺、肾、背最长肌中均有表达,其中在肝中的表达量极显著高于其他组织(P<0.01),其次是在背最长肌和脾脏中的表达水平较高且显著高于肝脏之外的组织(P< 0.05),在心、肺和肾中的表达水平相对较低;表明山羊PGRMC1具有组织表达特异性.
2.6 山羊PGRMC1在皮下脂肪细胞分化过程中的表达分析
利用RT-qPCR检测山羊PGRMC1在皮下脂肪细胞不同分化时期的表达水平变化(图6).结果表明随着分化的进行,与对照组相比,山羊PGRMC1的表达水平呈上升趋势,且在96 h时的表达量最高,显著高于其余时间段(P< 0.05).
3 讨论
研究表明PGRMC1与许多生物反应过程相关[11],但在山羊中的研究较少,其序列特征、组织表达特性及在脂肪细胞分化过程中是否具有调控作用尚不清楚.本研究克隆获得山羊PGRMC1基因序列1 024 bp,其中包括 CDS区585 bp,编码194氨基酸.磷酸化位点预测显示山羊PGRMC1有28个零酸化位点,主要发生在丝氨酸和苏氨酸上.磷酸化是蛋白质合成后的必要化学修饰,并且可以直接调节蛋白质各个方面的功能,因此山羊PGRMC1磷酸化位点对蛋白质的功能具有重要调控作用[12].亚细胞定位分析发现主要定位于细胞质和细胞核,这与Gras等人[13]的研究结果一致.山羊的PGRMC1的核苷酸及氨基酸序列与绵羊的相似度最高,并且在进化树中与绵羊的亲缘关系最近,表明山羊PGRMC1具有高度保守性并且符合物种的进化规律.
蛋白互作网络分析发现山羊PGRMC1蛋白可能与PAQR9、CYPB5A、EGFR等蛋白存在相互作用,Sandr等人发现PGRMC1与PAQR9通过协同作用调节孕酮(P4)的分泌来调节广泛的神经功能[14].有研究报道PGRMC1自身结构中的Cytb5结合CYB蛋白后可调控PGRMC1的表达[15],Ikhlas等人发现表皮生长因子受体(EGFR)是一种与癌症进展相关的跨膜受体酪氨酸激酶,PGRMC1 及其同源物与细胞信号传导有关,PGRMC1 增加了对 EGFR 抑制剂的敏感性,增加了质膜 EGFR 水平,并与 EGFR 共沉淀[16].此外PGRMC1可通过调控CYB的活性进而调控胆固醇的合成.综上所述山羊PGRMC1参与多种生物分子调控,并且可能脂肪合成过程.
为了探究山羊PGRMC1基因在各个组织中的表达模式,本研究选取心、肝、脾、肺、肾、背最长肌等几种组织进行检测,发现PGRMC1在各个组织中均有表达,且在肝中的表达量最高,其次是在背最长肌和脾脏中也存在较高水平的表达,但在心,肺和肾中的表达水平相对较低.高磊等人的研究表明绵羊PGRMC1在卵巢、子宫、肾和肝组织中表达丰度最高[17],Intlekofer等人证实PGRMC1在小鼠腹侧周核、脑视前区性别Ⅱ型神经元、腹内侧核、卵巢、骨骼肌等组织中也广泛表达[18].这些研究与本研究存在相似的是PGRMC1在肝中的表达量高,不同的是PGRMC1在山羊肾的表达量较低,而在绵羊中的表达量较高,表明PGRMC1的组织表达存在物种特异性.
作为动物的重要储能组织,皮下脂肪与脂肪的积累以及肉质的性状具有重要的关联;Zhang等人研究发现PGRMC1与脂肪细胞肥大相关[18],Furuhata等研究发现敲除PGRMC1显著抑制高脂肪饮食诱导的脂肪细胞肥大[9].本研究发现PGRMC1在分化后的山羊皮下脂肪细胞中表达水平高于分化前,且在96 h表达最高水平,推测其具有促进皮下脂肪细胞分化的作用,但具体机制还需做更深入的研究.
4 结论
本试验克隆得到山羊PGRMC1 基因序列1 024 bp,其中CDS区585 bp,编码194个氨基酸;5′UTR区域111 bp,3′UTR区域为342 bp.无信号肽且主要在细胞质中发挥生物学功能.PGRMC1基因在山羊肝中表达最高,并且伴随着皮下脂肪细胞的分化表达量发生变化,并随着脂肪细胞的分化整体表达量上调.以上结果表明PGRMC1可能对山羊脂肪细胞分化具有重要的调控作用,为最终阐明山羊PGRMC1基因功能提供重要的参考.

