蓝莲清瘟败毒饮方药抗艾滋病病毒作用机制的网络药理学分析及实验验证
秦明珍,陈路,刘钰,蓝鸣生,吕建楠,吴无畏*
(1.广西壮族自治区药用植物园,广西 南宁 530010;2.右江民族医学院附属医院,广西 百色 533099)
艾滋病是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染机体而产生的疾病。据联合国发布的最新数据统计,2020年全球共有3 770万艾滋病患者,其中新发150万人,68万人死于艾滋病相关疾病[1]。研究表明,应用抗反转录病毒药物治疗艾滋病具有良好的效果,但是随着药物使用规模增加以及治疗时间延长,HIV的耐药性也逐渐提高[2]。此外,抗反转录病毒药物与其他药物的联合使用可能会引起疗效降低以及不良反应,导致药物相互作用升高[3]。因此,开发具有抗HIV良好疗效同时副作用低的新药在治疗艾滋病难题上尤为重要。中药因其广谱药效以及低副作用,广泛应用于多种疾病的治疗,研究表明中药在治疗艾滋病及其并发症上显示出独特的优势。中药复方联合西药使用可以有效缓解艾滋病患者症状,提高免疫功能、改善焦虑情况等[4-5]。陈梅等[6]发现中药制剂唐草片联合西药抗病毒治疗,可以显著提高患者CD4+T细胞水平,减少副作用发生。此外,穿心莲、夏枯草、绞股蓝等中药也具有良好的抗HIV和治疗艾滋病的效果[7-10]。
蓝莲清瘟败毒饮方药(简称蓝莲方药)是根据收集的广西壮瑶药抗病毒民间验方改进而来的复方,包括穿心莲、桔梗、南板蓝根、党参、夏枯草、绞股蓝、黄芩、栀子和罗汉果。艾滋病属于中医之疫毒范畴[11]。表现为正气不足,感染湿热疫毒所致,且邪毒迅速传内恶化,损伤脏腑气血,以致湿热胶结,变证丛生。治宜清热解毒,凉血散结,益气扶正。根据中医理论,蓝莲方药重用南板蓝根清热解毒,凉血散结,善解瘟疫时毒。穿心莲清热解毒,燥湿凉血。蓝莲合用为君药,清瘟辟疫,凉血败毒以治病因。黄芩清热燥湿,凉血解毒,亦善清湿热疫毒。栀子泻火除烦,清热利湿,凉血解毒,消肿止痛。二者既增凉血解毒之效,又引三焦湿热火毒从下而去,使邪有出路,共为臣药。佐以夏枯草清热泻火,消散郁结。党参益气扶正,既可扶助正气,鼓邪外出,又能散中有补,不致耗伤正气;绞股蓝既清热解毒以助祛邪,又益气健脾以助固本。诸药合用,共奏清热解毒,凉血散结,益气扶正之功。本方的配伍特点是:祛邪扶正兼顾,祛邪为主。以君药辟疫解毒,臣药清热除湿,配小量补气药,祛邪不伤正,扶正不留邪。本文从蓝莲方药的中药成分出发,依托网络药理学方法开展了药理分析,并结合体外细胞学实验,验证方药抗HIV病毒的潜在活性并分析其分子机制,为后续的研究和临床应用提供理论和科学依据。
1 材料
1.1 药品与试剂蓝莲方药中药成分的来源及批号见表1;唐草片购自上海百岁行药业有限公司(批号:201112);TZM-bl细胞、293T细胞及假病毒包装质粒(pNL4-3.Luc.R-E-,pVSVG)由本实验室保存;转染试剂盒GenJet DNA In Vitro Transfection Reagent(美国SignaGen公司);荧光检测试剂盒ONE-Glo Luciferase Assay System(美国Promega公司)。

表1 蓝莲方药各中药成分来源及批号
1.2 仪器CI-191C二氧化碳细胞培养箱(美国Crystal公司);Infinite M200 Pro酶标仪(瑞士Tecan公司)等。
2 方法
2.1 药材制备分别称取蓝莲方药中药粉末:南板蓝根115 g、穿心莲94 g、黄芩58 g、夏枯草115 g、绞股蓝58 g、党参115 g、桔梗58 g、栀子58 g、罗汉果180 g。混匀后加70%乙醇回流提取两次,将提取液抽滤后水浴蒸发除去乙醇以及多余水分,收集浸膏A。将药渣再次提取后收集提取液并过滤,滤液蒸发浓缩到接近药材重量1.5倍时测定相对密度和浓缩液温度,当相对密度=1.10时,边搅拌边缓慢加入95%乙醇,使溶液含醇量达到70%。静置24 h后,将上清液与抽滤后的下层混悬液合并。水浴蒸发去除乙醇和多余水分,收集浸膏B。合并浸膏A和B,混匀后4 ℃保存。
唐草片处理:称取适量唐草片,研磨均匀后用去离子水充分溶解,过滤,4 ℃保存。
2.2 中药有效成分和潜在靶点筛选通过TCMSP数据库(https://old.tcmsp-e.com)查询各中药的化学成分,根据口服生物利用度(oral bioavailability,OB)≥30%且化合物类药性(drug like,DL)≥0.18的属性值筛选活性组分并获得相关的蛋白质靶点。根据已发表文献补充查找南板蓝根的化学结构组分,再将组分输入TCMSP平台获取化合物作用的蛋白质靶点。筛选结束后,将所有蛋白质靶点统一在Uniprot(http://beta.uniprot.org/)蛋白质数据库进行规范化。
2.3 疾病的相关靶点筛选以“HIV”为关键词在GeneCards数据库(https://www.genecards.org)、OMIM数据库(http://www.omim.org)、TTD数据库(http://db.idrblab.net)以及DrugBank数据库(https://go.drugbank.com)分别获取疾病的相关作用靶点,并将靶点进行合并。
2.4 生物学功能和通路富集分析将HIV和蓝莲方药的相关靶点利用R语言绘制成韦恩图,获取两者的交集基因。为进一步分析药物对HIV的分子作用机制,将交集基因导入Metascape数据库(http://metascape.org/gp/index.html),物种选择人类(H.sapiens),进行基因本体(gene ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。保存数据结果,利用微生信平台(http://www.bioinformatics.com.cn)分别绘制前20条通路的生物学过程(biological prpcess,BP)、细胞组分(cellular component,CC)和分子功能 (molecular function,MF)气泡图。采用Origin 8.0构建KEGG富集结果柱状图。
2.5 成分-靶点-通路网络图构建运用CytoScape 3.8.0构建HIV与蓝莲方药的成分-靶点-通路网络图,根据CytoScape内置分析工具“network analyze”计算网络图的拓扑参数,由参数中位数大小筛选关键成分与靶点,并分析主要的分子通路。
2.6 蛋白相互作用网络构建蛋白相互作用网络(protein-protein interaction network,PPI)是通过数据库将已知蛋白和预测蛋白的相互作用关系以网络图呈现出来,对研究疾病分子机制和关键靶点有重要作用。将蓝莲方药抗HIV的潜在靶点导入STRING数据库(https://cn.string-db.org),得到PPI相互作用网络。通过CytoScape 3.8.0对PPI网络进一步分析。
2.7 分子对接验证分子对接主要用于将小分子与蛋白质进行结构对接,预测分子结合位点并评估其互补分值[12]。本文通过分子对接分析主要活性成分与关键靶点的结合潜力。通过PDB数据库(https://www.rcsb.org/)获取蛋白结构,PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取配体小分子结构,采用AutoDock Tools 1.5.6软件对蛋白和配体结构文件进行去水、加氢、加电荷等预处理。利用AutoDock Vina 1.2.3将蛋白和配体分子进行对接,结果通过Pymol软件可视化分析。
2.8 HIV假病毒构建采用文献[13]的方法,将实验室保存的HIV假病毒包装质粒共转染293T细胞制备HIV假病毒。使用6孔细胞培养板,细胞浓度为5×105/孔,于 37 ℃、5% CO2的培养箱中培养细胞。24 h后进行质粒共转染,48 h后收集含假病毒的细胞上清,离心后置于-80 ℃冰箱冻存。
2.9 蓝莲方药细胞毒性试验实验分为蓝莲方药组、抗HIV中药唐草片组、无药物细胞对照组和无细胞对照组(只加培养基)。将药物溶解于DMEM完全培养基,配制成一定浓度梯度的培养液。使用96孔细胞培养板孵育TZM-bl细胞,每孔7 000个细胞,于37 ℃、5% CO2的培养箱中培养。24 h后换含药物的培养液继续培养。采用MTT染色法在酶标仪上检测细胞的化学发光值,即相对光单位(relative light unit,RLU),计算细胞活力(%)=RLU(药物组-无细胞对照组)/RLU(细胞对照组-无细胞对照组)×100%,Graphpad Prism 7软件得出药物对细胞的半数毒性浓度CC50。
2.10 蓝莲方药抗HIV假病毒实验实验分为蓝莲方药组(加蓝莲方药与HIV假病毒),蓝莲方药浓度分为65.625、13.125、2.625 μg·mL-1;唐草片组(加唐草片与HIV假病毒),唐草片浓度分为100、50、25 μg·mL-1;HIV假病毒对照组(只加HIV假病毒)和细胞对照组(不含HIV假病毒和药物)。以每孔10 μL HIV假病毒液感染TZM-bl细胞,添加DMEM完全培养基至100 μL,培养48 h后酶标仪检测细胞荧光发光值,得到5×106RLU·mL-1的HIV假病毒感染力。将HIV与不同浓度的药物共培养细胞,HIV假病毒每孔添加10 μL。TZM-bl细胞采用96孔黑色细胞培养板孵育,于37 ℃、5% CO2的培养箱中培养。各组细胞培养48 h后采用ONE-Glo Luciferase Assay System试剂盒对细胞进行荧光染色,酶标仪检测RLU值,Graphpad Prism 7软件计算药物对HIV假病毒的细胞半数抑制浓度IC50以及选择指数SI,SI=CC50/IC50。Origin 8.0绘制药物浓度与HIV假病毒感染率关系曲线图,HIV假病毒感染率(%)=RLU(药物组-细胞对照组)/RLU(HIV假病毒对照组-细胞对照组)×100%。
2.11 实时荧光定量PCR使用6孔板培养TZM-bl细胞,每孔2.5×105个细胞,于37 ℃、5% CO2的培养箱中培养24 h后更换含HIV或者药物的新鲜DMEM完全培养基。设置细胞对照组(无处理组)、HIV假病毒组(添加HIV假病毒液)、HIV+蓝莲方药组(添加HIV假病毒液与蓝莲方药)。培养24 h后收集各组细胞,根据试剂盒方法提取总RNA,反转录为cDNA,实时荧光定量PCR(quantitative Real-time PCR,qRT-PCR)检测各组细胞内基因的相对表达量,数据以2-△△Ct表示。筛选KEGG富集分析的主要信号通路分子AKT1、TNF-α以及IL-17为检测基因,内参基因为Actin,基因引物由擎科生物公司合成,引物序列见表2。qRT-PCR反应体系 20 μL,程序为:预热(95 ℃、30 s),扩增 (95 ℃、10 s, 58 ℃、15 s,72 ℃、15 s,共40个循环),冷却 (37 ℃、30 s)。
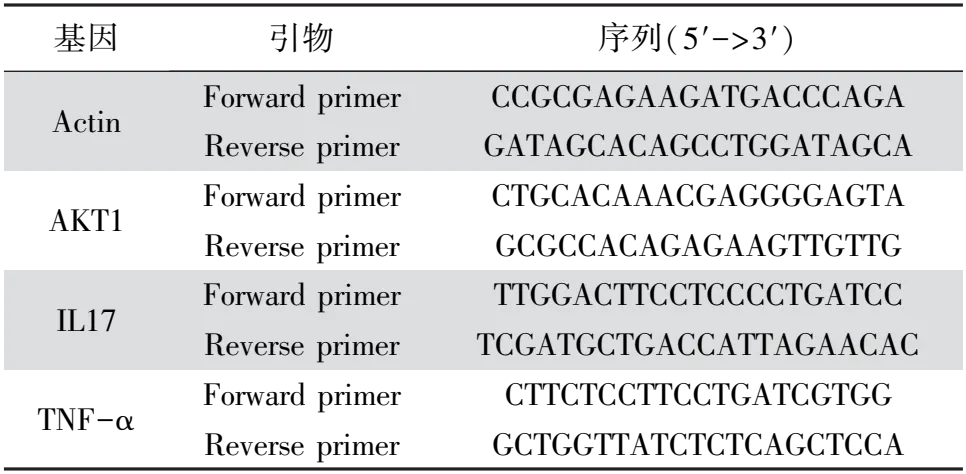
表2 qRT-PCR基因引物
3 结果
3.1 蓝莲方药和HIV的靶点获取经ADME筛选并去除重复项之后获得蓝莲方药的有效成分110种。各成分对应的靶点数目合计并去除重复靶点后获得蓝莲方药的有效靶点280个。
分别从各数据库获得HIV的相关靶点数为Drugbank 54个、GenCards 1 315个、OMIM 21个点、TTD 7个,去除重复项后获得靶点1 357个。
3.2 生物学功能和通路富集分析HIV和蓝莲方药的共同靶点有135个(见图1)。GO富集分析可阐明关键网络靶点发挥的主要生物学功能,结果见图2。由图2可知,关键网络靶点的BP主要包括response to inorganic substance、response to bacterium、response to lipopolysaccharide等。CC主要有membrane raft、membrane microdomain、side of membrane等。MF以protein kinase binding、kinase binding、phosphotransferase activity、alcohol group as acceptor等功能较明显。KEGG分析显示了主要通路参与的关键网络靶点数目以及P值大小,结果见图3。由图3可知,蓝莲方药抗HIV的基因主要富集在Hepatitis B、PI3K-Akt signaling pathway、TNF signaling pathway、IL-17 signaling pathway等信号通路。

图1 蓝莲方药与HIV的靶点韦恩图

图2 关键网络靶点的GO富集分析气泡图
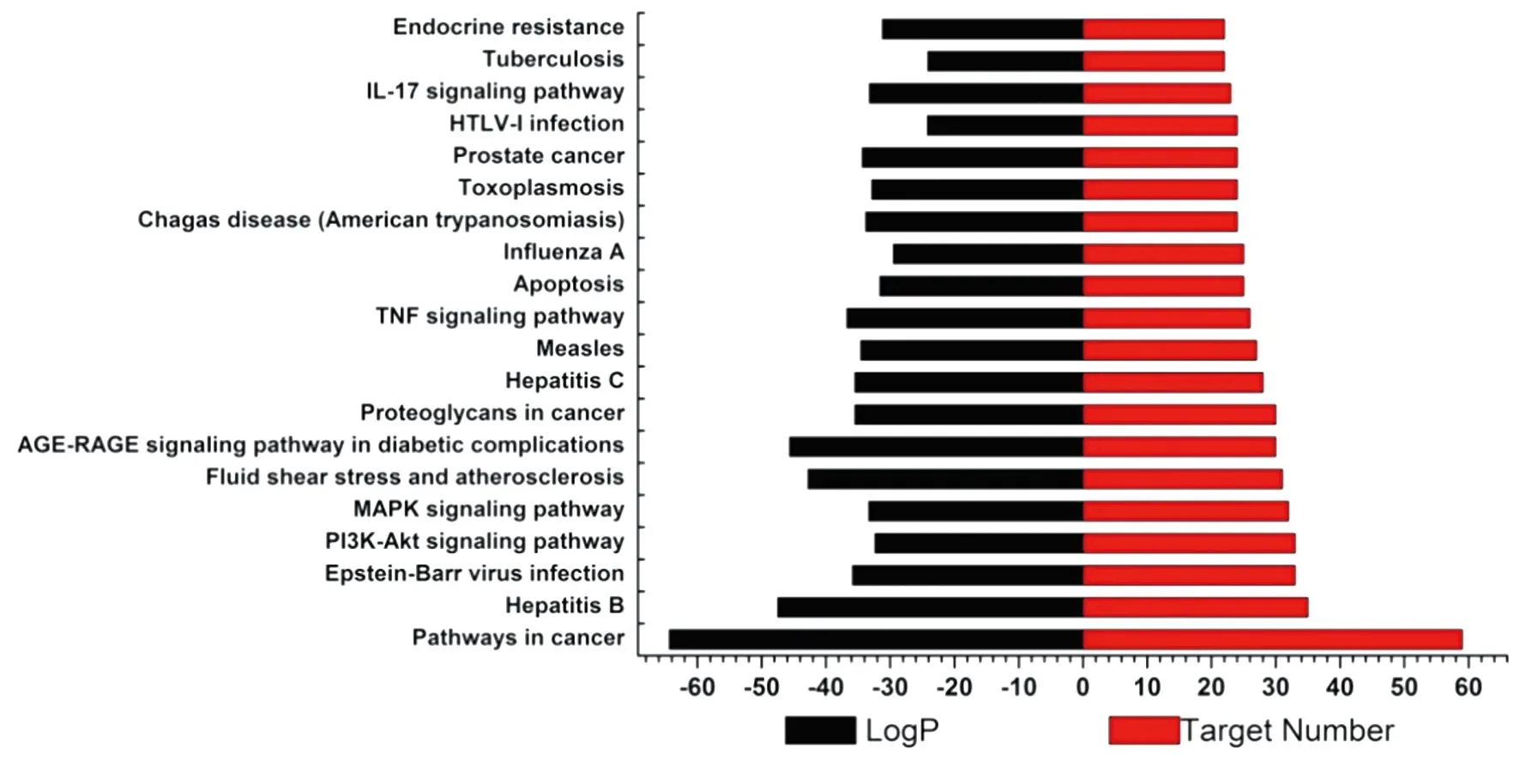
图3 关键网络靶点的KEGG通路富集分析柱状图
3.3 成分-靶点-通路网络图构建蓝莲方药与HIV的共同靶点所包含的蓝莲方药有效成分为104个。将104个有效成分与KEGG分析获取的前20条通路,通过CytoScape 3.8.0构建蓝莲抗HIV的成分-靶点-通路网络图(见图4)。
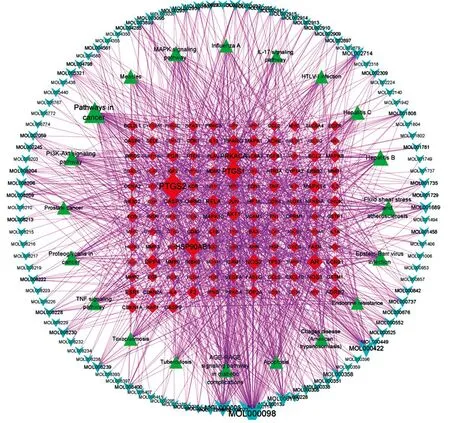
图4 蓝莲方药抗HIV的成分-靶点-通路网络图 注:蓝色的倒三角形为不同药物的活性成分,绿色三角形为通路,红色四边形为HIV和蓝莲方药的共同靶点。
根据CytoScape计算的度(degree)筛选关键成分和靶点。Degree值越大则图中的节点(node)面积越大,表示该节点在网络中可能发挥越关键的作用。成分的degree中位数为4,筛选degree≥8(2倍中位数),得到36种主要活性成分,包括槲皮素(quercetin)、木犀草素(luteolin)、山柰酚(kaempferol)、黄芩素(baicalein)等,具体见表3。靶点degree中位数为6,筛选degree≥12(2倍中位数),得到37个关键网络靶点。由成分-靶点-通路网络图可知,一种成分可与多种靶点相连,一种靶点也可能与多种成分相关,而靶点与通路也是多线连接的方式,提示提示蓝莲方药抗HIV的机制可能是多成分、多靶点、多通路的特点。

表3 蓝莲方药的关键活性成分
3.4 蛋白PPI网络构建将蓝莲方药与HIV的共同靶点导入STRING数据库,获得蛋白PPI网络,用
CytoScape对PPI网络进一步分析,并筛选核心网络靶点(见图5)。该网络由135个节点,2 837条边组成,节点连接的边越多表示该节点的重要性越强,节点间连接线越密集,表示节点间的关联越密切。PPI网络计算的degree值为40,筛选degree≥80(2倍中位数),得到14个节点,91条边的网络,即主要靶点14个。将这14个靶点与成分-靶点-通路网络筛选的37个靶点取交集,获得7个节点,21条边的网络,即核心网络靶点7个,为AKT1、TNF、CASP3、TP53、JUN、ESR1和PTGS2。

图5 PPI网络拓扑筛选核心靶点
3.5 分子对接验证将核心网络靶点AKT1、TNF、CASP3 、TP53、JUN、ESR1和PTGS2分别与主要活性成分槲皮素、木犀草素、山柰酚、黄芩素进行分子对接,对接结果见表4。AutoDock Vina 通过计算小分子与蛋白的结合能从而评估其相互作用强度,结合能<-7.0 kcal·mol-1被视为结合活性较强[12],结合能越小表示其结合越稳定,相互作用越强。对接结果显示,AKT1、TNF、CASP3、ESR1和PTGS2这5种主要成分与蛋白靶点的结合能均小于-7 kcal·mol-1,结合活性较强。将AKT1与黄芩素、TNF与槲皮素、CASP3与木犀草素的对接结果进行可视化,如图6。
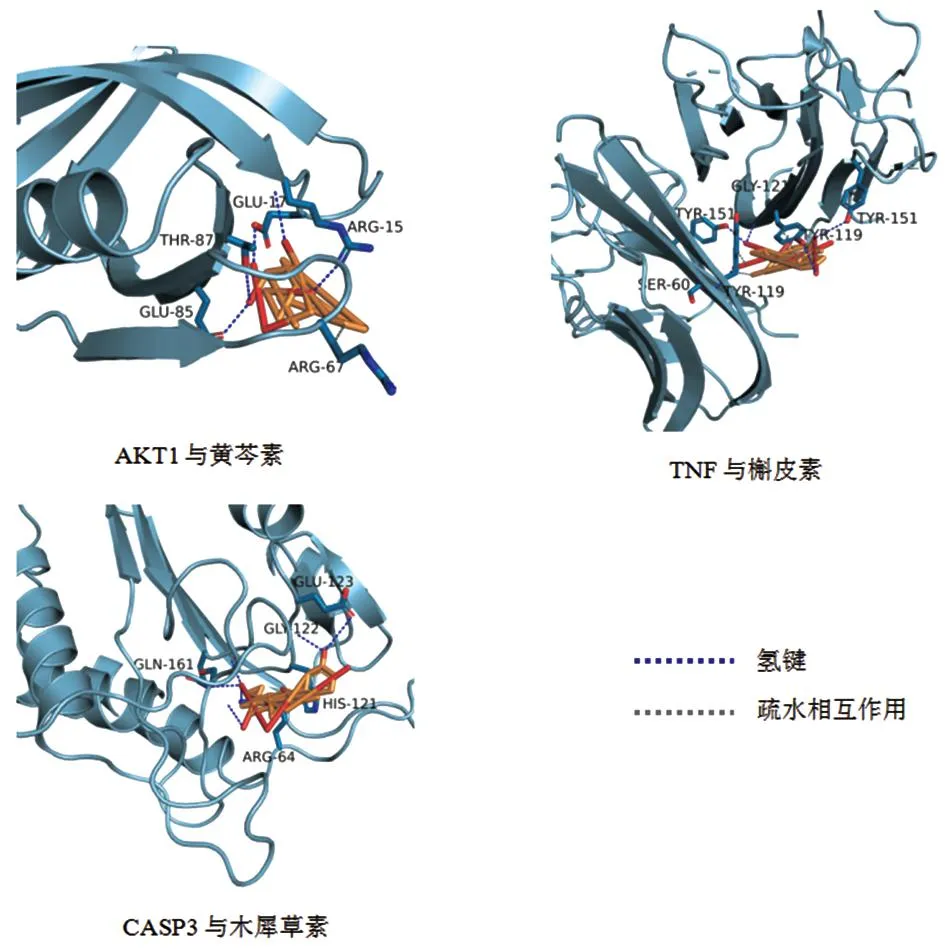
图6 部分成分与靶点分子对接3D效果图

表4 成分-靶点分子对接结合能
3.6 蓝莲方药的细胞毒性以及对HIV的抑制作用细胞毒性实验结果见图7,细胞活力与药物浓度有明显剂量依赖性,药物浓度越高细胞活力越低。计算得出,蓝莲方药与唐草片对TZM-bl细胞的CC50分别为(3.16±0.18)、(2.01±0.02)mg·mL-1。且蓝莲方药与唐草片对TZM-bl细胞的无毒浓度分别为0.21、0.38 mg·mL-1,后续实验均在无毒浓度范围内进行。

图7 蓝莲方药对细胞活力的影响曲线
药物与HIV假病毒共培养细胞48 h后检测荧光发光值,得到药物浓度与病毒感染产生的荧光信号抑制曲线(见图8),可见假病毒感染率随着蓝莲方药或唐草片的浓度增加而降低。经计算得出蓝莲方药与唐草片对HIV假病毒的IC50分别为17.10、94.42 μg·mL-1;其SI分别为184.80和21.29。

图8 蓝莲方药对HIV假病毒的抑制曲线
3.7 qRT-PCR检测HIV假病毒组每组以假病毒液250 μL感染细胞,蓝莲方药终浓度为26.25 μg·mL-1,添加DMEM完全培养基至2.5 mL。细胞培养24 h后获取各组基因qRT-PCR的Ct值,根据2-△△Ct公式,计算其他各组相对于细胞对照组的表达量。由图9可知,与细胞对照组相比,HIV假病毒组的IL-17基因的相对表达量显著降低,而AKT1以及TNF-α基因的相对表达量显著升高。与HIV假病毒组对比,HIV+蓝莲方药组的IL-17表达量明显升高,且具有统计学差异(P<0.01)。
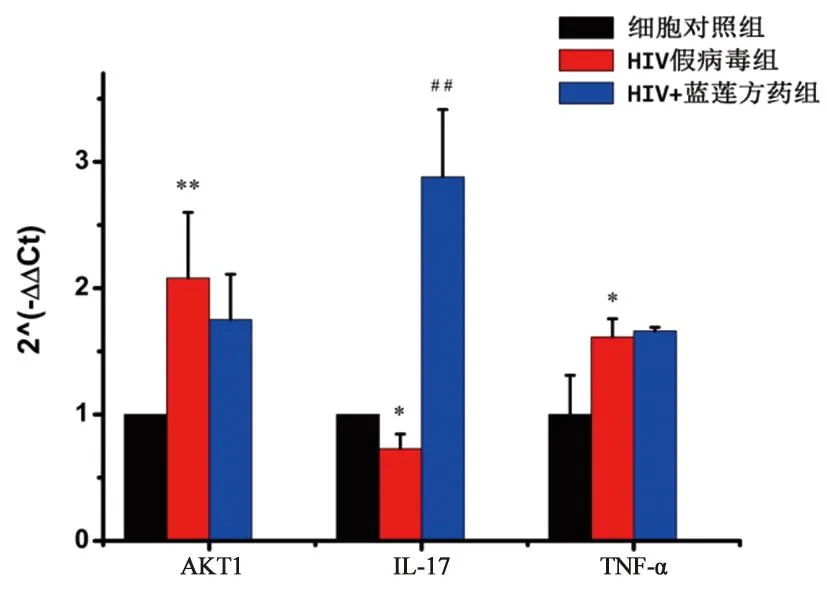
图9 qRT-PCR检测基因的相对表达量 注:*表示细胞对照组与HIV假病毒组比较,#表示HIV假病毒组与HIV+蓝莲方药组比较,n=3;其中*P<0.05,**P<0.01,##P<0.01。
4 讨论
本研究通过网络药理学方法分析蓝莲方药具有抗HIV潜在作用的化学组分,包括槲皮素、木犀草素、山柰酚、黄芩素等。研究发现,槲皮素具有良好的抗HIV-1作用[14-15]。Ahn等[16]从大戟分离出的3种槲皮素和山柰酚均能抑制HIV-1整合酶活性,其中槲皮素IC50为15.7~22.7 μmol·L-1,山柰酚IC50为16.7 μmol·L-1。山柰酚-7-O-葡萄糖苷的抗HIV活性高于山柰酚,糖苷衍生物能够利用较好的水溶性进入组织,在HIV感染早期抑制病毒反转录[17]。从大翅蓟提取的木犀草素对HIV-1逆转录酶RNase H具有较强的抑制作用,IC50为12.8 μmol·L-1,纯化的木犀草素还能抑制HIV-1整合酶活性[18]。Schonhofer等[19]发现木犀草素能够下调细胞周期素依赖性激酶9和HIV反式转录激活因子蛋白的表达,通过持续增强HIV潜伏期,使隐藏在CD4+T细胞中具有自发诱导和复制能力的病毒失活。黄芩素是一种黄酮类化合物,能与HIV-1整合酶的核心结构域结合,改变酶构象影响酶活从而抑制HIV病毒的复制[20]。
本文分析显示,蓝莲方药调控HIV感染的潜在核心网络靶点为AKT1、TNF、CASP3、TP53、JUN、ESR1和PTGS2等。AKT1在巨噬细胞的凋亡中发挥重要作用,过表达的AKT1促进了转录因子FOXO3a的磷酸化,磷酸化FOXO3a可以增加人单核巨噬细胞DNA片段化,调节HIV-1诱导的人巨噬细胞凋亡[21]。艾滋病患者血清中肿瘤坏死因子TNF-α表达水平普遍增强,陆宇红等[22]发现TNF-α基因多态性与HIV感染密切相关,患者的TNF-α位点rs1800629基因型为GA以及等位基因为A的分布频率显著高于正常组,其基因多态性也影响抗逆转录病毒治疗后CD4+T细胞水平的恢复。CASP3可以诱导细胞凋亡,由HIV-1编码的天冬氨酸激酶能激活突变型 CASP3*,通过消除HIV-1感染的细胞从而抑制病毒在SUP-T1细胞中的复制和传播[23]。分子对接验证结果也表明,槲皮素、木犀草素、山柰酚、黄芩素与靶点AKT1、TNF和CASP3的结合活性较强,提示蓝莲方药可能主要通过这几种成分参与调控AKT1、TNF和CASP3等关键基因的表达,从而抑制HIV-1病毒感染细胞。
通过基因富集分析发现,蓝莲方药抑制HIV感染细胞的信号通路主要有PI3K-Akt 信号通路、TNF信号通路和IL-17信号通路等。PI3K-Akt 信号通路在HIV-1的主要靶细胞中发挥关键作用,包括对巨噬细胞凋亡的调节以及寿命延长、影响干扰素IRF-7向浆细胞样树突状细胞核内转运、介导神经胶质细胞的炎症反应等[24]。PI3K/Akt抑制剂能够引起感染HIV-1病毒的巨噬细胞死亡,抑制病毒复制,而不影响正常细胞[25]。白细胞介素IL-17与艾滋病的发生密切相关,艾滋病患者血清IL-17水平以及Th17/Treg细胞比例偏低,经高效抗反转录病毒治疗后患者的IL-17水平明显升高,Th17/Treg比例也得以恢复,可见Th17和Treg细胞的失衡可能在艾滋病的发病机制中起着关键作用[26]。qRT-PCR结果显示,经HIV假病毒处理后的细胞IL-17表达量明显降低,而TNF-α和AKT1表达量明显升高,表明这几种基因与HIV病毒的感染密切相关。添加蓝莲方药处理后的细胞,IL-17表达量与单独HIV处理组相比显著上升,说明蓝莲方药可能主要通过调节IL-17信号通路来抑制HIV病毒对细胞的感染。
假病毒是一类经过基因工程改造的,只能进行单轮复制感染的病毒。由于HIV病毒的特殊性,直接应用HIV病毒进行细胞及动物实验需要生物安全3级实验室,因此很多抗HIV药物筛选和药物机理研究应用了HIV假病毒来模拟真病毒的感染[27]。唐草片是目前中国唯一批准用于艾滋病治疗的中成药,具有清热解毒、活血益气的作用[28]。因此本文应用HIV假病毒感染细胞模型对比了蓝莲方药和唐草片的抗病毒效果。结果显示,与唐草片相比,蓝莲方药抑制病毒感染的半抑制浓度IC50更小,选择指数SI更大,且二者具有显著性差异(P<0.5),表明蓝莲方药抗HIV活性比唐草片更好。本文采用网络药理学方法结合体外实验验证,从整体角度出发分析药物与疾病之间的关联,得出蓝莲方药抗HIV感染为多成分,多靶点,多通路的网络作用机制,其中蓝莲方药对IL-17信号通路的调控可能起关键作用。

