星康吉鳗精子的超微结构研究
史 宝, 王成刚, 汤晓华, 赵新宇, 晏科文, 马晓东
星康吉鳗精子的超微结构研究
史 宝1, 王成刚2, 汤晓华2, 赵新宇1, 晏科文1, 马晓东1
(1. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071; 2. 海阳市黄海水产有限公司, 山东 烟台 265100)
为探讨星康吉鳗()精子的超微结构和形态, 应用扫描电镜和透射电镜对星康吉鳗精子结构进行观察。结果表明, 精子由头部、中段和鞭毛3部分组成, 有其独特的结构, 总长度为35.75± 1.15µm。精子头部为新月形, 主要由细胞核构成, 细胞核内有核泡, 无顶体结构。精子头部的质膜内包含单一的线粒体。精子头部长为3.33±0.16um, 头宽为1.12±0.13 um。在精子头部的凸面上, 有4条从中段到头端的条纹。精子中段伸出一支根, 支根位于精子的中段末端。精子中段长度为0.55±0.05 um, 支根长度为1.38±0.08 um、直径为90.48±6.06 nm。精子尾部鞭毛细长, 鞭毛横切面呈圆形, 无侧鳍, 鞭毛的轴丝结构为“9+0”型; 一些鞭毛的末端呈现卷曲状, 发育机制尚不明确。精子鞭毛长为31.16±1.51 µm, 鞭毛直径为0.17±0.01 µm。通过比较分析发现精子的这些形态学特征不仅表现在星康吉鳗精子, 还表现在鳗鲡目其他属的精子; 表明是鳗鲡目精子的共同特征。本研究揭示了星康吉鳗精子的形态结构, 为突破星康吉鳗人工繁殖技术提供了理论参考。
星康吉鳗(); 精子; 超微结构; 精子形态
在超过17.1万种已做过分类学研究的水生动物中, 有超过3.3万种是鱼类, 其中1.98万种是海洋鱼类[1]。在大约350种鱼类研究了精子的形态、活力, 精液生化等生物学特征[2]。精子将雄性单倍体染色体组运送到卵母细胞。精子的形态与精子的质量密切相关, 高质量的配子是成功受精的先决条件, 并确保获得优质水产养殖苗种[3-4]。硬骨鱼类的繁殖方式和系统进化上所处的位置影响其精子结构。而且, 鱼类精子的形态和超微结构在不同科之间甚至在亚科之间存在差异[5]。精子形态和超微结构研究对于鉴定鱼类系统进化分类[6]以及确定冷冻保存操作引起的细胞损伤[7]等方面也具有指导作用。
星康吉鳗()隶属于脊索动物门(Chordata)、腹鳍鱼纲(Actinopterygii)、鳗鲡目(Anguilliformes)、康吉鳗科(Congridae)、康吉鳗属(), 系暖温性近海底层鱼类, 主要分布于中国黄渤海、东海, 以及朝鲜、日本、韩国等海域沿岸, 具有重要的生态和经济价值, 是重要的捕捞对象[8-9]。星康吉鳗肉质鲜美、出口创汇潜力大, 是中国重要的经济鱼种之一[10]。2011—2017年在中国东黄海进行的底拖网调查数据显示星康吉鳗开发率过高, 处于过度捕捞状态[11]; 1995—2008年日本农林水产省官网数据显示日本海域星康吉鳗渔获量从13 000 t降到6 300 t[12]; 1985—2001年联合国粮食及农业组织(FAO)数据显示韩国海域星康吉鳗渔获量从20 000 t降到8 000 t, 然后逐步恢复到20 000 t[13]。因为星康吉鳗较高的经济价值和持续增加的捕捞力度, 东亚国家的渔政管理者、科研工作者和水产养殖、加工企业加大对星康吉鳗这一重要渔业资源的关注[14-15]。但发展星康吉鳗养殖产业, 当前主要限制因素是还不能通过人工繁育技术提供玻璃鳗苗种, 亟需开展星康吉鳗繁育技术研究。
国内外对日本鳗鲡()、欧洲鳗鲡()等鳗鲡目鱼类的精子超微结构进行了研究[16-20]; 星康吉鳗为体外受精鱼类, 但其精子形态结构方面研究资料相对匮乏。在星康吉鳗繁育探索试验中, 我们发现精子活力弱、受精率低的现象。精子的形态和功能存在密切的关系, 影响精子游动速度、授精能力[21-23]。本研究采用扫描电镜和透射电镜对星康吉鳗精子形态的超微结构进行观察, 并和鳗鲡目鱼类精子形态进行比较分析, 探讨了星康吉鳗精子的形态和精细结构特征, 以期丰富星康吉鳗繁殖生物学的内容, 为提高星康吉鳗高精子活力、受精率和精子冷冻保存效果等研究提供科学依据, 并为提高其人工繁殖的成功率提供参考。
1 材料与方法
1.1 试验鱼和精液采集
挑选体质健壮、性成熟的雄性星康吉鳗亲鱼30尾用于本研究。试验鱼体质量范围84.9~2 413.7 g, 全长范围36.1~96.2 cm, 培育水温12~22 ℃, 盐度27~ 32, 光照强度 200~1 000 lx, 溶氧大于≥6 mg/L, pH 为7.8~8.2, 日换水率400%~900%; 试验所用的雄鳗培育在海阳市黄海水产有限公司的星康吉鳗亲鱼培育系统。
对性成熟雄性星康吉鳗亲鱼采用人工挤压的方式采集精液。采精时先将实验鱼以240 mg/L的MS222轻度麻醉, 后用干净纱布轻轻擦拭鱼体生殖孔及其周围区域, 防止体表尿液和粪便等污染。将雄鳗置于垫有干净湿毛巾的泡沫板上, 轻轻挤压雄鳗的生殖腺, 挤出精液, 待流出的精液呈乳白色后, 用经过消毒的干燥玻璃管吸取精液并置于洁净的离心管, 放入2.5%的戊二醛(0.1 mol/L PBS配制, pH 7.4, 4 ℃)固定, 置于4 ℃冰箱保存, 用于电镜制样和实验观察。同时, 每批雄鳗精子采集时, 取1 μL精液, 使用过滤的海水激活精子, 快速在显微镜下观察精子运动情况; 镜检发现精子运动率在90%以上的样品, 该批精子用于后续电镜试验研究。
1.2 扫描电镜样品准备
分别对10尾性成熟雄鳗精液取样, 每尾取约0.5 mL精液, 混合置于15 mL无菌的离心管中。取l mL混合精液立即注入盛有10倍体积2.5%戊二醛的离心管中, 4 ℃冰箱保存, 备用。用0.1 mol/L的PBS缓冲液(pH 7.4, 4 ℃)漂洗, 再用l%的锇酸进行固定, 经乙醇系列梯度脱水,后进行乙酸异戊酯取代乙醇。EiKo公司XD-1型二氧化碳临界点干燥器干燥, EiKo公司IB-3型离子镀膜仪喷金镀膜。采用日本日立公司SN-3500扫描电镜观察并拍照。
1.3 透射电镜样品准备
将1.2所述固定精液以2 000 r/min离心10 min, 去除上清液, 经0.1 mol/L pH值为7.4的PBS缓冲液洗涤, 用1%锇酸4 ℃固定2 h。PBS缓冲液洗涤, 乙醇系列逐级脱水, Epon812环氧树脂包埋, ULTRACUTE超薄切片机切片, 样品经乙酸铀-柠檬酸铅双重染色, 采用JEOL-100cx II型透射电镜观察并拍照。
1.4 图像与数据处理
选择清晰的电镜样品图像, 采用Adobe Photoshop CS3对图像进行编辑处理, 用Microsoft Excel 2010对精子各组成部分长度进行数据相关性分析。
2 结果
2.1 扫描电镜观察
扫描电镜结果显示星康吉鳗精子由头部(H, Head)、中段(MP, Middle piece)和鞭毛(F, Flagellum)3个部分组成, 总长度为35.75±1.15 µm。头部微微弯曲, 中段变窄, 中段除了与鞭毛链接外, 末端有1个突出的短棒状结构支根(R, Rootlet); 中段与尾部鞭毛相连, 部分精子鞭毛的末端卷曲略微呈扇形(图1-1、1-2)。
星康吉鳗精子头部长为3.33±0.16 µm, 头部宽为1.12±0.13 µm, 头部外观呈现为新月形, 无顶体结构; 精子头部后方逐渐变锥形至细的中段(图1-1、1-2)。在精子头部的凸面上, 可以看到4条从中段到头端的条纹(S, Striae)(图1-3)。精子的中段收缩, 长度为0.55±0.05 µm(图1-2)。支根长为1.38±0.08 µm, 支根直径为90.48±6.06 nm, 从中段末端靠近鞭毛的起始处向外突出形成(图1-2)。精子的鞭毛多数是延长的线型, 鞭毛长为31.16±1.51 µm, 鞭毛的直径为0.17±0.01 µm; 部分鞭毛呈现卷曲状, 在卷曲情况下鞭毛从中心到外围紧紧地卷曲着大约5~8层(图1-1、1-2)。星康吉鳗精子的头长、头宽、鞭毛长、支根长的长度与鳗鲡目其他鱼类精子相关指标的长度汇总见表1。
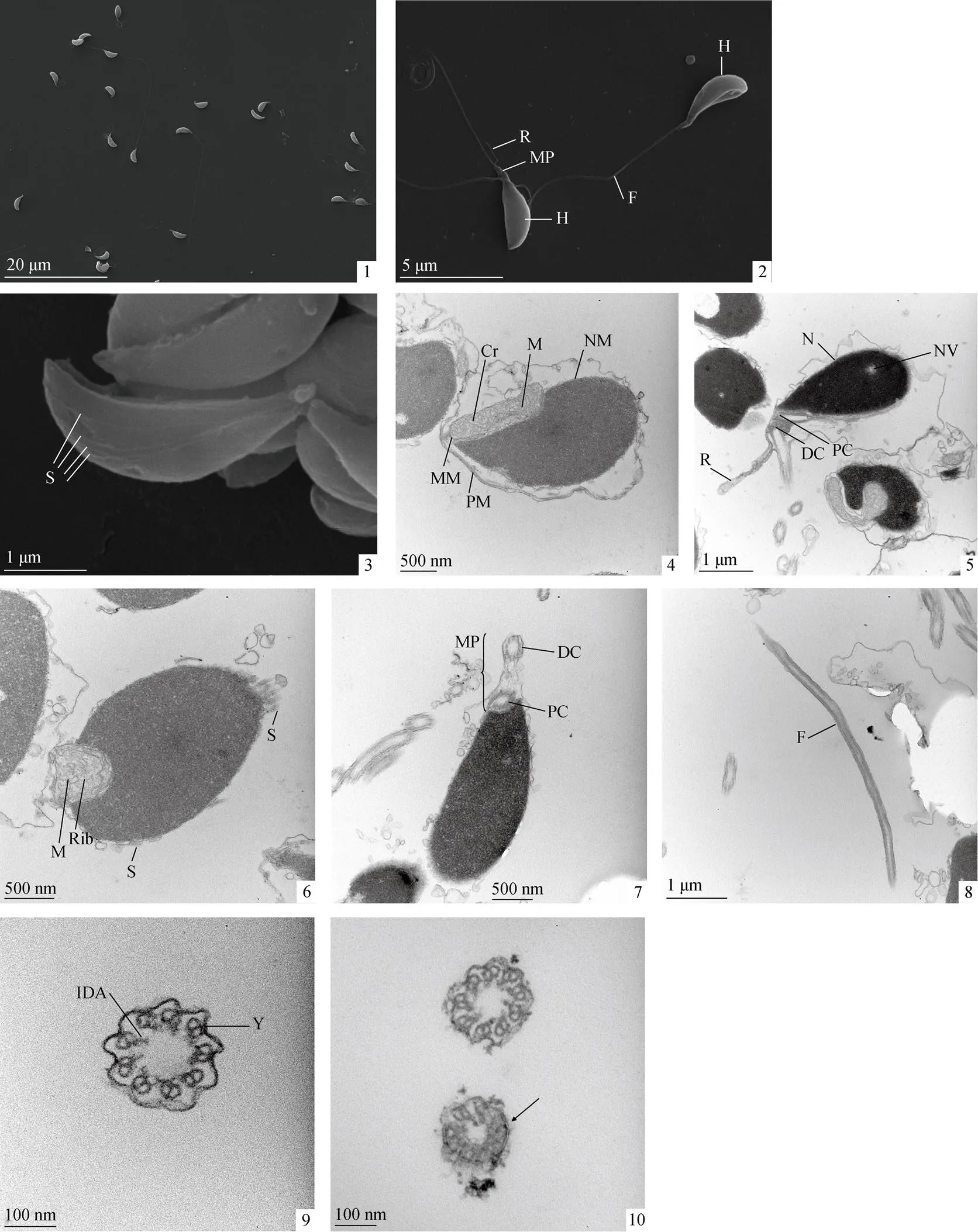
图1 星康吉鳗精子的超微结构
注: 1. 扫描电镜下精子全貌; 2. 扫描电镜下精子全貌的放大; 3. 扫描电镜下精子头部; 4. 透射电镜高倍下精子头部纵切, 可见线粒体; 5. 透射电镜下精子头部纵切, 可见支根; 6. 透射电镜高倍下精子头部纵切, 可见核糖核蛋白体; 7. 透射电镜高倍下精子头部纵切, 可见远端中心粒和近端中心粒; 8. 透射电镜下鞭毛纵切; 9. 透射电镜下鞭毛横切面; 10. 透射电镜下鞭毛远端横切面; H. 头部; MP. 中段; F. 鞭毛; R. 支根; S.条纹; PM. 质膜; N. 细胞核; NM. 核膜; NV. 核泡; M. 线粒体; MM. 线粒体膜; Cr. 嵴; Rib. 核糖核蛋白体; PC. 近端中心粒; DC. 近端中心粒; IDA. 内动力蛋白臂; Y. 放射状的Y形电子致密体
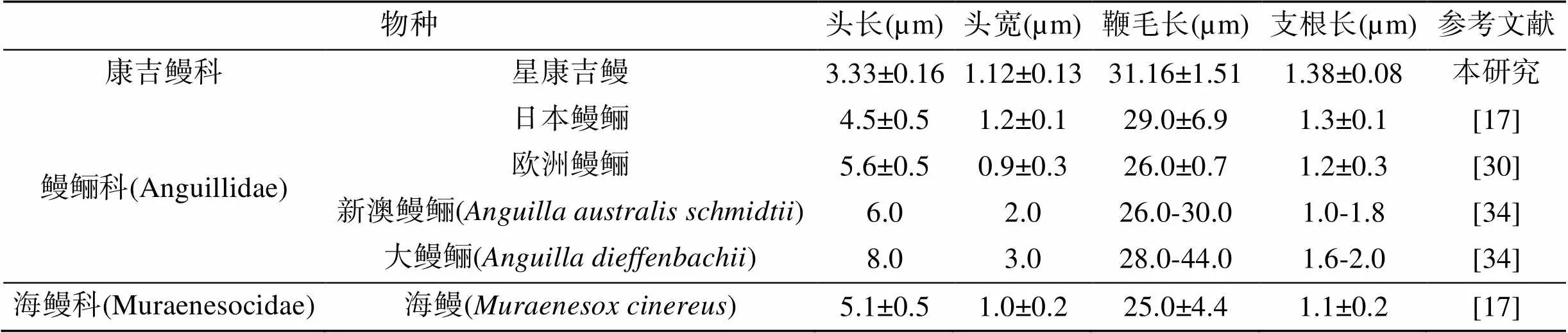
表1 鳗鲡目鱼类精子形态特征比较
2.2 透射电镜观察
2.2.1 头部微观结构
在透射电镜下纵切可以观察到星康吉鳗的精子头部外被一层不平滑的波浪形质膜(PM, Plasma membrane)包被, 质膜与致密的核(N, Nuclear)之间有较大的空隙(图1-4、1-5)。精子核很大, 几乎占据了精子头部整个空间, 精核由核膜(NM, Nuclear membrane)包裹, 核内充满电子致密物质, 含有形成细胞核的染色质物质; 细胞核内有核泡 (NV, Nuclear vacuole), 并且随机分布在细胞核内, 核泡中含有细胞质物质, 一些细胞核含有多个核泡(图1-4、1-5)。精子头部的质膜内包含一个球状体呈晶体结构, 表明它是线粒体(M, Mitochondrion), 线粒体由线粒体外膜(MM, Mitochondrial membrane)包围, 内膜向内延伸, 形成众多的嵴(Cr, Cristae), 基质和核糖核蛋白体(Rib, Ribonucleoprotein)分散在线粒体内(图1-4、1-6)。整个精子头部包括线粒体在内均覆盖着一层质膜(图1-4、1-5)。
2.2.2 中段微观结构
星康吉鳗精子头部靠近鞭毛侧基部凹陷形成中段(图1-5)。中段位于头、尾结合处, 中段与尾部鞭毛链接, 并伸出一支根(图1-5)。透射电镜下可观察到靠近精子头部的近端中心粒(PC, Proximal centriole)和靠近鞭毛的远端中心粒(DC, Distal centriole)(图1-5、1-7)。可以看到精子表面上的条纹(S)从近端中心粒延伸到精子头部(图1-5、1-6)。
2.2.3 尾部微观结构
星康吉鳗精子的鞭毛横切面呈圆形(图1-8), 无侧鳍, 鞭毛外由一层质膜包围, 鞭毛的轴丝为“9+0”结构(图1-9、1-10)。在鞭毛的横切面上, 每两个亚纤维上都有内动力蛋白臂(IDA, Inner dynein arm), 但没有发现外动力蛋白臂(图1-9)。在靠近远端中心粒的鞭毛中, 两个亚纤维通过放射状的Y形电子致密体(Y, Radial Y-shape electron dense body)与质膜相连(图1-9)。在鞭毛远端, 两个亚纤维变得不清楚(图1-10)。
3 讨论
鱼类的精子形态和功能密切相关[23-24]。在系统分类学水平上, 硬骨鱼类的精子结构显示出高度的多样性。硬骨鱼的精子结构按照受精方式可分为两类: 体内受精鱼类, 如杜父鱼科(Cottidae)、海鲫科(Embiotocidae)、花鳉科(Poeciliidae)和体外受精鱼类, 如鲤科(Cyprinidae)、狼鲈科(Moronidae)、鲑科(Salmonidae); 体内受精和体外受精鱼类的精子结构不同, 体外受精鱼类精子的结构相对简单, 具有卵圆形或球形的核和仅包含少量线粒体的较小的中段, 而体内受精的鱼类精子具有细长的核和相对较大的中段[5]。精子形态学特征研究对于阐明不同精子结构形式的适应性进化也具有重要的参考价值并可以将精子形态与系统分类联系起来[25-29]。
以往的研究结果揭示了鳗鲡目精子独特的超微结构, 包括一个新月形的核、一个附着在中段的支根、“9+0”型模式的鞭毛, 以及从近端中心粒延伸的条纹(拟鞭毛)[17, 30]。星康吉鳗的精子形态特征与鳗鲡目其他鱼类的比较表明它们在整体结构上非常相似,不同之处是形态大小和细胞器的位置。其他鳗鲡目鱼类精子的头长大约4~20 µm[31], 表明星康吉鳗精子头长(3.33±0.16 µm)相对较小。星康吉鳗精子头宽(1.12± 0.13 µm)接近于日本鳗鲡精子头宽(1.2±0.1 µm)[17],而且星康吉鳗的头部形状相比鳗鲡目其他鱼类更近似圆形[17, 30]。在哺乳动物各分支类群雄性动物精子头部、中段和鞭毛的尺寸存在正相关关系[29], 但在大西洋鲑()精子头部长度和鞭毛长度是负相关关系[24]。分析已报到的鳗鲡目鱼类精子头部和鞭毛长度数据(表1), 发现只有本研究中星康吉鳗和日本鳗鲡[17]精子头部长度和鞭毛长度存在类似正相关关系。尽管采用切片电镜观察的方法很难准确测量精子形态指标, 但通过形态的基本测量仍可看出鳗鲡目鱼类精子的形态差异。鳗鲡目鱼类精子头部细长的新月形与其他目鱼类精子头部近似球形的形态学上差异的机制仍不清楚。通常延长型的精子头部是与营体内受精方式相适应的[31]。但是鳗鲡目是营体外受精的鱼类, 所以鳗鲡目鱼类精子头部的奇特形态的受精生物学意义无法用上述理论解释。我们推测鳗鲡目精子特殊形状可能是中性进化如遗传漂变而不是自然选择产生的。精子头部形状对精子的运动能力和速率影响较大[22]。但精子头部尺寸和生物自身基因组大小、染色体数目无关, 其决定因素还不明确。章龙珍等[19]报道了日本鳗鲡正常、成熟精子头部的形态为圆形或近似圆形, 不成熟的精子头部为新月形。因此要进一步揭示形态学差异的问题仍需调查和研究。鱼类精子形态分析过程中采用的透射电镜和扫描电镜等分析技术, 涉及到精液样品稀释溶液固定或涂片/干燥、染色等操作步骤, 尽管采用标准的实验分析流程, 仍可能会得到一些改变精子形态的人工制品; 今后研究中需进一步采用透射电镜、扫描电镜和近年来新发展的、在鱼类精子形态研究中可实际应用的精子形态分析技术如TruMorph®技术结合计算机辅助精子形态分析[32]对鳗鲡目鱼类精子准确的三维结构进行评价。
在日本鳗鲡, 研究表明单一的线粒体位于精子头部的前端[16, 33]。在本研究, 一个较大的线粒体位于星康吉鳗精子头部前端, 这与日本鳗鲡精子线粒体位置的研究结果一致[16, 20, 33], 以及与鳗鲡目的新澳鳗鲡、大鳗鲡[34]和几内亚副康吉鳗()、小眼蟒鳗()[35]的研究结果一致。而且, 隶属于海鳗科的海鳗精子头部的线粒体位置也是类似鳗鲡科[17]。因此, 众多研究表明单个线粒体位于精子头部前端是鳗鲡目精子的共同特征。星康吉鳗精子中段的支根长约为1.38±0.08 μm, 与日本鳗鲡精子支根长(1.3±0.1 μm)和欧洲鳗鲡精子支根长(1.2±0.3 μm)较为相近[17, 30]; 星康吉鳗精子的支根长度位于鳗鲡目鱼类精子支根长度范围内(表1), 但当前有关精子支根的生理功能仍不清楚。
迄今, 所有分析过的鳗鲡目鱼类精子都有“9+0”型鞭毛模式, 鞭毛缺少中间的一对中央微管。本研究中星康吉鳗精子的鞭毛也是“9+0”结构。星康吉鳗精子鞭毛长度(31.16±1.51 μm)与日本鳗鲡精子鞭毛长度(29±6.9 μm)、大鳗鲡精子鞭毛长度(28~44 μm)相近[17, 34](表1)。本研究中发现在星康吉鳗精子头部有4条从近端中性粒向前方延伸的条纹(拟鞭毛)。有研究表明日本鳗鲡精子近端中心粒的这种延伸条纹(拟鞭毛)在中心粒-鞭毛复合体与精子头部的连接中起着稳定作用[16, 34, 36]。线粒体在是产生三磷酸腺苷ATP (Adenosine triphosphate, ATP)的主要细胞器, 而ATP是精子在有氧条件下运动的能量来源[37]。ATP通过精子鞭毛中的ATP酶(动力蛋白)水解, 由此释放出的能量用来移动鞭毛[38]。这种ATP从线粒体到鞭毛的转运或是通过简单的扩散或主要通过细胞生化途径中的磷酰肌酸穿梭和代谢分室作用进行的[39-40]。在大多数硬骨鱼精子中, 线粒体通常位于靠近鞭毛基部的中段[41-43], 因为距离相近, 使这两种ATP能量传递系统都能发挥功能。但是大多数鳗鲡目鱼类精子线粒体位于精子头部的前端, 距离鞭毛远, 因此ATP的运输可能较难用这些运输系统来解释。
我们观察到的星康吉鳗精子条纹结构可能在ATP运输中发挥作用, 从而为驱动鞭毛运动提供能量, 与精子在运动过程对较多能量的需求相适应, 与精子的泳动速率有关。有研究表明鞭毛轴丝动力蛋白臂利用ATP能量辅助鞭毛轴丝自旋弯曲[44]。类似的条纹在日本鳗鲡精子结构中被认为是“管状结构”, 参与运输ATP[17]。因此, 我们推测鳗鲡目鱼类精子通过这种管状结构条纹发生的ATP转运比通过细胞质更有效。但国内学者在日本鳗鲡精子结构的研究中没发现精子头部的这种延伸条纹结构[19-20]。鱼类精子线粒体的数目不一致, 从一个到几十个不等, 如褐石斑鱼()精子中有6~9个线粒体[45]、秦岭细鳞鲑()精子中有1个线粒体[23]。线粒体作为精子能量的一个来源, 线粒体的数目可能是一个关键因素影响精子泳动速度和时间, 并在鱼类受精过程起到重要作用[46]。在星康吉鳗繁育试验中, 发现存在精子活力弱, 受精率低的现象, 可能与精子中只有唯一的线粒体有关。
在当前研究中作者观察到了星康吉鳗部分精子有盘绕的鞭毛形态, 推测这些卷曲的鞭毛可能是不成熟的精子, 因为这种更紧凑的形状使它们更容易容纳在星康吉鳗精巢的有限空间中。有研究表明在部分日本鳗鲡精子鞭毛末端也存在形状近似的环状结构, 该结构容易与其他物质粘连, 便于完成受精[20]。但在本研究中我们无法明确这些卷曲鞭毛的发育机制及生理作用。在多种鱼类精子尾部鞭毛发现具有侧鳍结构, 但星康吉鳗精子尾部无侧鳍结构。关于鱼类精子鞭毛侧鳍结构能否改善精子游泳速度和提高受精率尚无定论。通过上述的比较分析, 星康吉鳗精子结构相对其他目鱼类的精子结构简单, 有可能作为研究鱼类精子超微结构和形态的理想实验材料, 笔者认为深入解析这些有差异的结构有助于了解这些结构的来源和进化上的意义及其生理作用, 并为提高星康吉鳗精子活力和受精率提供参考。
学者们一直以来认为鳗鲡目、海鲢目(Elopiformes)、背棘鱼目(Notacanthiformes)属于同一总目即海鲢总目(Elopomorpha)[47], 该分类是界定在鱼类解剖学和骨骼学特征的基础上, 并且另一最显著的特征是都出现了柳叶状幼体[48]。此外, 精子的主要特征即新月形头部、一个支根、“9+0型”模式的鞭毛, 不仅在鳗鲡目中发现, 而且在海鲢目[35]和背棘鱼目[49]中也有发现。但是有例外, 鳗鲡目中的海鳝科(Muraenidae)的精子有一个圆形的细胞核, 细胞核后方有一些线粒体, 无支根[50]。MATTEI等[35]指出精子之间的形态学特征的相似性可能对研究海鲢总目鱼类的进化具有重要意义。JAMIESON[31]随后将精子的形态特征研究叠加到海鲢总目鱼类的系统发育树上, 结果显示出与之前的分类情况有很好的一致性。这些研究发现表明, 除了传统的鱼类解剖学和骨骼学特征指标外, 精子的形态结构特征也越来越多地与海鲢总目鱼类的种间分化密切相关。我们当前的分析总结了多个鳗鲡目鱼类的形态学特征研究文献(包括表1),对进一步研究鳗鲡科鱼类或者海鲢总目鱼类的进化和分类学也具有重要作用。
4 结论
本研究以黄海海域星康吉鳗精子为研究对象, 采用扫描电镜和透射电镜揭示了星康吉鳗精子超微结构的详细特征。星康吉鳗精子由头部、中段和鞭毛3部分组成, 具有鳗鲡目精子独特的超微结构特征。星康吉鳗精子头部为新月形, 主要由细胞核构成, 无顶体结构; 精子中段伸出一支根, 支根位于精子的中段末端; 精子尾部鞭毛细长, 鞭毛横切面呈圆形, 无侧鳍, 鞭毛的轴丝结构为“9+0”型。星康吉鳗精子超微结构研究增加了我们对其繁殖生物学的理解, 并为突破星康吉鳗人工繁育技术提供了理论参考。
[1] MORA C, TITTENSOR D P, ADL S, et al. How many species are there on earth and in the ocean?[J]. PLoS Biology, 2011, 9: e1001127.
[2] ALAVI S M H, HATEF A, BUTTS I A E, et al. Some recent data on sperm morphology and motility kinetics in Atlantic cod (L.)[J]. Fish Physiology and Biochemistry, 2021, 47(2): 327-338.
[3] HE W C, SUN Y, QIANG J X, et al. Structural abnormalities of spermatozoa in triploid gynogenetic crucian carp ()[J]. Frontiers in Genetics, 2021, 12: 783014.
[4] BOBE J, LABBÉ C. Egg and sperm quality in fish[J]. General and Comparative Endocrinology, 2010, 165: 535-548.
[5] ALAVI S M H, COSSON J J, COWARD K, et al. Fish spermatology[M]. Oxford: Alpha Science Ltd, 2008: 1-61.
[6] QUAGIO-GRASSIOTTO I, BAICERE-SILVA C M, OLIVEIRA S J C, et al. Spermiogenesis and sperm ultrastructure as sources of phylogenetic characters. The example of characid fishes (Teleostei: Characiformes)[J]. Zoologischer Anzeiger, 2020, 289: 77-86.
[7] FIGUEROA E, LEE-ESTEVEZ M, VALDEBENITO I, et al. Effects of cryopreservation on mitochondrial function and sperm quality in fish[J]. Aquaculture, 2019, 511: 634190.
[8] 张春光. 中国动物志: 硬骨鱼纲·鳗鲡目·背棘鱼目[M]. 北京: 科学出版社, 2010: 199-203. ZHANG Chunguang. Chinese animal records: Actinopterygii Anguilliformes Notacanthiformes[M]. Beijing: Science Press, 2010: 199-203.
[9] 陈大刚, 张美昭. 中国海洋鱼类(上卷)[M]. 青岛: 中国海洋大学出版社, 2015: 176-188. CHEN Dagang, ZHANG Meizhao. Marine fishes of China (Volume 1)[M]. Qingdao: China Ocean University Press, 2015: 176-188.
[10] 杨浩, 史宝, 牛化欣, 等. 星康吉鳗生物学与生态学的研发现状与展望[J]. 海洋科学, 2020, 44(6): 152-158. YANG Hao, SHI Bao, NIU Huaxin, et al. Advances and future prospects inresearch[J]. Marine Sciences, 2020, 44(6): 152-158.
[11] 麻秋云, 牟秀霞, 任一平, 等. 东、黄海星康吉鳗生长、死亡和单位补充量渔获[J]. 水产学报, 2018, 42(6): 881-888. MA Qiuyun, MU Xiuxia, REN Yiping, et al. The growth, mortality and yield per recruitment of white- spotted conger () in the Yellow Sea and the East China Sea[J]. Journal of Fisheries of China, 2018, 42(6): 881-888.
[12] GORIE S, TANDA M, NAGASWA K. Movement and growth of whitespotted congerin the Eastern Seto Inland Sea, Japan[J]. Aquaculture Science, 2010, 58(2): 233-242.
[13] KUROGI H, MOCHIOKA N, OKAZAKI M, et al. Discovery of a spawning area of the common Japanese congeralong the Kyushu-Palau Ridge in the western North Pacific[J]. Fisheries Science, 2012, 78: 525-532.
[14] KAWAZU M, KAMEDA T, KUROGI H, et al. Biological characteristics ofduring the initial stage of spawning migration in the East China Sea[J]. Fisheries Science, 2015, 81: 663-671.
[15] LI M, JIAO Y, BI R J, et al. Population status and distribution of whitespotted conger () in Yellow Sea: An important migratory species along coastal China with limited data[J]. Fisheries Oceanography, 2020, 29: 32-45.
[16] GWO J C, GWO H H, CHANG S L. The spermatozoon of the Japanese eel,(Teleostei, Anguilliformes Anguillidae)[J]. Journal of Submicroscopic Cytology and Pathology, 1992, 24(4): 571-574.
[17] OKAMURA A, ZHANG H, YAMADA Y, et al. Re-examination of the spermatozoal ultrastructure of eels: observations of the external morphology of spermatozoa in three species[J]. Journal of Fish Biology, 2000, 57: 161-169.
[18] MARCO-JIMÉNEZ F, PÉREZ L, VIUDES D C M P, et al. Morphometry characterisation of European eel spermatozoa with computer-assisted spermatozoa analysis and scanning electron microscopy[J]. Theriogenology, 2006, 65: 1302-1310.
[19] 章龙珍, 乔振国, 庄平, 等. 人工催熟日本鳗鲡精子的显微和超微结构[J]. 水产学报, 2006, 30(5): 611-617. ZHANG Longzhen, QIAO Zhenguo, ZHUANG Ping, et al. Microstructure and ultrastructure of spermatozoa ofartificially induced by extraneous hormone[J]. Journal of Fisheries of China, 2006, 30(5): 611-617.
[20] 张涛, 柳凌, 张洁明, 等. 日本鳗鲡精卵的超微结构以及受精过程观察[J]. 水生生物学报, 2010, 34(4): 769-778. ZHANG Tao, LIU Ling, ZHANG Jieming, et al. Ultrastructure of spermatozoa and fertilized eggs ofand observation on the fertilization process[J]. Acta Hydrobiologica Sinica, 2010, 34(4): 769-778.
[21] ANDERSON M J, DIXSON A F. Sperm competition: motility and the midpiece in primates[J]. Nature, 2002, 416(6880): 496.
[22] MALO A F, GOMENDIO M, GARDE J, et al. Sperm design and sperm function[J]. Biology Letters, 2006, 2: 246-249.
[23] GUO W, SHAO J, LI P, et al. Morphology and ultrastructure ofspermatozoa by scanning and transmission electron microscopy[J]. Tissue and Cell, 2016, 48: 321-327.
[24] GAGE M J G, MACFARLANE C, YEATES S, et al. Relationships between sperm morphometry and sperm motility in the Atlantic salmon[J]. Journal of Fish Biology, 2002, 61: 1528-1539.
[25] ROWLEY A, LOCATELLO L, KAHRL A, et al. Sexual selection and the evolution of sperm morphology in sharks[J]. Journal of Evolutionary Biology, 2019, 32(10): 1027-1035.
[26] ROLDAN R S R, TEVES M E. Understanding sperm physiology: proximate and evolutionary explanations of sperm diversity[J]. Molecular and Cellular Endocrinology, 2020, 518: 110980.
[27] MEISNER A D, KLAUS A V, O’LEARY M A. Sperm head morphology in 36 species of artiodactylans, perissodactylans, and cetaceans (Mammalia)[J]. Journal of Morphology, 2005, 263(2): 179-202.
[28] ROLDAN E R S. Sperm competition and the evolution of sperm form and function in mammals[J]. Reproduction in Domestic Animal, 2019, 54(4): 14-21.
[29] GAGE M J G. Mammalian sperm morphometry[J]. Proceedings of the Royal Society of London, 1998, 265: 97-103.
[30] MÜLLER T, BASKA F, NIKLESZ C, et al. The testis histology of artificially maturated European eel (L.) at the end of sexual maturation, and spermatozoa ultrastructure in freshwater rearing[J]. Acta Biologica Hungarica, 2005, 56(1/2): 169-172.
[31] JAMIESON B G M. Fish evolution and systematics: Evidence from spermatozoa[M]. Cambridge: Cambridge University Press, 1991: 122-131.
[32] CALDEIRA C, HERNÁNDEZ-IBÁNEZ S, VENDRELL A, et al. Characterisation of European eel () spermatozoa morphometry using Trumorph tool in fxed and non-fxed samples[J]. Aquaculture, 2022, 553: 738047.
[33] MIURA T, YAMAUCHI K, NAGAHAMA Y, et al. Induction of spermiogenesis in male Japanese eel,, by a single injection of human chorionic gonadotropin[J]. Zoological Science, 1991, 8: 63-73.
[34] TODD P. Ultrastructure of spermatozoa and spermiogenesis in New Zealand freshwater eels (Anguillidae)[J]. Cell and Tissue Research, 1976, 171: 221-232.
[35] MATTEI C, MATTEI X. The functional anatomy of the spermatozoon[M]. Oxford: Pergamon Press, 1974: 211-221.
[36] GIBBONS B H, GIBBONS I R, BACCETTI B. Structure and motility of the 9+0 flagellum of eel spermatozoa[J]. Journal of Submicroscopic Cytology, 1983, 15: 1-20.
[37] BILLARD R, COSSON J, LINHART O. Changes in the flagellum morphology of intact and frozen/thawed Siberian sturgeon(Brandt) sperm during motility[J]. Aquaculture Research, 2000, 31: 283-287.
[38] MOHRI H. Amino-acid composition of ‘Tubulin’ consisting microtubules of sperm flagella[J]. Nature, 1968, 216: 1053-1054.
[39] NEVO A C, RIKMENSPOEL R. Diffusion of ATP in sperm flagella[J]. Journal of Theoretical Biology, 1970, 26: 11-18.
[40] SHAPIRO B M, TOMBES R M. A biochemical pathway for a cellular behavior: pHi, phosphorylcreatine shuttles, and sperm motility[J]. Bioessays, 1985, 3(3): 100-103.
[41] 刘琨, 刘长琳, 陈四清, 等. 绿鳍马面鲀精子的超微结构[J]. 海洋科学, 2017, 41(8): 40-45.LIU Kun, LIU Changlin, CHEN Siqing, et al. Ultrastructure of spermatozoa of[J]. Marine Sciences, 2017, 41(8): 40-45.
[42] DUMORNÉ K, VALDEBENITO I, RISOPATRON J, et al. Morphology and ultrastructure of pink cusk-eel (, Schneider 1801) spermatozoa by scanning and transmission electron microscopy[J]. Tissue and Cell, 2018, 54: 26-29.
[43] ULLOA-RODRÍGUEZ P, CONTRERAS P, DUMORNÉ K, et al. Sperm morphology and ultrastructure of Patagonian blenny ()[J]. Tissue and Cell, 2019, 57: 66-69.
[44] MARICCHIOLO G, GENOVESE L, LAURÁ R, et al. Fine structure of spermatozoa in the common pandora (Linnaeus, 1758) (Perciformes, Sparidae)[J]. Histology and Histopathology, 2004, 19: 1237-1240.
[45] KIM S H, LEE C H, SONG Y B, et al. Ultrastructure of late spermatids and spermatozoa during spermiogenesis in longtooth grouperfrom Jeju, Korea[J]. Tissue and Cell, 2013, 45(4): 261-268.
[46] LAHNSTEINER F, PATZNER R A. Fine-structure of spermatozoa of 2 marine teleost fishes, the red mullet,(mullidae) and the white bream,(sparidae) [J]. Journal of Submicroscopic Cytology and Pathology, 1995, 27(2): 259-266.
[47] GREENWOOD P H. Notes on the anatomy and classification of elopomorph fishes[J]. Bulletin Museum of Comparative Zoology, 1977, 32: 65-102.
[48] SMITH D G. Ontogeny and systematics of fishes[M]. New Hampshire: Allen Press, 1984: 94-102.
[49] MATTEI X. The flagellar apparatus of spermatozoa in fish. Ultrastructure and Evolution[J]. Biology of the Cell, 1988, 63(2): 151-158.
[50] BOISSON C, MATTEI X, MATTEI C. Le flagelle de type 9+0 et la remarquable extension du centriole proximal dans les spermatides de(Bloch, 1795) (Poisson Muraenidae)[J]. Comptes Rendus de l’Académie des Sciences (Paris), 1967, 264(25): 2909-2912.
A study on sperm ultrastructure in the whitespotted conger,
SHI Bao1, WANG Cheng-gang2, TANG Xiao-hua2, ZHAO Xin-yu1, YAN Ke-wen1, MA Xiao-dong1
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China; 2. Haiyang Yellow Sea Aquatic Product Co., Ltd., Yantai 265100, China)
Whitespotted conger,, is one of the most valuable fishery resources in the seas around China, Korea, and Japan. Thus, it has become important to protect this species, as the annual commercial catch is decreasing. Despite being an important resource for East Asian countries, little is known about the reproductive biologyof. Therefore, only very limited information is available regarding the reproductive characteristics of male. Teleost sperm is very morphologically diverse, particularly the sperm head shape; the shape, location, and number of mitochondria, and the structure and length of the flagellum. This study investigated the ultrastructure and morphology ofsperm by scanning electron microscopy (SEM) and transmission electron microscopy (TEM). The SEM and TEM images revealed that the sperm were composed of a head, a middle piece, and a flagellum..sperm hada unique structure except for the common sperm characteristics of teleost. The total mean length was 35.75±1.15 µm. The head of the spermatozoon was electron-dense and contained chromatin material forming the nucleus. The nucleus was asymmetrically shaped along the longitudinal axis. We observed nuclear vacuoles in the nucleus, which were not fixed in size or position. The head had no acrosomal structure. A single spherical mitochondrion was located along the longitudinal center line of the nucleus but was offset slightly to one side. The mitochondrion was surrounded by an outer mitochondrial membrane. The inner mitochondrial membrane extended inward, forming rich cristae. Ribonucleoprotein and matrix were scattered in the mitochondrion. The mean head length was 3.33±0.16 µm, and the mean head width was 1.12±0.13 µm. Four striae ran from the caudal portion to the cephalad on the convex surface of the head. Additionally, four striae arose from the proximal centriole. The middle piece was constricted and projected a short rootlet located at the end of the middle piece. The mean middle piece length was 0.55±0.05 µm. The mean length of the rootlet was 1.38±0.08 µm, and the mean diameter was 90.48±6.06 nm. The proximal centriole in the middle piece was located near the caudal portion of the sperm head. The distal centriole was located near the flagellum. A cross-section oftheflagellum was thin and appeared round with no side fin. Inner dynein arms were seen on the two subfibrils of each filament on a cross-section of the flagellum, but no outer dynein arms were seen. The two subfibrils of the flagellum near the distal centriole were linked to the plasma membrane by radial Y-shape electron-dense bodies. The flagellum was arranged in a 9+0 axonemal pattern. Some flagella were coiled, but the developmental mechanism was unclear. These flagella were coiled tightly, with about five strata counted from the center to the periphery. The mean flagellum length was 31.16±1.51 µm, and the mean flagellum diameter was 0.17±0.01 µm. These features were seen inand are also evident in other species of Anguilliformes. These findings suggest that these features are common to Anguilliformes. This study revealed the morphological structure of.sperm to improve our understanding of the reproductive biology of.and provide a theoretical basis for developing methods to artificially reproduce..
; sperm; ultrastructure; spermic shape
Dec. 15, 2022
[The Central Public-Interest Scientific Institution Basal Research Fund, YSFRI, CAFS, No. 20603022021004, 20603022023023; Key Research and Development Program of Shandong Province, No. 2021LZGC028; National Key Research and Development Program of China, No. 2019YFD0900503; China Agriculture Research System of MOF and MARA, No. CARS-47]
S962
A
1000-3096(2023)10-0112-09
10.11759/hykx20221215001
2022-12-15;
2023-03-30
中国水产科学研究院黄海水产研究所基本科研业务费资助项目(20603022021004, 20603022023023); 山东省重点研发计划项目(2021LZGC028); 国家重点研发计划项目(2019YFD0900503); 国家现代农业产业技术体系资助项目(CARS-47)
史宝(1979—), 男, 副研究员, 主要从事海水鱼类繁育理论与增养殖技术研究, E-mail: shibao@ysfri.ac.cn
(本文编辑: 谭雪静)

