兰花分子育种技术研究进展
贾思思,曾瑞珍,张志胜,魏 倩,谢 利,郭和蓉
(广东省植物分子育种重点实验室/华南农业大学 林学与风景园林学院,广东 广州 510642)
兰花是兰科Orchidaceae 植物的总称,但在中国,兰花是指兰科兰属Cymbidium植物,特别是其中的地生种类,也就是今天的国兰[1]。兰科是开花植物中最大的科之一,已鉴定的兰科植物有899 属29 199 种,约占开花植物的8%~10%,除极地和极端干旱的沙漠外,世界各地均有兰花分布[2-3]。兰花具有很高的观赏价值、药用价值、食用价值、生态价值和文化价值,是世界著名的观赏花卉,也是中国传统十大名花之一[3]。作为观赏花卉,兰花既可以做切花、也可以做盆花,既可以观花、也可以赏叶,同时也是园林造景优良植材,深受世界各国人民的喜爱。作为进化程度最高、种类最丰富的植物,兰花也是当今生物学领域研究生命和进化的理想模式植物。新品种选育是兰花产业自主和高质量发展的基础,而育种方法是快速高效选育兰花优良品种的关键。目前,兰花育种的主要方法有引种驯化、选择育种、杂交育种、诱变育种和多倍体育种等[4-5]。这些育种方法虽然有效,但可利用资源范围窄、育种周期长,不能定向培育市场所需品种。分子育种是采用转基因或基因编辑技术创造变异、或通过分子标记辅助选择技术培育新品种的方法,主要包括转基因育种、基因编辑育种和分子标记辅助选择育种。近年来,随着兰花组学技术的发展,兰花主要育种目标性状的分子遗传基础、基因鉴定和克隆、高密度分子图谱构建等取得巨大进步,兰花转基因技术和分子标记辅助选择技术也取得明显进展,本文对此进行综述并对未来兰花分子育种技术研究的重点和品种创新进行了展望,为进一步推动兰花分子育种技术研究和新品种选育提供参考。
1 兰花基因组测序和功能基因鉴定
1.1 基因组测序
自2015年Cai 等[6]完成小兰屿蝴蝶兰Phalaenopsisequestris基因组测序以来,迄今有来自4 亚科8 属18 种共27 份兰花完成了基因组测序,包括附生、地生和腐生3 类(表1)[6-31]。其中,广东舌唇兰Platantheraguangdongensis基因组最大(4.27 Gb)[20],深圳拟兰Apostasiashenzhenica基因组最小(348.73 Mb)[30],天麻Gastrodiaelata预测基因数最少(17 895 个)[25],染色体数最少的香荚兰Vanillafragrans预测基因数最多(59 128 个)[29]。基于基因组测序结果,对兰花叶艺、花型、花色、花期、适应性等性状的分子遗传基础分析结果表明,CH1基因家族显著缩减可能是导致墨兰Cymbidiumsinense叶艺形成的重要原因[7];光合天线和代谢途径相关基因表达水平降低引起建兰C.ensifolium叶艺的形成,叶片中与花发育相关的MADS-box基因表达水平显著提高导致花被状叶的形成[8]。
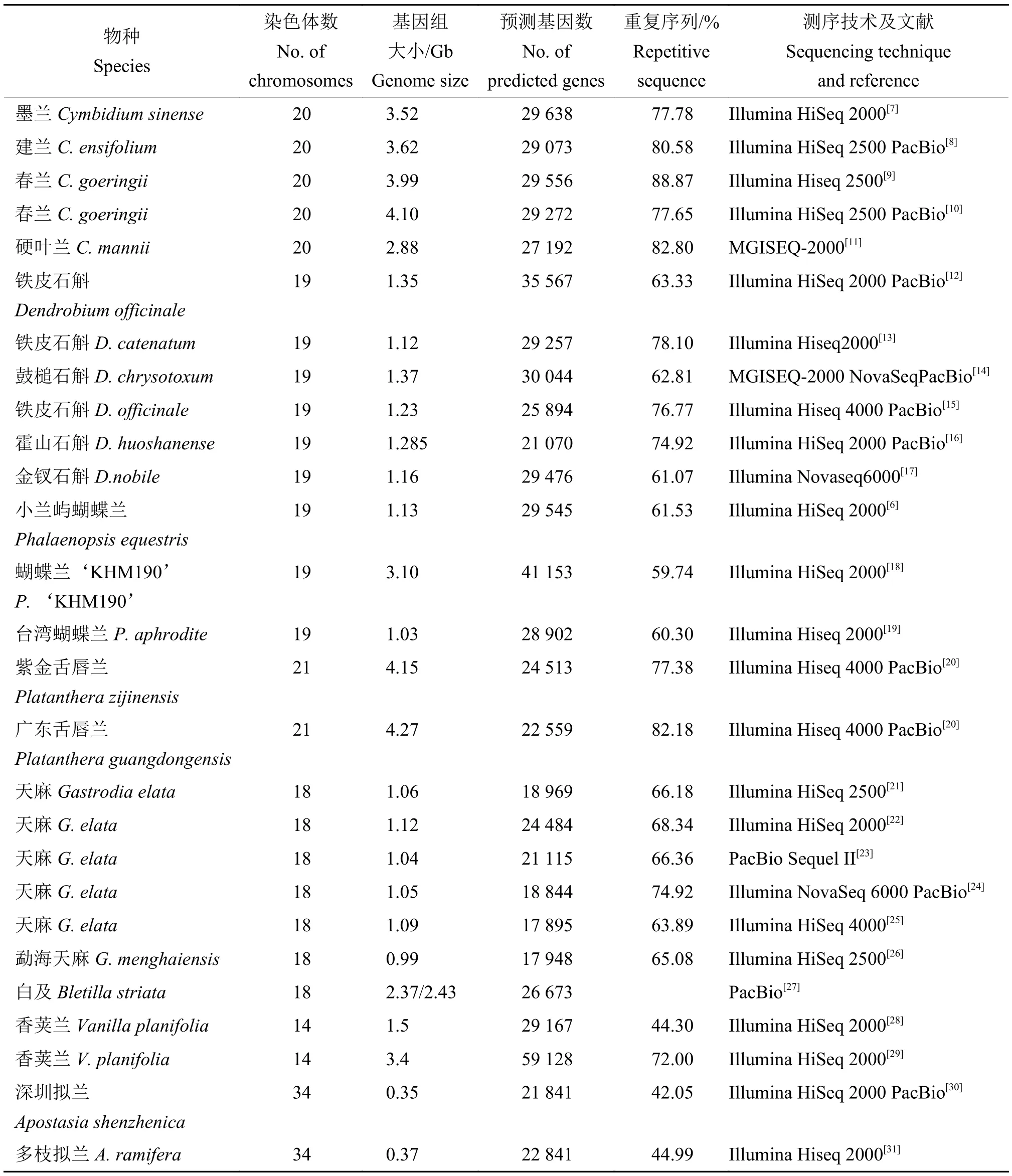
表1 兰花基因组测序Table 1 Genome sequencing of orchid
MADS-box基因影响花发育和形态。通过测序分析,在多枝拟兰A.ramifera、深圳拟兰、天麻、紫金舌唇兰Platantherajaponica、广东舌唇兰、香荚兰、小兰屿蝴蝶兰、台湾蝴蝶兰P.aphrodite、鼓槌石斛Dendrobiumchrysotoxum、铁皮石斛D.catenatum、春兰C.goeringii、建兰和墨兰中分别鉴定出30、36、40、43、43、55、51、56、58、63、69、71 和94 个MADS-box基因[2,7,9,19],且多数兰花中没有FLC、AGL12和AGL15基因。在小兰屿蝴蝶兰中有20 个基因优先在花组织中表达,MIKC等5 个基因只在花中表达,C/D 类和B 类基因AP3、AGL6基因家族的扩张和分化可能是兰花高度特化花型形成的原因[6]。CsSEP4基因正调控墨兰合蕊柱发育[7]。C 类基因CeAG-1和CeAG-2在建兰花瓣中的高表达形成鼻状花瓣,在花芽中低表达时,则花中没有鼻,取而代之的是几轮花被片,形成具有多花被片分枝花序的花;CeSEP-2基因表达上调对兰花形成特化的唇瓣十分重要,下调则形成菊瓣花;唇瓣结构由CeAP3-1、CeAP3-2、CeAP3-3、CeAP3-4和CeAGL6-2基因控制,CeAP3-3、CeAP3-4和CeAGL6-2在萼片和花瓣中高表达则分别形成唇瓣状萼片和花瓣突变体[8]。
萜类化合物在兰花香气和抗逆性中起关键作用。在深圳拟兰、小兰屿蝴蝶兰、鼓槌石斛、金钗石斛D.nobile和墨兰中鉴定出TPS基因数分别为14、21、48、51 和59 个[6,7,14,17,30]。墨兰的花香与TPS基因家族扩张有关,与无香的墨兰相比,有香的墨兰TPS家族基因表达量更高[7]。单萜和倍半萜主要在花发育晚期和开花期形成,与其生物合成的相关基因GDPS、FDPS和LIS高表达有关,FDPS和GDPS主要在萼片、花瓣和唇瓣中表达,说明萜类化合物主要在花被中合成[8]。
花色是兰花主要育种目标性状。通过基因组测序和表达分析,在墨兰中鉴定出56 个花青素合成代谢相关基因和125 个MYBs,花青素合成代谢相关基因在绿色、黄色、粉色和紫黑色花中差异表达,其中,4 个F3′H基因在红色和紫色花中高表达。调控花青素合成途径上游的MYBs一般在开紫黑色花的墨兰中表达上调,而调控下游的平行基因表达谱存在显著差异,此外,MYBs通过调控F3′5′H的表达影响墨兰的花色[7]。在白色和粉色台湾蝴蝶兰中,F3H的表达模式明显不同,R2R3-MYB在不同颜色蝴蝶兰中表达模式也不同[19]。
次生代谢物是药用兰花的主要育种目标性状。测序分析结果表明,铁皮石斛中SPS和SuSy基因扩张与石斛多糖形成有关[12];甲基赤藓糖醇磷酸途径中DXS、LUT1、LUT2、LCY1、LUT5等相关基因的丢失,导致天麻中叶黄素、胡萝卜素和脱落酸等物质的缺乏[23];OMT基因在秋水仙素生物合成中起重要作用[24]。
其他性状研究结果表明,墨兰CsSVP基因与其互作蛋白CsAP1 和CsSOC1 共同调控低温诱导开花[7]。附生兰耐热性与SDD1、PPP7和3MAT基因家族扩张有关[12]。鼓槌石斛花期短是由于在开花至凋谢过程中类胡萝卜素含量逐渐增加、叶黄素含量逐渐减少,导致ABA 含量减少、乙烯含量增加所致[14]。
1.2 功能基因鉴定
功能基因鉴定是兰花分子育种的基础。迄今采用转基因、RNAi 和VIGS 等技术已从兰属、石斛属、蝴蝶兰属和文心兰属Oncidium兰花中鉴定出功能基因91 个[32-103]。其中,通过将基因转入兰花中并验证功能的有24 个,占比24.7%。已鉴定出功能的基因包括植株生长发育、叶色、花发育、花色、开花时间、多糖合成、抗病、抗逆和组培快繁特性等基因(表2),其中,花色、花发育、花期、抗逆和多糖合成的基因数分别为20、19、15、13 和 5 个,占比分别为22.0%、20.9%、16.5%、14.3%和5.5%。
2 转基因和基因编辑
转基因技术是兰花分子育种核心技术之一。自Kuehnlehe 等[104]利用基因枪法将PRVCP基因转入石斛兰原球茎以来,兰花转基因技术研究取得巨大进展(表3)。迄今已建立蝴蝶兰、石斛兰、文心兰、大花蕙兰C.hybrida、春兰、墨兰、寒兰C.kanran、万代兰Vanda和小扇叶兰Erycina pusilla等兰花转基因技术体系,主要转基因方法为农杆菌介导法和基因枪法,涉及的性状包括花型、花色、花期、花寿命、次生代谢物、抗病、抗逆和组培快繁特性等[85-131]。通过过表达外源基因或自身基因、基因沉默、RNAi 和激活标签系统等手段已获得花色变深的蝴蝶兰‘TS444’[33]和‘V3’[94],花期提前的石斛兰[102],抗除草剂小扇叶兰[89],多糖和甘露糖含量高、抗逆性强的铁皮石斛[96],PLB 形成能力增强的蝴蝶兰[97],顶端分生组织形成多芽和花期提前的石斛兰[98],花瓣中出现红色斑点的南茜文心兰OncidiumGower Ramsey[101]和寒兰[103],鲜切花寿命增加、花蕾脱落延迟的石斛兰[119],抗病毒的蝴蝶兰[122,124]、石斛兰[104,123]和抗低温的蝴蝶兰[131]等转基因兰花。
基因编辑技术是一种有效定向育种技术。Kui 等[90]以原球茎为受体,通过农杆菌介导法建立了铁皮石斛CRISPR/Cas9 基因编辑技术体系,C3H、C4H、4CL、CCR和IRX基因编辑效率为10%~100%。Tong 等[95]以培养30 d 的原球茎为受体,对小兰屿蝴蝶兰MADS基因进行编辑,从20 个外植体中共获得47 个突变体,其中,46 个突变体在3 个位点均发生突变,总突变率为97.90%。
3 分子标记辅助选择
高密度遗传连锁图谱构建对QTL 定位、基因克隆和分子标记辅助选择等具有重要作用。在石斛兰、蝴蝶兰和兜兰Paphiopedilum等兰花上已构建出了高密度分子遗传图谱(表4)[19,132-139]。Lu 等[135]以细茎石斛D.moniliforme×铁皮石斛杂交后代为作图群体,构建了含 8 573 个SLAF 标记、19 个连锁群的石斛兰分子遗传图谱,标记间平均距离为0.32 cM,鉴定出5 个与茎多糖含量相关的QTLs。Li 等[136]以100 个金钗石斛和大苞鞘石斛D.wardianumF1杂交后代为作图群体,构建出含9 564个SNP 标记、19 个连锁群的石斛兰分子遗传图谱,标记间平均距离为 0.41 cM,鉴定出2 个与茎长和1 个与茎粗相关的QTLs。Hsu 等[138]通过测序基因分型(Genotyping-by-sequencing,GBS)鉴定出1 191个SNPs,基于1 191 个SNPs 和22 个SSRs 构建出含19 个连锁群的蝴蝶兰高密度分子遗传图谱,通过基因组关联分析(Genome-wide association study,GWAS),鉴定出7 个与1 个花部颜色相关联的SNPs。Li 等[139]以同色兜兰Paph.concolor和带叶兜兰Paph.hirsutissimum的95 个杂种后代为作图群体,构建出具有13 个连锁群、8 410 个SNP 标记的遗传图谱,标记间平均距离为0.19 cM,筛选出与叶长、叶宽、叶厚和叶数连锁的SNP 标记共12 个。
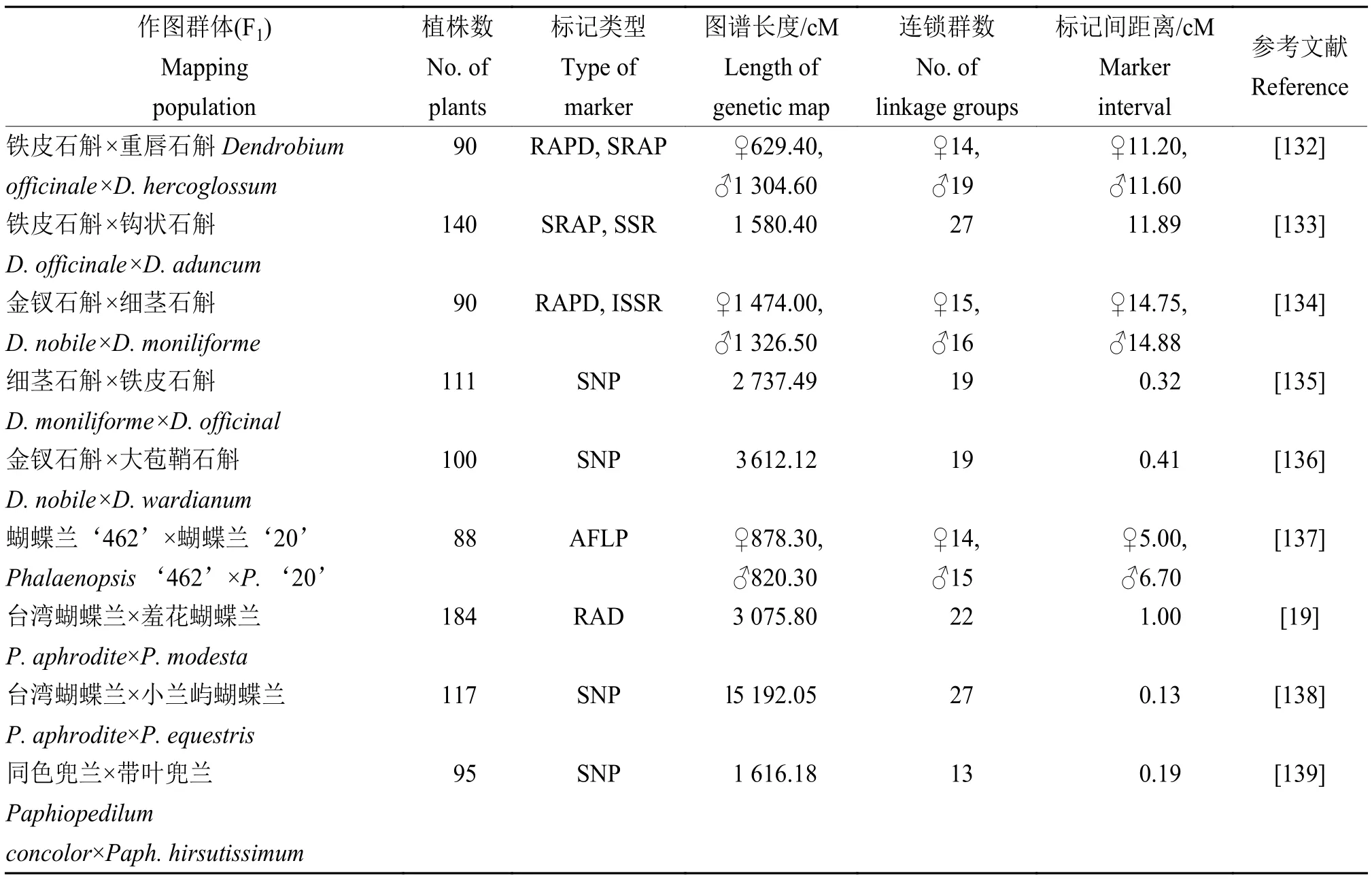
表4 兰花分子遗传图谱构建Table 4 Construction of genetic map in orchid by molecular marker
王健等[140]利用RAPD 分子标记对16 种有香和无香春兰进行分析,筛选到引物BA0088,该引物在有香春兰中扩增出一条特异性370 bp 条带,带型清晰,重复性好。刘泽强[141]利用大花蕙兰和墨兰杂交后代F1群体筛选到2 个与兰花香气性状紧密连锁的ISSR 标记b19 和b21,b19 对兰花有香后代的预测准确率为84%、b21 的预测准确率为88%,双标记预测准确率为98%。李晓红[142]筛选到8 个与兰花纯黄绿色花连锁的SSR 标记,这些标记辅助纯黄绿色花选择的准确率为52%~100%。肖文芳等[143]以黄金豹蝴蝶兰P.Frigdaas Oxford 和白天使蝴蝶兰P.Join Angel 及其杂交后代为材料,筛选到2 个与蝴蝶兰花底色关联的SNP 标记,Marker35886 和Marker70907 的2 个SNP 位点对花底色的鉴定准确率分别为66.67%和73.33%,双标记鉴定准确率达93.33%。
4 展望
兰花种类繁多、用途广泛、市场前景广阔。随着经济发展和人们个性化需求的增加,市场对兰花新品种的需求逐渐提高,如何快速高效选育兰花新品种,满足市场需求已成为育种家急需解决的问题。分子育种能够最大限度利用种质资源,快速定向培育兰花新品种,目前已成为兰花育种方法研究的热点[2,5]。随着组学技术的发展,分子育种技术将成为影响兰花新品种选育、决定产业竞争力和高质量发展的关键核心技术。
21 世纪以来,兰花分子育种技术研究取得了巨大进步,但鲜见利用分子育种方法培育出兰花新品种的报道,原因是兰花转基因、基因编辑和分子标记辅助选择等技术还处于技术研发阶段,且目前的研究主要是从技术创新而非品种创新的角度进行的。为了将分子育种技术更好地应用于品种创新,今后应加强以下几个方面的研究工作。
1)加强优良商业化品种转基因技术研究,建立稳定高效兰花转基因技术体系。转基因技术不仅是转基因和基因编辑育种的技术基础,也是挖掘兰花主要育种目标性状基因的关键技术。目前兰花转基因技术只在蝴蝶兰、石斛等少数兰花的个别材料中取得成功,而且转基因效率不高,今后应研究其他主要商业化兰花和优良品种的高效转基因技术,为选育具有商业化应用前景的兰花新品种奠定基础。
2)加强遗传图谱构建和标记辅助选择技术研究,构建以SSR、Indel 等分子标记为主的高密度分子遗传图谱,建立分子标记辅助主要育种目标性状选择技术体系。虽然目前已构建出几种兰花高密度分子遗传图谱,但这些图谱主要是SNP 标记图谱,育种应用价值不高,已建立分子标记辅助选择技术的只有花香和黄绿色花等少数性状,今后应加强筛选与育种早期无法选择或选择难度大、成本高和准确率低的性状紧密连锁分子标记,建立其辅助目标性状选择技术,实现育种早期高效定向选择的目的,以进一步提高育种效率和效益。
3)加强控制主要育种目标性状的主效基因挖掘。不管是转基因还是基因编辑育种,获得功能基因是前提,目前虽然鉴定出许多育种目标性状基因,但这些基因都是通过反向遗传学方法获得的,多数基因的功能未经验证,其效应和遗传规律不清楚,今后应加强采用正向遗传学方法或结合传统遗传学研究结果挖掘关键基因。
4)加强兰花基因编辑技术研究。利用CRISPR/Cas9 编辑兰花基因效率高[90,95],显示出其在兰花育种上的巨大应用潜力。因此,大力加强兰属兰花、卡特兰、文心兰等兰花基因编辑技术研究、建立基因编辑技术体系,对进一步推动兰花育种和产业高质量发展具有重要意义。

