纳米材料固定化植酸酶的制备及其催化效率与影响因素综述
杨晓莉,毛佳璇,马露冉,徐其静,刘雪*
1. 西南林业大学生态与环境学院,云南 昆明 650224;2. 西南林业大学环境修复与健康研究院,云南 昆明 650224
磷(P)是植物生长发育大量必需营养元素,而无机磷肥进入土壤后,极易被土壤固相吸附或与钙(Ca)、镁(Mg)、铁(Fe)、铝(Al)等金属离子结合形成难溶性或不溶性化合物,导致生物有效性极低,仅有~10%可被植物吸收利用,导致大量磷在土壤中固定和积累(Xiao et al.,2005),且在物理、化学及生物等作用下活化和迁移,易引起潜在水体和面源污染风险(Withers et al.,2014)。此外,磷的生产原料—磷矿石为不可再生资源,磷被称为“正在消失的营养”(Vance,2001)。由此,提高土壤内源磷的利用率具有重要的现实意义。有机磷是土壤磷的重要组成部分,占总磷的20%—80%(鲁芳,2020),是植物生长所需磷素的巨大储备库(Liu et al.,2018)。土壤有机磷主要以植酸(肌醇六磷酸;myo-inositol hexakisphosphate)及其盐类形式存在,占有机磷的50%—80%(刘雪,2017)。植酸可被专一性酶——植酸酶矿化水解,经脱磷酸化过程释放无机磷(MacDonald et al.,2011),供植物吸收利用。微生物和植物根系分泌的植酸酶进入土壤后,易受土壤吸附、温度、pH 值、金属离子等影响,导致酶活性降低甚至失活。因此,提高植酸酶在土壤中的稳定性和活性是发挥其催化作用的重要前提。目前,可通过固定化、酶修饰和基因工程等提高酶的稳定性(Popat et al.,2011),其中固定化技术操作简便、快速、经济易得等优势而被广泛应用。
通过将酶固定于载体表面或孔内,可保持或提高酶的稳定性和催化活性(Hoarau et al.,2017)。固定化的负载率及固定后酶的稳定性和活性取决于载体特性(Wang et al.,2009),特别是纳米基材的类型和性质(Ushasree et al.,2012)。壳聚糖、羟基磷灰石、氧化石墨烯和介孔二氧化硅等纳米基材已广泛应用于酶的固定化(Wahab et al.,2020)。酶的固定化技术主要包括物理和化学方法(Guo,2019),不同固定化方法对酶的酶学特性(活性、稳定性、选择性、特异性和重复使用性)具有不同影响(Xu et al.,2016;Ziegler-Borowska et al.,2017),可通过吸附力、共价键、离子键、交联和包封等提高酶的稳定性和活性,亦可通过改变酶的构型和构象调控酶的选择性(Hanefeld et al.,2013;Wang et al.,2022)。
近年来,随着对植酸酶研究的逐渐深入,关于其在农业领域的应用已引起关注。但由于植酸酶来源及酶学性质等差异性造成其实际应用的局限性,主要表现为热稳定性差和活性低。如何提高植酸酶在土壤中的催化活性,本文基于前期研究,通过综述植酸酶和纳米材料的来源与特性,重点阐述纳米材料固定化植酸酶的制备技术、负载率、稳定性、活性与表征方法,以及实际应用效率与影响因素等研究进展。综述内容可为提高土壤有机磷的生物利用率、降低外源磷肥施用、降低土壤磷流失及水体污染风险提供理论依据和技术支撑,为植酸酶功能的深入挖掘并应用于农业生产实践及保障生态环境安全提供参考。
1 植酸酶和纳米载体的来源与特性
1.1 植酸酶的来源与特性
植酸酶来源于微生物和植物,其中,微生物植酸酶易于生产和分离提纯、产量高、pH 值和温度适应范围广(2.0—8.5、20—80 ℃)且活性高(811—1 800 U·mg-1),是植酸酶的主要来源(孙临泉等,2011;Greiner,2017)。植酸酶通过脱磷酸化过程将植酸水解为无机磷和肌醇(图1),提高磷的生物有效性(Rousseau et al.,2020)。植酸酶水解植酸产生的释磷量占土壤可提取态磷的48%—55%(Liu et al.,2022),对土壤中磷素供应具有重要作用。植酸酶在土壤改良、植物营养、环境治理、动物饲料添加剂、食品工业等领域具有广泛应用(Menezes-Blackburn et al.,2011)。植酸酶作为土壤改良剂,可提高土壤内源植酸磷的利用率(杨晓莉等,2023)。然而,实际应用过程中植酸酶活性极易受温度、pH 值、金属离子等的影响,导致其稳定性降低、活性降低甚至失活。因此,通过固定化或负载技术制备缓释型植酸酶制剂,利于提高植酸酶的环境稳定性及推广应用。
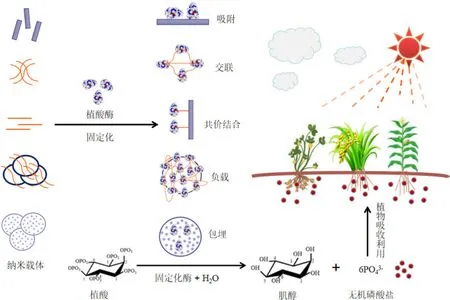
图1 固定化植酸酶矿化水解植酸释放无机磷供植物吸收利用Figure 1 Immobilized phytase hydrolyzes phytate to release inorganic P for plant utilization
1.2 纳米载体的来源与特性
目前用于植酸酶固定化的纳米基材主要包括无机(羟基磷灰石、氧化石墨烯、介孔二氧化硅、氧化铝、活性炭和沸石)(Mohamad et al.,2015)、有机(壳聚糖、聚丙烯酰胺、环氧树脂、纤维素、合成聚合物、藻酸盐和淀粉琼脂)(Elias et al.,2017;Ureta et al.,2021)和可溶性基质(聚乙烯醇)三类(Pragya et al.,2023)。其中,壳聚糖、羟基磷灰石、氧化石墨烯和介孔二氧化硅等纳米基材应用最广泛。
壳聚糖是从虾蟹壳等海洋生物质废物中,将生物质进行化学降解和酶水解提取得到的生物高分子吸附材料(宋俊颖等,2019;罗华丽等,2021),具有无毒、抑菌、生物相容性和生物降解性好等特点(Song et al.,2020)。亦是从几丁质中通过碱性脱乙酰化获得的阳离子多糖(Rahimi et al.,2019),壳聚糖阳离子可与阴离子或带负电荷的蛋白质、脂质、DNA 结合形成聚合物,壳聚糖纳米粒已用作活性成分蛋白质、DNA、siRNA、药物等的固定化载体(Kamat et al.,2015)。此外,与游离酶相比,壳聚糖纳米粒固定化酶表现出更广泛的pH 值和温度稳定性(Verma et al.,2016),故壳聚糖在酶固定化方面已得到广泛应用(Wardhani et al.,2019)。羟基磷灰石是脊椎动物骨骼、牙齿及自然界矿物中广泛存在的吸附能力强的无机矿物(Sun et al.,2017;Liao et al.,2020),具有结构稳定性好、成本低、无毒、无刺激性、表面积大、富含羟基、较好的生物活性和生物相容性等优势(Sun et al.,2013;Xie et al.,2017;洪杰等,2021),亦是常用的酶固定化材料,其结构中的Ca2+易被二价金属离子替换(张连科等,2018),因此吸附能力和离子交换能力较强(Cui et al.,2014),常用作化学反应催化剂载体(Wang et al.,2007)。
石墨烯是以一个碳原子与周边3 个邻近碳原子结合成的六边蜂窝结构的单层碳原子,结构稳定具有较好的延展性和机械强度(Solís-Fernández et al.,2017;曾洪亮等,2021),应用于生物传感器、药物载体和纳米复合材料等领域(Verma et al.,2018;Zhang et al.,2019)。氧化石墨烯作为石墨烯的重要含氧衍生物,其表面和内部含有大量羟基、羧基等含氧官能团(Zhang et al.,2020),具有较大的比表面积、较好的分散性、吸附性、环保性、生物相容性和缓释功能等特性(Han et al.,2013;Che et al.,2013),是聚合物纳米材料重要的基材,亦是酶固定化的纳米级材料。介孔二氧化硅来源于天然无机化合物,存在于沙子、石英或燧石中,形状各异,如凝胶、晶体和无定形(Sapawe et al.,2018)。目前,农业过程产生的原料(稻壳、麦草和玉米芯等)中二氧化硅含量高,生产成本低、快速、简单,产出的介孔二氧化硅纯度高、孔体积大、比表面积高、单分散且相对稳定(Patel et al.,2017),同时介孔二氧化硅基材纳米材料具有无毒、硬度高、耐酸碱、稳定性好、透光性好、绝缘性好等特点,亦具有化学和生物惰性,根据酶分子的大小,介孔材料孔径可调,因而成为一种优良的酶固定化载体(Maity et al.,2017),在生物催化剂、药物载体及生物酶吸附中应用广泛(Yang et al.,2015;陈康等,2022)。近年来,壳聚糖、羟基磷灰石、氧化石墨烯和介孔二氧化硅基材纳米载体已广泛用作生物催化剂和酶固定化的载体。
2 纳米材料及固定化植酸酶的制备技术
2.1 不同纳米材料载体的制备技术
纳米载体具有较大的比表面积和体积比,且酶与纳米载体的结合效率高,可实现对植酸酶的高效负载(Qamar et al.,2022)。以壳聚糖及其衍生物为基材的纳米材料载体制备方法主要包括喷雾干燥法、离子交联法和乳化交联法等(Cota-Arriola et al.,2013)。羟基磷灰石纳米材料的制备方法主要为水热法(Jin et al.,2015)、沉淀法(Mobasherpour et al.,2007)和固相反应法(郭效军等,2012)。氧化石墨烯纳米复合材料的制备方法主要为原位聚合法、溶液共混法和熔融共混法(张雷等,2020)。纳米介孔二氧化硅制备方法包括软模板法、硬膜板法和自模板法等(李雨露等,2020)。通常根据粒子大小和形状、热稳定性、活性成分的释放时间和最终产物的残留毒性等选择适宜的制备方法(Cota-Arriola et al.,2013)。不同纳米材料的常用制备方法及其外观特征与优缺点如表1 所示。

表1 不同纳米材料制备方法Table 1 Preparation methods for different nanomaterials
2.2 不同纳米材料固定化植酸酶的制备技术
通过负载、包埋等方式,固定化可提高酶的环境稳定性和活性,是商业植酸酶应用最为广泛的酶保护技术,常用的植酸酶固定化技术包括吸附、共价结合、包埋、交联、负载等(图1)(Jain et al.,2016;Singh,2016;Verma et al.,2019)。固定化植酸酶的负载率及其活性和稳定性受固定化载体特性、植酸酶特性、制备方法、表征技术等的影响(Dwevedi et al.,2016),需根据酶的特性和生物催化反应(酶水解)选择载体和固定化方法(表2)。

表2 不同纳米材料固定化植酸酶的制备技术、负载率及机理Table 2 Synthesis techniques, loading ratio and mechanisms of different immobilized phytases
壳聚糖具有多种几何构型(粉末、薄片、水凝胶、膜、纤维等)及丰富的活性官能团(–NH2、–COOH),通过与蛋白质或碳水化合物结合将植酸酶固定化(Cipolatti et al.,2014)。例如,采用离子凝胶法将商业植酸酶包埋到壳聚糖纳米粒内部(图1),负载率为69.2%,载药量为18 mg·g-1(钱浩,2021)(表2)。采用共价结合法将地芽孢杆菌(Geobacillussp. TF16)植酸酶负载于壳聚糖内部,负载率为38%,酶活达3.4 U·g-1(Sirin et al.,2017)。壳聚糖微粒具有缓释内部蛋白酶的能力,将植酸酶负载于内部,酶分子受外部环境的影响较小,对底物的作用时间增加,提高植酸水解效率,进而提高土壤磷的利用率、减少土壤中有机磷的残留量。
羟基磷灰石作为酶的固定化材料,蛋白质吸附的基质,结构包括磷酸和钙基团,与蛋白质的带电基团发生静电相互作用(吸附蛋白质的侧基)(Ozhukil et al.,2015),其Ca2+也可以与酶氨基酸中的–COOH 发生螯合反应,产生高度稳定的固定化作用(Coutinho et al.,2018)。亦可以通过Cu2+、Zn2+、Ni2+或Co2+等金属离子在固体载体上与蛋白质电子供体基团氨基酸(组氨酸、半胱氨酸、色氨酸和精氨酸)的选择性相互作用(Coutinho et al.,2020a),提高酶的吸附能力。羟基磷灰石纳米粒可快速吸附进而固定黑曲霉(A.niger)植酸酶,植酸酶通过与羟基磷灰石上存在的Ca2+与植酸酶表面的天冬氨酸和谷氨酸残基的–COOH 侧链螯合建立离子吸附,其植酸酶的吸附率达到100%,载药量为5 mg·g-1(Coutinho,2020b)。黑曲霉(A.niger)植酸酶通过共沉淀法吸附在载体上的负载率为70%,最大蛋白量为4.5 mg·g-1,植酸酶固定在纯羟基磷灰石上的吸附率更高(6 mg·g-1),酶活达118 U·g-1(Coutinho et al.,2020c)。由此,羟基磷灰石作为酶固定化载体其作用机理简单、负载率和酶活高,且可以提供钙源和磷源,在工业、医药及农业领域具有潜在应用价值。
氧化石墨烯表面富含含氧官能团,蛋白质通过物理吸附或化学键固定在氧化石墨烯上(Wang et al.,2011),酶分子与氧化石墨烯表面官能团(环氧化物、羟基和羧基)通过静电相互作用快速固定,是纳米结构材料酶固定化的理想载体(Zhang et al.,2010)。Dutta et al.(2017)采用吸附-交联法将枯草芽孢杆菌(B.subtilis)植酸酶固定在氧化石墨烯纳米载体上,其负载率为74.2%,酶活达3.3 U·g-1。介孔二氧化硅的通道较短、开放、畅通易于酶吸附,其开放孔道(100 nm)易装载大量生物大分子物质,植酸酶(直径4—10 nm)可快速吸附,进入内表面(Kao et al.,2014)。Xin et al.(2020)采用物理吸附法将商业植酸酶固定在单分散的介孔二氧化硅纳米粒上,其植酸酶负载量为237 mg·g-1,酶活达9.53 U·g-1。因此,氧化石墨烯、介孔二氧化硅通过物理吸附将酶固定化于载体表面及微孔内,是经济、简便的酶保护技术,且负载率和活性较高,可开发其在酶载体行业的潜在价值。
2.3 纳米材料固定化植酸酶的表征方法
植酸酶固定化的表征方法较多,不同的固定化技术对应不同的表征方法。目前,大量研究将酶的动力学研究与傅里叶红外光谱(FTIR)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、原子力显微镜(AFM)、圆二色性光谱(CD)、热重分析(TGA)、差示扫描量热法(DSC)、拉曼光谱、紫外-可见光谱等技术相结合,用于研究纳米材料附着酶的功能和结构等特性,以及表征植酸酶的固定化。不同纳米材料固定化植酸酶负载率、酶活性的表征方法及结果如表2 所示。
3 纳米材料固定化植酸酶的催化水解效率
3.1 纳米材料固定化植酸酶的水解效率
壳聚糖纳米粒具备一定缓释内部蛋白酶的能力,可延长蛋白酶对底物的作用时间,从而提高水解效率。Onem et al.(2016)用磁铁矿-壳聚糖固定辣乳菇(L.piperatus)植酸酶和游离植酸酶对谷物和豆类外壳的植酸进行水解效率分析,结果表明,固定化酶对作物中植酸的水解效率高于游离酶,表现为玉米(47.1%和53.3%)、小麦(65.7%和75.0%)、花生(67.5%和75.4%)、绿色小扁豆(36.5%和48.3%)、豌豆(56.8%和68.9%)(表3),该固定化酶可作为面包制作、植物蛋白水解产物制备和谷物麸皮分解的添加剂。将鳄梨(P.americanaMill)植酸酶固定于环氧树脂,用于豆类中植酸的水解,60 ℃反应8 h 后,固定化酶与游离酶的水解效率分别为65%和56%(Çelem et al.,2009a)。用藻酸钙固定酿酒酵母(S.cerevisiae)植酸酶水解植酸,酶活达93.9 mU·g-1,反应1 h 后水解率为50%,固定化酶和游离酶对植酸盐的降解量分别为653 g·g-1和378 g·g-1。固定化酶在植酸降解方面更有效,较游离酶而言植酸降解率提高了170%(In et al.,2017)。固定化酶具有更全面的应用,如用作生物传感器、作为植物肥料,以及作为外源无机磷的来源(Belho et al.,2021)。
3.2 纳米材料固定化植酸酶的水解效率和释磷量
植酸酶与壳聚糖纳米粒结合后,对催化反应温度的敏感性下降,因此固定化植酸酶比游离植酸酶更加稳定,且磷的释放量增强。例如,钱浩(2021)研究表明,在相同酶活前提下,壳聚糖固定化酶相较于游离酶更稳定,且释磷量由1.03 mg提高至1.86 mg,干物质消化率由58.8%提高至60.4%。Coutinho et al.(2020a)用羟基磷灰石固定植酸酶,研究水解特定底物植酸(150 U·g-1)的性能,在37 ℃反应2 h 后,固定化酶和游离酶水解释磷量为 168 μmol·mL-1和149 μmol·mL-1。以富含植酸的豆粕为底物,在55 ℃(pH=5)时研究游离植酸酶和固定化植酸酶的水解效率,游离酶与固定化酶水解豆粕释磷量为7.35 μmol·mL-1和 7.92 μmol·mL-1(Coutinho et al.,2020d),固定化酶具有良好的活性,在动物饲料、农业以及降低豆粕中的植酸含量中具有较大应用潜力。
介孔二氧化硅颗粒固定化植酸酶能有效的水解土壤中植酸盐,释放植物可吸收利用的无机磷酸盐。Trouillefou et al.(2015)报道了介孔二氧化硅固定黑曲霉(A.niger)植酸酶对植物磷营养的作用,负载植酸酶能有效地水解植酸盐,并将无机磷酸盐输送到植物的生长中,从而在根和芽中积累新的有效磷。负载酶催化活性相较于游离酶提高,其正磷酸盐的释放量由0.18 μmol 提高至302 μmol;添加植株培养30 d 后,游离酶正磷酸盐的释放量由0.3 μmol 提高至4.7 μmol;负载酶正磷酸盐的释放量由15.7 μmol 提高至154 μmol。添加负载酶植物根系的干质量相较于游离酶由4.5 mg 提高至7.4 mg,添加负载酶植株磷积累量约为每株10 μmol,是对照(4.2 μmol)的约2.5 倍,可见负载酶提高了植物对土壤有机磷的利用,为植酸酶制剂的开发和土壤磷库在集约化农业生产中的利用提供依据。
4 纳米材料固定化植酸酶酶活性的影响因素
4.1 pH 值
pH 对植酸酶的催化活性有重要影响,壳聚糖纳米粒在对植酸酶进行固定化时,壳聚糖纳米粒与植酸酶蛋白之间形成的氢键使植酸酶蛋白的三维构象更加稳定,植酸酶蛋白对外界环境的敏感性降低,从而导致在碱性条件下固定化酶的稳定性强于游离酶,固定化酶随环境pH 值升高活性下降的趋势小于游离酶(钱浩,2021)(表3)。例如,Kamaci et al.(2020)用聚乙烯醇壳聚糖纳米纤维固定豇豆(V.unguiculata)植酸酶,研究植酸酶pH 值(pH=2.0—9.0)的稳定性,固定化酶的最适pH 值较游离酶碱性更强(6.0 和5.0),在pH 值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0 时,游离酶和固定化酶的酶活性分别为46.9%和65.8%、55.8%和71.3%、78.8%和72.1%、100.0%和77.5%、74.4%和100.0%、63.1%和76.6%、8.8%和71.3%、0.17%和61.7%,在pH=7.0 时游离酶的催化活性急剧降低,pH=9.0时几乎已失活,而固定化酶活性变化较小,且酶活高于游离酶。因此,壳聚糖固定化植酸酶的pH 稳定性提高,酶的催化活性增强。植酸酶作为磷酸水解酶,通常在酸性条件下较为稳定,而固定化酶的pH 稳定性提高。Onem et al.(2016)用磁铁矿-壳聚糖固定辣乳菇(L.piperatus)植酸酶,研究植酸酶pH 值(pH=3.0—9.0)的稳定性,固定化酶的最适pH 值较游离酶酸性更强(4.0 和5.0),在pH=3.0时,游离酶与固定化酶的剩余酶活分别为46%和82%;在pH=9.0 时,游离酶与固定化酶的剩余酶活分别为45%和70%,故壳聚糖固定化植酸酶的pH值稳定性提高。Awad et al.(2015)用藻酸盐固定紫原青霉(PenicilliumpurpurogenuGE1)植酸酶,固定化酶的最适pH 值较游离酶酸性更强(4.0 和5.5),在pH=4.0 下反应45 min,固定化酶与游离酶的剩余酶活分别为100%和54%;2 h 时,固定化酶的活性降低到约60%,而游离酶已失活。植酸酶在藻酸盐纳米载体上固定化后,固定化酶酶活的pH值稳定性提高,酶催化活性增强,在工业、农业领域中具有很大的应用潜力。
4.2 温度
植酸酶是一种热不稳定生物活性酶,受温度的显著影响。酶的温度稳定性取决于其三维结构及构象完整性,构象完整性越好,则稳定性越好。酶/纳米纤维通过纳米纤维表面–OH 与植酸酶中中的自由–C=O 和–NH 基团形成强氢键形成稳定交联(Rathnayake et al.,2018)。Kamaci et al.(2020)利用聚乙烯醇壳聚糖纳米纤维固定豇豆(V.unguiculata)植酸酶,研究植酸酶的温度(25—95 ℃)稳定性,发现固定化酶的最适温度较游离酶升高20 ℃(65 ℃和45 ℃),其游离酶在低温(60 ℃)下的催化活性高于高温(70—95 ℃),在60 ℃时游离酶的活性急剧降低至45%,95 ℃时酶几乎失活剩余酶活为10%;而固定化酶催化活性在25—65 ℃的温度范围内增加,在65 ℃后逐渐降低,95 ℃时剩余酶活性为65%,固定化植酸酶的温度稳定性提高,且固定化后植酸酶的催化活性增强。Coutinho et al.(2020d)用羟基磷灰石纳米粒固定黑曲霉(A.niger)植酸酶,研究植酸酶的温度(20—90 ℃)稳定性。固定化酶的最适温度较游离酶升高10 ℃(60 ℃和50 ℃),将游离酶和固定化酶在60—90 ℃反应3 h,游离酶和固定化酶在60 ℃和70 ℃下都是稳定的。游离酶在反应3 h 后相对活性略有下降,在80 ℃和90 ℃反应20 min内完全失活,且降解过程是不可逆的;而固定化酶在80 ℃反应3 h 后剩余酶活为60%,在90 ℃反应20 min 后剩余活性为40%,随着温度的升高,固定化酶的酶活性升高,而游离酶的酶活性降低,且固定化后对温度的稳定性增强。Dutta et al.(2017)用氧化石墨烯固定枯草芽孢杆菌(B.subtilis)植酸酶,与游离植酸酶相比,固定酶在42 ℃时酶活性增加了2.4 倍;在60 ℃时,酶活性提高3.76 倍;在70、80 和85 ℃时,酶活性分别提高5.79、8.04 和20.3倍。Naghshbandi et al.(2018)用羧化多壁碳纳米管固定大肠杆菌(Escherichiacoli)植酸酶,在80 ℃和90 ℃反应2 min,游离酶剩余活性由27%降至3%,固定化酶剩余酶活由51%降至33%。因此,纳米材料固定化植酸酶酶温度稳定性提高,酶的催化活性增强,可提供可观的经济效益,在生物医学、生物感应、生物成像、药物/基因递送及组织工程等领域广泛应用(张峰,2019)。
4.3 金属离子
植酸酶与大多数金属离子具有很强的螯合能力,因此金属离子在植酸酶催化活性、生物功能中起着重要作用。金属通过不可逆地掩蔽催化活性基团、变性蛋白质构象可与金属离子辅因子竞争,是著名的酶活性抑制剂(Bohn et al.,2008;Hamada,2016)。金属离子的作用各不相同,二价阳离子(如Co2+、Mn2+、Zn2+、Cu2+和Ni2+)通常比单价阳离子(如Na+)具有更强的抑制性(Li et al.,2021)。例如,Onem et al.(2016)用磁铁矿-壳聚糖固定化辣乳菇(L.pipatus)植酸酶研究金属离子对固定化酶催化活性的影响,固定化酶对金属离子的抗性比游离酶更强,Fe2+(189%和16.2%)、Co2+(105%和37.8%)、Mg2+(127%和72.9%)、Zn2+(100%和37.8%)。金属离子对游离酶活性均有较强的抑制作用,而固定化酶活性有明显的促进作用。Kamaci et al.(2020)研究金属离子对豇豆(V.unguiculata)植酸酶催化活性的影响,固定化酶对Ag+的抗性比游离酶更强(113%和78%),Mg2+(108%)、Li+(107%)和Ca2+(112%)对固定化酶催化活性也增加。Hidayatullah et al.(2020)用藻酸盐包封克雷伯氏菌(Klebsiella)植酸酶,研究表明金属离子对包封酶的酶活高于游离酶,Ca2+(0.23 U·mL-1和0.049 U·mL-1)、Mg2+(0.22 U·mL-1和0.03 U·mL-1)、Fe2+(0.23 U·mL-1和0.08 U·mL-1)、Zn2+(0.228 U·mL-1和0.052 U·mL-1)。因此,固定化植酸酶对金属离子具有抗性,且酶的催化活性增强,在食品、动物饲料和肥料领域有很大的应用潜力。
植酸酶在正电荷离子方面具有很高的螯合能力,Sharma et al.(2023)用藻酸钙固定米曲霉(A.oryzae)植酸酶,研究金属离子对植酸酶催化作用的影响,结果表明固定化酶活性促进作用强于游离酶。例如,Mg2+(135%和105%)、Cu2+(132%和117%)、Fe2+(122%和80%)、Na+(142%和126%)、Fe3+(118%和115%)和Ca2+(128%和114%),固定化酶对金属离子的催化活性高于游离酶。Duru et al.(2021)用藻酸钠固定豇豆(V.unguiculata)植酸酶研究金属离子抗性,结果表明Ni2+(90%和79%)、Ba2+(182%和151%)、Ag+(190%和84%)对固定化酶的催化活性高于游离酶。因此,纳米材料固定化植酸酶在金属离子存在环境中的稳定性更强,在工业领域具有很高的应用价值。
5 结论与展望
磷的生物利用率低、植酸酶稳定性差和易失活等问题已引起广泛关注,尤其是农业过程中植酸酶活降低甚至失活影响植酸盐水解和磷释放,通过将植酸酶固定在纳米载体上提高其环境稳定性和活性,改善植酸酶的催化特性,产生更多肌醇和无机磷酸盐,可为植酸酶应用于农业生产、提高土壤难利用态植酸磷的利用效率提供有效途径,对降低外源磷肥施用和环境磷污染具有重要的现实意义。
纳米材料辅助固定化技术用于开发稳定性植酸酶,植酸酶活性的提高有利于植酸的分解,开发稳定性植酸酶可以防止磷酸盐积累导致的环境污染。纳米基材的适当选择是其应用成功的关键,固定化植酸酶在实际应用中仍具有一定局限性,为此,可加强以下几方面研究:1)了解植酸酶的来源与特性,致力于筛选出稳定性好、活性高的产植酸酶微生物;2)筛选稳定性好、高效负载的固定化载体,并利用经济、工艺简单的技术制备纳米级材料;3)研发快速、经济的纳米材料固定化植酸酶方法,提高固定化率和载药量,降低固定化成本,解决在植酸酶生产、运输、使用和储存中保持酶活性的问题;4)将固定化植酸酶应用于土壤中作为土壤改良剂,水解土壤中络合的植酸,缓解植酸在土壤中的各种弊端,将植酸作为植物生长的磷供给源进行利用,减少磷源肥料的施用,促进磷元素的循环利用。

