广东省湛江水产养殖区表层水中抗生素污染特征及风险评估
彭 勃, 张 彪, 曾祥英, 梁 医, 吴 杨, 于志强*
广东省湛江水产养殖区表层水中抗生素污染特征及风险评估
彭 勃1, 2, 3, 张 彪1, 2, 3, 曾祥英1, 梁 医1, 吴 杨1, 于志强1*
(1. 中国科学院 广州地球化学研究所, 有机地球化学国家重点实验室 广东省环境资源利用与保护重点实验室, 广东 广州 510640; 2. 中国科学院深地科学卓越创新中心, 广东 广州 510640; 3.中国科学院大学, 北京 100049)
在广东湛江选择代表性的不同水产品(鱼虾和牡蛎)养殖区域, 研究表层水中抗生素分布特征, 并初步评估抗生素对水体生物的潜在风险。结果表明, 在养殖区表层水中检测到16种抗生素, 检出率为14%~79%, 总浓度范围为6.75~592 ng/L, 依诺沙星(ENO)、氧四环素(OTC)、甲砜霉素(TAP)和氟苯尼考(FF)是主要抗生素。不同养殖环境表层水中抗生素含量和组成规律明显不同, 其中牡蛎养殖海域抗生素总浓度最高(147~592 ng/L),以OTC和FF为主; 而鱼虾养殖池塘抗生素总浓度相对较低(6.75~77.2 ng/L), 以恩诺沙星(ENR)和ENO为主。不同养殖物种投放饲料和药物以及养殖环境水动力条件对水体抗生素分布有明显影响。风险评估结果表明, 环丙沙星(CIP)可能对藻类造成中–高风险; ENO对藻类和无脊椎动物造成中–高风险。
水产养殖区域; 抗生素; 养殖种类和方式; 空间分布; 风险评估
0 引 言
抗生素主要用于治疗人类和动物疾病、预防细菌感染以及作为饲料添加剂促进动物生长(Merve and Nursen, 2019), 经体内代谢后通过粪便和尿液排出体外, 最终进入污水厂处理或者直接进入水环境(Hirschet al., 1999; Kümmerer et al., 2000; Levison and Levison, 2009; Tuc et al., 2017)。抗生素及其代谢转化产物广泛存在于水体、沉积物和土壤中, 并由此产生抗性基因(ARGs)和抗性细菌(ARBs)(Li et al., 2018b; Danner et al., 2019)。据报道, 较低浓度的抗生素仍可诱导ARGs和ARBs的积累和繁殖(Gullberg et al., 2011; Sandegren, 2014), 进而在水生系统中传播, 对生态系统造成潜在的危害(Marti et al., 2014; Nnadozie and Odume, 2019)。因此, 抗生素、ARGs及ARBs成为过去十年间全球普遍关注的重要污染物。
中国是世界上最大的抗生素使用国之一, 其中大部分抗生素用于畜牧和水产养殖(Yin et al., 2013; Zhang et al., 2015)。湛江海域作为广东主要渔业养殖基地, 其水产品年产量为81.9万吨, 占全省总产量的25.8%, 包括鱼类10.2万吨、虾类19.6万吨和贝类51.1万吨。目前湛江海水养殖技术成熟, 依据不同水产品的种类, 可采用网箱、池塘、筏氏、吊笼和底播养殖等, 其中网箱和池塘等养殖方式常用于鱼虾等, 筏氏、吊笼和底播养殖主要用于牡蛎等贝类。养殖过程中大量投放药物和饲料, 其后, 未被代谢的抗生素及代谢产物直接排入养殖水体中。目前关于湛江水产养殖海域表层水中抗生素组成和分布的研究有限, 仅Liu et al. (2020)报道了湛江国家红树林自然保护区沉积物中14种抗生素的浓度。
本研究选择了19种抗生素作为目标化合物, 包括12种氟喹诺酮(FQs)、4种四环素(TCs)和3种氯霉素(CPs), 调查它们在雷州半岛东北部牡蛎养殖海域(筏式养殖)、南三岛鱼虾养殖池塘(池塘养殖)、南三岛鱼虾养殖海域(网箱+池塘养殖)以及流沙鱼港养殖海域(网箱养殖)等表层水中的组成和分布。主要目的是: ①检测表层水中19种抗生素的浓度水平和组成特征; ②研究不同养殖环境和养殖种类对抗生素分布的影响; ③初步评估抗生素的潜在生态风险。
1 材料和方法
1.1 试剂与标准品
本研究中, 12种FQs目标化合物为环丙沙星(CIP)、恩诺沙星(ENR)、洛美沙星(LOM)、马波沙星(MAB)、诺氟沙星(NOR)、氧氟沙星(OFL)、左氧氟沙星(LOFL)、依诺沙星(ENO)、双氟沙星(DIF)、氟罗沙星(FLE)、沙拉沙星(SAR)和加替沙星(GAT)。4种TCs包括氧四环素(OTC)、四环素(TTC)、金霉素(CTC)和多西环素(DC)。3种CPs分别为氯霉素(CAP)、氟苯尼考(FF)和甲砜霉素(TAP)。ENR-D5、CIP-D8、CAP-D5、卡马西平-D10(CBZ-D10)和氟康唑-D4(FCZ-D4)用作回收率指示物。目标抗生素的详细信息和理化性质参考Zhang et al. (2020)。
准确称量10 mg标样, 溶解于10 mL甲醇中, 制成1 mg/mL的储备标样。标样保存于棕色细胞瓶中, 于−20 ℃下避光保存备用。仪器分析之前, 再用甲醇和水(1∶1)稀释, 建立浓度范围为2~500 ng/mL的工作曲线。色谱纯甲醇和甲酸购自默克公司(Darmstadt, Germany), 盐酸来自广州化学试剂厂。乙二胺四乙酸二钠(Na2EDTA)和Oasis HLB小柱(6 mL, 500 mg)购自沃特世公司(Waters, Milford, MA, USA), 玻璃微纤维滤膜(GF/F, 0.7 μm)购自英国沃特曼公司(Whatmann, Maidstone, England), 并在使用前于450 ℃加热4 h去除有机杂质。超纯水(>18.2 MΩ·cm)由FBZ2002-UP-P超纯水净化系统生产。
1.2 研究区域及样品采集
在雷州半岛东北部牡蛎养殖海域(筏氏养殖, A1~A6)、南三岛鱼虾养殖池塘(池塘养殖, B1~B6)、南三岛鱼虾养殖海域(网箱+池塘养殖, C1~C6)和流沙鱼港养殖海域(网箱养殖, D1~D11)一共设置了29个采样点(表1)。使用不锈钢桶从养殖区采集1 L表层水转入预先清洗过的1 L棕色玻璃瓶中, 立即加入10 mL甲醇以抑制微生物活性。样品在4℃下运送到实验室, 经0.7 μm 玻璃纤维滤膜滤除颗粒物, 2 d内完成前处理。
1.3 抗生素富集与定量分析
1 L表层水中加入500 mg Na2EDTA, 并用4 mol/L盐酸调节pH值为2, 然后再加入100 ng回收率指示物。表层水中抗生素采用Oasis HLB小柱(6 mL, 500 mg)来富集和净化, 用12 mL甲醇洗脱目标化合物。洗脱液用柔和的N2吹至近干, 重新溶解于1 mL甲醇和水(1∶1)中, 过0.22 μm PTFE滤头, 待进样分析。
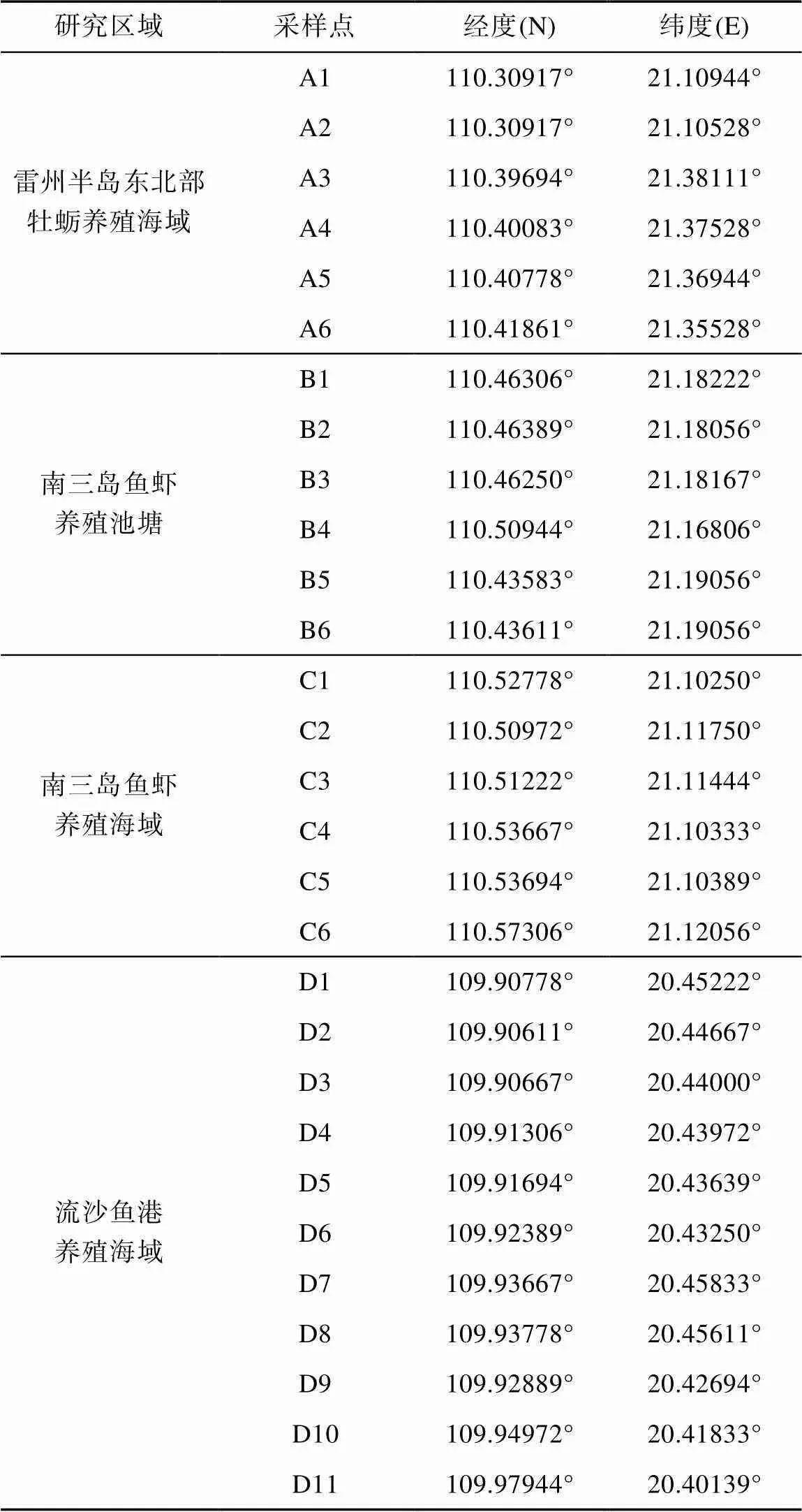
表1 研究区域及样品采集位置
抗生素定性定量分析由液相色谱–质谱(安捷伦1100液相色谱与AB SCIEX API 4000三重四极杆质谱仪联用, LC-MS-MS)完成。Zorbax Eclipse Plus C18色谱柱(4.6 mm×250 mm×5 μm; Agilent Technology)用于分离样品中的抗生素, 柱温30 ℃, 进样体积10 μL; 流动相为0.05%甲酸的水(A)和0.05%甲酸的甲醇(B)。FQs和TCs在正电离模式下检测, 流速为0.6 mL/min; CPs在负电离模式下检测, 流速为0.5 mL/min。在目前的LC-MS-MS条件下, OFL和LOFL不能基线分离, 因此本研究报道了两者的总浓度。详细前处理过程和仪器分析见Zhang et al. (2020)。
1.4 质量保证和质量控制
研究中采用严格质量保证和质量控制措施, 每一批次样品中掺入程序空白(=3)、基质加标(=3)和重复样品(=3)进行分析。分别以3倍和10倍信噪比(S/N)计算检出限(LOD)和定量限(LOQ)(Jelic et al., 2009)。结果表明, 程序空白中未发现抗生素, 不同浓度水平抗生素加标回收率为50%~150%, LOD为0.170~1.95 ng/L, LOQ为0.510~5.84 ng/L(表2)。
1.5 风险评估
本研究中, 使用风险商(risk quotients, RQ)来初步评估水产养殖区表层水中抗生素对不同营养级生物(藻类、无脊椎动物和水生植物)的潜在生态风险(Sun et al., 2016)。其中, 0.01≤RQ<0.1指示低风险, 0.1≤RQ<1.0指示中风险, RQ≥1.0 指示高风险(Hernando et al., 2006)。
2 结果与讨论
2.1 表层水中抗生素浓度水平
本研究中, 所有29个表层水样品中均未检测出LOM、MAB 和CAP。检测结果表明, 湛江水产养殖区表层水中不同抗生素浓度水平和检出率存在显著差异(表3)。
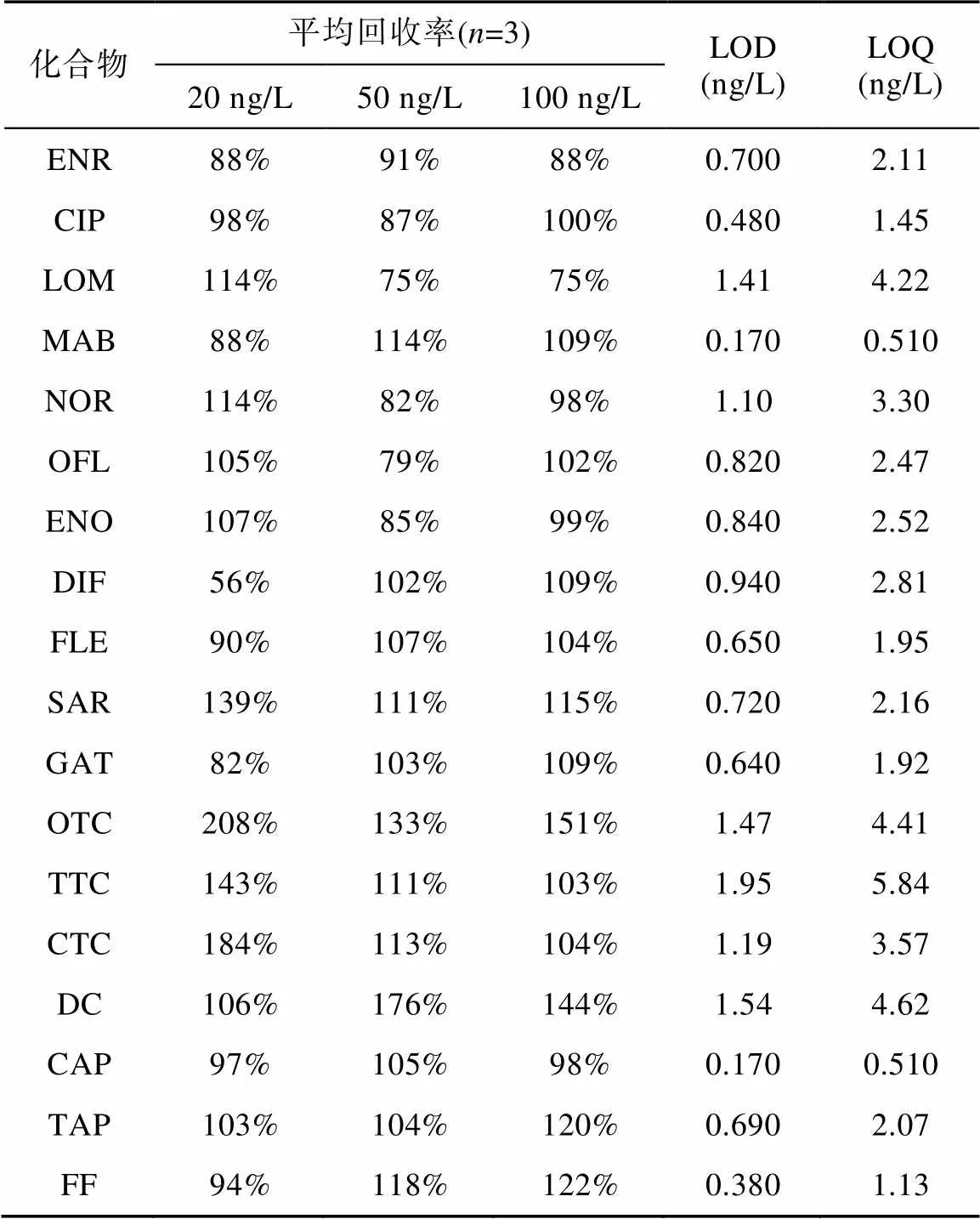
表2 表层水中目标抗生素加标回收率与检测限和定量限

表3 广东省湛江水产养殖区表层水中抗生素检出率和浓度
注: ND. 未检出。
在养殖环境表层水检出9种FQs, 其中ENO和SAR检出率大于50%; ENO平均浓度水平(ND~ 43.7 ng/L,均值10.2 ng/L)最高, 其次是NOR (ND~10.4 ng/L, 均值6.31 ng/L)、SAR(ND~23.7 ng/L,均值5.73 ng/L)、ENR(ND~17.1 ng/L, 均值5.49 ng/L)和CIP(ND~26.4 ng/L, 均值5.41 ng/L), 表明这些抗生素在水产养殖业中被不同程度地使用。值得注意的是, 在封闭池塘养殖环境中检出了人用抗生素CIP、ENO和GAT, 因此抗生素滥用的问题需要高度关注。
部分国内外代表性水体中抗生素研究结果(表4)显示, 本研究中ENO浓度与法国普通水体相似(Dinh et al., 2017; Tuc et al., 2017), 但低于莱州湾和江汉平原(Zhang et al., 2012; Yao et al., 2015); NOR浓度远低于莱州湾海水养殖场(Han et al., 2021); ENR浓度与莱州湾海水养殖场和太湖相当(Xiong et al., 2017; Han et al., 2021); CIP浓度相对较低。大多数FQs(ENO和FLE除外)的半衰期为2.05(NOR)~ 771(GAT) min, 因此它们在表层水中的检出率和浓度较低(Ge et al., 2010; Bacanlı and Başaran, 2019)。整体来看, 湛江表层水中FQs浓度处于较低的水平。
注: ND. 未检出; NA. 未检测。
4种TCs均有检出, 检出率为28%(DC)~72%(OTC), 浓度排序为OTC(ND~137 ng/L, 均值27.5ng/L)> TTC(ND~26.6 ng/L, 均值15.0 ng/L)>DC(ND~16.2 ng/L, 均值8.44 ng/L)>CTC(ND~12.1 ng/L, 均值7.67 ng/L) (表3)。TCs被广泛用于动物疾病预防或治疗, 并作为添加剂提高畜禽养殖和水产养殖的饲料转化效率(Zhou et al., 2013)。Zhang et al. (2020)研究发现, 养猪废水中TCs主要来源于饲料添加剂。因此, 推测表层水中TCs可能来源于饲料添加剂以及预防或治疗动物疾病的药物。与国内外研究结果相比, 本研究中OTC浓度与白洋淀和莱州湾海水养殖场相当(Li et al., 2012; Han et al., 2021); TTC浓度高于莱州湾海水养殖场(Han et al., 2021), 低于法国普通水体(Dinh et al., 2017); DC浓度与鄱阳湖相当(Ding et al., 2017); CTC浓度远低于太湖周边鱼类养殖场和洪湖养殖池塘(Song et al., 2016; Wang et al., 2017)(表4)。总体而言, 本研究中OTC和TTC浓度处于中等水平。
就CPs而言, 所有样品中均未检测到CAP, FF和TAP检出率分别为79%和66%, 浓度分别为ND~369 ng/L(均值78.9 ng/L)和ND~48.3ng/L(均值19.3 ng/L)。由于严重的不良反应, 我国在2002年明令禁止在动物尤其是食用动物疾病防治上使用CAP(http://jiuban.moa.gov.cn/zwllm/zcfg/qtbmgz/200601/t20060123_540873.htm); 而FF和TAP作为CAP的衍生物, 毒性小, 抗菌活性高, 在许多国家替代CAP用于预防或治疗畜牧养殖和水产养殖中细菌性疾病(Ge et al., 2009; Barreto et al., 2016), 因此CAP在普通水体中甚少检出。本研究中, FF浓度低于太湖周边鱼类养殖场(Song et al., 2016); TAP浓度高于太湖(Xiong et al., 2017), 整体来看处于较高的污染水平。
2.2 不同养殖环境中抗生素组成特征及影响因素
本研究包括4类特征性养殖环境, 由于不同采样点养殖水产品种类和所处环境的特异性, 表层水中不仅抗生素浓度水平差异显著(图1), 其组成特征差异也非常显著(图2)。总体来说, 雷州半岛东北部牡蛎筏式养殖海域表层水中抗生素总浓度最高(147~592 ng/L,均值368 ng/L), 主要抗生素为FF; 南三岛鱼虾网箱+池塘养殖海域(6.75~77.2 ng/L, 均值53.0 ng/L)和流沙鱼港网箱养殖海域(18.8~164 ng/L, 均值48.2 ng/L)抗生素浓度大致相当, 其主要抗生素均为OTC和TAP、FF, 而南三岛鱼虾养殖池塘(6.75~77.2 ng/L, 均值35.1 ng/L)浓度最低, 主要抗生素为ENR和ENO。
雷州半岛东北部牡蛎养殖海域为半封闭海域, 牡蛎采用筏式养殖, 养殖区海水流速低、交换慢, 抗生素稀释程度较低(Han et al., 2021)。A1采样点抗生素总浓度最高(592 ng/L), 主要抗生素为FF和OTC,占总浓度的73%。FF和OTC广泛用于水产养殖业(Chen et al., 2015), 因此牡蛎养殖海域中抗生素可能来源于养殖活动。A2采样点位于牡蛎养殖场与海水的交换通道, A2采样点较高浓度(147 ng/L)的抗生素表明, 水产养殖业产生的污染物质主要以向外海输出的方式, 对周边海域环境产生影响。采样点A3~A6抗生素总浓度分别为399 ng/L、413 ng/L、355 ng/L和302 ng/L, 主要组分为FF, 分别占总浓度的81%、89%、97%和91%。
南三岛鱼虾养殖池塘(B1、B2、B4和B5)为相对封闭的环境, 主要抗生素为ENR和ENO, 分别占总浓度的84%、100%、61%和91%, 表明池塘中的ENR和ENO来源于养殖活动, 如饲料添加剂或者作为治疗或者预防疾病的药物直接加入。有研究在饲料样品中检测到大量ENR(Rico et al., 2013; Chen et al., 2015)。为了保证食品安全, 一般在水产品收获之前会控制抗生素使用(6.75~30.7 ng/L; Chen et al., 2015), 在本研究样品采集之前, 池塘中的鱼虾已经收获, 这可能是本研究中抗生素浓度水平低的原因之一。B3(50.2 ng/L)和B6(77.2 ng/L)位于养殖池塘废水排放通道, 废水最终进入湛江海域, B3和B6抗生素浓度高于B1、B2、B4和B5, 含有较高浓度的FF, 反映了养殖废水中FF的残留, ENR和ENO仅占总浓度的23%和28%。
在南三岛鱼虾养殖海域, 鱼类深海养殖区中(C2和C3)主要抗生素为FF和TAP, 分别占总浓度的85%和67%。FF和TAP广泛用于动物疾病防治, 尤其是食品类动物, 如虾(Rico et al., 2013)。而其他抗生素(如OTC)可能来源于饲料添加剂。南三岛上既有村民养殖池塘(C4), 也有工业化养殖海域(C6)。C4中主要抗生素为CIP、ENO、FLE、SAR和OTC, 而C6中主要抗生素为ENR、CIP、ENO、SAR和GAT,显示出不同的抗生素使用特征。
在流沙鱼港养殖海域中(D1~D11), OTC、TAP和FF是主要抗生素, 占抗生素总浓度的60%~95% (D9除外)。鱼类养殖过程中, 需要喂养大量饲料, TCs作为促进鱼类生长的添加剂被广泛使用, 因此推测本研究表层水中TCs可能主要来源于饲料。TAP和FF广泛用于鱼类养殖中预防和治疗鱼类疾病。
以上结果表明, 除了封闭的池塘养殖环境, 其余养殖环境中FF被高频使用。不同养殖环境中抗生素浓度和组成差异与养殖种类(鱼虾和牡蛎)、养殖环境(池塘养殖、网箱养殖和筏式养殖)以及不同的生长期(幼苗期、成长期、成熟期和收获期)有关。不同的养殖种类(如鱼虾和牡蛎等)会投放不同饲料, 饲料中抗生素种类和含量均有明显差异; 在不同生长期(幼苗期、成长期、成熟期、收获期), 为促进鱼虾生长以及控制病害微生物影响, 也可能投放不同类型和不同剂量的抗生素(Chen et al., 2015)。养殖方式(池塘养殖、网箱养殖和筏式养殖等)对水体中抗生素分布也会有较大影响, 在封闭式的池塘中, 抗生素容易富集于水体; 而在半封闭的海湾环境, 有一定程度的海水交换, 可稀释水体中抗生素浓度。此外, 抗生素本身的理化性质也会显著影响其环境过程(如颗粒–水–沉积物的分配、降解和转化等)和最终归趋(Kümmerer, 2009; Van Doorslaer et al., 2014; Li et al., 2018a; Zhang et al., 2020)。尤其值得注意的是, 抗生素半衰期差异显著, 在2.05 min(NOR)~20.8 d (CAP)之间(Zhang et al., 2020), 因此它们在环境中的持久性不同(Yi et al., 2019), CPs的半衰期(4.80~ 20.8 d)远高于FQs和TCs(0.75~3 h)(Zhang et al., 2020), 可能也是FF和TAP表现出较高检出率的原因之一。

图1 广东省湛江不同养殖环境表层水中抗生素分布特征

图2 广东省湛江不同养殖环境表层水中抗生素组成特征
2.3 风险评估
湛江水产养殖区不同抗生素对藻类、无脊椎动物和水生植物风险商箱型图(图3)表明, 湛江水产养殖区大部分采样点的CIP(RQ=0.390~5.28)和ENO (RQ=0.100~1.52)可能对藻类造成中–高风险。美国和加拿大已经禁止ENR和CIP用于水产养殖(Rico et al., 2013)。ENO也可能对无脊椎动物产生中–高风险, 类似的结果在渤海沿岸的莱州湾养殖海域被发现(Han et al., 2021)。在雷州半岛东北部牡蛎养殖海域A1采样点检出了最高浓度的CIP和ENO, 它们的RQ>1, 表明这两种抗生素可能会对该区域水生系统产生长期不良影响(图3)。在雷州半岛东北部牡蛎养殖海域A1和A2采样点, OTC、TTC和CTC也可能对藻类产生中等风险, 且OTC会对无脊椎动物产生中等风险。本研究中虽然FF浓度较高, 检出率也高, 但其预期无效应浓度(PNEC)远高于其表层水浓度, 因此RQ远低于0.01, 其潜在生态风险有限。ENR、CIP和OTC也可能对水生植物产生中等风险。必须注意的是, 以上关于养殖环境中抗生素生态风险的评估讨论均基于单个抗生素而言, 实际环境中抗生素并非单一物种分布, 而是多种复合存在, 多种抗生素作用下可能会产生毒性协同效应。因此, 基于单个抗生素的生态风险评估可能低估了实际环境中抗生素生态风险。
研究表明, 即使在低浓度下, 抗生素也能诱导抗生素ARGs和ARBs的产生、积累和传播,从而对非目标生物产生长期不良影响(Gullberg et al., 2011; Sandegren, 2014)。因此, 为了保护人类和维护生态系统安全, 必须切实控制养殖行业中抗生素的添加使用。后续研究也需高度关注养殖海域中ARGs的分布及其可能对非目标生物带来的风险。

图3 广东湛江养殖区表层水中抗生素对藻类(a)、无脊椎动物(b)和水生植物(c)的风险评估箱线图
3 结 论
(1) 湛江水产养殖区表层水中检出16种抗生素, 其中CPs和TCs为主要抗生素种类, ENO、OTC、TAP和FF为主要抗生素单体。另外, 人用抗生素也广泛用于水产养殖业中。
(2) 不同水产养殖种类(鱼虾和牡蛎)和养殖环境(池塘养殖、网箱养殖和筏式养殖)抗生素浓度水平与组成特征差异明显, 反映出不同养殖物种投放饲料和药物的差异。其中, 牡蛎养殖海域抗生素总浓度最高(147~592 ng/L), 以OTC和FF为主; 鱼虾养殖池塘抗生素总浓度相对较低(6.75~77.2 ng/L), 以ENR和ENO为主。
(3) 初步风险评估结果表明, CIP和ENO会对水产养殖区表层水中的藻类和无脊椎动物产生中–高风险。为了保护人类健康和生态系统安全, 必须合理使用抗生素CIP和ENO。
致谢:感谢华南师范大学赵建亮教授和中国科学院南海海洋研究所徐维海研究员提出宝贵的修改意见。
Bacanlı M, Başaran N. 2019. Importance of antibiotic residues in animal food., 125: 462–466.
Barreto F, Ribeiro C, Hoff R B, Costa T D. 2016. Determination of chloramphenicol, thiamphenicol, florfenicol, and florfenicol amine in poultry, swine, bovine, and fish by liquid chromatography-tandem mass spectrometry., 1449: 48–53.
Chen H, Liu S, Xu X R, Liu S S, Zhou G J, Sun K Y, Zhao J L, Ying G G. 2015. Antibiotics in typical marine aquaculturefarms surrounding Hailing Island, South China: Occurrence, bioaccumulation, and human dietary exposure., 90(1–2): 181–187.
Chen K, Zhou J L. 2014. Occurrence and behavior of antibioticsin water and sediments from the Huangpu River, Shanghai, China., 95: 604–612.
Danner M C, Robertson A, Behrends V, Reiss J. 2019. Antibioticpollution in surface fresh waters: Occurrence and effects., 664: 793–804.
Ding H J, Wu Y X, Zhang W H, Zhong J Y, Lou Q, Yang P, Fang Y Y. 2017. Occurrence, distribution, and risk assessment of antibiotics in the surface water of Poyang Lake, the largest freshwater lake in China., 184: 137–147.
Dinh Q T, Moreau-Guigon E, Labadie P, Alliot F, Teil M J, Blanchard M, Chevreuil M. 2017. Occurrence of antibiotics in rural catchments., 168: 483–490.
Ge L K, Chen J W, Qiao X L, Lin J, Cai X Y. 2009. Light- source-dependent effects of main water constituents on photodegradation of phenicol antibiotics: Mechanism and kinetics., 43(9): 3101–3107.
Ge L K, Chen J W, Wei X X, Zhang S Y, Qiao X L, Cai X Y, Xie Q. 2010. Aquatic photochemistry of fluoroquinolone antibiotics: Kinetics, pathways, and multivariate effects of main water constituents., 44(7): 2400–2405.
Gullberg E, CaoS, Berg O G, Ilback C, Sandegren L, Hughes D, Andersson D I. 2011. Selection of resistant bacteria at very low antibiotic concentrations., 7(7), e1002158.
Han Q F, Zhang X R, Xu X Y, Wang X L, Yuan X Z, Ding Z J, Zhao S, Wang S G. 2021. Antibiotics in marine aquaculture farms surrounding Laizhou Bay, Bohai Sea: Distribution characteristics considering various culture modes and organism species., 760, 143863.
Hernando M D, Mezcua M, Fernandez-Alba A R, Barcelo D. 2006. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters, and sediments., 69(2): 334–342.
Hirsch R, Ternes T, Haberer K, Kratz K L. 1999. Occurrence of antibiotics in the aquatic environment., 225: 109–118.
Jelic A, Petrovic M, BarceloD. 2009. Multi-residue method for trace level determination of pharmaceuticals in solid samples using pressurized liquid extraction followed by liquid chromatography/quadrupole-linear ion trap mass spectrometry., 80(1): 363–371.
Kümmerer K. 2009. Antibiotics in the aquatic environment — A review — Part Ⅰ., 75(4): 417–434.
Kümmerer K, Al-Ahmad A, Mersch-Sundermann V. 2000. Biodegradability of some antibiotics, elimination of the genotoxicity and affection of wastewater bacteria in a simple test., 40(7): 701–710.
Lei X N, Lu J J, Liu Z L, Tong Y B, Li S M. 2015. Concentration and distribution of antibiotics in water-sediment system of Bosten Lake, Xinjiang., 22(3): 1670–1678.
Levison M E, Levison J H. 2009. Pharmacokinetics and pharmacodynamics of antibacterial agents., 23(4): 791–814.
Li S, Huang Z, Wang Y, Liu Y Q, Luo R, Shang J G, Liao Q J H. 2018a. Migration of two antibiotics during resuspension under simulated wind-wave disturbances in a water- sediment system., 192: 234–243.
Li S, Shi W Z, Liu W, Li H M, Zhang W, Hu J R, Ke Y C, Sun W L, Ni J R. 2018b. A duodecennial national synthesisof antibiotics in China’s major rivers and seas (2005–2016)., 615: 906–917.
Li W H, Shi Y L, Gao L H, Liu J M, Cai Y Q. 2012. Occurrence of antibiotics in water, sediments, aquatic plants, and animals from Baiyangdian Lake in North China., 89(11): 1307–1315.
Liu T K, Lun J S, Zheng P, Feng J R, Meng S S, Peng T, Hu Z.2020. Diversity and distribution of antibiotics and antibiotic resistance genes in seven national mangrove nature reserves, South China., 153(1), 105000.
Marti E, Variatza E, Balcazar J L. 2014. The role of aquatic ecosystems as reservoirs of antibiotic resistance., 22(1): 36–41.
Merve B, Nursen B. 2019. Importance of antibiotic residues in animal food., 125: 462–466.
Na G S, Gu J, Ge L K, Zhang P, Wang Z, Liu C Y, Zhang L. 2011. Detection of 36 antibiotics in coastal waters using highperformance liquid chromatography-tandem mass spectrometry., 29: 1093–1102.
Nnadozie C F, Odume O N. 2019. Freshwater environments as reservoirs of antibiotic resistant bacteria and their role in the dissemination of antibiotic resistance genes., 254(Part B), 113067.
Rico A, Phu T M, Satapornvanit K, Min J, Shahabuddin A M, Henriksson P J G, Murray F J, Little D C, Dalsgaard A, van den Brink P J. 2013. Use of veterinary medicines, feed additives and probiotics in four major internationally traded aquaculture species farmed in Asia., 412–413: 231–243.
Sandegren L. 2014. Selection of antibiotic resistance at very low antibiotic concentrations., 119(2): 103–107.
Song C, Zhang C, Fan L M, Qiu L P, Wu W, Meng S L, Hu G D, Kamira B, Chen J Z. 2016. Occurrence of antibiotics and their impacts to primary productivity in fishponds around Tai Lake, China., 161: 127–135.
Sun M, Chang Z Q, van den Brink P J, Li J, Zhao F Z, Rico A. 2016. Environmental and human health risks of antimicrobials used inaquacultureproduction in China., 23: 15689–15702.
Tang J, Shi T Z, Wu X W, Cao H Q, Li X D, Hua R M, Tang F, Yue Y D. 2015. The occurrence and distribution of antibiotics in Lake Chaohu, China: Seasonal variation, potential source and risk assessment., 122: 154–161.
Tuc D Q, Elodie M G, Pierre L, Fabrice A, Marie-Jeanne T, Martine B, Joelle E, Marc C. 2017. Fate of antibiotics from hospital and domestic sources in a sewage network., 575: 758–766.
Van Doorslaer X, Dewulf J, Van Langenhove H, Demeestere K. 2014. Fluoroquinolone antibiotics: An emerging class of environmental micropollutants., 500–501: 250–269.
Wang Z, Du Y, Yang C, Liu X, Zhang J Q, Li E H, Zhang Q, Wang X L. 2017. Occurrence and ecological hazard assessment of selected antibiotics in the surface waters in and around Lake Honghu, China., 609: 1423–1432.
Xiong H F, Zou D L, Zhou D D, Dong S S, Wang J W, Rittmann B E. 2017. Enhancing degradation and mineralization of tetracycline using intimately coupled photocatalysis and biodegradation (ICPB)., 316: 7–14.
Yan C X, Yang Y, Zhou J L, Liu M, Nie M H, Shi H, Gu L J. 2013. Antibiotics in the surface water of the Yangtze Estuary: Occurrence, distribution and risk assessment., 175: 22–29.
Yao L L, Wang Y X, Tong L, Li Y G, Deng Y M, Guo W, Gan Y Q. 2015. Seasonal variation of antibiotics concentration in the aquatic environment: A case study at Jianghan Plain, central China., 527–528: 56–64.
Yi X Z, Lin C H, Ong E J L, Wang M, Zhou Z. 2019. Occurrence and distribution of trace levels of antibiotics in surface waters and soils driven by non-point source pollution and anthropogenic pressure., 216: 213–223.
Yin X X, Song F J, Gong Y H, Tu X C, Wang Y X, Cao S Y, Liu J N, Lu Z X. 2013. A systematic review of antibioticutilization in China., 68(11): 2445–2452.
Zhang B, Xu L, Hu Q P, Zeng X Y, Yu Z Q. 2020. Occurrence, spatiotemporal distribution and potential ecological risks of antibiotics in Dongting Lake, China., 192, 804.
Zhang Q Q, Ying G G, Pan C G, Liu Y S, Zhao J L. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimediamodeling, and linkage to bacterial resistance., 49(11): 6772–6782.
Zhang R J, Zhang G, Zheng Q, Tang J H, Chen Y J, Xu W H, Zou Y D, Chen X X. 2012. Occurrence and risks of antibiotics in the Laizhou Bay, China: Impacts of river discharge., 80(2): 208–215.
Zhou L J, Ying G G, Liu S, Zhang R Q, Lai H J, Chen Z F, Pan C G. 2013. Excretion masses and environmental occurrence of antibiotics in typical swine and dairy cattle farms in China., 444(2): 183–195.
Zou S C, Xu W H, Zhang R J, Tang J H, Chen Y J, Zhang G. 2011. Occurrence and distribution of antibiotics in coastal water of the Bohai Bay, China: Impacts of river discharge and aquaculture activities., 159(10): 2913–2920.
Concentration levels and potential risk assessment of antibiotics in surface water in Zhanjiang aquaculture area, Guangdong Province
PENG Bo1, 2, 3, ZHANG Biao1, 2, 3, ZENG Xiangying1, LIANG Yi1, WU Yang1, YU Zhiqiang1*
(1. State Key Laboratory of Organic Geochemistry, Guangdong Provincial Key Laboratory of Environmental Protectionand Resources Utilization, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640,Guangdong, China; 2. CAS Center for Excellence in Deep Earth Science, Guangzhou 510640, Guangdong, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China)
This study investigates the occurrence and composition profiles of antibiotics in surface water from typical marine aquaculture farms in Zhanjiang, Guangdong Province, China. The research includes a rough assessment of potential ecological risks based on measured concentrations. Sixteen antibiotics were detected in surface water at total concentrations ranging from 6.75 ng/L to 592 ng/L, with detection frequencies varying from 14% to 79%. Enoxacin, oxytetracycline, thiamphenicol, and florfenicol were identified as the main antibiotics in the surface waters of the study region. Distinct antibiotic levels were found in different aquaculture farms due to specific feed and drug usage for shrimp, fish, and oysters. The oyster area using raft culture exhibited the highest concentrations (147–592 ng/L), with oxytetracycline and florfenicol as the primary components. Shrimp ponds, conversely, showed the lowest concentrations (6.75–77.2 ng/L), with enrofloxacin and enoxacin as the main components. Risk assessment indicated that ciprofloxacin may pose a moderate or high risk to algae, while enoxacin may pose a moderate or high risk to algae and invertebrates in the Zhanjiang aquaculture area.
aquaculture area; antibiotics; culture species and modes; spatial distribution; risk assessment
X142
A
0379-1726(2023)06-0663-10
10.19700/j.0379-1726.2023.06.001
2022-01-06;
2022-02-24
广东省“珠江人才”计划本土创新科研团队(2017BT01Z134)和广东省省级科技计划项目(2020B1212060053)联合资助。
彭勃(1985–), 男, 博士研究生, 环境科学专业。E-mail: 1211784405@qq.com
于志强(1970–), 男, 研究员, 主要从事环境污染与健康、污染物环境地球化学行为研究。E-mail: zhiqiang@gig.ac.cn

