三种不同指数模型对乳腺良恶性病变鉴别诊断效能的比较:一项基于多b值MUSEDWI的研究
袁晓凡 李海歌 朱建国 郭浩东 张紫燕 蔡康杰
南京医科大学第二附属医院医学影像科(江苏 南京 210011)
乳腺癌在全球发病率逐年上升,已成为女性因癌症死亡的主要原因[1]。早发现、早诊断有助于帮助患者尽早选择合适的治疗方案,改善预后[2]。磁共振成像(magnetic resonance imaging,MRI)具有良好的组织分辨率,无辐射,是诊断乳腺癌的重要影像学方法[2]。常规MRI通过扩散加权成像(diffusion-weighted imaging,DWI)反映病灶扩散受限情况[3];借助动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI),获取病灶的血流动力学信息[4],但对比剂会增加肾衰及脑部钆沉积的风险[5]。近年来,随着MRI技术的发展,引入了多b值DWI序列,无需对比剂,通过实现三种模型,可同时评估病灶的灌注水平、扩散情况和异质性[6-8]。使患者从三个方面获益:提高检查时效性、降低检查成本、避免对比剂的风险。
多b值DWI的三种模型包括:单指数模型,通过表观扩散系数(apparent diffusion coefficient,ADC)评估病灶的扩散水平,但单指数模型没有考虑微循环灌注的影响,不能准确地反映病灶的组织特征[6];双指数模型分别评估病灶组织和微循环血管的质子扩散情况[7],并将其量化,得到:慢速表观扩散系数(slow apparent diffusion coefficient,ADCslow)、快速表观扩散系数(fast apparent diffusion coefficient,ADCfast)和快速扩散成分所占比例(fraction of fast apparent diffusion coefficient,ADCfractionoffast);拉伸指数模型,基于质子在微环境中呈连续分布的假设,通过分布扩散系数(distributed diffusion coefficient,DDC)和扩散异质性值(Alpha,α),评估病灶的异质性[8]。
既往研究对基于多b值DWI序列得到的三种模型进行比较,发现双指数模型对肺良恶性结节的鉴别能力优于单指数模型[9];拉伸指数模型对肝癌和肝血管瘤的鉴别能力[10]、对胶质瘤的分级评估[11]优于双指数模型及单指数模型。在乳腺癌方面,也有研究发现双指数模型对乳腺癌的诊断效能优于单指数模型[12],但拉伸指数模型在乳腺良恶性病变鉴别中的应用较少。
复合灵敏度编码扩散加权成像(multiplexed sensitivity-encoding diffusionweighted imaging,MUSE-DWI)是基于平面回波成像(echo planar imaging,EPI)序列的新成像技术,通过在相位方向多次激发采集,可以提高扩散图像质量和分辨率[13]。
因此,本研究旨在分析基于多b值MUSE-DWI的单指数、双指数和拉伸指数模型的定量参数在乳腺良恶性病变的差异;并比较三种模型对乳腺良恶性病变鉴别的诊断效能。
1 资料与方法
1.1 研究资料本研究采用回顾性分析的方法,收集2021年11月至2022年11月在我院就诊并接受乳腺手术的62例女性患者。
纳入标准:检查前未进行活检、化疗或其他临床干预;有完整的手术病理资料;均接受统一的多b值MUSE-DWI检查。排除标准:运动伪影较重,图像质量较差;病变直径小于1cm。
1.2 图像采集MRI检查采用3.0 T磁共振扫描仪(GE Premier),16通道乳腺专用相控线圈。扫描序列包括:T1WI、T2WI、多b值MUSE-DWI、DCE-MRI。
扫描参数如下:T1WI序列:TR=404ms,TE=6.9ms,层厚=5.0mm,间距=1.0mm,FOV=360mm×360mm,矩阵=412×320,NEX=1;T2WI序列:TR=4858ms,TE=85ms,层厚=5.0mm,间距=1.0 mm,FOV=360mm×360mm,矩阵=352×288,NEX=1;
多b值MUSE-DWI序列:TR=4239ms,TE=63.3ms,层厚=5.0mm,间距=1.0mm,FOV=360mm×360mm,矩阵=130×180,b值=0,70,100,150,200,400,800,1200,1800s/mm2,相应的NEX分别为1,1,1,1,2,2,4,10,14,分别在频率编码、相位编码、层面(x、y、z)三个方向施加扩散梯度;DCE-MRI序列:TR=4.2ms,TE=2.1ms,层厚=1.0mm,FOV=320mm×320mm,矩阵=320×320,NEX=1,共4期,单期扫描时间为75s。
1.3 图像后处理和分析将所有图像传输到后处理工作站(ADW4.6),分别由两名具有5年、8年乳腺影像诊断经验的医师采用双盲法单独评估图像。结合T1WI、T2WI及DCE-MRI序列图像确定病灶位置,通过后处理工作站的后处理软件(Functool MADC),沿病灶实体边缘、避开坏死及囊变区绘制感兴趣区(region of interest,ROI)。记录自动生成的多b值MUSE-DWI的三种模型参数:1.单指数模型参数ADC,基于公式S(b)/S(0)= exp(-b × ADC)[14]获得;2.双指数模型参数ADCslow、ADCfast、ADCfractionoffast,基于公式S(b)/S(0)= [(1- ADCfractionoffast)× exp(-b×ADCslow)] +[ADCfractionoffast×exp(-b×ADCfast)][15]获得;3.拉伸模型参数DDC、α,基于公式 S(b)/S(0)= exp[-(b × DDC)]α[16]获得;其中S(b)为特定b值下的信号强度,S(0)为无扩散梯度时的信号强度。
1.4 统计分析采用统计软件SPSS 26.0、Medcalc 20.0对数据进行统计分析,P<0.05认为具有统计学差异。
组内一致性检验:计算每个参数的平均值,采用组内相关系数(Intraclass Correlation Coefficient,ICC)评价两名医师测量参数结果的一致性(ICC<0.4为一致性差,0.4≤ICC<0.75为一致性一般,ICC≥0.75为一致性良好)。以两名医师测量的算术平均值作为最终数据,纳入统计分析。良恶性组间比较:分别对单指数模型、双指数模型及拉伸指数模型采用Kolmogorov-Smirnov检验评估病变区域各项参数,符合正态分布且组间数据方差齐同(Levene检验)使用ANOVA方差分析;否,则使用Kruskal-Wallis H检验。对具有组间差异的参数,进一步采用二元Logistic回归分析,分别构建双指数模型参数的联合模型、拉伸指数模型参数的联合模型。通过DeLong检验比较单指数模型、双指数模型参数联合模型、拉伸指数模型参数联合模型的受试者工作特征(receiver operator characteristic,ROC)曲线下面积(area under curve,AUC),评估三种模型诊断效能的差异。
2 结 果
最终共纳入62例患者,共64个病灶。其中良性病灶28个、恶性病灶36个(表1)。两名医师基于多b值MUSE-DWI获得的定量参数一致性良好(ICC=0.796~0.972)(表2)。组间比较中,下列参数在恶性组低于良性组,包括:ADC值(良性vs恶性:1.20×10-3s/mm2vs 0.94×10-3s/mm2,P=0.016)、ADCslow值(良性vs恶性:7.83×10-3s/mm2vs 4.45×10-3s/mm2,P=0.011)、ADCfast值(良性vs恶性:4.05×10-3s/mm2vs 0.665×10-3s/mm2,P<0.001)、ADCfractionoffast值(良性vs恶性:55.2% vs 39.5%,P=0.016)、DDC值(良性vs恶性:1.34×10-3s/mm2vs 0.905×10-3s/mm2,P<0.001)、α值(良性vs恶性:0.579 vs 0.422,P<0.001)(表3)。双指数模型参数联合模型: Y1=67.5×ADCslow+77.8×A DCfast+4.48×ADCfractionoffast;拉伸指数模型参数联合模型:Y2=63.48×DDC+5.53×α。(表4)
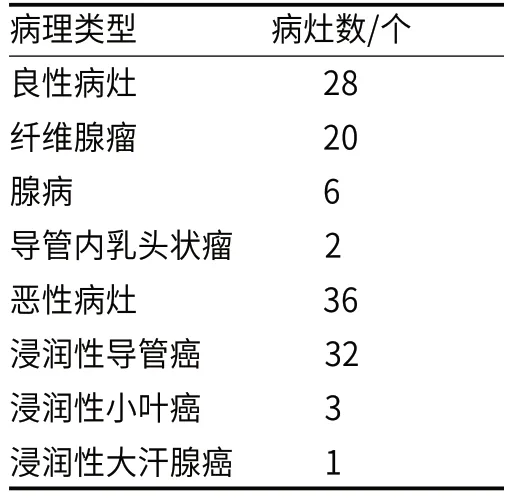
表1 乳腺良恶性病灶的病理类型
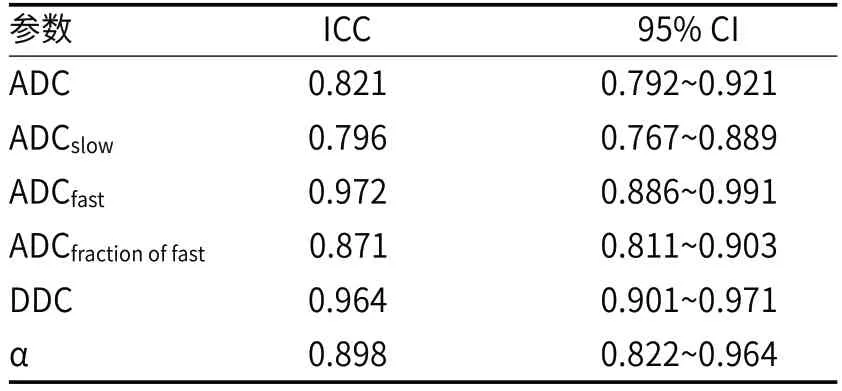
表2 两名医师测量多b值MUSE-DWI参数的一致性比较

表3 良恶性组多b值MUSE-DWI参数的比较
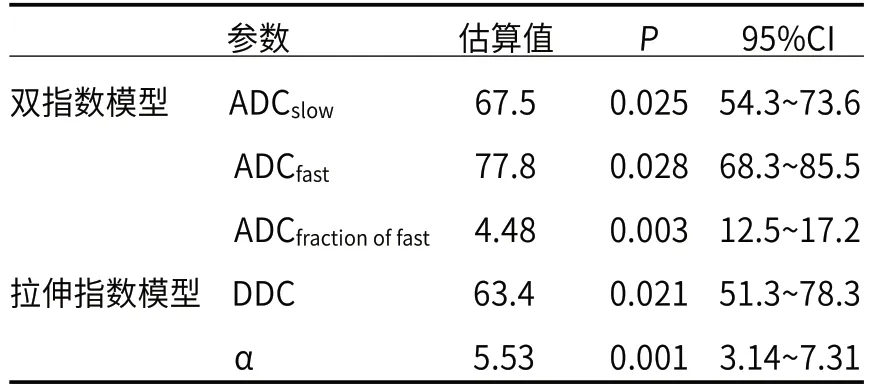
表4 二元Logistic回归结果
单指数模型、双指数模型参数联合模型、拉伸指数模型参数联合模型的AUC分别为0.701、0.859、0.828(图3)。DeLong检验结果显示双指数模型参数联合模型与单指数模型有统计学差异(P=0.023),拉伸指数模型参数联合模型的诊断效能与双指数模型参数联合模型(P=0.52)、单指数模型(P=0.08)无统计学差异。拉伸指数模型参数联合模型鉴别乳腺良恶性病变的敏感性(96.4%)高于单指数模型(85.7%)和双指数模型参数联合模型(89.3%),双指数模型参数联合模型鉴别乳腺良恶性病变的特异性(69.4%)高于单指数模型(58.3%)和拉伸指数模型参数联合模型(52.8%)(表5)。

图1A-图1F 女,51岁,乳腺癌。避开坏死及囊变区勾画ROI;图1A ADC伪彩图,病灶呈偏暖色调,ADC值=0.611×10-3s/mm2;图1B ADCslow伪彩图,病灶主体呈偏冷色调,局部呈偏暖色调,ADCslow值=0.480×10-3s/mm2;图1C ADCfast伪彩图,病灶呈偏冷色调,ADCfast值=1.020×10-3s/mm2;图1D ADCfraction of fast伪彩图,病灶呈暖色调,ADCfraction of fast值=0.222;图1E DDC伪彩图,病灶呈偏暖色调,DDC值=0.225×10-3s/mm2;图1F α伪彩图,病灶呈偏冷色调,α值=0.634。
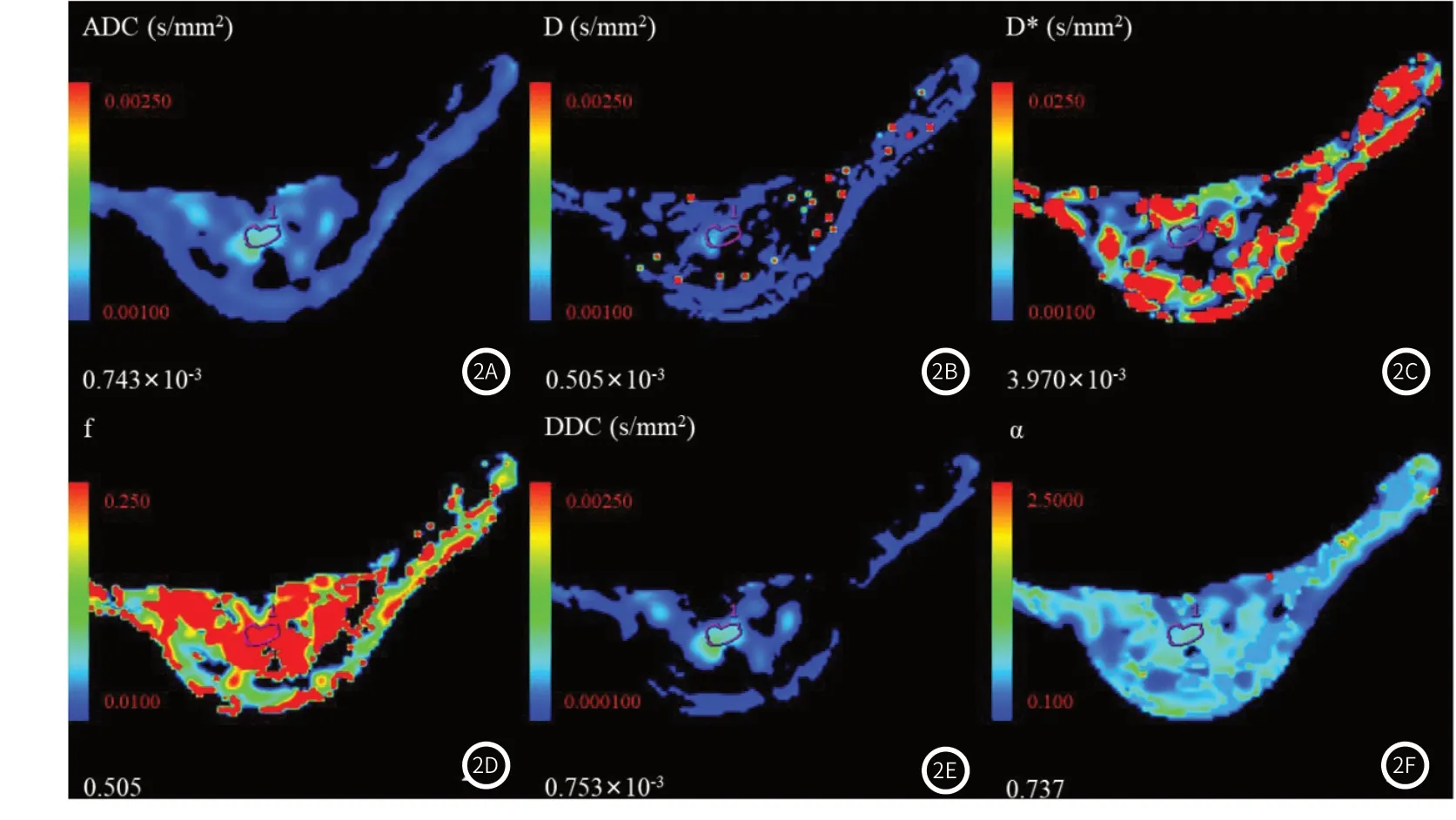
图2A-图2H 女,49岁,乳腺腺病。避开坏死及囊变区勾画ROI;图2A ADC伪彩图,病灶呈偏暖色调,ADC值=0.743×10-3s/mm2;图2B ADCslow伪彩图,病灶呈偏暖色调,ADCslow值=0.505×10-3s/mm2;图2C ADCfast伪彩图,病灶呈偏冷色调,ADCfast值=3.970×10-3s/mm2;图2D ADCfraction of fast伪彩图,病灶呈暖色调,ADCfraction of fast值=0.505;图2E DDC伪彩图,病灶呈偏暖色调,DDC值=0.753×10-3s/mm2;图2F α伪彩图,病灶呈偏暖色调,α值=0.737。

图3 单指数模型、双指数模型参数联合模型、拉伸指数模型参数联合模型预测乳腺癌的ROC曲线;ROC曲线显示,单指数模型、双指数模型参数联合模型、拉伸指数模型参数联合模型鉴别乳腺良恶性病变的AUC分别为0.701、0.859、0.828;经Delong检验比较,双指数模型参数联合模型与单指数模型之间有统计学差异(P=0.023);拉伸指数模型参数联合模型与双指数模型参数联合模型(P=0.52)及单指数模型(P=0.08)之间无统计学差异。(注:ROC=receiver operating characteristic curve=受试者工作特性曲线;AUC=area under the curve=受试者工作特性曲线下面积)

表5 三种模型对乳腺癌诊断效能的比较
3 讨 论
本研究以病理结果为“金标准”,综合评估了单指数、双指数、拉伸指数模型的参数在乳腺良恶性病变中的差异。发现乳腺癌的ADC、ADCslow、ADCfast、ADCfractionoffast、DDC、α值低于良性病灶;基于多b值MUSE-DWI的三种模型对鉴别乳腺良恶性病变有诊断价值;双指数模型参数联合模型的诊断效能优于单指数模型。
ADC与病灶的细胞密度相关;本研究中,乳腺癌的ADC值明显低于良性病变,与段斌等[17]结果一致。这可能是由于乳腺癌组织内癌细胞异常增殖,导致局部细胞密度增大,使得细胞外间隙变小,对质子扩散的限制更大[17]。
ADCslow和ADCfast分别代表了质子在组织中的真实扩散和微循环灌注形成的假性扩散,ADCfractionoffast代表灌注分数[18]。本研究发现乳腺癌的ADCslow值明显低于良性病变,这与既往研究[16]结果一致。根据Le Bihan[7,18]的研究,通过双指数模型计算的ADCslow避免了微循环的影响,与ADC相比,可以更准确地量化恶性病变的细胞增殖情况。ADCfast值与病灶的血流速度以及病灶中的毛细血管长度有关,ADCfractionoffast反映了组织灌注中快速扩散成分的体积分数[18],本研究中,乳腺癌中ADCfast值和ADCfractionoffast值低于良性病灶,与Tamura的结果一致[19]。但另外两项研究[12,20]发现ADCfast值和ADCfractionoffast值在乳腺癌中较高,在良性病灶中较低。结果出现差异的原因一方面可能是尽管乳腺癌血流增加,但新生血管扭曲变性,分支紊乱,最终造成组织微循环灌注的降低,进而降低快速扩散成分;另一方面可能是由于所选b值不同,本研究中使用最大b值=1800s/mm2,高于既往研究[12,20]中使用的最大b值=1000s/mm2。
DDC反映了质子的平均扩散速率,也与组织的细胞水平有关[8],是具有多指数衰减特性的ADC值的加权,客观反映质子的扩散情况[21]。乳腺癌中DDC值低于良性病变,可能是由于较大的细胞密度限制了组织中质子的运动,导致扩散速率降低[22]。α与组织的异质性程度相关[9],范围为0~1,当α=1时,DDC等于ADC,表明病灶内扩散均匀,呈单指数信号衰减,α越趋近于0,表明组织内扩散异质性越高,代表复杂的多指数信号衰减。本研究中,乳腺癌的α值低于良性病灶,与既往研究一致[22],可能由于乳腺癌分化程度低,其内细胞异型性大,组织异质性增加。
既往研究表明,基于单指数模型得到的ADC未考虑微循环血管灌注的影响,并不能真实的反映组织中的质子扩散水平,而双指数模型兼顾组织内、微循环两个独立的扩散区域,反映了肿瘤的细胞密度和微循环情况。本研究中,双指数模型参数联合模型诊断乳腺癌的敏感性和特异性都高于单指数模型。拉伸指数模型在乳腺方面的研究目前较少,根据Bennett[8]的研究,拉伸指数模型参数考虑了质子扩散的多区间性,比双指数模型得出的参数更客观。但在本研究中,拉伸指数模型参数联合模型与单指数模型及双指数模型参数联合模型无统计学差异,这可能与ROI的选取有一定的关系。既往研究[23]认为,拉伸指数模型反映了恶性病灶的异质性,应尽可能包括整个肿瘤病灶,包括囊变、坏死、出血、钙化等区域,但本研究中在勾画ROI时避开了这些区域。
本研究与既往研究不同之处在于:既往研究主要评估单个模型对乳腺癌的诊断效能[19],本研究分别对单指数、双指数、拉伸指数模型的参数进行定量分析,且比较了三种模型鉴别乳腺良恶性病灶的能力。
本研究尚存一些不足:采用了单中心的回顾性研究方法,病例数较少,在后续研究中拟进一步扩大样本量并进行多中心验证;未纳入浸润性非特殊类型癌的浸润程度、分子亚型等亚分型,未来将探讨三种模型参数与浸润性非特殊类型癌浸润程度及分子亚型的相关性。
4 结 论
本研究发现,通过单指数、双指数和拉伸指数模型得到的ADC、ADCslow、ADCfast、ADCfractionoffast、DDC、α在乳腺癌病灶中的值小于乳腺良性病变;单指数模型、双指数模型与拉伸指数模型对鉴别乳腺良恶性病变有诊断价值;双指数模型参数联合模型的诊断效能优于单指数模型。

