基于多参数磁共振放射组学预测临床显著性前列腺癌
沈茜樱 顾红梅
南通大学附属医院放射科 (江苏 南通 226006)
前列腺癌是全球男性发病率第二高的癌症,仅次于肺癌[1]。在中国,前列腺癌的发病率呈逐年上升的趋势,是近十年来男性患病率上升最快的疾病。由于患病初期没有特异的临床表现,部分患者在初次诊断时已处于中晚期,导致预后不佳[2]。所以,早期诊断和治疗是提高诊断率和预后的关键。
目前,前列腺疾病的诊断方法依赖于血清检验学检查、影像学检查。前列腺特异性抗原(prostate specific antigen,PSA)是一种由前列腺上皮细胞分泌的蛋白酶[3],是用于前列腺癌筛查的重要指标,与前列腺癌的诊断、病理分级及预后密切相关[4-6],但其水平受前列腺炎、尿路感染及导尿管留置等因素影响[7],导致其诊断前列腺癌的特异度较低。病理学结果是诊断前列腺疾病的 “金标准”,前列腺癌最广泛应用的组织病理学分级方法是Gleason评分系统(gleason score,GS)。根据以往的研究和指南,CsPCa的定义为Gleason评分为≥3+4。2017年,美国泌尿外科协会(American Urological Association,AUA)、美国放射治疗学和肿瘤学协会(American Society for Therapeutic Radiology and Oncology,ASTRO)联合发布的指南建议对穿刺结果为Gleason评分≥3+4的患者,应采取手术根治、药物和放射治疗等措施[8]。因此,对于患者来说,避免不必要的活检而又能早期发现有临床意义的前列腺癌是临床研究的重点。多参数磁共振成像(multi-parameters magnetic resonance images,mp-MRI)由于其优越的软组织分辨率,在前列腺疾病的诊断和定位方面具有很大的优势,可以对肿瘤进行无创和全面的评估[9-10],几乎所有的国际指南都建议在最初的活检前使用mp-MRI[11-12]。常用的扫描序列包括T1加权(T1-Weighted Image,T1-WI)、T2加权(T2-Weighted Image,T2-WI)、弥散加权成像(Diffusion Weighted Imaging,DWI)和动态增强成像(dynamic contrast enhanced,DCE)。T2WI对前列腺腺体各区分辨良好,从而较清晰地显示各区的病灶,DWI通过探测水分子的热运动反映组织的微观结构,可以用于良恶性肿瘤的鉴别。DCE通过正常组织和肿瘤组织摄取造影剂的差异形成的图像对比,能提供一些功能信息如组织的灌注、血管的通透性等。既往的研究表明mp-MRI对于鉴别前列腺良性疾病有很高的价值[13-15],无法从微观角度探索肿瘤的更有价值的信息。近年来,随着人工智能的发展和精准医疗的提出,放射组学受到了广泛的关注。放射组学通过勾画感兴趣区、高通量提取影像学特征来反映肿瘤的生物学行为,对疾病的诊断提供了客观的证据[16]。放射组学已被研究证明在多种疾病的诊断、疗效与预后评估方面为临床决策提供有力证据,如肺癌[17]、食管癌[18]、卵巢癌[19]等。通过对图像表征的深入分析,放射组学揭露了肿瘤的内部特征,为研究前列腺癌的诊断与治疗提供了更多指导意见。
本研究是探讨基于mp-MRI的放射组学模型是否能在术前预测CsPCa,为临床治疗提供指导性意见。
1 资料与方法
1.1 研究对象回顾性研究了2020年6月至2022年6月在南通大学附属医院进行前列腺mp-MRI检查并经过前列腺切除术的患者。
纳入标准:完整的m p-M R I 图像,包括横断位T2-WI,DWI,DCE-MRI;完整的临床和病理学资料;排除标准:患者同时罹患其他恶性肿瘤;MRI图像质量欠佳;MRI检查前进行过相关治疗,如放化疗。
1.2 临床资料完整收集所有入组患者术前的年龄、血清tPSA、fPSA、f/tPSA的水平,并根据(前列腺的前后径×左右径×上下径)*π/6计算出前列腺的体积(prostrate volume,PV);血清tPSA/PV计算出前列腺特异性抗原密度(prostate specific antigen density,PSAD)。采用独立样本t检验或卡方检验评估入组患者所有临床参数在训练组和验证组中的差异是否具有统计学意义。
1.3 病理资料所有入组患者将根据病理结果分为两组:CsPCa组(GS≥3+4)和非CsPCa组 (GS≤3+3和良性病变)。
1.4 MRI检查和图像获取MRI图像(包括轴向T2WI、DWI和DCEMRI序列)都是最接近手术日期且患者没有接受任何治疗。MRI检查由一台3.0T MRI扫描仪(Discovery MR750,GE Healthcare)利用8通道的腹部表面线圈完成,DWI的b值为0,1000s/mm²。患者取仰卧位,扫描范围为髂前上棘至耻骨联合下缘,扫描参数列于表1。

表1 mp-MRI检查各序列的扫描参数
1.5 放射组学处理流程
1.5.1 病灶分割与特征提取 一位有5年腹部放射诊断经验的放射科医师Reader1在ITK-SNAP软件对三个序列分别逐层勾画ROI,并生成VOI,他将在至少一周后重复勾画ROI。然后,另一位有20年诊断经验的放射科医师Reader2独立对序列进行勾画ROI。勾画ROI时,应仔细观察肿瘤的边缘及形状,最终得出VOI。对图像进行高斯拉普拉斯算子(laplacian of gaussian,LoG)和小波(Wavelet)滤波器进行预处理,使用PyRadiomics包进行放射组学特征的提取,从每个序列中分别提取到1075个特征,每个病人共提取了3225个放射组学特征。提取的特征包括:(1)形态学特征:病灶的圆形度,三角形网格面积、球形度等;(2)一阶纹理特征:病灶的灰度均值、熵等;(3)基于体素空间分布强度的纹理特征:灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度游程长度矩阵(gray level run-length matrix,GLRLM)、灰度尺寸区域矩阵(gray level size zone matrix,GLSZM)等。
1.5.2 特征筛选与模型构建、评估 将提取的特征归一化,以消除不同灰度值范围的影响,并且剔除了Spearman相关系数小于0.9的冗余特征。最终用于后期建模的放射组学特征是通过以下步骤选择的:(1)通过计算组间相关系数评估Reader1和Reader2筛选特征的可重复性,组内相关系数比较Reader1的两次分割的可重复性,最终保留相关系数>0.9的特征。(2)使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)对特征进行降维,利用5折交叉验证筛选出偏倚最小的最佳λ值来构建放射组学模型。根据最佳λ值,保留了特征系数不为0的参数。(3)将上述最终保留的放射组学特征及其相应系数的乘积相加得到最终的放射组学评分(radiomics score,Radscore)分别构建了五种影像组学模型,包括三个分别基于轴位T2WI、DWI、DCE的单一模型以及两种多模态模型。多模态放射组学模型A是对T2、DWI和DCE序列的放射组学评分线性回归建立的,而多模态模型B是基于1075×3的放射组学特征降维后构建的。使用准确度、特异度、灵敏度、AUC值、ROC曲线、DCA曲线和校准曲线来评估五种放射组学模型的性能,并在验证组中进行验证。
1.6 统计分析使用SPSS软件(V.26.0)和R统计软件(V.3.6.3 https://www.R-project.org)对数据进行分析。R统计软件中的“pROC”、“rmda”、“rms”和“foreign”软件包分别用于绘制ROC曲线、DCA曲线、校准曲线。在SPSS软件中用t检验来比较符合正态分布的连续变量,这些变量用平均值±标准差来描述,对分类变量的比较采卡方检验,这些变量用频率和百分比来描述。P值<0.05认为差异具有统计学意义。
2 结 果
图1展示了我们的工作流程。
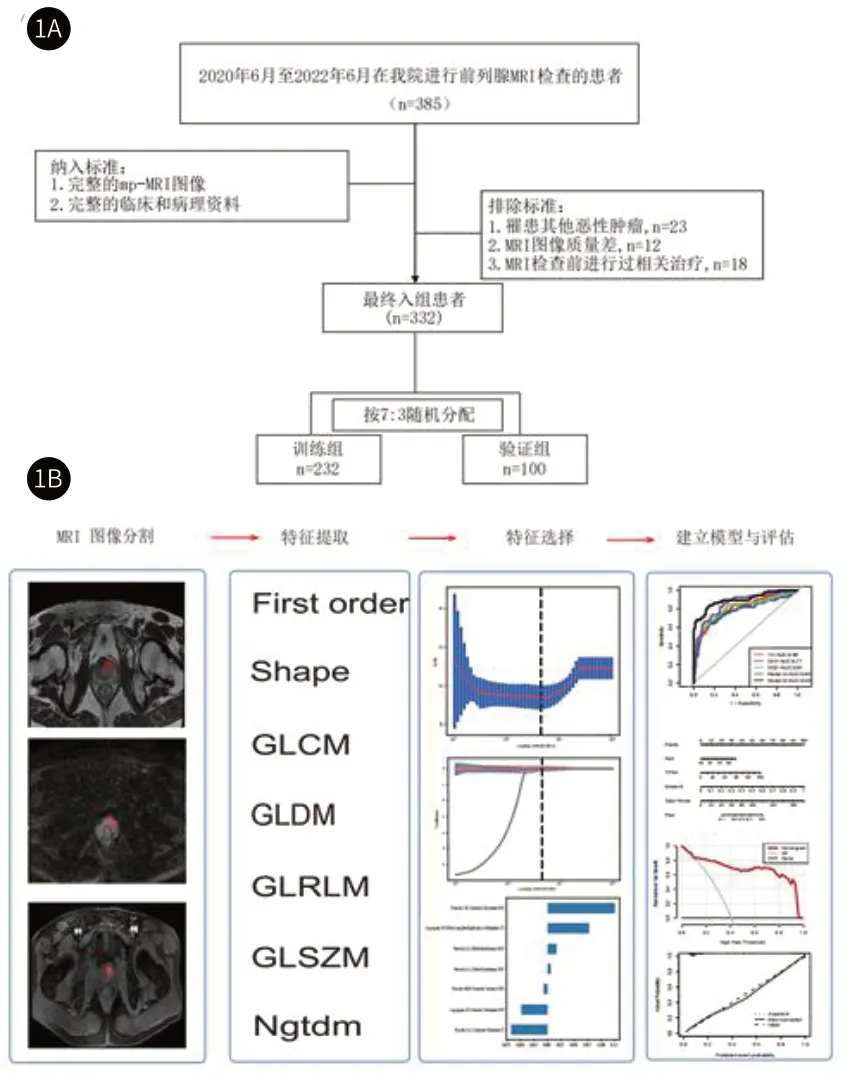
图1A-图1B 工作流程;图1A 收集入组患者的工作流程;图1B 放射组学工作流程图
2.1 患者一般资料将最终纳入研究的332名患者按7:3的比例随机分为训练组(232名患者)和验证组(100名患者),所有临床病理参数包括年龄,术前tPSA,fPSA, f/tPSA,PV和PSAD差异在两组间均无统计学意义(P>0.5,表2)。332名患者中,共有140例CsPCa和192例非-CsPCa(包括临床无意义前列腺癌和前列腺增生)。患者的平均年龄在训练组中为69.45±7.93岁,验证组中为69.85±7.53岁。
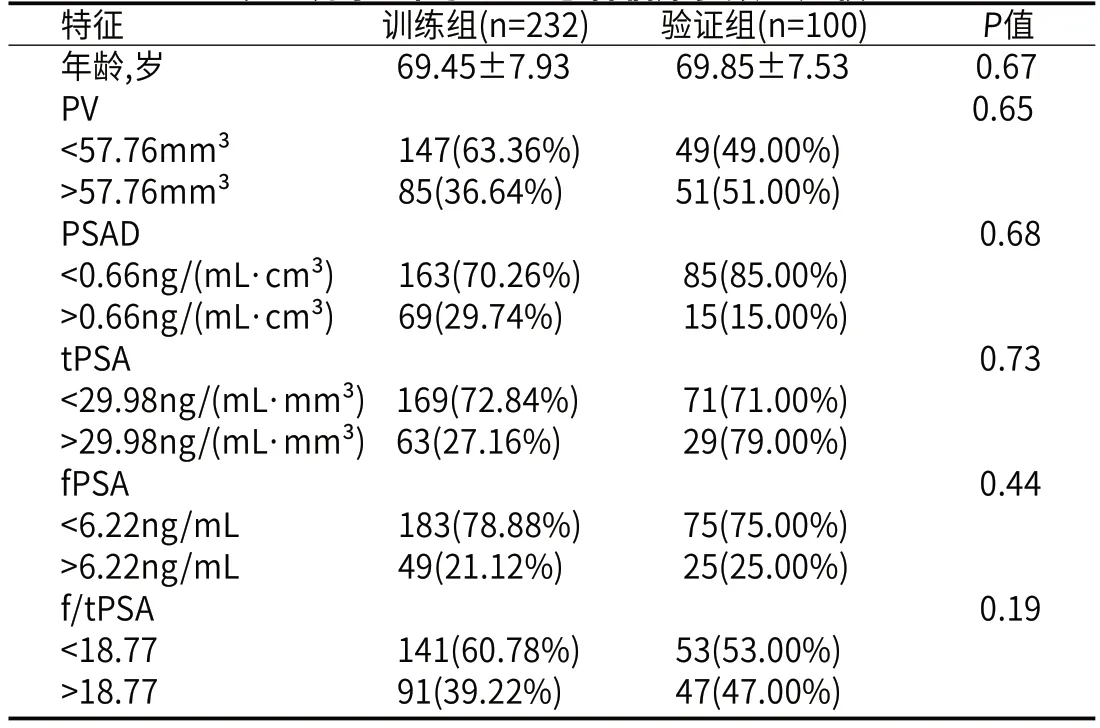
表2 训练组和验证组患者临床参数的比较
2.2 放射组学模型建立与评价从T2、DWI、DCE三个序列分别提取到1075个初始特征,通过特征降维后(图2)T2、DWI、DCE三个序列分别保留了9、14、4个关键的放射组学特征(图3),表3展示了每个模型的放射组学公式。对五个模型在训练组和验证组中的诊断效能评估后发现(表4-5),模型 B的AUC值最高,在训练组和验证组中分别达到0.90(0.86-0.94)和0.86(0.79-0.93)。模型A的准确度和敏感度在五个模型中达到最高,训练组中分别为0.86和0.86,验证组中分别为0.81和0.78。DWI模型的特异度在两组分别达到了0.91和0.80,这在五个模型中是最高的。ROC曲线(图4)显示,模型B的AUC值最大。DCA曲线和校准曲线(图5)也证明了模型B的临床实用性。
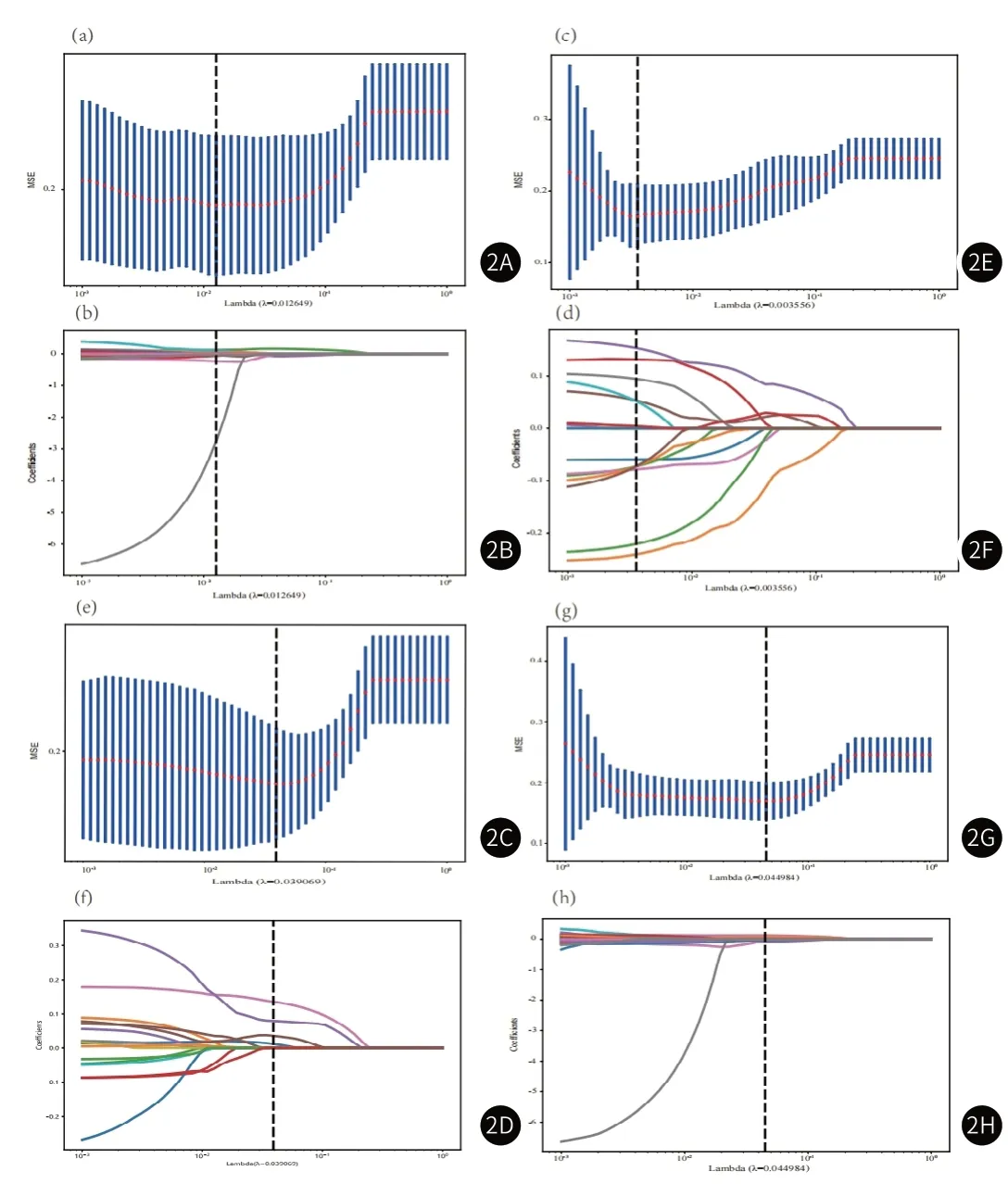
图2A-图2H 基于mp-MRI的放射组学特征筛选;(图2A,图2C,图2E,图2G):T2、DWI、DCE和模型B分别在LASSO模型中通过5折交叉验证和最小标准化,选择最佳参数λ;(图2B,图2D,图2F,图2H):LASSO回归在最佳参数λ处选择的系数非0的放射组学特征。
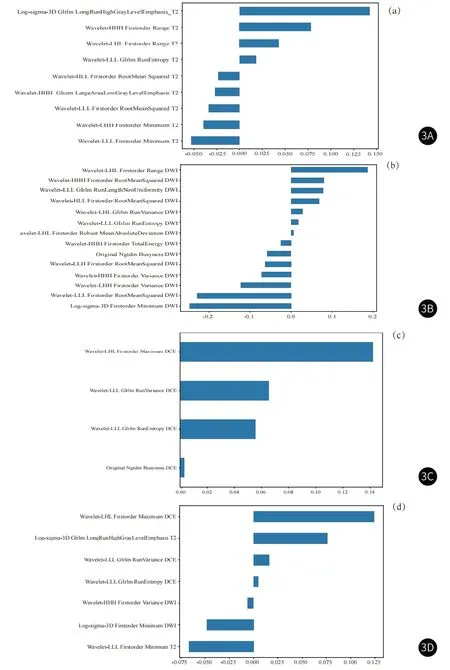
图3A-图3D 分别基于T2、DWI、DCE、模型B筛选出的影像组学特征;横轴表示影像组学特征的系数,纵轴表示所筛选出的特征。
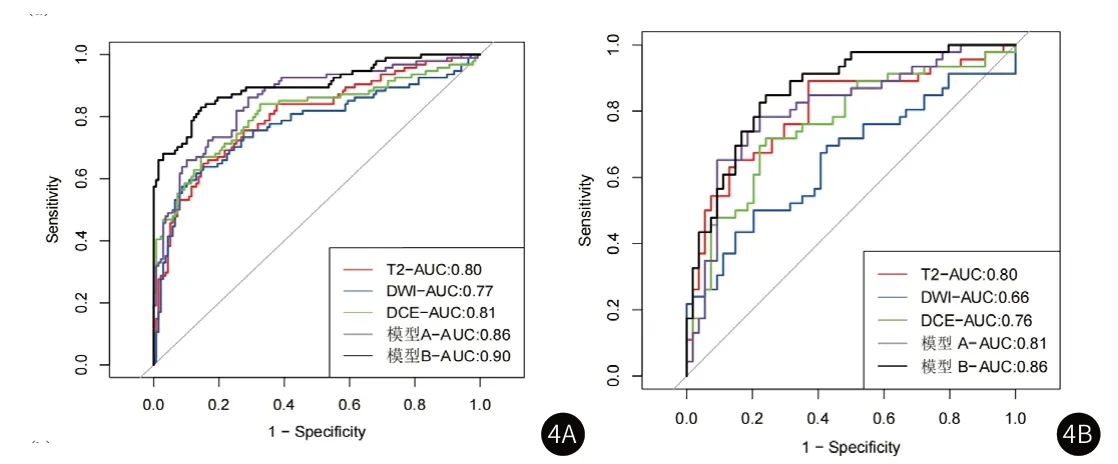
图4A-图4B 所有放射组学模型的ROC曲线(图4A 训练组;图4B 验证组)
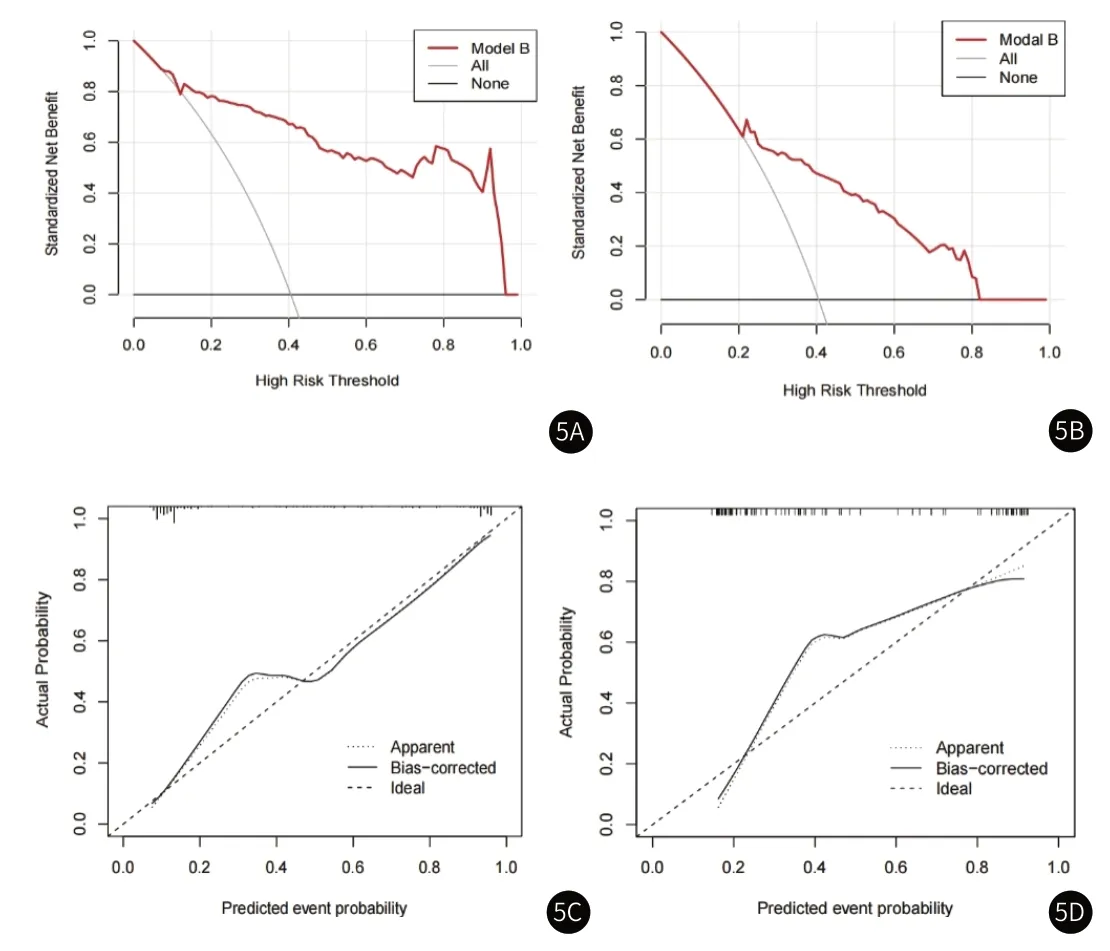
图5A-图5D 放射组学模型B的DCA曲线和校准曲线;图5A-图5B DCA曲线:y轴表示净收益;x轴表示阈概率;灰线和黑线表示所有患者和没有患者为CsPCa的假设。(图5A:训练组;图5B:验证组);(图5C-图5D)y轴表示实际CsPCa的概率;x轴表示预测的概率;45度虚线代表理想预测结果;虚线代表预测CsPCa的表现;黑色实线代表校准后预测CsPCa的表现。

表3 每个放射组学模型的Radscore公式

表4 训练组中各模型的诊断效能
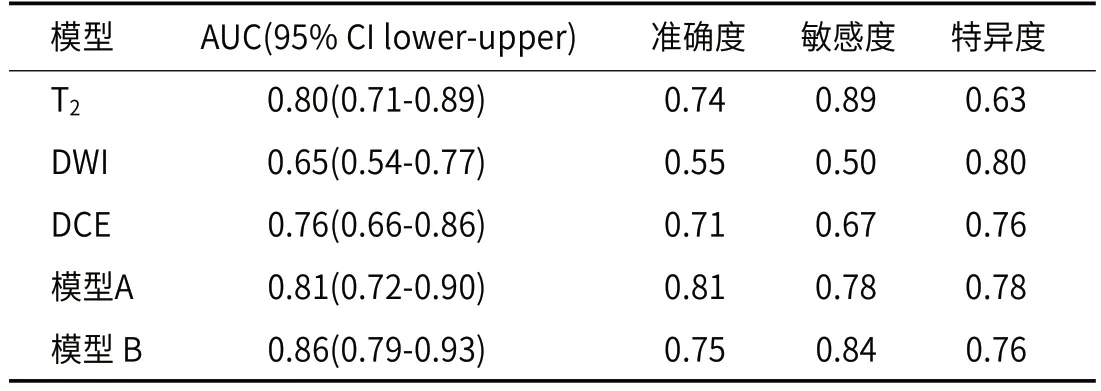
表5 验证组中各模型的诊断效能
3 讨 论
mp-MRI是诊断前列腺疾病首选的影像学检查技术在前列腺癌的诊断、病理分级预测及预后评估等方面具有明显的优势。放射组学作为一种新兴的无创定量技术,利用大量的特征提取与机器学习技术结合进行动态监测,在表征肿瘤异质性和改善各类型癌症的预后预测方面显示出一定潜力[16]。因此,通过放射组学高通量地提取反映前列腺癌的生物学行为的组学特征,并保留最有效的特征来构建预测模型。既往已有放射组学关于前列腺疾病诊断的研究,如Min等人[20]建立了一个基于mp-MRI的放射组学模型,用于鉴别CsPCa和CiPCa,在训练队列中的AUC值为0.872(95%CI:0.823-0.921),在验证队列中达到0.823(95%CI:0.669-0.976)。此外,Stefanie J等人基于T2WI序列的特征建立的放射学模型在CsPCa预测中表现良好(AUC=0.76 ,95% CI:0.60-0.92)[21]。除了单一的模型,本研究还提出了两个多模态的模型,多模态机器学习是一个动态的、多学科的领域,旨在建立能够处理和连接多种模式的模型[22]。在三种单一模型中,基于T2和DCE的模型诊断效能相当,训练组中的AUC值分别为0.80和0.81,而DWI模式的AUC值最低,可能是因为研究中DWI选择的b值均为0、1000s/mm²。DWI序列对诊断前列腺疾病具有重要意义[23],但最佳b值的选择还没有明确的结论, Kim等人[24]的回顾性研究,认为b值为0、1000s/mm²时DWI序列对前列腺癌的诊断效能最大,但Metens等人报道,前列腺癌诊断效能最大的b值为0、1500s/mm²[25],关于最佳b值的选择仍是未来研究的方向。
本研究采用了全肿瘤体积分割的方法,因为三维模型包括了整个病灶的信息,比二维模型更真实、全面地反映肿瘤的异质性。全肿瘤体积分割的优势在以前的卵巢癌[19]和食道癌[18]的放射组学研究中也得到证实。特征的提取和选择是放射组学研究的重要步骤。多模态模型B是基于术前mp-MRI中提取到的3325个模型降维后得到的7个特征建立的模型,包括2个来自T2序列的特征,2个来自DWI序列的特征和3个来自DCE序列的特征。与其他研究不同的是,除了提取了原始的一阶特征,还使用了高斯滤波和小波滤波对原始图像进行预处理和转换,这使得提取的特征具有更明显的分辨能力,并且最大程度消除了来自多个维度的噪声,从而提高了获得更多与肿瘤异质性相关信息的可能性[26-27]。在本研究中,T2模型和多模态模型B的最终特征都是经过高斯滤波和小波滤波处理后的,而DWI模型和DCE模型的特征均仅有一个来自原始图像,说明经过处理过的特征与CsPCa的相关性比原始图像更大。
目前本研究尚有局限性。首先,本研究是一个单中心的回顾性研究,这可能导致患者的选择偏差,影响模型的可信度,我们将在后续与其他单位进行合作,探讨模型的合理性。第二,本研究中DWI模型的诊断效能较低,可能是由于选择得的b值为0,1000s/mm2,在后续的研究中,将纳入更多患者选择不同的b值进行分层分析,对不同b值的诊断疗效进行研究。
综上,基于术前mp-MRI放射组学特征的组学模型在预测CsPCa中具有较高的诊断价值。

