铁死亡:抑郁症治疗的新靶点
杜书琴 钱立锋 熊烈 史汉强 石彦波

【摘要】 抑郁症是常见的情感类精神障碍疾病,是目前世界范围内第二大健康負担,但其发病机制仍有待明晰。临床抗抑郁症治疗以西药为主,但目前所用药物差强人意的效果、显著的治疗时滞和难以耐受的不良反应,反映出临床对有效和快速起效抗抑郁症药物的巨大需求。铁死亡是近年来发现的新型细胞死亡方式,其参与了包括抑郁症在内的多种神经系统疾病发病进程。目前已有部分研究将目光转向靶向抑制铁死亡的抗抑郁症治疗,并显现出了积极的疗效。本文以抑郁症与铁死亡机制为基础,结合临床与临床前研究,总结了铁死亡参与抑郁症发病机制及其治疗抑郁症的可能性。
【关键词】 抑郁症;铁死亡;铁沉积;线粒体;脂质过氧化作用;综述
【中图分类号】 R 749.41 R 329.2 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0228
Ferroptosis:a New Target for the Treatment of Depressive Disorder
DU Shuqin1,2,3,QIAN Lifeng4,5,XIONG Lie1,2,SHI Hanqiang1,2,SHI Yanbo1,2*
1.Central Laboratory of Molecular Medicine Research Center,Zhejiang Chinese Medical University Affiliated Jiaxing TCM Hospital,Jiaxing 314000,China
2.Jiaxing Key Laboratory of Diabetic Angiopathy Research,Jiaxing 314000,China
3.School of Pharmacy,Zhejiang University of Technology,Hangzhou 310002,China
4.Department of Rehabilitation,Zhejiang Chinese Medical University Affiliated Jiaxing TCM Hospital,Jiaxing 314000,China
5.Jiaxing Key Laboratory of Cerebrovascular Disease Rehabilitation Research of Integrated Chinese and Western Medicine,Jiaxing 314000,China
*Corresponding author:SHI Yanbo,Principle investigator;E-mail:shiyanbocas@163.com
【Abstract】 As a common affective mental disorder,depressive disorder has currently become the second health burden worldwide,however,its pathogenesis remains to be further elucidated. The clinical treatment of depressive disorder primarily relies on western medicine. However,there is great clinical need for effective and rapid-onset antidepressants for the unsatisfactory effect,obvious treatment time-lag,and intolerable adverse reactions of current drug treatment. Ferroptosis is a novel form of cell death discovered in recent years,which has been found to be involved in the pathogenesis of numerous neurological disorders,including depressive disorder. Currently,some studies have shifted the focus of antidepressant treatment towards targeted inhibition of ferroptosis,and achieved positive outcomes. The present paper provides a comprehensive review of the involvement of ferroptosis in depressive disorder pathogenesis and its potential therapeutic implications,drawing on clinical and preclinical evidence that elucidates the underlying mechanisms linking depressive disorder with ferroptotic processes.
【Key words】 Depressive disorder;Ferroptosis;Iron overload;Mitochondria;Lipid peroxidation;Review
抑郁症是一种严重影响心理、社会功能和生活质量的精神障碍疾病,其特点是持续性情绪低落、兴趣减退、认知障碍、睡眠障碍、食欲减退和自杀倾向[1]。有报道指出,将近1/4的女性和1/6的男性会经历抑郁症,并且高达65%的抑郁症患者会反复发作[2]。据世界卫生组织预测,到2030年抑郁症将成为全球最重要的致残原因[3]。抑郁症发病机制尚未明确,随着大量临床和临床前试验的展开,多种因素被发现可能参与了抑郁症的形成[4-15](表1)。
铁是生物体必需的微量金属元素,同时也是大脑中最丰富的过渡金属[16]。作為重要的辅助因子,大脑中的铁离子参与包括髓鞘形成、神经递质合成、突触发育和能量产生在内的多种重要生理过程[17],对神经系统的生长和传导起着至关重要的作用。而另一方面,高水平的铁可导致有毒活性氧(reactive oxygen species,ROS)的积累,从而干扰线粒体功能、破坏DNA合成、催化多巴胺(dopamine,DA)氧化反应产生有毒醌类化合物[18],导致细胞死亡,诱发神经系统疾病。铁死亡是STOCKWELL B课题组在2012年提出的一种新型细胞死亡模式,与传统程序性细胞死亡不同的是,发生铁死亡的细胞具有鲜明的形态特征、生化特征和遗传特征,主要包括线粒体形态变化、铁沉积和脂质ROS累积[19]。近年来大量的研究已证实铁死亡与阿尔茨海默病[20]、帕金森病[21]、亨廷顿病[22]等多种神经系统疾病有着密不可分的联系。在抑郁症患者/动物模型中,也发现铁含量或铁死亡相关基因出现显著改变[23],这意味着大脑内异常的铁代谢可能是抑郁症病理生理改变的潜在因素。基于此,本文讨论了抑郁症与铁死亡之间的内在联系,以期为抑郁症的防治提供有价值的信息。
1 抑郁症中的中枢神经系统(CNS)铁沉积
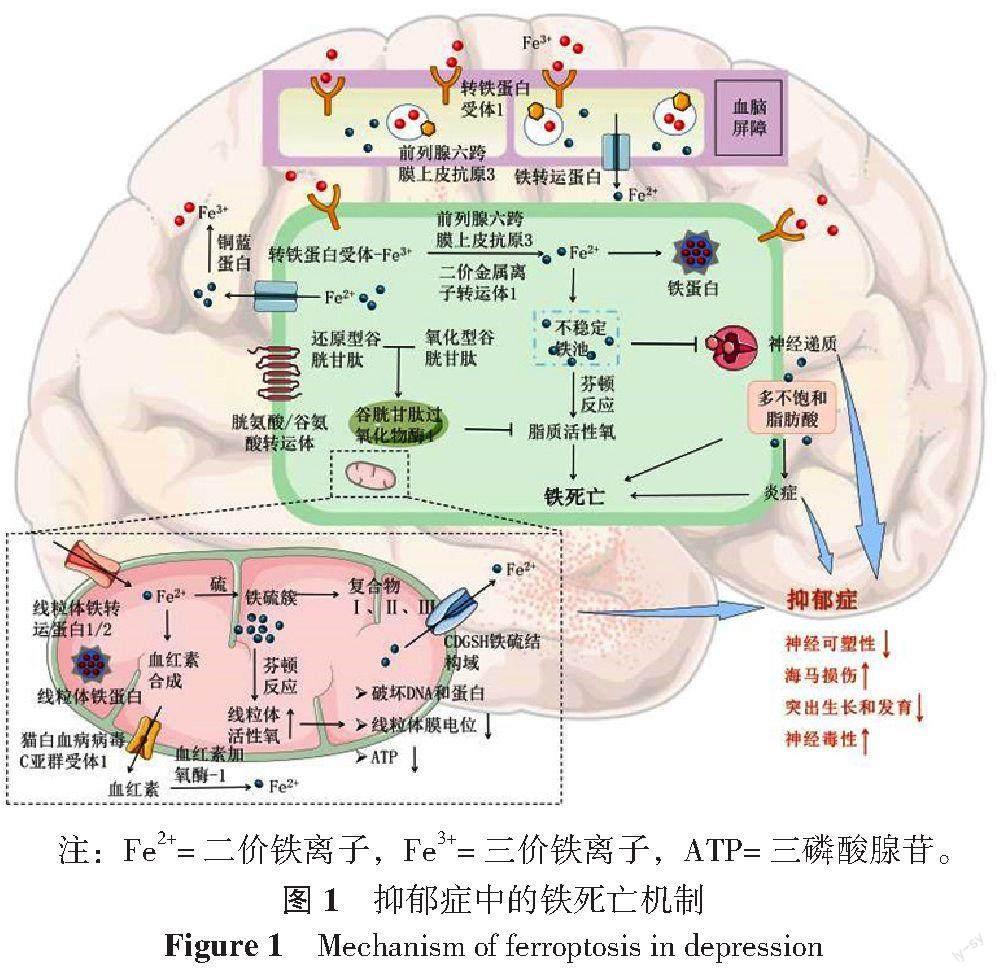
在CNS中被摄取的三价铁离子(Fe3+)会首先在脉络丛与脑脊液(cerebrospinal fluid,CSF)中分泌的转铁蛋白(transferrin,Tf)结合[24],再通过血-脑脊液屏障(blood brain barrier,BBB)中的内皮细胞高密度表达转铁蛋白受体1(transferrin receptor 1,TfR1)识别进入脑实质中,进而被神经细胞吸收利用[25]。进入细胞的Fe3+在金属酶的作用下转化为二价铁离子(Fe2+)并被释放到胞质中,参与多种生理过程,同时过量的Fe2+以稳定的Fe3+形式储存起来,或通过铁转运蛋白(ferroportin,FPN)输出细胞(图1)。在大脑中,高表达的Tf和TfR1意味着神经元铁摄取能力的增强和对铁死亡敏感性的增高[26]。
在1995年便有学者发现,患有精神疾病的患者,尤其是患有精神分裂症和重度抑郁症(major depressive disorder,MDD)患者血浆中TfR1的表达高于正常对照组[27],提示精神分裂症患者和MDD患者较正常人更容易摄入铁离子和出现铁沉积。在一项抑郁症患者脑成像研究中发现,患者壳核和丘脑核中可见铁沉积现象,且进一步研究发现这种脑铁沉积与抑郁症的严重程度有关[28],这一研究结果与YAO等[29]的类似,其认为脑铁沉积可能与抑郁症有关,甚至可能是抑郁症病理生理机制的生物标志物。CHANG等[30]使用二维电泳(two-dimensional electrophoresis,2-DE)结合质谱分析技术比较了正常小鼠和慢性不可预知压力应激(chronic unpredictable mild stress,CUMS)小鼠中Tf和TfR1的变化,结果显示与对照组相比,CUMS小鼠中Tf和TfR1的表达在肝脏、血液和多个大脑区域中均显著上调。另一项动物研究也证实了TfR1的表达在抑郁小鼠模型神经元中被上调,并且发现过量的铁可以加剧神经细胞的死亡[25]。MAAROUFI等[31]实验发现大鼠使用一定剂量(3 mg/kg)的铁剂后,大鼠的学习能力、运动技能、情绪行为均受到影响,作者认为实验大鼠出现的这些行为障碍,与大鼠海马体和基底神经节中显著的铁沉积有关。以上研究表明在抑郁患者/动物模型中存在铁沉积现象,过量的铁累积与抑郁样行为有关,针对抑郁症中的铁沉积可能成为抗抑郁的新方向。
2 抑郁症中的CNS铁死亡
铁是神经细胞存活不可或缺的一部分,被神经细胞吸收的铁离子,除了影响髓鞘形成及新陈代谢外,其还在单胺类神经递质合成中发挥作用,包括辅助酪氨酸羟化酶和色氨酸羟化酶的生成[32-33]。当神经细胞内出现铁沉积时,铁离子会通过影响酪氨酸羟化酶和色氨酸羟化酶的活性直接抑制DA、5-羟色胺(5-hydroxytryptamine,5-HT)的合成[34];另一方面,尽管机体具有防御细胞铁毒性的生理机制,但铁的转移电子能力允许其通过芬顿反应产生有害的羟基自由基,产生的有毒物质不但会导致DNA氧化和脂质损伤,还会加快DA的分解代谢[23]。并且在此过程中,游离铁在催化多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)产生过氧化物的同时,还会促进与花生四烯酸代谢相关炎症因子的释放[35],诱发免疫炎症反应,这些危险因素相互影响,会共同促进大脑运动和认知功能受损。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是体内重要的脂膜修复酶,其通过利用两个谷胱甘肽分子作为电子供体,将脂质过氧化氢(PL-OOH)还原成无毒的脂质醇(PL-OH)和水,进而减少自由基对细胞膜的损害(图1)。GPX4作为铁死亡的关键调节因子,其缺失会增加氧化应激诱导神经细胞死亡的易感性[36]。
在卒中后抑郁症患者[37]和多发性硬化症抑郁症患者[38]中也发现了铁沉积现象,抑郁症状较严重的患者血清铁蛋白(ferritin,FTH)水平较低,而血清FTH水平的升高对情绪有积极影响,与较低的抑郁症患病率呈正相关。在抑郁症与铁相关的啮齿动物研究中,CAO等[39]通过定量蛋白组学分析对比了CUMS小鼠与正常小鼠海马体的蛋白表达,在4 046个定量蛋白质中存在47个差异表达蛋白,富集分析显示,这些差异表达的蛋白表明CUMS小鼠海马神经元的坏死和铁死亡被显著激活,抑制抑郁症病程中的神经元坏死与铁死亡可能为抑郁症的治疗提供了潜在的靶点。值得注意的是,还有研究人员发现,适度补铁(12 mg/kg)可以显著增加CUMS大鼠脑源性神经营养因子(brain derived neurotrophic factor,BDNF)表达,缩短不动行为时间,而高剂量的铁会增加神经元的退化和丢失,但铁螯合剂去铁酮可以逆转这种影响[40];与此研究相反的是,UZUNGIL等[41]认为去铁酮能够缓解5-羟色胺转运体(serotonin transporter,5-HTT)敲除小鼠出现的抑郁样行为,但对大脑中的铁水平没有显著影响。这些研究均证实了针对抑郁症中铁死亡相关机制开展治疗可以有效缓解抑郁症,并且近期研究表明另一种铁离子螯合剂去铁胺(deferoxamine,DFO)可以显著减轻CUMS引起的损伤[42],这进一步印证了抑郁症中铁死亡相关机制在治疗抑郁症方面的重要性。
3 抑郁症与CNS线粒体功能障碍
线粒体是细胞内具有高度动态的细胞器,能够根据环境变化而改变自身功能和结构。铁离子在线粒体中同样起着重要作用,包括参与线粒体血红素生成、铁硫簇(iron-sulfur cluster,ISC)组装和氧化磷酸化(oxidative phosphorylation,OXPHOS)等过程[43]。线粒体铁沉积可以通过影响线粒体功能和结构成为抑郁症的重要致病因素。生理条件下,线粒体内的铁稳态受到线粒体铁蛋白(mitochondrial ferritin,FtMt)严格控制,这种由核编码的线粒体铁储存蛋白与胞内的FTH一样,可以将Fe2+氧化为氧化还原活性较低的Fe3+[44],防止游离铁沉积。当线粒体中发生铁沉积,铁离子也会通过芬顿反应促进线粒体ROS累积;另一方面,铁作为OXPHOS的主要调节剂,由于OXPHOS过程中的生理电子泄漏,导致线粒体成为细胞内ROS的主要生产者[43],多种因素促使线粒体ROS激增,破坏线粒体自身结构和产生ATP的能力(图1)。神经递质的合成与释放、神经元的分化和下游通路的激活与传导均需要线粒体提供足够的能量,丧失正常功能的线粒体不仅可能导致神经传导障碍,还可能损伤抑郁症患者的神经可塑性,并且线粒体在神经发生、神经干细胞增殖和分化为新神经元的过程中也起着关键作用[45-46]。除此之外,线粒体的部分成分(N-甲酰肽、心磷脂等)也可以促进炎症反应[47]。
一项评估双相情感障碍(bipolar disorder,BD)患者8种氧化应激标志物的荟萃分析报告了在BD患者中出现脂质过氧化、DNA/RNA损伤、线粒体电子传递链蛋白质水平降低和一氧化碳(carbon monoxide,CO)标志物增加现象[48]。IWAMOTO等[49]对BD患者和MDD患者尸检样本的DNA微阵列分析研究结果表明,与对照组相比,模型组中的多个线粒体相关基因被下调。CATALDO等[50]在BD患者大脑前额皮质中的神经元中观察到线粒体形态明显缩小、线粒体产生三磷酸腺苷(ATP)能力下降的现象。在另一项探讨患有线粒体细胞病受试者的精神病合并症患病率的研究中,有54%的患者表现出抑郁症状,17%的患者出现BD[51]。临床前研究亦证明了在抑郁症啮齿动物模型中存在线粒体障碍。袁清洁等[52]发现CUMS大鼠的前额叶细胞和肝细胞中线粒体明显少于正常组,且线粒体肿胀,线粒体内嵴紊乱或溶解消失,基质疏松,部分呈空泡变性,抗抑郁治疗后,前额叶细胞和肝细胞中的线粒体数目明显增多,线粒体形态变化也得到明显改善。REZIN等[53]在暴露于慢性轻度压力下大鼠的大脑皮层和小脑中观察到线粒体呼吸链被抑制。
4 通过抑制铁死亡发挥抗抑郁的药物
部分药物通过抑制铁死亡发挥抗抑郁作用也进一步证实了抑郁症与铁死亡之间的相关性。抗抑郁药物氟西汀治疗抑郁症的机制不限于抑制5-HT再摄取,还与减少铁沉积、调节铁死亡相关基因[3]、促进自噬体形成并增加受损线粒体的清除有关[54]。自由基清除剂依达拉奉可以通过增加小鼠海马中铁死亡蛋白沉默信息调节因子1(silent information regulator 1,SIRT1)、核因子 E2 相关因子 2(nuclear factor E2-related factor 2,Nrf2)、血红素加氧酶1(heme oxygenase-1,HO-1)和GPX4的表达,改善慢性社交失败压力抑郁小鼠出现的抑郁样和焦虑样行为[55];硫氢化钠(sodium hydrosulfide,NaHS)通过减少铁沉积和氧化应激,增加GPX4和SLC7A11的表达,显著减轻1型糖尿病(type 1 diabetes mellitus,T1DM)引起的抑郁样和焦虑样行为[56];网络药理学分析显示中药逍遥散中的133种成
分,可调节抑郁症中43种与铁死亡相关的基因,进一步的动物实验结果发现CUMS组小鼠海马组织可能存在铁死亡,中药逍遥散的抗抑郁作用可能与抑制铁死亡相关[3];氯胺酮[57]也有类似的作用。中药单体黄芩苷[58]和人参皂苷Rg1[59]对抑郁症的缓解作用均与改善线粒体功能障碍相关。辅酶Q10(coenzyme Q10,CoQ10)是线粒体电子传递过程中必不可少的辅助因子,可以通过增强呼吸链复合物的作用,促进线粒体生物功能并激发神经保护作用[60]。近年来,相关研究发现CoQ10可能参与了铁死亡调节,如FSP1-CoQ10途径,补充外源性CoQ10可以保护膜脂免于过氧化,增加细胞对铁死亡的抵抗力[61]。在神经系统疾病中,BD患者使用CoQ10后,其抑郁严重程度均呈下降趋势[62]。最近的研究显示,线粒体靶向抗氧化剂Mito-TEMPO可以缓解穿心莲内酯诱发的铁死亡[63],同时也有研究证明Mito-TEMPO可显著改善脂多糖(lipopolysaccharide,LPS)引起的线粒体超氧化物累积、线粒体膜电位增加和ATP生成减少,从而缓解小鼠抑郁状态[13]。综上所述,过度的铁沉积导致的神经递质合成减少、脂质过氧化物累积、线粒体障碍、促炎因子释放增多、DNA及蛋白质损伤与抗氧化系统被破坏,是最终致使神经可塑性下降、突触生长和发育迟缓、神经网络传导延迟和神经毒性结果从而诱发抑郁症的重要因素。总之,上述來自临床和临床前的研究为铁死亡在抑郁症病理生理学中所起的关键作用提供了有力的证据。
5 讨论与展望
抑郁症是一种常见的、高致死率、高致残率和高复发率的精神障碍疾病,是一个全球性的精神卫生挑战。尽管目前对抗抑郁治疗的药物研究取得了进展,但对于抑郁症患者而言,抗抑郁治疗的选择仍是有限且不足的[64]。传统抗抑郁药物除去不良反应多、疗程长等缺点外,还有1/3的抑郁症患者对抗抑郁药物无反应[1],且病情恢复可能需要多种不同的药物治疗,这说明抑郁症的作用机制可能涉及其他靶点,加之影响因素众多,导致了治疗方案的复杂性。在过去10年,治疗试验已经开发和测试了许多新的靶向干预措施。本文重点关注了铁稳态失衡及铁死亡与抑郁症的关联研究,评估了上述因素在抑郁症诊疗中的应用价值,希望以此抛砖引玉,进一步拓宽抑郁症相关研究领域,促进抑郁症研究继续向更广、更深的方向发展。
由于獨特的氧化还原特性,铁通常作为酶和结构蛋白的辅基参与多种酶促反应[65],在多个细胞生物过程中扮演重要角色。而作为一把双刃剑,不足或过量的铁元素均会对人体造成病理损伤。就抑郁症而言,一方面,铁离子不仅在髓磷脂的生产和维持、神经可塑性和突触发育中起重要作用,其还是芳香酸羟化酶[合成DA、去甲肾上腺素(noradrenaline,NE)、5-HT必需的关键酶]的必需辅助因子[24],这意味着缺乏铁离子会导致神经网络传导延迟和神经递质匮乏,从而诱发抑郁症,并且已有相关文献报道了铁缺乏在抑郁症中的促进作用[66];另一方面,过量的铁亦会通过影响神经系统正常传导、促进脂质过氧化物生成,以及破坏氧化还原系统的同时干扰线粒体功能,推动抑郁症的进程。在此,本文主要关注的是过量铁对抑郁症的影响。
铁死亡是近年来提出的新型细胞死亡方式,被定义为铁依赖性的脂质过氧化物累积。随着研究的广泛展开,铁死亡被发现参与了多种神经系统疾病的病理生理过程。在抑郁症患者/动物模型中,同样观察到铁沉积和铁死亡相关基因变化[27,30]。随着这些现象的发现,近几年针对抑郁中的铁代谢紊乱的治疗研究也应运而生,比如铁离子螯合剂去铁酮[41]和DFO[42],可改善铁死亡引发抑郁症模型出现的行为认知障碍;部分药物的抗抑郁功效也被发现与调节铁死亡相关,如自由基清除剂依达拉奉[55]、氯胺酮[57]、抗抑郁药氟西汀以及中药逍遥散[3]等,尽管目前对铁死亡和抗抑郁的相关研究还较少,且主要集中于动物实验,但展现出的良好结果为接下来靶向抑郁症中的铁死亡治疗提供了基础和信心。
本文汇总并讨论了铁死亡参与抑郁症发病机制的可能性,表明铁沉积可能参与了抑郁症的发展进程,铁代谢途径被认为是抗抑郁治疗的潜在靶点,针对抑郁症中的铁死亡治疗将显著提高抗抑郁治疗的效果,然而,实际应用也面临着诸多困难。首先,抑郁症属于精神障碍,带有极强的主观性,研究对象、研究时长或生活环境的不同和变化均会导致结果偏差,这些均增加了研究的不稳定性和复杂性。其次,抑郁症与大脑中交错复杂的神经网络异常相关,脑组织中的铁稳态也受到多种因子的精密调控,不同细胞对铁需求或表达的铁调控基因也有所不同。综上,目前,抑郁症与铁死亡之间的因果关系及相关机制尚未明确,但已有研究证明铁沉积引发的铁死亡在抑郁发生过程中起着重要作用。因此,进一步深入探究抑郁症与铁死亡相关的机制,将为寻找有效的抗抑郁治疗药物提供科学依据。最后,铁缺乏和铁沉积均会促进抑郁样行为发生,如何准确平衡体内铁含量,在不诱导疾病发生的同时又能满足机体生理需求,这需要未来更深入地了解抑郁症与铁死亡相关的机制以解决这些问题。
作者贡献:杜书琴负责文章的构思与设计、研究资料的收集与整理、论文撰写;钱立锋负责论文修订和质量控制;熊烈、史汉强负责图片的编辑、整理;石彦波负责论文修订、文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
参考文献
ZUO C C,CAO H,SONG Y,et al. Nrf2:an all-rounder in depression[J]. Redox Biol,2022,58:102522. DOI:10.1016/j.redox.2022.102522.
SLAVICH G M,IRWIN M R. From stress to inflammation and major depressive disorder:a social signal transduction theory of depression[J]. Psychol Bull,2014,140(3):774-815. DOI:10.1037/a0035302.
JIAO H Y,YANG H J,YAN Z Y,et al. Traditional Chinese formula Xiaoyaosan alleviates depressive-like behavior in CUMS mice by regulating PEBP1-GPX4-mediated ferroptosis in the Hippocampus[J]. Neuropsychiatr Dis Treat,2021,17:1001-1019. DOI:10.2147/NDT.S302443.
SHAO X J,ZHU G. Associations among monoamine neurotransmitter pathways,personality traits,and major depressive disorder[J]. Front Psychiatry,2020,11:381. DOI:10.3389/fpsyt.2020.00381.
JIANG Y,ZOU D,LI Y M,et al. Monoamine neurotransmitters control basic emotions and affect major depressive disorders[J]. Pharmaceuticals (Basel),2022,15(10):1203. DOI:10.3390/ph15101203.
VAV?KOV? M,DURACKOV? Z,TREBATICK? J. Markers of oxidative stress and neuroprogression in depression disorder[J]. Oxid Med Cell Longev,2015,2015:898393. DOI:10.1155/2015/898393.
M?NARD C,HODES G E,RUSSO S J. Pathogenesis of depression:insights from human and rodent studies[J]. Neuroscience,2016,321:138-162. DOI:10.1016/j.neuroscience.2015.05.053.
VOGELZANGS N,DUIVIS H E,BEEKMAN A T,et al. Association of depressive disorders,depression characteristics and antidepressant medication with inflammation[J]. Transl Psychiatry,2012,2(2):e79. DOI:10.1038/tp.2012.8.
KIECOLT-GLASER J K,DERRY H M,FAGUNDES C P. Inflammation:depression fans the flames and feasts on the heat[J]. Am J Psychiatry,2015,172(11):1075-1091. DOI:10.1176/appi.ajp.2015.15020152.
BENEDETTI F,ZANARDI R,MAZZA M G. Antidepressant psychopharmacology:is inflammation a future target?[J]. Int Clin Psychopharmacol,2022,37(3):79-81. DOI:10.1097/yic.0000000000000403.
SHARMA S,AKUNDI R S. Mitochondria:a connecting link in the major depressive disorder jigsaw[J]. Curr Neuropharmacol,2019,17(6):550-562. DOI:10.2174/1570159x16666180302120322.
CASARIL A M,DANTZER R,BAS-ORTH C. Neuronal mitochondrial dysfunction and bioenergetic failure in inflammation-associated depression[J]. Front Neurosci,2021,15:725547. DOI:10.3389/fnins.2021.725547.
CHEN W J,DU J K,HU X,et al. Protective effects of resveratrol on mitochondrial function in the hippocampus improves inflammation-induced depressive-like behavior[J]. Physiol Behav,2017,182:54-61. DOI:10.1016/j.physbeh.2017.09.024.
HAN X K,GAO Y,YIN X,et al. The mechanism of electroacupuncture for depression on basic research:a systematic review[J]. Chin Med,2021,16(1):10. DOI:10.1186/s13020-020-00421-y.
MIKULSKA J,JUSZCZYK G,GAWRONSKA-GRZYWACZ M,et al. HPA axis in the pathomechanism of depression and schizophrenia:new therapeutic strategies based on its participation[J]. Brain Sci,2021,11(10):1298. DOI:10.3390/brainsci11101298.
WANG Y,GU C Y,EWING A G. Single-vesicle electrochemistry following repetitive stimulation reveals a mechanism for plasticity changes with iron deficiency[J]. Angew Chem Int Ed Engl,2022,61(20):e202200716. DOI:10.1002/anie.202200716.
FERREIRA A,NEVES P,GOZZELINO R. Multilevel impacts of iron in the brain:the cross talk between neurophysiological mechanisms,cognition,and social behavior[J]. Pharmaceuticals (Basel),2019,12(3):126. DOI:10.3390/ph12030126.
DUAN X X,XIE Y H,ZHU X F,et al. Quantitative susceptibility mapping of brain iron deposition in patients with recurrent depression[J]. Psychiatry Investig,2022,19(8):668-675. DOI:10.30773/pi.2022.0110.
DIXON S J,LEMBERG K M,LAMPRECHT M R,et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell,2012,149(5):1060-1072. DOI:10.1016/j.cell.2012.03.042.
JAKARIA M,BELAIDI A A,BUSH A I,et al. Ferroptosis as a mechanism of neurodegeneration in Alzheimer's disease[J]. J Neurochem,2021,159(5):804-825. DOI:10.1111/jnc.15519.
MAHONEY-S?NCHEZ L,BOUCHAOUI H,AYTON S,et al. Ferroptosis and its potential role in the physiopathology of Parkinson's Disease[J]. Prog Neurobiol,2021,196:101890. DOI:10.1016/j.pneurobio.2020.101890.
REICHERT C O,DE FREITAS F A,SAMPAIO-SILVA J,et al.
Ferroptosis mechanisms involved in neurodegenerative diseases[J]. Int J Mol Sci,2020,21(22):8765. DOI:10.3390/ijms21228765.
YAO S,ZHONG Y,XU Y H,et al. Quantitative susceptibility mapping reveals an association between brain iron load and depression severity[J]. Front Hum Neurosci,2017,11:442. DOI:10.3389/fnhum.2017.00442.
BERTHOU C,ILIOU J P,BARBA D. Iron,neuro-bioavailability and depression[J]. EJHaem,2022,3(1):263-275. DOI:10.1002/jha2.321.
LIANG S S,LU Y,LI Z X,et al. Iron aggravates the depressive phenotype of stressed mice by compromising the glymphatic system[J]. Neurosci Bull,2020,36(12):1542-1546. DOI:10.1007/s12264-020-00539-x.
YU Y,YAN Y,NIU F L,et al. Ferroptosis:a cell death connecting oxidative stress,inflammation and cardiovascular diseases[J]. Cell Death Discov,2021,7(1):193. DOI:10.1038/s41420-021-00579-w.
MAES M,MELTZER H Y,BUCKLEY P,et al. Plasma-soluble interleukin-2 and transferrin receptor in schizophrenia and major depression[J]. Eur Arch Psychiatry Clin Neurosci,1995,244(6):325-329. DOI:10.1007/BF02190412.
ZHANG W H,ZHOU Y,LI Q Q,et al. Brain iron deposits in thalamus is an independent factor for depressive symptoms based on quantitative susceptibility mapping in an older adults community population[J]. Front Psychiatry,2019,10:734. DOI:10.3389/fpsyt.2019.00734.
YAO S,ZHONG Y,XU Y H,et al. Quantitative susceptibility mapping reveals an association between brain iron load and depression severity[J]. Front Hum Neurosci,2017,11:442. DOI:10.3389/fnhum.2017.00442.
CHANG X,MA M X,CHEN L P,et al. Identification and characterization of elevated expression of transferrin and its receptor TfR1 in mouse models of depression[J]. Brain Sci,2022,12(10):1267. DOI:10.3390/brainsci12101267.
MAAROUFI K,AMMARI M,JELJELI M,et al. Impairment of emotional behavior and spatial learning in adult Wistar rats by ferrous sulfate[J]. Physiol Behav,2009,96(2):343-349. DOI:10.1016/j.physbeh.2008.10.019.
KIM J,WESSLING-RESNICK M. Iron and mechanisms of emotional behavior[J]. J Nutr Biochem,2014,25(11):1101-1107. DOI:10.1016/j.jnutbio.2014.07.003.
YOUDIM M B H. Brain iron deficiency and excess; cognitive impairment and neurodegenration with involvement of striatum and hippocampus[J]. Neurotox Res,2008,14(1):45-56. DOI:10.1007/BF03033574.
MEISER J,WEINDL D,HILLER K. Complexity of dopamine metabolism[J]. Cell Commun Signal,2013,11(1):34. DOI:10.1186/1478-811X-11-34.
YU Y,YAN Y,NIU F L,et al. Ferroptosis:a cell death connecting oxidative stress,inflammation and cardiovascular diseases[J]. Cell Death Discov,2021,7(1):193. DOI:10.1038/s41420-021-00579-w.
YU M Y,GAI C C,LI Z,et al. Targeted exosome-encapsulated erastin induced ferroptosis in triple negative breast cancer cells[J]. Cancer Sci,2019,110(10):3173-3182. DOI:10.1111/cas.14181.
ZHU L,HAN B,WANG L P,et al. The association between serum ferritin levels and post-stroke depression[J]. J Affect Disord,2016,190:98-102. DOI:10.1016/j.jad.2015.09.074.
KNYSZYNSKA A,RADECKA A,ZABIELSKA P,et al. The role of iron metabolism in fatigue,depression,and quality of life in multiple sclerosis patients[J]. Int J Environ Res Public Health,2020,17(18):6818. DOI:10.3390/ijerph17186818.
CAO H,ZUO C C,HUANG Y Q,et al. Hippocampal proteomic analysis reveals activation of necroptosis and ferroptosis in a mouse model of chronic unpredictable mild stress-induced depression[J]. Behav Brain Res,2021,407:113261. DOI:10.1016/j.bbr.2021.113261.
MEHRPOUYA S,NAHAVANDI A,KHOJASTEH F,et al. Iron administration prevents BDNF decrease and depressive-like behavior following chronic stress[J]. Brain Res,2015,1596:79-87. DOI:10.1016/j.brainres.2014.10.057.
UZUNGIL V,TRAN H,AITKEN C,et al. Novel antidepressant-like properties of the iron Chelator deferiprone in a mouse model of depression[J]. Neurotherapeutics,2022,19(5):1662-1685. DOI:10.1007/s13311-022-01257-0.
ZHANG W X,YU M Q,ZHANG Q Y,et al. DFO treatment protects against depression-like behaviors and cognitive impairment in CUMS mice[J]. Brain Res Bull,2022,187:75-84. DOI:10.1016/j.brainresbull.2022.06.016.
HOROWITZ M P,GREENAMYRE J T. Mitochondrial iron metabolism and its role in neurodegeneration[J]. J Alzheimer's Dis,2010,20(s2):S551-568. DOI:10.3233/jad-2010-100354.
CAMPANELLA A,ROVELLI E,SANTAMBROGIO P,et al. Mitochondrial ferritin limits oxidative damage regulating mitochondrial iron availability:hypothesis for a protective role in Friedreich ataxia[J]. Hum Mol Genet,2009,18(1):1-11. DOI:10.1093/hmg/ddn308.
ALLEN J,ROMAY-TALLON R,BRYMER K J,et al. Mitochondria and mood:mitochondrial dysfunction as a key player in the manifestation of depression[J]. Front Neurosci,2018,12:386. DOI:10.3389/fnins.2018.00386.
GIM?NEZ-PALOMO A,DODD S,ANMELLA G,et al. The role of mitochondria in mood disorders:from physiology to pathophysiology and to treatment[J]. Front Psychiatry,2021,12:546801. DOI:10.3389/fpsyt.2021.546801.
DENG L Y,HE S S,GUO N Q,et al. Molecular mechanisms of ferroptosis and relevance to inflammation[J]. Inflamm Res,2023,72(2):281-299. DOI:10.1007/s00011-022-01672-1.
NICOLE C,BROWN. An updated meta-analysis of oxidative stress markers in bipolar disorder[J]. Psychiatry Res,2014,218(1/2):61-68. DOI:10.1016/j.psychres.2014.04.005.
IWAMOTO K,BUNDO M,KATO T. Altered expression of mitochondria-related genes in postmortem brains of patients with bipolar disorder or schizophrenia,as revealed by large-scale DNA microarray analysis[J]. Hum Mol Genet,2005,14(2):241-253. DOI:10.1093/hmg/ddi022.
CATALDO A M,MCPHIE D L,LANGE N T,et al. Abnormalities in mitochondrial structure in cells from patients with bipolar disorder[J]. Am J Pathol,2010,177(2):575-585. DOI:10.2353/ajpath.2010.081068.
FATTAL O,LINK J,QUINN K,et al. Psychiatric comorbidity in 36 adults with mitochondrial cytopathies[J]. CNS Spectr,2007,12(6):429-438. DOI:10.1017/s1092852900015303.
袁清潔,郭建友,王建伟,等. 基于皮质酮-炎性反应-线粒体网络研究抑郁症肝郁脾虚病机及醒脾解郁方干预效应[J]. 中华中医药杂志,2017,32(5):2241-2245. DOI:10.3969/j.issn.1673-7202.2014.12.22.
REZIN G T,CARDOSO M R,GON?ALVES C L,et al. Inhibition of mitochondrial respiratory chain in brain of rats subjected to an experimental model of depression[J]. Neurochem Int,2008,53(6/7/8):395-400. DOI:10.1016/j.neuint.2008.09.012.
SHU X D,SUN Y M,SUN X Y,et al. The effect of fluoxetine on astrocyte autophagy flux and injured mitochondria clearance in a mouse model of depression[J]. Cell Death Dis,2019,10(8):577. DOI:10.1038/s41419-019-1813-9.
DANG R Z,WANG M Y,LI X H,et al. Edaravone ameliorates depressive and anxiety-like behaviors via Sirt1/Nrf2/HO-1/Gpx4 pathway[J]. J Neuroinflammation,2022,19(1):41. DOI:10.1186/s12974-022-02400-6.
WANG Y,WANG S W,XIN Y,et al. Hydrogen sulfide alleviates the anxiety-like and depressive-like behaviors of type 1 diabetic mice via inhibiting inflammation and ferroptosis[J]. Life Sci,2021,278:119551. DOI:10.1016/j.lfs.2021.119551.
ZHANG M K,LYU D B,WANG F,et al. Ketamine may exert rapid antidepressant effects through modulation of neuroplasticity,autophagy,and ferroptosis in the habenular nucleus[J]. Neuroscience,2022,506:29-37. DOI:10.1016/j.neuroscience.2022.10.015.
LU S F,LI C Y,JIN X H,et al. Baicalin improves the energy levels in the prefrontal cortex of mice exposed to chronic unpredictable mild stress[J]. Heliyon,2022,8(12):e12083. DOI:10.1016/j.heliyon.2022.e12083.
LI J N,GAO W,ZHAO Z H,et al. Ginsenoside Rg1 reduced microglial activation and mitochondrial dysfunction to alleviate depression-like behaviour via the GAS5/EZH2/SOCS3/NRF2 axis[J]. Mol Neurobiol,2022,59(5):2855-2873. DOI:10.1007/s12035-022-02740-7.
PALLOTTI F,BERGAMINI C,LAMPERTI C,et al. The roles of coenzyme Q in disease:direct and indirect involvement in cellular functions[J]. Int J Mol Sci,2021,23(1):128. DOI:10.3390/ijms23010128.
RIZZARDI N,LIPARULO I,ANTONELLI G,et al. Coenzyme Q10 phytosome formulation improves CoQ10 bioavailability and mitochondrial functionality in cultured cells[J]. Antioxidants (Basel),2021,10(6):927. DOI:10.3390/antiox10060927.
FORESTER B P,HARPER D G,GEORGAKAS J,et al. Antidepressant effects of open label treatment with coenzyme Q10 in geriatric bipolar depression[J]. J Clin Psychopharmacol,2015,35(3):338-340. DOI:10.1097/JCP.0000000000000326.
LI J Q,HUANG S Q,WANG Q,et al. Andrographolide promoted ferroptosis to repress the development of non-small cell lung cancer through activation of the mitochondrial dysfunction[J]. Phytomedicine,2023,109:154601. DOI:10.1016/j.phymed.2022.154601.
TRIPATHI A,SCAINI G,BARICHELLO T,et al. Mitophagy in depression:Pathophysiology and treatment targets[J]. Mitochondrion,2021,61:1-10. DOI:10.1016/j.mito.2021.08.016.
BATTAGLIA A M,CHIRILLO R,AVERSA I,et al. Ferroptosis and cancer:mitochondria meet the "iron maiden" cell death[J]. Cells,2020,9(6):1505. DOI:10.3390/cells9061505.
HAMEED S,NASER I A,AL GHUSSEIN M A,et al. Is iron deficiency a risk factor for postpartum depression?A case-control study in the Gaza Strip,Palestine[J]. Public Health Nutr,2022,25(6):1631-1638. DOI:10.1017/s1368980021003761.

