脱落酸调控‘品丽珠’葡萄果实白藜芦醇合成的研究
王俊芳,姜凯凯,杨东岳,孙玉霞,管雪强*
(山东省葡萄研究院/山东省酿酒葡萄与葡萄酒技术创新中心,山东济南 250100)
芪类化合物是一类多酚类次生代谢产物,属于植物抗毒素,存在于包括葡萄在内的部分植物中[1-2]。而其中的白藜芦醇(Resveratrol,Res)具有医学保健作用,可预防和减缓癌症、心脑血管疾病的发生[3-4]。葡萄及其产品被认为是食品中Res的重要来源,但是在大量栽培的葡萄果实中Res含量很低(<10 µg•g-1),因此,研究葡萄中Res的合成与积累及其调控机制,提高成熟果实中Res含量具有重要意义。
Res在葡萄果实中主要有4种存在形式:反式-白藜芦醇(trans-resveratrol,trans-res)、顺式-白藜芦醇(cis-resveratrol,cis-res)、反式-白藜芦醇苷(trans-piceid,trans-pd)、顺式-白藜芦醇苷(cispiceid,cis-pd)[5]。通常情况下,Res在不同组织器官和不同基因型葡萄品种中含量不同[6-7]。很多研究均表明,葡萄果实中Res的合成与积累从葡萄的转色期(veraison,即果实开始进入成熟阶段,着色品种开始着色,白色品种果皮绿色减退、变浅、变黄,果肉开始变软)迅速增加,且与葡萄的成熟过程及果实中植物激素的动态变化密切相关[8-11]。
葡萄果实的成熟受植物激素的调控,包括脱落酸(Abscisic acid, ABA)、油菜素内酯(Brassinosteroids,BR)、乙烯(Ethylene, ETH)等[12-15]。在葡萄发育过程中,ABA的合成与积累出现在果实的始熟期或略早[16-18]。大量的研究表明,ABA在调控葡萄果实成熟过程中起着十分重要的作用,包括促进果实着色、糖分积累和果实变软等[12,16,19-24],而施用ABA合成抑制剂氟啶酮(fluridone)可以抑制葡萄果实着色,延迟果实成熟[11,25]。
本研究采用外源ABA及其合成抑制剂处理‘品丽珠’葡萄果实,探讨果实发育及成熟过程中Res合成与积累的动态变化规律,并通过分析果实中ABA的含量,进一步探讨ABA调控葡萄果实Res合成与积累机制,对研究外源诱导子调控葡萄果实Res的合成具有重要意义。
1 材料与方法
1.1 试验材料
(+)-脱落酸(ABA)(分析纯,纯度≥98%)购于生工生物工程(上海)股份有限公司,氟啶酮(Fluridone,分析纯)购于Sigma-Adrich公司(美国)。
配制方法:称取一定量的(+)-ABA,先用少量的乙醇(0.1%,Vol,分析纯)溶解,然后加水充分震荡使其完全溶解,定容到一定体积,使其浓度为500 mg•L-1。然后在溶液中加入一定体积的表面附着剂Tween 80,其体积占最终溶液总体积的0.1%;氟啶酮溶液配制方法同上;对照(CK)的去离子水中也加入相同比例的乙醇和Tween 80。
以中粮集团(蓬莱)酿酒试验基地的酿酒葡萄品种‘品丽珠’为试材,单干双臂整形,南北行向,株行距为1 m×2.5 m,其他田间管理按常规。
1.2 处理方法
于2018年7月27日,即在‘品丽珠’果实的花后60 d(始熟期前10 d左右),选取72个果穗,在前期研究的基础上,分别用500 mg•L-1的(+)-ABA、氟啶酮溶液进行喷施直至溶液刚开始下滴,每种溶液均处理24穗果;同时用去离子水浸泡处理的果穗作为对照。
1.3 取样时间及方法
花后60 d(处理前)、花后61 d(处理后1 d)、花后62 d(处理后2 d)、花后67 d(处理后7 d)、花后81 d(处理后21 d)、花后95 d(处理后35 d)、花后116 d(处理后56 d)、花后138 d(处理后78 d,成熟期)取样。
每次取3穗果,每穗果作为一个重复,样品先用自来水冲洗,再用去离子水冲洗(去除果实表面外源ABA及氟啶酮溶液的残留),吸水纸吸干表面,分离果实的果皮、果肉和种子,液氮速冻,研磨,-80 ℃冰箱下保存。
1.4 Res的提取与检测分析
Res的提取参照Wang等[10]的方法:称取1 g果皮粉末,用10 mL甲醇和乙酸乙酯50∶50(Vol)的浸提液提取,25 ℃ 条件下避光浸提24 h 。然后在4 ℃、10 000 r•min-1下离心10 min,取上清液。再用3 mL浸提液重复提取,离心,取上清液。合并两次上清液,用旋转蒸发仪在40 ℃下旋蒸至干,用2 mL甲醇复溶,-40 ℃储存,待测。
Res的检测与分析参照Wang等[10]的方法。样品均采用安捷伦高效液相色谱系统进行测定。样品上机分析前用0.22 μm PTFE膜(上海安谱科学仪器有限公司)过滤。色谱柱为Atlantis®T3反相C18柱(4.6 mm×250 mm,5.0 μm, Waters,USA),保护柱为Atlantis T3(4.6 mm×20 mm,5.0 μm,Waters,USA)。
高效液相色谱的测定条件参照Wang等[10]。采用外标法定量,标样trans-res和trans-pd可以在紫外线-C(UV-C)辐射处理下部分转化为顺式异构体,所以两种顺式异构体(cis-res和cis-pd)是通过UV-C辐射处理30 min后得到的,且两种顺式异构体的含量是假设反式异构体能够百分之百转化而计算,根据转化率,做出标准曲线。由于本研究中主要测定trans-res、cisres、trans-pd和cis-pd的含量,因此,把上述4种物质的总和计为Res总量。
1.5 基因表达分析
1.5.1 葡萄果皮RNA的提取
利用通用植物总RNA提取试剂盒(离心柱型,购于北京百泰克生物技术有限公司)提取果皮RNA。具体操作如下:
取100 mg葡萄果皮于液氮中快速研磨,将匀浆转移至1.5 mL RNase free离心管中,加入1 mL的裂解液PL,在65 ℃条件下孵育5 min。然后在4 ℃条件下,以12 000 r•min-1转速离心10 min,转入新的RNase free过滤柱中。以10 000 r•min-1转速离心45 s。收集滤液(含有总RNA)于收集管中,加入1倍体积70%乙醇,充分颠倒混匀,将得到的溶液转入吸附柱中。以10 000 r•min-1转速离心45 s,加入500 μL的去蛋白液,以12 000 r•min-1转速离心45 s。加入700 μL漂洗液,以12 000 r•min-1转速离心60 s,弃掉废液。再加入500 μL漂洗液RW,以12 000 r•min-1转速离心60 s,弃掉废液。将吸附柱放回空收集管中,以12 000 r•min-1转速离心2 min,尽量除去漂洗液。取出吸附柱,放入一个新的RNase free离心管中,在吸附膜的中间部位加45 μL RNase free water,室温放置2 min,以12 000 r•min-1转速离心1 min,即获得了RNA提取物,置于-80 ℃保存。
1.5.2 DNA消化及反转录过程
利用天根生化科技(北京)有限公司的快速反转录试剂盒(Fast quant RT with gDNase KR106,中国)进行反转录。具体操作如下:
将模板RNA在冰上解冻,5×DNA Buffer、FQRT Primer Mix、10×Fast RT Buffer、RNase-Free ddH2O在室温(15~25 ℃)解冻,然后置于冰上,使用前震荡摇匀,收集残留管壁的液体。
DNA的消化:在无核酸酶的离心管中,将13 μL总RNA和2 μL 5×gDNA Buあer配制成反应液,共15 μL,混匀,然后42 ℃下反应3 min。
反转录过程:在无核酸酶的离心管中,将2 μL的10×Fast RT Buffer、1 μL的RT Enzyme Mix和2 μL的FQ-RT Primer MIX配制成反应液,并将5 μL该反应液加入到DNA消化过程中的15 μL液体中,总反应体积为20 μL,然后先在42 ℃下反应15 min,再在95 ℃下反应3 min,即得到cDNA,在-20 ℃保存,备用。
1.5.3 引物的合成
引物序列参照作者及前人[9,14]已发表文章中所用的引物,由上海生工生物技术有限公司合成,引物序列如表1所示。

表1 Res及ABA合成及调控相关基因的引物序列Table 1 Primers of genes related to Res and ABA biosynthesis and regulation
1.5.4 荧光定量PCR
使用天根生化科技有限公司的RealMasterMix(SYBR Green)试剂盒进行荧光定量PCR。先将20×SYBR Solution和2.5×RealMasterMix在冰上解冻,然后将125 μL 20×SYBR Solution加入至2.5×RealMasterMix中,彻底混匀。在PCR反应管中配制20 μL的反应体系:9 μL 2.5×RealMasterMix/SYBR Solution、0.6 μL/0.6 μL的正反向引物、1 μL的DNA模板、8.8 μL的超纯水。
使用7500荧光定量PCR仪进行以下程序:先在94 ℃预变性2 min;按以下程序进行40个循环PCR扩增:94 ℃变性10 s,58 ℃退火18 s,68 ℃延伸30 s;然后按照以下梯度采集溶解曲线:95 ℃保持1 min,55 ℃保持30 s,95 ℃保持30 s结束整个程序,荧光定量数据采用2-ΔΔCT法分析基因相对表达量。
1.6 数据统计分析
每个葡萄样品3次重复的平均值被用来进行进一步的数据分析,采用PASW Statistics 13.0(SPSS,USA)处理数据,不同发育时期之间用One-Way ANONA 进行方差分析,所有图表用Sigma Plot 12.5制作。
2 结果与分析
2.1 不同处理对果实粒质量及可溶性固形物含量影响
从图1可以看出,所有处理的粒质量均表现为前期快速增大,在花后80 d以后趋于平稳的状态。在138 d,ABA处理的粒质量比对照增加约11%,而ABA合成抑制剂氟啶酮处理的粒质量低于对照。在可溶性固形物含量方面,在成熟过程中3个处理均呈不断上升趋势,在花后116 d所有处理基本相同,但此后表现不同,ABA处理和对照继续增加,在花后138 d达到最大值;氟啶酮处理则不再增加,显著低于对照约20%。
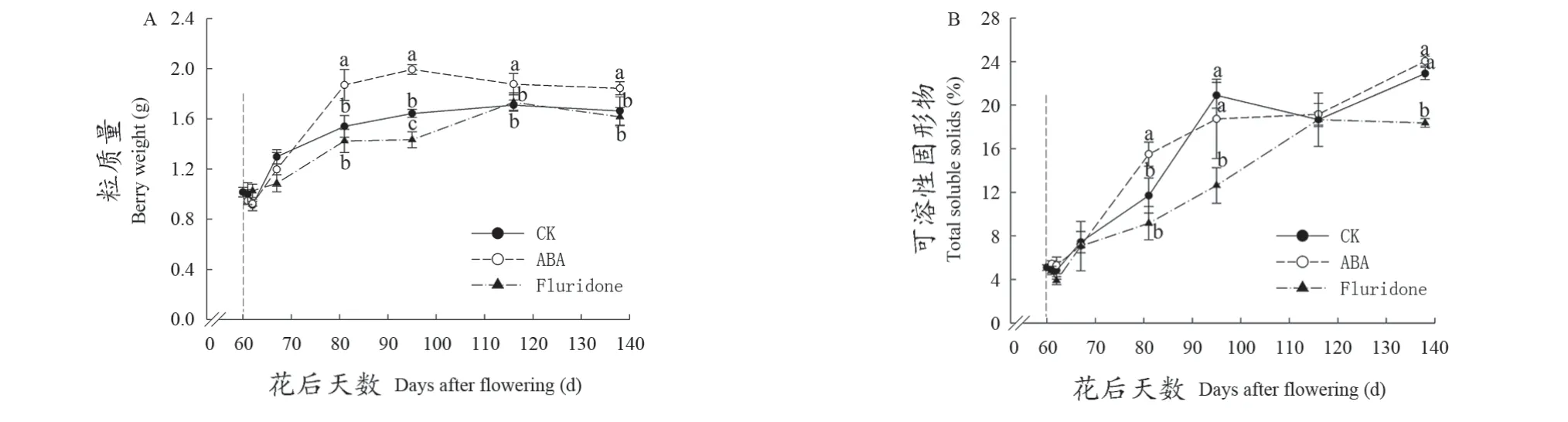
图1 不同处理对‘品丽珠’发育过程中果实粒质量(A)及可溶性固形物(B)的影响Figure 1 Berry weight(A) and total soluble solids (B) over the growing season in 'Cabernet France' berries
2.2 不同处理对果实内源ABA含量及其相关基因表达的影响
外源ABA处理‘品丽珠’葡萄果实后,显著增加了果实中内源ABA的含量,且在果实整个成熟过程中,ABA的含量均高于对照(图2),尤其是在花后62 d达到高峰(约0.7 µg•g-1);氟啶酮处理后降低了果实中内源ABA的含量,但其变化趋势与对照一致。

图2 不同处理下‘品丽珠’果实发育过程中ABA含量变化Figure 2 Changes of ABA content in the development of'Cabernet Franc' berries under diあerent treatments
外源ABA处理后,ABA的两个合成基因VvNCED1和VvNCED2的表达在前期升高(图3),VvNCED1在花后62 d和67 d时显著高于对照,并在花后67 d出现表达高峰,但是在花后116 d,出现第二个表达高峰,显著低于对照;而VvNCED2在ABA处理后前期显著高于对照,在花后81 d出现表达高峰,花后95 d低于对照。而氟啶酮处理后,VvNCED1的表达在整个发育过程中呈下降趋势,在处理前期和后期,果实中VvNCED1的表达都低于对照,但在花后95 d高于对照(图3A);而VvNCED2表达在氟啶酮处理后显著受到抑制(图3B)。

图3 不同处理对葡萄果实中ABA合成基因表达的影响Figure 3 Eあects of diあerent treatments on ABA synthesis gene expression in grape fruits
2.3 不同处理对总Res含量及其组分的影响
如图4所示,在‘品丽珠’葡萄果实发育过程中,总Res含量持续增加,从花后81 d开始直到成熟,ABA处理的葡萄果实中总Res含量均显著高于对照;用氟啶酮处理后,总Res含量积累减慢,并显著低于对照。由图5可以看出,‘品丽珠’果实总Res主要是由trans-res和cis-pd组成,约占53%和38%(图5B,C),且二者含量在外源ABA处理后显著增加;氟啶酮处理后,trans-res在果实发育过程中变化不明显,只有在花后81 d和成熟期显著低于对照(图5B),但是cis-pd显著降低(图5C);而trans-pd和cis-res含量较低,在ABA及氟啶酮处理后变化较小(图5A,D),但在花后116 d和成熟期的ABA处理葡萄果实中trans-pd显著高于对照,而花后95 d的果实中cis-res含量显著高于对照。
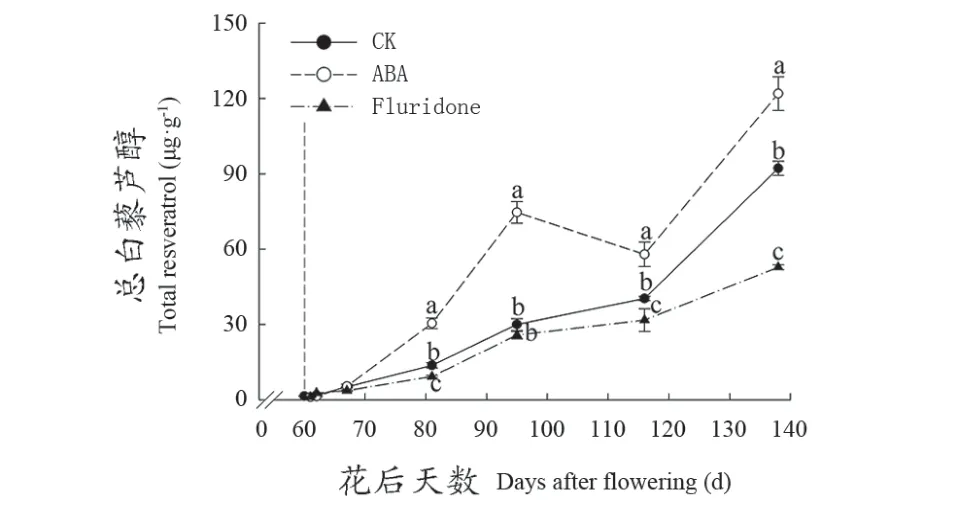
图4 不同处理对‘品丽珠’发育过程中总Res含量的影响Figure 4 Eあects of diあerent treatments ontotal Res content duringdevelopment of 'Cabernet Franc' berries

图5 不同处理对‘品丽珠’发育过程中Res各组分含量的影响Figure 5 Eあects of diあerent treatments on the content of Res components during development of 'Cabernet Franc' berries
2.4 不同处理对Res合成基因表达的影响
外源ABA处理后的前期,苯丙氨酸代谢途径的第一个基因VvPAL表达没有变化,但在成熟期显著高于对照,而在花后67 d的氟啶酮处理葡萄果实中显著低于对照(图6A);VvC4H在花后67 d和138 d的ABA处理葡萄果实中显著高于对照,而氟啶酮处理后几乎没有变化(图6B);Vv4CL在花后67 d和81 d 的ABA处理后葡萄果实中表达显著低于对照,但在成熟期高于对照,而花后67 d、81 d、95 d的氟啶酮处理后葡萄果实中显著低于对照(图6C)。

图6 不同处理对‘品丽珠’发育过程中Res合成相关基因表达的影响 (续)Figure 6 Eあects of diあerent treatments on the expression of genes related to Res synthesis during development of 'Cabernet Franc' berries

图6 不同处理对‘品丽珠’发育过程中Res合成相关基因表达的影响Figure 6 Eあects of diあerent treatments on the expression of genes related to Res synthesis duringdevelopment of 'Cabernet Franc' berries
在‘品丽珠’葡萄果实花后60 d用ABA处理发现,在花后81 d,VvSTS表达显著高于对照,在花后95 d,ABA处理和对照果实中VvSTS的表达都达到最高,但无显著性差异;随后表达量降低,在成熟期略有增加(图6D);VvSTS的一个重要调节基因VvMyb14在花后67 d的ABA处理葡萄果实中显著高于对照,随后其表达趋势和对照基本一致,但无显著性差异(图6E);VvSTS的另一个重要调节基因VvMyb15在外源ABA处理后的果实成熟过程中基本无变化,但是在成熟期显著高于对照(图6F);Res糖苷合成的关键基因VvO3GT在花后95 d的ABA处理果实中与对照同时达到表达高峰,并显著高于对照,随后降低(图6G)。
而ABA合成抑制剂处理后,VvSTS、VvMyb14、VvMyb15及VvO3GT的表达量均或多或少的降低,且在整个果实成熟过程中没有出现表达高峰。
3 讨论与结论
本研究表明,外源ABA处理能够促进‘品丽珠’葡萄果实提前成熟,果实中内源ABA含量增加,且ABA处理后果实中Res含量增加。氟啶酮处理则抑制了葡萄果实成熟,且果实中Res含量降低。葡萄果实发育过程中Res合成受转录水平的调控,外源ABA处理后ABA合成基因VvNCED1和VvNCED2表达升高,Res合成相关基因及其调控基因(尤其是VvSTS、VvMyb14及VvMyb15)表达升高,而氟啶酮处理后表达量降低。
众多研究表明,外源ABA的施加,能够增加果实着色,加速果实成熟,即ABA在果实成熟过程中起着重要作用。在本研究中,外源ABA施用后,内源ABA的含量增加,有可能是因为外源ABA进入果实内部造成的;然而ABA合成基因VvNCED1和VvNCED2表达升高,表明是由于外源ABA的刺激,导致内源ABA的合成增加[26]。同时表明由于外源ABA的施用先启动内源ABA的合成与积累,当内源ABA的含量积累到一定程度之后,再启动葡萄果实的成熟,即促使‘品丽珠’葡萄提前进入始熟期,进而启动Res的合成与积累。
在ABA信号途径中,ABEB/ABFs是bZIP(basic leucine zipper)家族Group A中可以结合在ABA-响应元件上的一类转录因子,对ABA的信号转导起着重要作用[27-28]。VvABF2是一个与葡萄果实成熟相关且在细胞核中表达的ABEB/ABF-like转录因子,通过与下游基因启动子上特定序列结合,激活下游基因表达;当VvABF2过表达时,受ABA调控的多个转录因子家族成员(DREB、WRKY和MYB等)上调;同时在VvABF2过表达的葡萄细胞悬浮系中Res含量增加,且ABA处理能够增强此作用[18]。因此本试验对将来研究ABA信号途径调控Res的合成与积累具有重要意义。
综上所述,在葡萄生产上可利用相应的栽培措施促进植物体内ABA积累增加,调控葡萄果实的成熟[29],进而调控葡萄果实中Res的合成与积累,有利于促进果实营养物质的增加。

