定风止痉散对抽动障碍大鼠纹状体多巴胺及CDNF、DR、DAT的影响*
李海峰,都修波
1.河南中医药大学儿科医学院,河南 郑州 450000; 2.河南中医药大学第一附属医院,河南 郑州 450000
抽动障碍(tic disorder,TD)是一种在儿童时期发病的神经精神性疾病,常伴有多动、睡眠障碍、情绪障碍等症状。临床上通常将其分为三种类型,即短暂性抽动障碍(transient tic disorder,TTD)、慢性抽动障碍(chronic tic disorder,CTD)和图雷特综合征(Tourette′s syndrome,TS)[1]。Meta分析结果显示,我国TD患病率为6.1%,男性患病率(5.1%)高于女性(2.4%);TTD、CTD和TS的患病率分别为1.7%、1.2%和0.3%[2]。若未能及时治疗,可能导致病情迁延难愈,抽动症状延至成年,严重危害儿童的身心健康[3]。
定风止痉散由经典方剂天麻钩藤饮与止痉散化裁而成,在临床应用中效果显著,且具有副作用小、患者依从性高等优点[4-5]。本研究旨在观察定风止痉散对TD模型大鼠纹状体的脑多巴胺神经营养因子(cerebral dopamine neurotrophic factor,CDNF)、多巴胺D1受体(dopamine D1 receptor,DRD1)、多巴胺D2受体(dopamine D2 receptor,DRD2)、多巴胺转运体(dopamine transporter,DAT)、多巴胺(dopamine,DA)及高香草酸(homovanillic acid,HVA)的影响,以探讨定风止痉散治疗TD的作用机制。
1 材料
1.1 动物SPF级雄性Wistar大鼠36只,4周龄,体质量190~218 g,购自济南朋悦实验动物繁育有限公司,许可证号:SYXK(鲁)20190003。动物饲养于河南省中医药研究院动物房,室温20~24 ℃,昼夜12 h/12 h光暗循环,自由进食和饮水,定时通风换气,严格遵循实验动物伦理学相关规定。本实验由河南省中医药研究院伦理委员会审核批准,伦理批号:HNTCMDW-20210115。
1.2 药物与试剂定风止痉散(天麻、钩藤、石决明、杜仲、川牛膝、桑寄生、黄芩、栀子、夜交藤、益母草、茯神、全蝎、蜈蚣,江阴天江药业有限公司生产,由河南中医药大学第一附属医院颗粒剂药房制备颗粒剂,生产批号:20190622);硫必利(规格100 mg/片,天津中新药业集团股份有限公司,批号:国药准字H12021228);亚氨基二丙腈(iminodipropionitrile,IDPN)、甲酸铵(美国Sigma公司,货号:02716CTV、516961);CDNF抗体、DRD1抗体、DAT抗体(美国Abcam,货号:ab253238、ab279713、ab184451);DRD2抗体(武汉三鹰生物技术有限公司,货号:55084-1-AP);GAPDH抗体(杭州贤至生物科技有限公司,货号:AB-P-R001);甲醇、乙腈(美国Fisher Chemical,货号:A452-4、A955-4);甲酸(美国Honeywell,货号:94318);高效RIPA裂解液、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,货号:R0010、PC0020-50T)。
1.3 仪器ELx800型酶标仪(美国BIO-Tek);EPS200型蛋白电泳仪、5200型全自动化学发光图像分析仪(上海天能生命科学有限公司);质谱仪(美国SCIEX,型号:6500/5500 QTRAP);超高效液相色谱仪(Agilent,型号:1290 Infinity UPLC);离心机(德国Eppendorf,型号:5430R);研磨仪(上海净信实业有限公司,型号:JXFSTPRT-CL);涡旋仪(上海琪特分析仪器有限公司,型号:QT-1);超声仪(深圳市洁盟清洗设备有限公司,型号:JP-100);色谱柱(美国Waters,型号:ACQUITY UPLC BEH C18 1.7 μm,2.1 mm×100.0 mm)。
2 方法
2.1 药物制备硫必利片碾碎,加入生理盐水配成质量浓度为4.2 g·L-1的混悬液。IDPN溶于生理盐水,配成质量浓度为30 g·L-1的溶液。
2.2 TD模型制备方法造模大鼠腹腔注射IDPN(300 mg·kg-1),每日1次,连续注射7 d,将造模首日标记为第1天。造模结束后次日大鼠未见死亡,对造模大鼠进行抽动行为评分[6];若运动行为评分和刻板行为评分均≥2分,提示造模成功。见表1。

表1 大鼠抽动行为评分标准
2.3 分组及给药将36只大鼠采用随机数字表法分为空白组、模型组、硫必利组(16.8 mg·kg-1)和定风止痉散高(4.536 g·kg-1)、中(2.268 g·kg-1)、低(1.134 g·kg-1)剂量组,每组6只。空白组大鼠腹腔注射生理盐水,其余各组按照“2.2”项方法进行造模。造模后次日各药物组按照相应给药剂量灌胃,空白组与模型组给予生理盐水(10 mL·kg-1)灌胃,每天2次(700—900、1900—2100),连续4周。
2.4 标本采集末次给药后大鼠禁食不禁水24 h,10%水合氯醛腹腔注射(1 mL·kg-1)麻醉,大鼠断头,在冰盒上迅速剥离脑组织并分离纹状体,放入冻存管内,液氮速冻后转移至-80 ℃冰箱保存待测。
2.5 高效液相色谱法检测纹状体DA、HVA含量取纹状体组织,每50 μg样本加入200 μL预冷的乙腈(含1.25%甲酸)/甲醇溶液,涡旋混匀30 s,冰浴超声30 min,-20 ℃孵育1 h沉淀蛋白;4 ℃离心20 min取上清,加入37 μL Na2CO3(200 g·L-1),涡旋混匀后加入50 μL DSCl溶液(10 g·L-1),30 ℃ 恒温摇床反应60 min;加入50%甲酸水溶液 1 μL 将pH调至5,然后4 ℃离心5 min取上清,上机检测。色谱条件:采用超高效液相色谱系统进行分离,样品置于4 ℃自动进样器中,柱温40 ℃;流动相A:50 mmol·L-1甲酸铵水溶液+0.425%甲酸,流动相B:甲醇溶液,流速400 μL·min-1,进样量 2 μL。梯度洗脱:0—5 min,5%—70%B;5—11 min,70%—100% B;11—13 min,100% B;13—13.1 min,100%—10% B;13.1—16 min,10% B。质谱条件:采用质谱仪在负离子模式下进行分析,采用MRM模式检测离子。采用Multiquant 3.0.2软件提取色谱峰面积及保留时间,采用目标物质的标准品矫正保留时间后进行代谢物鉴定。
2.6 Western Blot检测纹状体CDNF、DAT、DRD1、DRD2蛋白表达水平取纹状体组织,加入RIPA裂解液与磷酸酶抑制剂,研磨后4 ℃放置20 min,离心(12 000 r·min-1)15 min取上清。采用BCA法进行蛋白定量,电泳(80 V,30 min;120 V,45 min),转膜(280 mA,40 min),室温封闭(5%脱脂牛奶)2 h。4 ℃摇床孵育一抗(11 000)过夜,1×TBST洗膜3次,每次10 min。室温摇床孵育二抗1 h(120 000),TBST洗膜3次,每次 10 min。配制ECL反应液,使用Bio-RAD曝光仪使蛋白条带显影并拍照,Image J软件分析条带灰度值并计算目的蛋白的相对表达量。
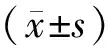
3 结果
3.1 各组大鼠体质量比较造模前各组大鼠体质量比较,差异无统计学意义(P>0.05);第14天、第21天,与空白组比较,模型组和各药物组大鼠体质量显著降低(P<0.05);第35天,与空白组比较,模型组与定风止痉散低剂量组大鼠体质量显著降低(P<0.05),空白组与其他药物组大鼠体质量比较,差异无统计学意义(P>0.05)。见表2。
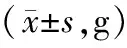
表2 各组大鼠体质量比较
3.2 各组大鼠抽动行为评分比较造模后,与空白组比较,其余各组大鼠运动行为评分、刻板行为评分均显著增加(P<0.05);第28天,与模型组比较,定风止痉散中、高剂量组和硫必利组大鼠的运动行为评分显著降低(P<0.05),各药物组大鼠的刻板行为评分显著降低(P<0.05);第35天,与模型组比较,各药物组大鼠的运动行为评分、刻板行为评分显著降低(P<0.05)。见表3、表4。
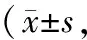
表3 各组大鼠运动行为评分比较 分)
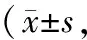
表4 各组大鼠刻板行为评分比较 分)
3.3 各组大鼠纹状体DA、HVA含量比较与空白组比较,模型组大鼠纹状体DA、HVA含量显著升高(P<0.05);与模型组比较,各药物组大鼠纹状体DA、HVA含量显著降低(P<0.05)。见表5。
表5 各组大鼠纹状体DA、HVA含量比较
3.4 各组大鼠纹状体CDNF、DAT、DRD1、DRD2蛋白表达水平比较与空白组比较,模型组大鼠纹状体CDNF、DAT、DRD1蛋白表达水平显著降低(P<0.05);与模型组比较,定风止痉散中、高剂量组大鼠纹状体CDNF、DAT、DRD1蛋白表达水平显著增加(P<0.05);与模型组比较,硫必利组大鼠DRD1蛋白表达水平显著增加(P<0.05);与硫必利组比较,定风止痉散中、高剂量组大鼠纹状体CDNF蛋白表达水平显著增加(P<0.05),定风止痉散中剂量组大鼠纹状体DAT蛋白表达水平显著增加(P<0.05)。各组大鼠纹状体DRD2蛋白表达水平比较,差异无统计学意义(P>0.05)。见图1—图3,表6。

注:A:空白组;B:模型组;C:定风止痉散低剂量组;D:定风止痉散中剂量组;E:定风止痉散高剂量组;F:硫必利组。
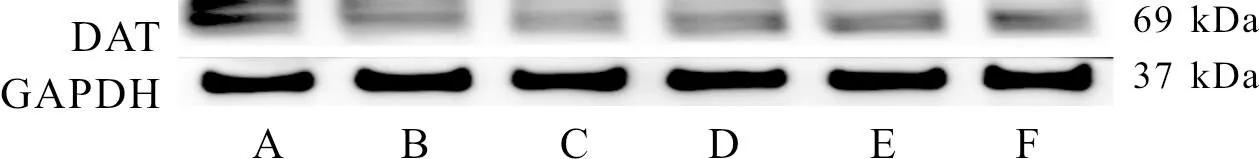
注:A:空白组;B:模型组;C:定风止痉散低剂量组;D:定风止痉散中剂量组;E:定风止痉散高剂量组;F:硫必利组。

注:A:空白组;B:模型组;C:定风止痉散低剂量组;D:定风止痉散中剂量组;E:定风止痉散高剂量组;F:硫必利组。
表6 各组大鼠纹状体CDNF、DAT、DRD1、DRD2蛋白表达水平比较
4 讨论
TD归属于中医学“筋惕”“惊风”“肉瞤”“瘛疭”等范畴,主要与肝、心、脾三脏相关,同时涉及肺、肾两脏。其主要病机为肝亢风动、外风引动、痰火扰神、气郁化火、脾虚痰聚、阴虚风动等[7],在临床实践中,肝亢风动证最为常见[8]。都修波教授从五行生克关系出发,提出“木旺则火旺,木旺则土虚”的理论,认为无论是痰火扰神、外风引动内风,还是脾虚痰聚,肝亢均为TD发病的根本原因,风动则是TD发病的具体表现形式。其主要病机在于肝阳上亢、肝风内动,波及四肢则发为肢体抽动,上窜头面则见挤眉弄眼、头面部抽动,肝风挟痰上攻咽喉则见喉间吭吭作声,肝风痰火扰动心神则见抽动秽语。主要治则为平肝潜阳、熄风止痉,从而创制定风止痉散,该方由天麻、钩藤、石决明、杜仲、川牛膝、桑寄生、黄芩、栀子、夜交藤、益母草、茯神、全蝎、蜈蚣组成,具有平肝潜阳、清热除烦、祛风通络、定风止痉的功效。药理学研究发现,天麻素可抑制IDPN诱导的大鼠纹状体DA及其代谢物减少以及多巴胺周转率升高[9],同时增加DAT数量,减少TS模型大鼠的刻板行为[10];钩藤碱能清除氧自由基、增强机体抗氧化能力、减少细胞凋亡,从而保护神经元[11];黄芩苷、栀子苷具有抗氧化、抗凋亡等作用[12];全蝎、蜈蚣组方能显著改善TD小鼠行为及单胺类神经递质释放[13];石决明具有降血压、抗氧化等作用[14];桑寄生可抑制乙酰胆碱活性,保护神经元[15]。因此,定风止痉散治疗TD的机制可能与抑制细胞凋亡、保护神经元有关。
目前,DA系统功能失调和神经递质失衡被广泛认为是TD的主要病理机制[16]。研究显示,神经元受损与TD的发生发展密切相关[17],TD患儿大脑皮质基底节存在结构和功能异常[18],解剖学和影像学研究提供了证据支持[19-20]。IDPN诱导的TD模型大鼠纹状体神经元超微结构显示,DA神经元细胞结构破坏明显,DA系统功能相对紊乱,而接受抗抽动药物干预的大鼠神经元结构相对完好[21]。CDNF是一种新型神经营养因子,对DA神经系统具有保护与修复作用,其与多种神经系统疾病关系密切。研究显示,CDNF可明显抑制DA能神经元变性,并减轻阿扑吗啡诱导的大鼠单侧旋转行为[22]。CDNF通过参与内质网的调节,不仅保护中枢神经系统DA能神经元和纹状体DA神经纤维,还能增强存活DA神经元的功能,修复受损的黑质纹状体DA系统[23]。研究发现,注射6-羟基多巴胺两周后,接受CDNF干预的大鼠旋转行为逐渐恢复正常[24]。
本研究发现定风止痉散组大鼠纹状体DAT表达水平升高。DAT的重吸收是DA主要的灭活方式之一[25],因此定风止痉散可提高DA的重吸收率,降低DA活性。定风止痉散组大鼠纹状体DRD1表达水平升高,提示定风止痉散可改善DA系统功能紊乱,使其由亢进渐趋正常。另外,模型组大鼠纹状体DA、HVA含量升高,提示DA活性增强,DA系统功能亢进,支持TD发病机制的DA系统活动亢进学说[26];定风止痉散组大鼠纹状体DA含量下降,提示定风止痉散可抑制DA系统功能亢进。由此推测,DA能神经元损伤,DA活性增强、亢进,导致DA系统功能紊乱可能是TD的发病机制之一;定风止痉散治疗TD的机制可能与提高CDNF表达,保护和修复DA能神经元损伤有关。
综上,定风止痉散可改善TD大鼠的抽动行为,可能与增加纹状体CDNF、DAT、DRD1蛋白表达水平,降低DA、HVA含量,从而调节DA系统功能有关。

