日本脑炎病毒感染宿主后m6A甲基化相关蛋白的表达和定位研究
欧宇达,李晓晗,陈婧,赵炳枢,陈健芃,毛玎懿,周江飞,周斌
(南京农业大学动物医学院,江苏 南京 210095)
日本脑炎病毒(Japanese encephalitis virus,JEV)属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),是一种单股正链RNA病毒[1-2]。由JEV感染引起的日本脑炎是一种蚊媒嗜神经性人兽共患病毒性传染病,严重危害畜牧养殖业和公共卫生安全[3]。研究JEV与宿主的互作,有助于发掘新的抗病毒靶点,为研发有效的抗病毒药物提供理论基础。m6A甲基化(N6-methyladenosine)是RNA中腺嘌呤6号碳原子发生甲基化修饰,是真核生物mRNA上最重要的表观遗传修饰方式之一,参与调控mRNA的转录、剪接、翻译、降解等过程,在真核生物的生长、代谢、生殖、疾病发生发展等多种生理或病理过程中起着重要的作用[4]。m6A甲基化修饰是个动态可逆的过程,主要由其相关蛋白家族如甲基转移酶样蛋白3(methyltransferase-like protein 3,METTL3),甲基转移酶样蛋白14(methyltransferase-like protein 14,METTL14),去甲基化酶肥胖和脂肪相关蛋白(fat mass and obesity-associated,FTO),结合蛋白如YTF家族蛋白(YTHDF1、YTHDF2、YTHDF3)等发挥各自的功能而共同完成[5-10]。近年来,关于m6A及其相关蛋白影响病毒-宿主互作的研究屡有报道,它们可通过对病毒基因组的修饰直接影响病毒的生命周期,或者通过调控宿主免疫、代谢等途径等间接影响病毒复制,提示m6A是调节抗病毒免疫的潜在靶点。
目前已发现黄病毒科、黄病毒属的一些成员如寨卡病毒(Zika virus,ZIKV)和丙型肝炎病毒(hepatitis C virus,HCV)的感染与m6A及其相关蛋白具有关联性,m6A通过不相同的机制,调控它们的复制[11-12]。然而对于JEV是否受到m6A调控,目前暂未有研究报道。因此,本研究选择JEV的易感动物C57BL/6小鼠作为体内模型,易感细胞BHK-21作为体外模型,通过m6A水平检测、Western blot、激光共聚焦等试验探究JEV感染在体内外两个层面的m6A水平的变化及其主要相关蛋白的表达水平和亚细胞定位的变化,对JEV的感染与m6A的关系进行初步探究,为后续进一步研究m6A对JEV感染的调控及其相关机制奠定基础。
1 材料与方法
1.1 细胞、病毒和试验动物
乳仓鼠肾细胞(BHK-21)和JEV NJ2008株(GenBank序列号:GQ918133)由本实验室保存。3周龄SPF级雌性C57BL/6小鼠购自南京青龙山动物繁殖场。
1.2 主要抗体、试剂
鼠源JEV-NS5单克隆抗体由华中农业大学曹胜波教授惠赠;兔源METTL3(15073-1-AP)、METTL14(26158-1-AP)、FTO(27226-1-AP)、YTHDF1(17479-1-AP)、YTHDF2(24744-1-AP)、YTHDF3(25537-1-AP)多克隆抗体购自Proteintech公司。
高糖DMEM培养基、胎牛血清(FBS)、青链霉素购自Gibco公司;预染蛋白Marker购自南京诺唯赞生物科技股份有限公司;鼠源β-actin单抗,羊抗鼠、羊抗兔IgG HRP,购自Santa Cruz公司;TRIzol购自TaKaRa公司;羊抗兔 IgG H&L(Alexa Fluor 488)、羊抗鼠IgG H&L(Alexa Fluor 594)购自Proteintech公司;EvaGreen 2×qPCR MasterMix、5×All-In-One RT Master Mix快速反转录试剂盒购自南京爱必梦生物材料有限公司;增强型ECL化学发光检测试剂盒购自Biosharp公司;AR级纯度化学试剂购自南京寿德试验器材有限公司;RIPA 细胞裂解液购自北京索莱宝科技有限公司;DAPI染色液购自上海碧云天生物技术有限公司;EpiQuikTMm6A RNA甲基化定量比色法检测试剂盒(P-9005)购自EpiGentek公司。

A. 生存曲线;B.感染第9天;C.感染第13天;D.感染第14天。***表示肾组织与脑组织比较差异极显著(P<0.001)。
1.3 细胞接毒及样本处理
将BHK-21细胞传代后均匀铺至35 mm细胞碟皿进行培养,待细胞密度长至80%左右时,接种稀释好的JEV病毒液,感染复数(MOI)=0.1,孵育1.5 h后弃去病毒液,用含有2% FBS的DMEM培养基维持,继续培养相应的时间,收取样本用于后续试验。若收样用于m6A水平检测,则提取RNA;若收样用于Western blot,则提取总蛋白,将35 mm细胞碟皿弃上清液,用预冷的1×PBS清洗后加入RIPA裂解液,置于4 ℃摇床孵育30 min,于冰浴中用细胞刮子刮下残留团块,将液体转移到离心管,以4 ℃,12 000 r/min离心10 min,弃沉淀,将上清液转移到新的离心管,测定蛋白浓度,按体积比1∶5的比例加入5×SDS Loading buffer,待上样用。上样时根据每个样品蛋白浓度加入不同体积样品,以调齐蛋白上样量(统一为30 μg)。
1.4 小鼠模型建立与脏器样本的处理
将同批次小鼠分别设置对照组10只和JEV攻毒组10只,随机分笼饲养。为了使腹腔注射的病毒能较完全地进入血脑屏障,攻毒前将所有小鼠用微量注射器进行破脑处理,并缓慢注射50 μL无菌1×PBS以保证破脑成功,待小鼠状态恢复后开始攻毒。攻毒组每只小鼠腹腔注射稀释好2×104PFU(0.2 mL毒价为105PFU/mL的病毒液)的JEV病毒,对照组腹腔注射等量无菌1×PBS。每日观察小鼠生命体征和精神状态,攻毒组每次有小鼠出现JEV感染典型症状(拒食、离群、精神沉郁、共济失调、颤抖)后,抽取等量同日对照组小鼠,一同断颈处死后剖取脑、脾和肾等脏器,迅速冻存于液氮中,待后续试验取用。若样本用于m6A水平检测或荧光定量PCR(RT-qPCR),则将样品各切取0.1 g,在冰浴中加入RIPA充分研磨后,在4 ℃、12 000 r/min的条件下离心2 min,弃沉淀将研磨液转至离心管,进行RNA的提取;若样本用于Western blot,则提取总蛋白,加入RIPA裂解液充分研磨,于4 ℃摇床孵育30 min,孵育后每个样品超声破碎10 min,再以4 ℃、12 000 r/min离心10 min,将上清液转移到新的离心管,测定蛋白浓度,按1∶5比例加入5×SDS Loading buffer,待上样用。上样时根据每个样品蛋白浓度加入不同体积样品,以调齐蛋白上样量(统一为30 μg)。
1.5 RNA的提取和反转录
用TRIzol试剂抽提总RNA,根据5×All-In-One MasterMix快速反转录试剂盒配制反转录体系。体系1:将4 μL提取的RNA和2 μL 4×AccuRT Reaction Mix加入PCR管中,总体系为6 μL,混匀、瞬离,室温静置5 min。体系2:将2 μL 5×Accurt Reaction Stopper、4 μL 5×All-In-One RT Master Mix以及6 μL DEPC水同时加入PCR管中,总体系为12 μL,混匀、瞬离。将体系2与体系1混匀、瞬离。置于PCR仪中进行反转录,反转录程序:25 ℃ 10 min,42 ℃ 15 min,85 ℃ 5 min(35个循环)。
1.6 RT-qPCR检测小鼠脏器中病毒载量
选取1.4中每个发病日同一只发病小鼠的脑、脾和肾,各脏器切取等质量的3份(均为0.1 g),进行样本处理、RNA的提取和反转录。设计qPCR引物序列,由南京金斯瑞生物科技有限公司合成引物。本研究所使用的引物序列如表1所示。根据EvaGreen试剂盒说明书配制反应体系,设置qPCR反应程序。根据qPCR试验数据比较各脏器中病毒载量。试验数据使用相对定量法进行分析,每组数据均设置3个重复。将试验得到的JEV的目的基因Ct值与自身内参(GAPDH)Ct值相减得到每一组的ΔCt,再将试验组ΔCt与对照组ΔCt相减可得ΔCt,2-ΔCt表示目的基因表达水平与对照组的倍数差异。
表1 RT-qPCR引物序列
1.7 细胞和小鼠脏器的m6A水平检测
按照1.3的方法在35 mm细胞碟皿铺细胞,同时设置对照组,感染JEV 24 h后,收集和处理样品,提取RNA;切取1.4中第1个发病日(第9天)的感染小鼠和对照小鼠的脑、肾,处理样品,将上述样品提取RNA。按照EpiQuikTMm6A RNA Methylation Quantification Kit说明书中的具体步骤检测样本中m6A水平。
1.8 蛋白免疫印迹试验检测细胞和小鼠脏器m6A相关蛋白表达水平
选取1.2中第1个发病日(第9天)的JEV感染小鼠和对照小鼠的脑、肾切取等质量(0.1 g)样品,收取35 mm中细胞碟皿中JEV(MOI=0.1)感染0、6、12、24和36 h的细胞样品,按照1.3和1.4中的方法提取总蛋白。通过Western blot检测组织和细胞中m6A相关蛋白水平,以β-actin为内参蛋白。
1.9 激光共聚焦
将BHK-21细胞均匀铺于共聚焦小皿,待细胞汇合度为90%左右,感染JEV(MOI=0.1)24 h,设对照组和感染组。感染24 h后,收获细胞样本,用4%多聚甲醛室温固定15 min,并用0.1% Triton X-100室温透膜处理,然后各组使用METTL3、METTL14、FTO、YTHDF1、YTHDF2、YTHDF3和JEV NS5抗体4 ℃孵育过夜,并通过FITC和TRITC标记的荧光二抗染色,使用DAPI染核,使用共聚焦显微镜观察蛋白在胞内的定位分布。
1.10 数据统计与分析
使用GraphPad Prism 8软件分析,用t检验方法比较对照组和试验组中的数据,各试验均独立重复3次。所有数据均表示为“平均值±标准差”。
2 结果与分析
2.1 JEV感染小鼠模型的生存曲线和脏器病毒载量
初步建立了JEV感染的C57BL/6小鼠模型,攻毒组部分小鼠分别于攻毒后的第9、13和14 天开始出现感染症状,第15天后未出现发病小鼠,最终存活率为30%(图1A)。每个发病日选取同一只发病鼠的脑、脾和肾3种JEV靶器官,各器官切取等质量的3份(均为0.1 g)提取RNA进行RT-qPCR。检测各器官中病毒载量,以JEV在小鼠中组织嗜性最强的靶器官脑为参照,对3种器官的病毒载量进行比较。结果显示,3个发病日的样品中,均只在脑和肾中检出有病毒,且脑中的病毒载量极显著高于肾(P<0.001),而脾脏中始终未检出病毒(图1B、1C、1D)。因此采用脑和肾进行后续试验。
2.2 JEV感染对体内外m6A水平的影响
采取同一个发病日的对照小鼠和发病小鼠的脑和肾以及感染JEV(MOI=0.1)的BHK-21细胞,分别提取RNA并检测总体m6A水平。结果显示,与对照组小鼠相比,攻毒组小鼠的脑、肾中带有m6A修饰的RNA占总RNA的比例极显著升高(P<0.01,图2A、2B);同样地,感染JEV的BHK-21细胞和未感染细胞相比,m6A修饰的RNA占比也极显著升高(P<0.01,图2C)。结果说明,JEV感染能使小鼠脑、肾以及BHK-21细胞总体m6A水平上升,推测JEV的感染可能通过m6A水平的上升来触发细胞内的某些生物学变化,这些变化与JEV的感染具有关联性。

**表示差异极显著(P<0.01)。
2.3 JEV感染对体内外m6A相关蛋白表达水平的影响
通过Western blot检测同一个发病日(第9天)的JEV感染小鼠和对照小鼠脑、肾中METTL3、METTL14、FTO、YTHDF1、YTHDF2和YTHDF3蛋白表达量。结果发现,与对照组相比,在感染JEV小鼠的脑和肾中,METTL3表达均显著增加,且脑中该蛋白与对照组相比的上升幅度远大于肾,而其他蛋白未发生明显变化(图3A)。随着时间点的推移,感染JEV(MOI=0.1)的BHK-21细胞中METTL3表达量逐渐增加,而其他蛋白未呈现出明显的或有规律的变化趋势(图3B、3C)。以上结果说明,JEV感染促进了C57BL/6小鼠脑、肾以及BHK-21细胞中METTL3的表达。
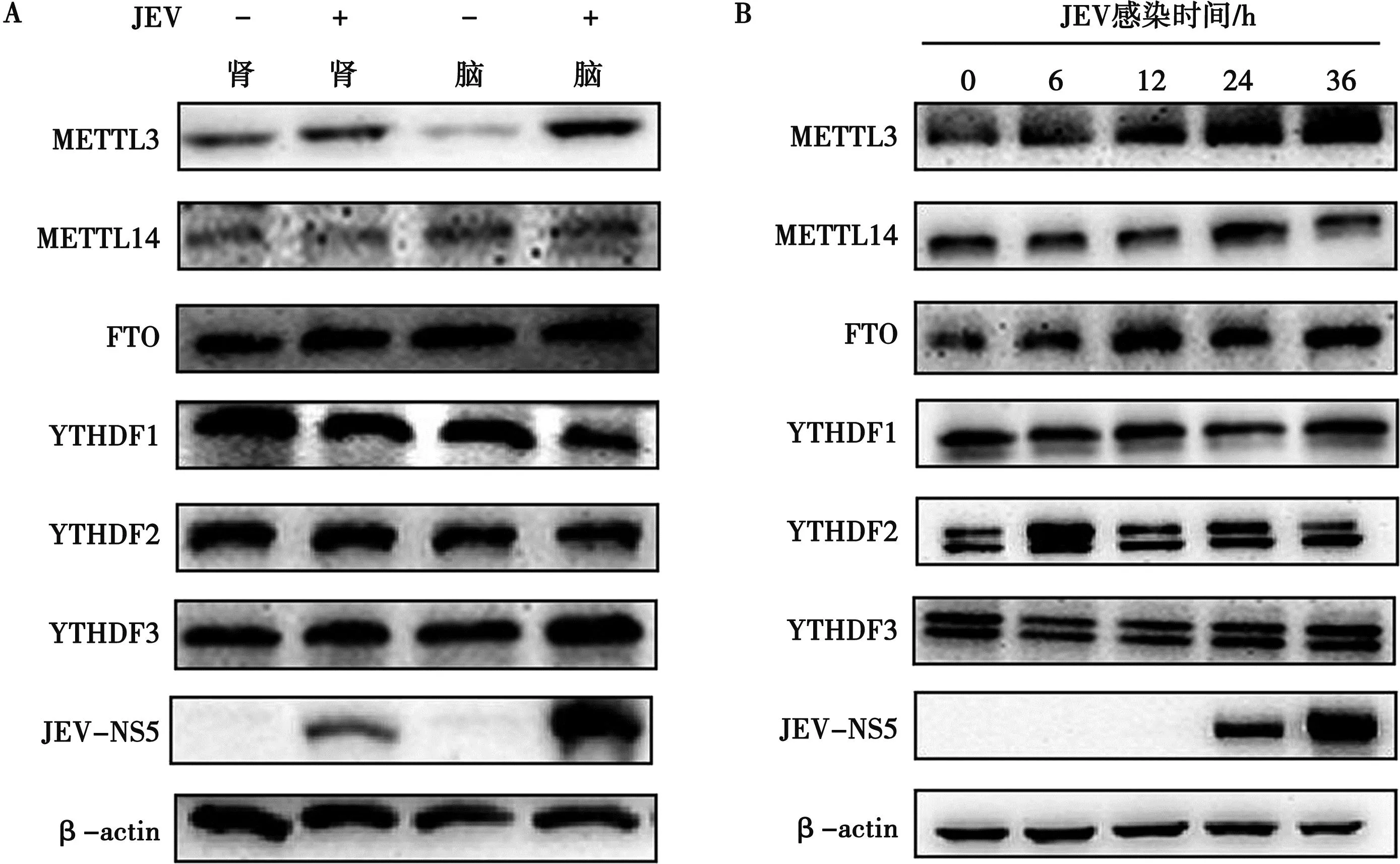
图3 JEV感染后小鼠脑、肾(A)和BHK-21细胞(B)中m6A相关蛋白的变化
2.4 JEV感染对细胞中m6A相关蛋白亚细胞定位的影响
将JEV(MOI=0.1)感染BHK-21细胞24 h,用共聚焦显微镜进行观察。结果显示,对照组细胞中的METTL3、METTL14、FTO基本分布在细胞核中,YTHDF1、YTHDF2、YTHDF3基本分布在细胞质中,而感染JEV后METTL3、METTL14的亚细胞定位发生了明显的改变,从核中往外弥散到细胞质,与JEV的NS5蛋白共存于细胞质中(图4A、4B),但其他蛋白的亚细胞定位未出现明显变化(图4C、4D、4E和4F)。这个现象说明JEV具备“招募”甲基转移酶并改变其亚细胞定位的能力,这样更多的METTL3和METTL14蛋白出现在细胞质中,然后与JEV产生某些联系,调控其复制。

图4 JEV感染后BHK-21细胞中m6A相关蛋白的亚细胞定位(标尺=10 μm)
3 讨论
以JEV、ZIKV、HCV、登革病毒(DENV)、西尼罗河病毒(WNV)和黄热病毒(YFV)为代表的黄病毒严重危害人类和动物健康[13],揭示病毒与宿主互作关系是不断提升病毒病诊断与防治技术的基础。近年来,学者们填补了m6A甲基化在黄病毒中作用研究的空白,m6A对ZIKV和HCV的负向调控作用被发现,其通过加速病毒RNA转录本的降解抑制ZIKV的复制,通过结合蛋白YTHDF1、YTHDF2、YTHDF3作用于脂滴影响病毒的装配、释放,抑制HCV的复制[11-12],但仍然存在许多未知的机制有待发掘,并且同为黄病毒属的JEV的m6A相关研究也仍是一片空白。因此,探究m6A是否调控以及如何调控JEV的复制,揭示m6A修饰在JEV感染中的作用,具有重要意义。
JEV具有强烈的神经嗜性,脑是JEV在小鼠体内十分重要的靶器官[3,14-15]。除脑外,脾脏、肾脏、肝脏、肺脏和肠也是较为重要的靶器官,且侵染选择性、侵染效率因毒株、小鼠种类、周龄和个体差异而异[14,16]。本文以C57BL/6小鼠作为JEV体内感染模型,在脑和肾脏中检测出明显的病毒载量,而脾脏未检测出,说明在3周龄雌性C57BL/6小鼠中,JEV在脑和肾脏中具有较强的复制能力,而在脾脏中的复制能力极其微弱。随后发现感染了JEV的小鼠脑和肾脏以及BHK-21细胞中总体m6A水平都显著高于对照组,说明JEV的感染可诱导体内外m6A水平上调,这表明JEV的复制可能受到m6A修饰的调控。
在m6A修饰的过程中,METTL3和METTL14等甲基转移酶催化甲基化过程,FTO等去甲基化酶催化去甲基化过程,两过程动态可逆,而结合蛋白YTHDF1、YTHDF2、YTHDF3发挥了辅助作用,帮助m6A修饰实现对靶RNA的生物学功能,如提高翻译效率,延缓或加速mRNA的降解,调控RNA的剪切和核转运等[4-10]。而m6A对不同病毒复制的促进或者抑制,通常由上述蛋白中的1~2种起着决定性作用,如m6A在A549细胞中正向调控甲型流感病毒(IAV)复制由METTL3和YTHDF2主导[16],在小鼠源巨噬细胞中正向调控水疱性口炎病毒(VSV)和仙台病毒(SeV)由METTL14主导[17-18]。参考Winkler等[19]、李卫宇[20]的相关研究方法进一步试验,发现感染JEV小鼠的脑和肾中METTL3的表达量相比对照组有了明显增加,且病毒载量较高的脑中METTL3表达量上升幅度显著高于病毒载量相对较低的肾脏;感染JEV的BHK-21细胞中METTL3表达量随感染时间推移而上升,初步推测JEV感染C57BL/6小鼠和BHK-21细胞造成的m6A水平上升,是由METTL3主导,JEV的感染与METTL3存在较大关联。
与其他黄病毒一样,JEV复制的全过程在细胞质中完成[3]。正常情况下,METTL3、METTL14和FTO定位于细胞核中表达[5,7],而YTHDF1、YTHDF2、YTHDF3则分布在细胞质中[8-10]。因此,在共聚焦显微镜下观察,理论上感染JEV后如果METTL3、METTL14和FTO不发生易位,则不会和病毒蛋白共存于细胞质内,而YTHDF1、YTHDF2、YTHDF3能和病毒蛋白共存于细胞质内。已有文献报道一些在细胞质中复制的病毒如柯萨奇病毒A组16型(CVA16)、肠病毒71(EV71)、新型冠状病毒(SARS-CoV-2)感染细胞后,可诱导METTL3、METTL14和FTO定位改变,即大量蛋白由细胞核被“招募”到了细胞质,从而细胞核、细胞质均有弥散分布该蛋白的情况[19-22]。研究者发现,METTL3与EV71的3D蛋白之间存在互作,并通过降低3D的泛素化和SUMO化修饰提高3D稳定性及聚合酶活性进而促进病毒复制,这个过程却与m6A修饰没有直接关系[21]。不同的是,SARS-CoV-2的RdRP(RNA依赖的RNA聚合酶)可反过来抑制METTL3的泛素化和SUMO化而促进METTL3的表达,进而加强SARS-CoV-2自身RNA的m6A修饰,促进病毒复制,这个发现的前提是建立在他们已发现SARS-CoV-2基因组RNA上存在m6A修饰,且m6A修饰促进该病毒复制[23]。本研究的共聚焦显微镜结果表明,在感染JEV的BHK-21细胞中也发现了类似现象,JEV感染“招募”METTL3和METTL14出核,而这种亚细胞定位改变的具体机制有待进一步探究。
本研究将JEV的感染和m6A甲基化建立起联系,JEV感染后在体内外引起m6A水平和METTL3蛋白上调,但是m6A调控JEV复制的具体机制是今后试验中需要解决的问题。总之,本文为JEV的感染机制研究提供了新思路。

