栀子苷抑制HSP70释放改善风湿热痹证胶原性关节炎大鼠血管新生的作用研究
舒 寅,甘珮荣,王 言,卜妍红,吴 虹
(安徽中医药大学药学院,新安医学教育部重点实验室,中药复方安徽省重点实验室,安徽 合肥 230012)
类风湿关节炎(rheumatoid arthritis, RA)是一类慢性自身免疫性疾病,RA归属中医“痹症”、“络病”范畴,是因外感风湿热邪,痹阻气血经络,滞留于关节筋骨而发病[1]。《素问》中“脉者,血之府也”提醒RA络病实质是滑膜血管新生。血管新生作为RA主要病理特征之一,是RA迁延不愈的根本原因[2]。血管内皮细胞(vascular endothelial cells, VECs)是血管新生的效应细胞,受多种信号因子网络调控。在RA病理状态下,促/抑血管生成因子平衡打破,促血管生成因子占主导作用[3]。风湿热痹证被认为是RA活动期的主要病机,此证型患者血清、滑膜液中热休克蛋白70(heat shock proteins 70, HSP70)含量异常升高[4]。因此,辨证论治探究差异物HSP70在风湿热痹证滑膜血管新生的作用亟需展开深入研究。
HSP70-1A作为HSP70家族的一员,是一种应激诱导蛋白,在大多数非应激的正常细胞和组织中低水平表达,在缺氧、炎症、热诱导等应激条件下迅速产生并积累。应激后在细胞内发挥维持蛋白质合成、折叠、降解和转位的动态平衡作用,是重要的分子伴侣。之前被认为只能在细胞内环境存在并发挥作用,新的研究证实,HSP70-1A也存在于细胞外,并发挥出不同于熟知的分子伴侣功能,包括调节细胞免疫、炎症,血管新生[5]。近期研究发现,HSP70能够通过稳定缺氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)α亚基积累,参与多种疾病血管新生过程。细胞外HSP70与人脐静脉血管内皮细胞(human umbilic vein endothelial cells, HUVECs)表面受体紧密结合,通过细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)依赖机制诱导血管新生[6]。因此,有效降低HSP70的胞外释放和胞外HSP70与胞膜受体的结合,抑制滑膜血管新生,有望成为RA治疗的新策略。
栀子,作为RA临床常用清热解毒通络方君药,主要药效成分栀子苷(geniposide, GE)。课题组前期发现GE显著改善关节炎大鼠滑膜病变和血管新生[7]。GE不仅可以通过调节鞘氨醇激酶1(sphingosine kinase 1, SphK1)表达和活性来缓解成纤维滑膜细胞的异常增殖,还可以抑制滑膜组织中促血管生成介质的产生,恢复促/抑血管生成因子平衡[8]。栀子性寒,清热利湿,宣痹通络,同时风湿热痹证病因以热邪为主,热性炎上,治疗应以清热为基本原则,辨证论治。因此本实验旨在探究GE是否通过抑制HSP70释放改善风湿热痹证CIA大鼠滑膜血管新生。
1 材料与方法
1.1 动物与细胞雄性SPF级SD大鼠,6~8周龄,48只,体质量210±10 g,购于济南朋悦实验动物繁育有限公司[合格证号:SCXK(鲁)20190003],所有实验均在安徽中医药大学伦理委员会的批准下进行(许可证号:AHUCM-rats-2021049),实验过程中自然光照周期,自由饮水进食。HUVECs:上海中乔新舟生物科技有限公司,货号:DFSC-EC-01。细胞使用ECM培养,其中含有5%胎牛血清,1%内皮生长因子和1%青、链霉素,培养环境为37 ℃、5% CO2培养箱,当细胞密度至80%时进行胰酶消化传代。
1.2 试剂与仪器人工气候造模箱:宁波江南仪器厂;YLS-7C型足趾容积测量仪:北京凯辉盛达科技发展有限公司;红外热成像仪:美国FLUKE公司;OLYMPUS BX51 高效荧光显微镜:上海富莱光学科技有限公司;GE:深圳海思安生物技术有限公司(hsag1899);甲氨蝶呤(M57520):上海吉至生化科技有限公司;弗氏完全佐剂(F5881):美国Sigma公司;鸡Ⅱ型胶原(220184):美国Sigma公司;胎牛血清(fC04001-500):VivaCell;大鼠HSP70 ELISA试剂盒(1935)、人HSP70 ELISA试剂盒(1737):酶免生物;ECM(#1001):美国ScienCell研究实验室;乳酸脱氢酶(LDH)试剂盒(A020-2-2):南京建成生物工程研究所;CD31 antibody(65058-1-1lg):武汉三鹰生物技术有限公司;VEGF-A antibody(F1019Y):武汉华美生物工程有限公司;HSP70 antibody(250141):成都正能生物技术有限公司。Cell Counting Kit 8(CCK-8)试剂盒(BS3508):白鲨生物科技有限公司;kFluor488 Click-iT EdU成像检测试剂盒(KGA331-100):凯基生物公司。
1.3 风湿热痹证CIA大鼠模型的建立及分组给药将48只大鼠以相同数量(n=8)分别随机分为6组:正常对照组(Control)、CIA模型组(CIA)、风湿热刺激CIA模型组(CIA-S)、GE中剂量组(GE-M)、GE高剂量组(GE-H)和阳性药组(MTX)。除正常组外的大鼠d 1在尾根部皮内注射100 μL CFA与鸡II型胶原乳剂(2 g·L-1)等体积混合物,d 7进行二次免疫。从初次免疫当天开始将除正常组和CIA组以外大鼠饲养在风速5 m·s-1、温度37 ℃、湿度90%的人工气候造模箱中,每次2 h,每天2次,连续干预28 d后,GE-M、GE-H、MTX组大鼠分别用GE(60、120 mg·kg-1·d-1)、MTX(0.5 mg·kg-1·3d-1)灌胃两周。
1.4 关节炎大鼠模型评价指标通过关节炎指数、足爪肿胀容积(mL)、关节肿胀数来评估关节炎严重程度,评估方法与我们之前的研究相同[9]。
1.5 关节表面温度、彩色多普勒超声和血液流变学指标大鼠造模成功后,使用红外热成像仪检测大鼠足、踝关节局部的表面温度及热成像图谱,用于反映关节的发热程度;大鼠适量吸入异氟烷麻醉,使用剃毛器对继发侧关节脱毛处理,在膝关节处涂抹偶合剂,选用Color Doppler-mode,将超声探头对准膝关节处,检测大鼠膝关节的血流信号;给药最后一天,大鼠麻醉处理,使用含有肝素的一次性负压采血管腹主动脉取血,置于冰上,上下颠倒以确保不发生凝血,送至安徽中医药大学第一附属医院进行血流变指标的检测,其中包括全血黏度、血浆黏度和红细胞压积。
1.6 HE染色及免疫组化取大鼠滑膜组织4%多聚甲醛进行固定,乙醇脱水,二甲苯处理,石蜡包埋切片,苏木精-伊红(HE)染色切片,显微镜明场对关节滑膜组织进行病理观察,收集照片并进行分析和处理。滑膜组织石蜡切片脱蜡至水分,抗原修复3% H2O2后浸泡6 min以消除内源性过氧化物酶的干扰,PBS清洗5 min × 2次。滴加CD31、HSP70和VEGF的一抗溶液,在4 ℃下放置一夜。用辣根过氧化物酶标记的IgG抗体37 ℃孵育20 min。用DAB显色液染色3 min,苏木精重染,浸泡置二甲苯中,进行透明处理,再封片置光学显微镜观察。
1.7 Western blot样本加入适量RIPA裂解液、PMSF、蛋白酶和磷酸酶抑制剂,冰上裂解30 min,使用超声破碎仪对其破碎处理,使其裂解更加充分,离心机4 ℃,12 000g,5 min,小心吸取上清,留取10 μL用于蛋白定量,加入适量的上样缓冲液,金属浴煮沸8 min,-40 ℃保存备用。采用湿转法将蛋白转印到NC膜上,5%的脱脂牛奶封闭2 h,一抗孵育4 ℃过夜,TBST摇洗3次,二抗室温孵育1.5 h,TBST摇洗3次,最后使用ECL发光检测试剂,在显影仪中曝光成像,保存并使用ImageJ分析处理。
1.8 ELISA法用ELISA试剂盒检测大鼠血清和细胞上清液中HSP70的水平,全程按照试剂盒说明书操作。
1.9 细胞HSP70释放模型的建立取生长状态良好的HUVECs,选用热休克温度(41~45)℃设立3个梯度并分组,刺激1 h后培养箱稳定30 min后,Western blot检测胞内HSP70表达量,ELISA检测胞外释放量。取细胞上清液,根据说明书,通过酶标仪检测450 nm处每个样品的A值并计算LDH相对含量。LDH含量 =(测量A值 - 空白A值)/(标准A值 - 空白A值)× 100%。选择细胞毒性低且HSP70显著升高的温度(41 ℃)作为建立细胞模型的条件。
1.10 条件培养基(HUVECs-CM)的制备与质控用不同浓度的GE(25、50和100 μmol·L-1)预处理细胞24 h,细胞换液处理,接下来使用上一步筛选出的温度41 ℃水浴加热细胞1 h,收集细胞上清液ELISA检测胞外HSP70含量,收集细胞Western blot检测HSP70表达情况。选择最有效的GE浓度(100 μmol·L-1)用于接下来的条件培养基诱导模型的构建。
1.11 HUVECs-CM诱导模型的建立用不同体积分数的HUVECs-CM(0%、25%、50%、75%、100%)刺激细胞24 h,CCK-8法检测细胞活力。以最佳浓度(100%)的HUVECs-CM刺激细胞,检测细胞增殖、水平迁移、垂直迁移和成管能力。
1.12 CCK-8实验取生长状态良好的HUVECs,96孔板每孔加入100 μL含7×103个HUVECs的细胞悬液。细胞贴壁后,使用不同体积分数的条件培养基处理24 h。培养结束后,吸除旧培养基,每孔加入100 μL含10% CCK-8的培养基,培养2 h,于酶标仪450 nm处测吸光度值,计算细胞活力。
1.13 EdU染色取生长状态良好的HUVECs,24孔板提前加入细胞爬片,每孔加入1 mL含1×105个HUVECs的细胞悬液,待细胞融合至70%~80%后,分别用完全培养基、41 ℃-CM、41 ℃+GE-CM培养HUVECs 24 h后,吸弃旧培养基,使用含有EdU的培养基200 μL孵育2 h。4%多聚甲醛固定15 min,PBS摇洗3次,0.5% Triton X-100通透,每孔加入200 μL Click-iT反应混合物,避光孵育30 min。接着,使用Hoechst 33342溶液对细胞进行DNA复染。预先在载玻片上滴加适量抗荧光淬灭剂,取出爬片,细胞面紧贴载玻片,指甲油滴于四周封片,通风橱避光晾干,使用荧光倒置显微镜拍照观察。
1.14 细胞划痕实验取生长状态良好的HUVECs,6孔板每孔加入1 mL含1×105个HUVECs的细胞悬液,待细胞贴壁后,使用已经灭菌的200 μL枪头抵住直尺垂直于孔板底部用力均匀划线,吸取PBS沿孔壁缓慢加入,洗去细胞碎片,此时在显微镜下摄取划痕照片,记为0 h。分组给药处理细胞24 h后,在显微镜下观察并拍照,记为24 h。根据公式:划痕愈合率=(划痕面积0 h - 划痕面积24 h)/ 划痕面积0 h × 100%,计算细胞划痕愈合率。
1.15 Transwell小室迁移实验取生长状态良好的HUVECs,Transwell小室上室加入200 μL含1×104个HUVECs的细胞悬液,在下室加入15%胎牛血清的完全培养基600 μL,细胞贴壁后,吸弃上室旧培养基,分组给药处理24 h。使用棉签轻轻擦去上室未透膜细胞,4%多聚甲醛固定20 min,结晶紫染色20 min,晾干。在倒置显微镜下观察细胞垂直迁移情况并拍照,ImageJ分析穿膜细胞数量。
1.16 成管实验取第7代生长状态良好的HUVECs,取50 μL Matrigel基质胶加入96孔板中,待胶凝固后,分组每孔加入100 μL不同的含药细胞悬液,密度为每100 μL含7×103个HUVECs,置于细胞培养箱孵育4 h后,在倒置显微镜下观察细胞成管情况并采集图像。使用ImageJ软件计算成管的数量和长度。

2 结果
2.1 GE缓解CIA-S大鼠炎症建立了模拟RA活动期特征为红、肿、热、痛的CIA-S模型以及CIA模型,给予不同剂量的GE和阳性药MTX。在初次免疫后,每7天进行一次大鼠模型评价,数据显示,CIA-S大鼠相较于CIA大鼠,症状出现时间早,高峰期高,持续时间长,体质量涨幅也不同(Fig 1B)。d 28给药后,GE和MTX明显改善CIA-S大鼠症状(P<0.05,P<0.01),包括关节肿胀严重度(Fig 1A)、足肿胀数量(Fig 1C)、AI指数(Fig 1D)、足肿胀容积(Fig 1E)。GE(120 mg·kg-1)组与MTX(0.5 mg·kg-1)组治疗效果相似,GE(60 mg·kg-1)组治疗效果较高剂量组差,说明GE治疗风湿热痹证大鼠关节炎有效且呈剂量依赖性。
2.2 GE逆转CIA-S大鼠热属性指标风湿热痹证CIA大鼠踝、趾关节红、肿、热,给药后症状缓解(Fig 2A)。CIA-S大鼠关节表面温度(35.39 ± 0.20)℃较正常组(27.37 ± 0.37)℃和CIA组(32.76 ± 0.23)℃明显升高(P<0.01),给药后向正常组恢复(P<0.01)(Fig 2B)。低切率下全血黏度越高,红细胞聚集性越强,血液流变学结果显示,与正常组相比,CIA组与CIA-S组血浆黏度升高,但两组间无明显差异;CIA组与CIA-S组红细胞压积均高于正常组且CIA组较CIA-S组更高。这反映CIA模型在风湿热的条件刺激下,表现为遇热血流快,血液黏度降低(Fig 2C,D)。
2.3 GE改善CIA-S大鼠滑膜病理形态HE结果显示(Fig 3),与正常相比,CIA组与CIA-S组大鼠滑膜组织中可见异常增殖且排列紊乱的滑膜细胞,大量浸润的炎性细胞以及微血管形成,且CIA-S更严重。GE和MTX给药可有效改善这种异常病理形态。
2.4 GE抑制CIA-S大鼠滑膜血管新生应用彩色多普勒超声观察大鼠膝关节滑膜血流信号显示(Fig 4A),正常组无明显血流信号,而CIA与CIA-S组有点状和短线状血流信号,且CIA-S组较CIA组更为明显,这表明两种大鼠模型膝关节滑膜组织中均有新生血管形成并且CIA-S组血管新生更强烈。GE和MTX组较CIA-S组观察到的血流信号减少。此外,采用免疫组化和Western blot检测大鼠滑膜组织中血管内皮细胞标志物CD31和促血管生成因子VEGF表达水平(Fig 4B-G),与正常组比,CIA和CIA-S组CD31和VEGF表达明显增加(P<0.01)。与CIA-S组相比,CIA组两者表达量稍少,GE和MTX干预后,CIA-S大鼠滑膜CD31和VEGF水平降低。表明CIA-S大鼠滑膜血管新生明显,GE具有抑制血管新生的作用。

Fig 1 GE alleviated inflammation in CIA-S rats n=8)
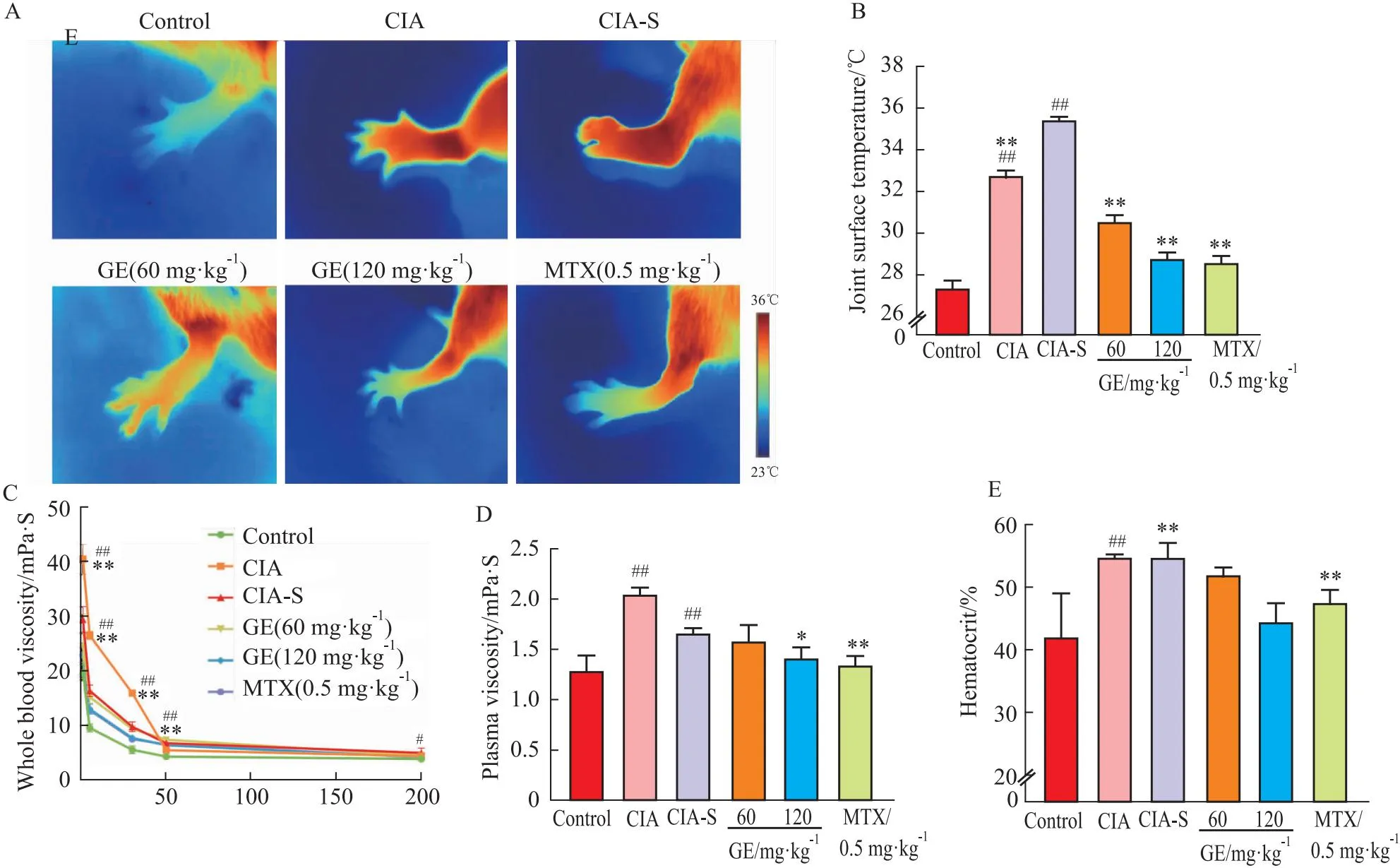
Fig 2 GE reversed CIA-S rat thermal properties indicator n=8)

Fig 3 GE improved synovial pathology in CIA-S rats (×100) n=8)
2.5 GE减少HSP70在CIA-S大鼠滑膜组织与血清中的含量免疫组化结果(Fig 5A, B)和滑膜组织Western blot结果(Fig 5C, D)显示,CIA-S大鼠滑膜组织中HSP70表达较正常组大鼠明显升高(P<0.01)。GE和MTX给药抑制CIA-S大鼠滑膜HSP70表达(P<0.01)。ELISA结果显示(Fig 5E),CIA-S大鼠血清中HSP70较正常组大鼠明显升高(P<0.01)。GE和MTX给药会减少CIA-S大鼠血清中HSP70的表达(P<0.01)。
2.6 GE抑制热诱导的HSP70表达和释放首先建立热诱导表达释放HSP70的细胞模型,选用热休克温度(41~45)℃设立梯度并分组,刺激1 h后培养箱稳定30 min后Western blot检测胞内HSP70表达量,ELISA检测胞外释放量,结果发现41℃刺激明显升高HSP70释放量和表达量(Fig 6A-C)(P<0.01),并且41 ℃条件下细胞毒性较43 ℃与45 ℃低(P<0.05),因此我们选用41 ℃刺激1 h作为诱导HSP70表达和释放升高模型的刺激剂。在细胞热刺激造模前1天分别GE(25、50、100 μmol·L-1)处理给药,结果表示HSP70胞内含量降低,与模型组相比差异有统计学意义(P<0.05,P<0.01)(Fig 6E,F),HSP70胞外释放量经给药处理后明显降低(P<0.05,P<0.01)(Fig 6G),因此,GE能有效降低热刺激导致的HSP70表达和释放的升高,且在25~100 μmol·L-1范围内呈剂量性依赖,因此条件培养基的制备选用GE 100 μmol·L-1。CCK-8结果显示(Fig 6H),在不同体积分数的条件培养基刺激下HUVECs增殖能力增强,体积分数为0.75和1时差异有统计学意义,且体积分数为1时增殖活性最强,因此选择体积分数为1的条件培养基用于接下来的实验(P<0.01)。
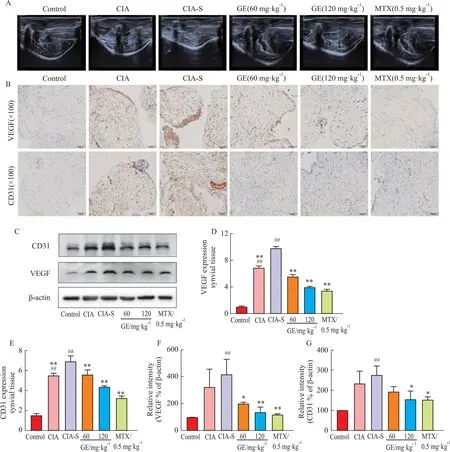
Fig 4 GE inhibited synovial angiogenesis in CIA-S rats n=8)
2.7 GE抑制HSP70释放进而改善HUVECs生物学功能使用条件培养基(HUVECs-CM)处理HUVECs,分别为41 ℃加热1 h,GE(100 μmol·L-1)处理24 h后41 ℃加热1 h的细胞上清液刺激细胞,并以单独刺激65 μg·L-1的HSP70作为对照(与条件培养基中HSP70含量相似)。具体分组为:Control组,41 ℃-CM组,GE+41 ℃-CM组,HSP70组。EdU染色实验检测HUVECs DNA复制能力,评价HUVECs增殖能力。EdU结果显示(Fig 7A),与Control组相比,41 ℃-CM组和HSP70组增殖能力增强,GE+41 ℃-CM组增殖能力较41 ℃-CM组减弱。采用细胞划痕实验和Transwell小室实验分别检测HUVECs水平迁移和竖直迁移能力(Fig 7B-E)。41 ℃-CM组和HSP70组的水平和竖直迁移能力均明显高于对照组(P<0.01),GE+41 ℃-CM组迁移能力较41 ℃-CM组明显减弱(P<0.05)。采用Matrigel基质胶成管实验检测HUVECs细胞管腔形成能力。如Fig 7 F-H所示,与Control组相比,41 ℃-CM组和HSP70组HUVECs形成连续、密集的网状结构,管腔数目和长度明显增加(P<0.01)。GE+41 ℃-CM组成管能力较41 ℃-CM组明显减弱(P<0.05)。

Fig 5 GE reduced HSP70 in synovial tissue and serum of CIA-S rats n=8)
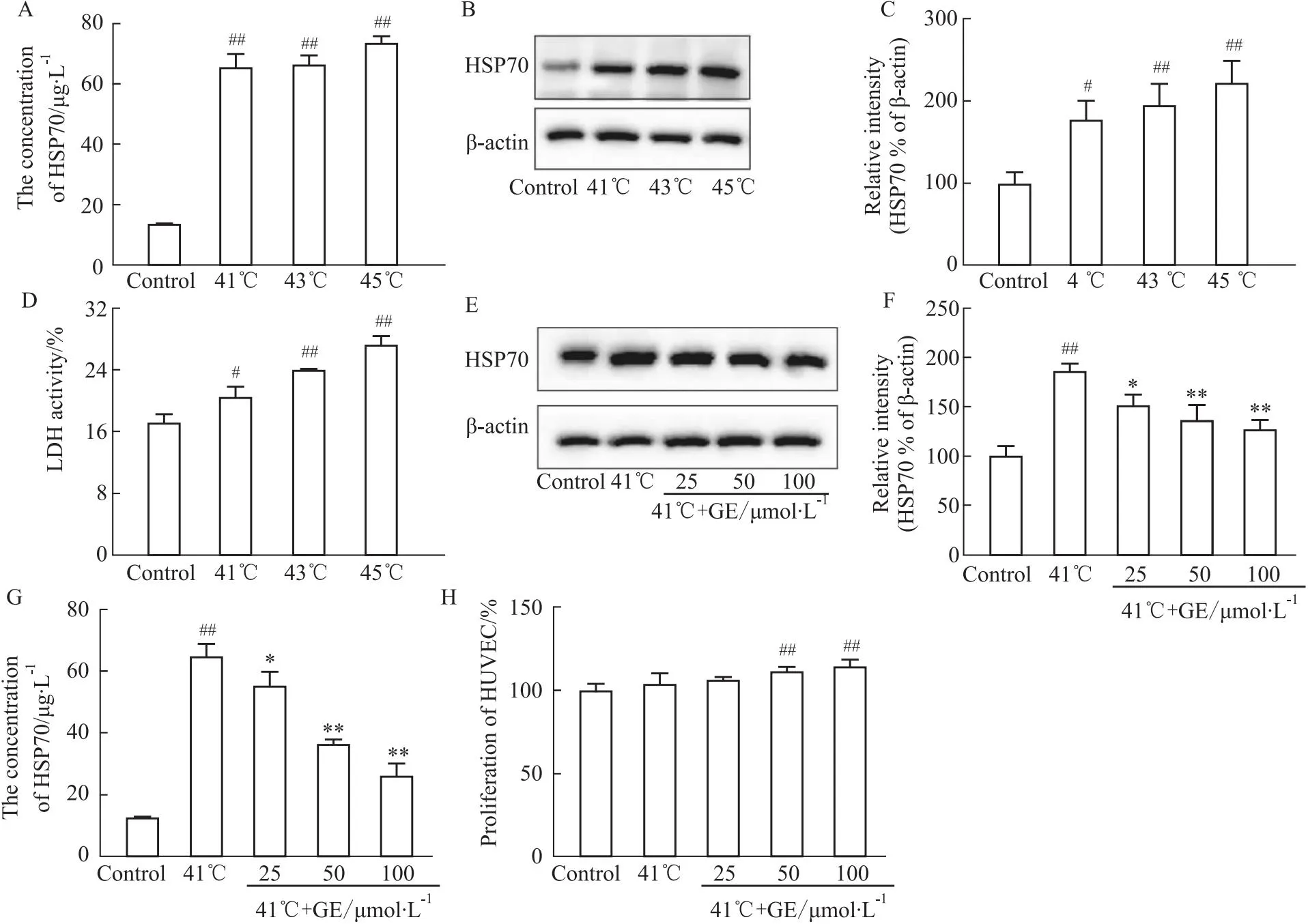
Fig 6 GE reduced heat-induced HSP70 expression and release n=3)

Fig 7 GE inhibited HSP70 release and thereby improved biological function of HUVECs n=3)
3 讨论
新生微血管、异常增殖的滑膜细胞与炎性细胞构成血管翳,侵蚀软骨进而造成关节不可逆损伤。血管新生是形成和维持RA血管翳的重要因素。在RA病理状态下,促/抑血管生成因子平衡打破,促血管生成因子占主导作用,促进血管新生。抑制内源性促血管生成因子产生的药物已在临床上被证明有效[10]。因此,阐明一种新的血管生成因子的功能对理解血管新生的复杂机制有重要意义。已有研究表明,应激诱导蛋白HSP70发挥出不同于熟知的分子伴侣功能,作为新型促血管生成因子发挥作用[6],但其在RA滑膜血管新生中的作用还尚不清楚。
研究表明,风湿热痹证患者血清、滑膜液中HSP70含量异常升高。合适的动物模型是实验研究的基础。CIA是一种内源性自身抗原介导自身免疫性疾病的模型,在临床表现、病理及免疫学变化等方面与RA有许多相似之处,是研究RA病理机制和评价RA药物疗效的理想的动物模型[11]。CIA大鼠的基础属性偏向热,病理实质为炎症细胞浸润,经风湿热刺激后,血管翳形成及骨质破坏更为明显。本研究在CIA模型的基础上,使用人工气候造模箱,控制温度、湿度和风速,建立病证结合的风湿热痹证CIA大鼠模型。以治疗RA的金标准药物MTX为阳性对照,探究GE(60、120 mg·kg-1)对CIA-S大鼠的治疗作用。结果显示,CIA-S较CIA关节炎峰值提前、持续时间延长,消退缓慢,血管新生与HSP70表达更为强烈。这与之前的研究相同[4],可能表明HSP70是区别于风湿热痹证与其他证型的差异物,HSP70含量多少同血管新生严重程度趋势相同。热属性是评价CIA-S模型的特殊指标,其中CIA-S关节表面温度平均值达到35.39 ℃,器官的变化及血流受阻都会引起血流和热量从深层组织传导至局部皮肤,导致温度升高[12]。CIA-S血液黏度及血流速度在风湿热条件刺激下分别表现为降低、加快,符合现代医学认为RA存在血液黏度增高的状态[13]。GE干预明显抑制CIA-S大鼠关节炎症,改善滑膜病理,减少膝关节滑膜血流信号以及抑制CD31和VEGF的表达,提示GE对CIA-S大鼠治疗作用明显著,可以抑制CIA-S大鼠滑膜血管新生。我们检测了各组别滑膜和血清中HSP70的含量,进一步探究GE体内改善滑膜血管新生是否与HSP70表达释放相关。结果发现,与空白对照组相比,GE干预后明显减少HSP70在CIA-S大鼠滑膜组织表达与血清含量,这提示GE改善RA滑膜血管新生可能与HSP70有关。
如前所示,我们继续进行体外实验探究HSP70对HUVECs生物学功能的影响以及GE的干预作用。热应激41~45 ℃是诱导HSP70表达和释放最直接最有效的因素之一。本研究在选择41 ℃水浴加热1 h建立HSP70胞外释放模型,结果发现GE能够降低热应激后HUVECs HSP70的蛋白含量。胞外HSP70刺激HUVECs增殖、迁移和形成管状结构,进一步支持HSP70在RA血管新生中的作用。热应激的条件培养基同时也发挥相同作用,GE预处理后明显逆转,这可能与GE抑制热应激诱导的HSP70释放有关。体外实验进一步证实了GE抑制HSP70释放改善RA滑膜血管新生。
此研究当前还存在局限性,HSP70作为细胞因子发挥作用的前提是释放至胞外,然而HSP70的胞外释放机制仍不明确。它区别于普通分泌型蛋白,通过非经典的、独立于内质网-高尔基体的途径被运输到质膜,主动释放可能与脂筏相关,通过与细胞内叶磷脂酰丝氨酸结合外翻至胞外空间[14-15]。有研究表明,非应激细胞的脂筏中含有稳定的HSP70,细胞受到刺激时,细胞内HSP70选择性在脂筏中聚集增加,同时HSP70的释放也增加,用甲基环糊精破坏脂筏的结构后,HSP70释放明显降低[16]。同时,课题组前期也发现GE靶向作用于SphK1,抑制SphK1过度转位至胞膜。有研究发现质膜中的脂筏微域很有可能是SphK1再定位的目标[17]。GE减少胞外的HSP70分泌是否与抑制SphK1再定位有关仍待探究。
综上所述,在RA血管新生过程中,过度分泌的HSP70作用于HUVECs,促进病理性血管新生;GE体内、外有效的减少HSP70释放改善RA滑膜血管新生。在之后的研究中,我们将更深入的阐明GE抑制HSP70释放的机制,为中药治疗RA血管新生的研究与应用提供新的实验依据。